PPARβ/δ激动剂GW501516对人角质形成细胞增殖、迁移和粘附的影响
胡小平 张 伟 陈办成 陈史宏 王勇强 于 波
·论著·
PPARβ/δ激动剂GW501516对人角质形成细胞增殖、迁移和粘附的影响
胡小平 张 伟 陈办成 陈史宏 王勇强 于 波
目的: 评价过氧化物酶体增殖物激活受体β/δ(PPARβ/δ)的激动剂GW501516对人角质形成细胞(KC)增殖、迁移和粘附的影响。方法: 体外培养正常人KC,采用MTT比色法及体外计数法,观察正常人KC在不同浓度GW501516(0,1,5,10,25,50,100 ng/m l)作用下,其增殖、迁移及粘附情况。结果: 与对照组比较,GW501516促进KC增殖(P<0.01),呈剂量依赖性;GW501516显著促进了KC的迁移(P<0.001);细胞粘附性与对照组间无统计学差异(P>0.05)。结论: GW501516能够促进人KC增殖和迁移,对KC粘附无影响。
过氧化物酶体增殖物激活受体; GW501516; 角质形成细胞; 增殖; 迁移; 粘附
过氧化物酶体增殖物激活受体(Peroxisome proliferator-activated receptors,PPARs)是一类激素核受体超家族成员。现已证实有三种不同的PPARs亚型:PPARα、PPARβ/δ、PPARγ。近年来,对于PPARs和炎症性皮肤病的关系受到了学者们的关注。1而人皮肤角质形成细胞(keratinocytes,KC)中,PPARβ/δ是主要的亚型。研究发现PPARβ/δ在增殖的HaCaT细胞和银屑病皮损中表达明显上升,2提示PPARβ/δ可能和KC增殖具有一定的关系。为进一步了解PPARβ/δ对KC的影响,我们选择PPARβ/δ的激动剂GW501516和KC体外共同培养,研究PPARβ/δ激活后对KC的增殖、迁移和粘附功能作用的影响。
1 材料和方法
1.1 组织标本和材料 15名正常人(19~58岁)健康皮肤来自我院皮肤科和整形外科,均按照知情同意的原则留取组织标本。无血清KC培养基(KSFM,含5μg/mL的庆大霉素),0.5%dispase分离酶(Gibco,美国),胎牛血清、0.25%胰酶/EDTA(Peprotech,美国);GW501516试剂(上海浩天然生物技术有限公司);MTT;二甲基亚砜(DMSO,Solarbio,美国);其他试剂及器材:T-75培养瓶(Fluka,UK)、细胞计数板、12孔板、96孔板(Costar,美国)等。
1.2 表皮KC的分离和培养 无菌手术后保存在0.5%dispase分离酶中的正常人皮肤标本在4℃过夜后,无菌操作台中分离表皮和真皮。将分离下的表皮置于0.25%的胰酶中,37℃静置10 min。然后以胎牛血清中止胰酶的活性,轻轻吹打表皮,以200目滤网过滤KC悬液,1000 r/min离心7min。然后,弃上清,加入KSFM,将正常表皮KC种植于T-75培养瓶中,37℃,5%CO2培养、传代,所有的实验均利用2~3代对数生长期的KC。
1.3 MTT法检测GW501516对KC增殖的影响MTT法参照文献,3略加改变。对数生长期KC用胰酶/EDTA消化后重悬于KSFM,以5×104/mL密度种植于96孔板,每孔100μL。放置于培养箱中,细胞铺满孔底部60%~70%后,弃培养基,然后用PBS冲洗两次。加入100μL含有不同浓度GW 501516(0、1、5、10、25、50、100 ng/m L)的基础KSFM中,继续孵育48 h。最后每孔加入2μL用PBS配置的MTT(5mg/ mL)。放置于孵箱中3 h后,弃除培养基,加入100 μL DMSO后置于水平振荡器上振荡,然后置于分光光密度仪570 nm读取吸光度值。每种处理因素均设6复孔,重复3次,结果取平均值,以均数±标准差表示。
1.4 细胞迁移实验检测GW 501516对KC迁移能力的影响 细胞迁移实验参照既往的研究方法,4略加改变。改良Boyden chambers中装入8μm孔径的PVP膜,PVP膜光滑面预先用20μg/mL IV型胶原40℃预孵育24 h并在室温下风干,光面向下。趋化盒的下层每孔加入27μL含有不同浓度GW 501516 (0、1、5、10、25、50、100 ng/mL)的基础KSFM,上层加入50μL密度为5×104/m L的基础KSFM混悬的HaCaT细胞悬液。放置于培养箱中12 h后,取出PVP膜,小心刮去正面的非迁移性的细胞,保留朝下的光滑面的细胞,4%多聚甲醛固定10 min,2%结晶紫染色5 min后流水冲洗,在光镜400×放大倍数每孔随机取5个视野计数迁移到光滑面的细胞,5个视野计数之和代表每孔的细胞迁移数目。每种处理因素均设3复孔,重复3次,结果取平均值,以均数±标准差表示。
1.5 细胞粘附实验检测GW 501516对正常表皮KC粘附能力的影响 对数生长期KC用胰酶/EDTA消化后用PBS冲洗2次后重悬于基础无血清KC培养基,以1×105/mL密度种植于20μg/mL IV型胶原预包被的96孔板,每孔100μL,同时加入不同浓度GW 501516(0、1、5、10、25、50、100 ng/mL),在培养箱中继续培养4 h。最后弃培养基,然后用37℃预热的无血清KC培养基轻轻冲洗3次以去除未粘附的细胞,每孔加入20μL用PBS配置的MTT(5 mg/mL),放置于培养箱中3 h后,加入100μLDMSO后水平振荡器振荡5min后,置于分光光密度仪570 nm读取吸光度。每种处理因素均设6复孔,重复3次,结果取平均值,以均数±标准差表示。
1.6 统计学方法 数据采用¯x±s表示,多组均值间比较采用单因素方差分析,两组间比较采用配对t检验,P<0.05为有统计学意义。
2 结果
GW501516呈剂量依耐性的促进KC增殖,50 ng/ mL时达到峰值。GW501516能显著促进KC的迁移,浓度在100 ng/mL时约是对照组的11倍。GW501516对KC粘附作用无影响(P>0.05)。见表1、图1~3。
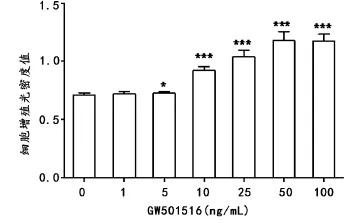
图1 GW501516对KC促增殖效应。GW501516呈剂量依耐性的促进KC增殖,50 ng/mL时达到峰值。∗表示在GW501516处理组和未处理组之间具有统计学意义(∗:P<0.05;∗∗∗:P<0.001)

图2 GW501516对KC迁移的影响。GW501516能显著促进细胞的迁移。∗∗∗表示在GW501516处理组和未处理组之间有统计学意义(P<0.001)

图3 GW501516对KC粘附作用的影响
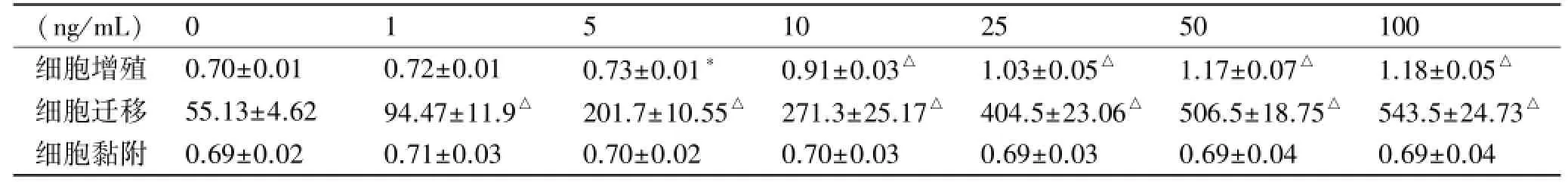
表1 GW501516对正常KC增殖、迁移和黏附的影响
3 讨论
一系列研究发现,PPARs被相应的激动剂活化后,在皮肤和其他器官中可调节重要的细胞功能,这些新的功能支持PPARs和相应激动剂可作为治疗不同皮肤病的潜在靶位。5人皮肤KC中,PPARβ/δ是主要的亚型,已有研究认为PPARβ/δ与表皮分化有关。6尽管内源性PPARβ/δ配体激动剂的本质仍不清楚,但几种化学合成的激动剂如GW 501516已在研究PPARβ/δ生理功能的科学实验中被广泛应用。
在已发表的研究中,PPARβ/δ对表皮的增殖作用存在争议,一些研究认为PPARβ/δ的激活促进了表皮细胞的增殖,7而另一些研究认为其活化后会抑制表皮细胞增殖。8,9近年来,在一些KC增生性疾病中如银屑病皮损中发现PPARβ/δ表达明显增加,2并且小鼠体内实验发现PPARβ/δ活化能够触发银屑病特征性的免疫反应,引起银屑病样皮肤损害。10这些研究似乎更倾向于表明PPARβ/δ的激活具有促进表皮KC增殖作用。Tan等研究发现,PPARβ/δ在皮肤伤口愈合过程中有重要的作用,11表明PPARβ/δ活化促进了表皮细胞的迁移功能。对于这些研究现象的争议,目前的解释认为:细胞中PPARβ/δ活化可能存在双相反应,这种反应主要依赖于炎症信号所诱发的变量情况,即在炎症刺激作用下,PPARβ/δ表现为促进细胞增殖作用,而在非炎症情况下表现为抑制细胞增殖功能。
本研究发现PPARβ/δ在激动剂GW 501516的活化下,对正常KC具有明显的促增殖和迁移作用,而对细胞粘附功能无影响,实验结果支持了PPARβ/δ促增殖和迁移的功能,但炎症刺激理论并不能解释这种正常情况下的PPARβ/δ所产生的促增殖和迁移的效应,但由于实验中使用了外源性激动剂GW501516,可能也说明体外实验的结果并不能真实反映PPARβ/δ在体内时的实际功能,因为需要对PPARβ/δ产生作用的机理进一步深入研究。近期发现了一种新的KC增殖和分化稳态控制路径,即PPARβ/δ凭借调节皮肤成纤维细胞的IL-1信号,12为解释此现象带来了希望。
本研究结果显示,PPARβ/δ促进KC增殖和迁移功能与激动剂GW501516的工作浓度呈剂量依耐性,这说明激动剂的浓度大小影响和调节了PPARβ/δ的促增殖和迁移效应,这可能从另外角度说明正常非炎症情况下,虽然表皮KC细胞中有PPARβ/δ的表达,但由于无激动剂活化,PPARβ/δ不会促进正常的KC细胞增殖和迁移。这也间接支持了炎症状态下PPARβ/δ的促增殖效应。另外,研究结果显示PPARβ/δ对KC的粘附作用无影响,而粘附功能在炎症因子趋化过程中发挥重要作用,这提示PPARβ/δ可能对炎症过程无调节作用。
总之,结合相关研究,13说明PPARβ/δ在调节细胞存活、增殖和迁移以及修复等方面具有重要作用,尤其可能在增殖性炎症性皮肤病发病机制中有重要影响,表明其将来可能成为治疗此类疾病的药物作用靶点。
1 Sertznig P,Reichrath J.Peroxisome proliferator-activated receptors(PPARs)in dermatology:challenge and prom ise.Dermatoendocrinol,2011,3(3):130-135.
2 El EishiN,Hegazy R,Abou Zeid O,etal.Peroxisome proliferator receptor(PPAR)β/δin psoriatic patients before and after two conventional therapeutic modalities:methotrexate and PUVA.Eur JDermatol,2011,21(5):691-695.
3Weichert H,Blechschmidt I,Schroder S,et al.The MTT assay as a rapid test for cell proliferation and cell killing:application to human peripheral blood lymphocytes(PBL).Allerg Immunol (Leipz),1991,37(4):139-144.
4 Zhang K,Krammer RH.Laminin 5 deposition promotes keratinocytemotility.Exp Cell Res,1996,227(2):309-322.
5 Villarrubia VG,Vidal-Asensi S,Pérez-Bañasco V,etal.Lipid nutrition and the epidermal barrier:The connection between immune-mediated inflammatory diseases and peroxisome proliferator-activated receptors,a new therapeutic target in psoriasis and atopic dermatitis.Actas Dermosifiliogr,2010,101(7):585-599.
6 Burdick AD,Kim DJ,Peraza MA,et al.The role of peroxisome proliferator-activated receptor-beta/delta in epithelial cell growth and differentiation.Cell Signal,2006,18(1):9-20.
7Hao CM,Redha R,Morrow J,et al.Peroxisome proliferatoractivated receptor deltaactivation promotes cell survival following hypertonic stress.JBiol Chem,2002,277(24):21341-21345.
8 Burdick AD,Bility MT,Girroir EE,et al.Ligand activation of peroxisome proliferator-activated receptor-beta/delta(PPARbeta/delta)inhibits cell growth of human N/TERT-1 keratinocytes.Cell Signal,2007,19(6):1163-1171.
9 Borland MG,Foreman JE,Girroir EE,et al.Ligand activation of peroxisome proliferator-activated receptor-beta/delta inhibitscell proliferation in human HaCaT keratinocytes.Mol Pharmacol,2008,74(5):1429-1442.
10 Romanowska M,Reilly L,Palmer CN,et al.Activation of PPARbeta/delta causes a psoriasis-like skin disease in vivo. PLoSOne,2010,5(3):9701.
11 Tan NS,Michalik L,Desvergne B,etal.Genetic-or transforming growth factor-beta 1-induced changes in epidermal peroxisome proliferator-activated receptor beta/delta expression dictate wound repair kinetics.J Biol Chem,2005,280(3): 18163-18170.
12 Chong HC,Tan MJ,Philippe V,et al.Regulation of epithelial-mesenchymal IL-1 signaling by PPARbeta/delta is essential for skin homeostasis and wound healing.JCell Biol,2009,184 (6):817-831.
13 Man MQ,Barish GD,Schmuth M,et al.Deficiency of PPAR-beta/delta in the epidermis results in defective cutaneous permeability barrier homeostasis and increased inflammation.J Invest Dermatol,2008,128(2):370-377.
(收稿:2013-11-17 修回:2014-01-05)
Effects of PPARβ/δagonist GW 501516 on the proliferation,m igration and attachment of human keratinocytes in vitro
HU Xiao-ping,ZHANGWei,CHEN Ban-cheng,etal.Department ofDermatology,Shenzhen Hospital,Peking University,Guangdong,518036
Objective:To investigate the influence of peroxisome proliferator receptorβ/δ(PPARβ/δ)agonist GW501516 on the proliferation,migration and attachment of cultured human keratinocytes(KC).Methods:After the KCs were treated with different concentrations of GW 501516(0,1,5,10,25,50,100 ng/ m l),the cell proliferation,migration and attachmentweremeasured by MTTmethod.Results:Compared with control group,GW 501516 significantly increased the cell proliferation(P<0.001),in a dose-dependentmanner,and markedly promoted the cellmigration(P<0.001).There was no significant difference in the cell attachmentbetween the experimental group and control group(P>0.05).Conclusion:The results demonstrate that GW501516 can stimulate human KC proliferation andmigaration,but has no effect on KC attachment.
peroxisome proliferator receptor;GW 501516;human keratinocytes;proliferation;migration;attachment
广东省自然科学基金项目(编号:S2012040006694)
广东省医学科研基金项目(编号:B2012329)
深圳市科技计划项目(编号:201203035)
北京大学深圳医院皮肤科,广东深圳,518036

