骨髓来源间充质干细胞培养上清液减轻脂多糖诱导的小鼠急性肺损伤*
许欣婷,董明清,胡美,徐敦全,李志超,吴昌归△
(第四军医大学1西京医院呼吸与危重症医学科,2病理和病理生理教研室,陕西西安 710038)
骨髓来源间充质干细胞培养上清液减轻脂多糖诱导的小鼠急性肺损伤*
许欣婷1,董明清2,胡美1,徐敦全2,李志超2,吴昌归1△
(第四军医大学1西京医院呼吸与危重症医学科,2病理和病理生理教研室,陕西西安 710038)
目的:观察经尾静脉输注骨髓间充质干细胞培养上清液(MSCs CdM)对脂多糖(LPS)诱导的小鼠急性肺损伤的治疗作用及其机制。方法:采用全骨髓培养法分离纯化骨髓间充质干细胞,传至第3代时观察细胞形态,流式细胞术检测细胞表面标志,并且收集上清液用超滤离心管进行离心。30只BALB/c小鼠随机分为对照组、LPS模型组和MSCs CdM治疗组。对照组腹腔内注射生理盐水(0.01 mL/g),LPS组和MSCs CdM治疗组腹腔内注射LPS(5 mg/kg,0.01 mL/g)制备急性肺损伤模型。造模1 h后经尾静脉输注MSCs CdM(MSCs CdM治疗组)或生理盐水(LPS组或对照组)300 μL。6 h后处死小鼠,留取标本检测肺组织病理形态学、肺组织湿干重比(W/D)、支气管肺泡灌洗液(BALF)中蛋白含量、血清及BALF中细胞因子水平和肺组织中髓过氧化物酶(MPO)的活性。结果:与对照组比较,LPS处理后肺组织病理损伤严重,BALF中蛋白、血清肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)含量、肺组织中MPO活性及肺组织湿干重比均显著升高。与LPS组比较,MSCs CdM治疗组肺组织病理损伤程度减轻,BALF中蛋白、血清TNF-α和IL-6含量、肺组织中MPO活性及肺组织湿干重比均显著降低,而BALF中白细胞介素10(IL-10)和角质细胞生长因子(KGF)水平显著高于LPS组和对照组。结论:骨髓间充质干细胞培养上清液可有效减轻LPS诱导的急性肺损伤,其作用机制可能与其调节肺部TNF-α、IL-6、IL-10和KGF的水平有关。
急性肺损伤;角质细胞生长因子;脂多糖类;间充质干细胞
急性肺损伤(acute lung injury,ALI)是肺内外多种致病因素导致的肺泡和毛细血管膜弥漫性损伤、肺组织充血、水肿的急性病理过程,发展至严重阶段为急性呼吸窘迫综合症(acute respiratory distress syndrome,ARDS)。ARDS严重影响肺脏气体交换功能,临床表现为进行性呼吸困难和顽固低氧血症,死亡率高达40%以上[1]。其发病机制尚未完全阐明,目前认为,炎症反应-抗炎反应失衡是ALI/ARDS发生发展最重要的病理生理机制[2]。近年来对ALI/ ARDS的治疗药物和措施进行了大量研究,业已证实呼吸支持治疗仍是当前的主要救治手段,治疗药物的研究尚未取得突破性进展。
骨髓间充质干细胞(bone marrow mesenchymal stem cells,MSCs)是一类具有不同的自我更新能力和多向分化潜能的未分化细胞,归巢到肺脏损伤部位后可分化为肺内多种细胞参与修复[3]。无论是气管内滴注MSCs还是外源性输入MSCs都可以减轻脂多糖(lipopolysaccharide,LPS)导致的小鼠肺损伤[4-5]。MSCs治疗ALI在动物模型中取得了理想的效果,但是其机制尚未完全明确。MSCs作为全细胞疗法治疗肺损伤对于病人可能存在一些风险[6-7],因此探讨其培养上清液(MSCs-conditioned medium,MSCs CdM)是否具有同样治疗作用是很有意义的工作[8]。本研究利用LPS诱导肺损伤小鼠模型,观察了MSCs CdM对肺损伤的治疗作用并初步探讨其作用机制。
材料和方法
1 主要仪器及试剂
LPS(O55:B5),显微镜(Olympus),离心机(Herus),髓过氧化物酶(myeloperoxidase,MPO)活性试剂盒(南京建成生物医学工程研究所),超滤离心管(Millipore Amicon Ultra-15,3 000 Da),酶标仪(Tecan)。
2 方法
2.1 MSCs分离、鉴定和培养断颈处死BALB/c小鼠后于75%乙醇中浸泡5 min,移入超净台,取出双下肢股骨及胫骨,眼科剪剪去股骨及胫骨骨髁,用PBS液反复冲洗骨髓腔3次,收集骨髓。将获得的骨髓细胞悬浮液移入离心管,以1 000 r/min离心5 min,弃上清,用DMEM-LG培养液(10%FBS,100 U/L青霉素,100 U/L链霉素)重悬,接种于塑料培养皿中,置于37℃、5%CO2培养箱内培养。原代培养第2天换液1次,去除未贴壁细胞,倒置相差显微镜观察细胞生长情况及形态特征。以后每3 d换液1次。当细胞铺满瓶底约80%时,用0.25%含 EDTA胰蛋白酶室温消化1 min,按1∶2传代培养。留取第3代、第4代细胞进行流式细胞术鉴定。
2.2 MSCs培养上清液的收集每次换液时收集MSCs上清液于离心管中,1 000 r/min离心5 min,弃掉细胞碎渣和死细胞,将获得的上清倒入超滤离心管中离心(4℃、3 000×g,2 h)。收集超滤液体,置4℃保存备用。
2.3 动物模型制备健康、雄性清洁级BALB/c小鼠30只,体重18~22 g,8~10周,由第四军医大学实验动物中心提供。所有实验均经过第四军医大学动物护理和使用委员会同意。小鼠随机均分为3组,每组各10只,即对照组、LPS组和MSCs CdM治疗组。对照组腹腔内注射0.01 mL/g生理盐水,LPS组和MSCs CdM治疗组腹腔内注射LPS(5 mg/kg,0.01 mL/g)制备急性肺损伤模型。造模30 min后经尾静脉输注MSCs CdM(MSCs CdM治疗组)或生理盐水(LPS组或对照组)300 μL,6 h后麻醉后处死小鼠,留取肺组织标本作各种检测用。
2.4 肺组织病理检测放血处死动物,取出左肺的一叶肺组织迅速放入4%多聚甲醛中4℃固定24~48 h,取出后置于70%乙醇溶液中,标本取全后,进行石蜡包埋。制作5 μm厚的切片,进行HE染色,光学显微镜下观察组织病理学结构改变。
2.5 肺水肿参数测定小鼠放血处死后迅速分离右肺,用吸水纸吸干表面水分和血液,电子天平称量肺湿重,57℃烤箱内将肺烘干至质量衡重(72 h)。计算得出肺湿干重比(wet/dry weight ratio,W/D)。此可反映肺水肿程度。
2.6 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中蛋白、角质细胞生长因子(keratinocyte growth factor,KGF)和白细胞介素10(interleukin-10,IL-10)含量测定用3%戊巴比妥钠腹腔注射麻醉小鼠,固定于恒温手术架上,放血处死动物,剪开颈部皮肤,钝性分离暴露器官并剪一倒“V”字型切口,进行气管内插管,用4℃PBS灌洗液灌洗肺并回收BALF,每次1 mL(反复灌洗3次后抽出),共4次,回收率约90%(约3.6 mL)。用考马斯亮蓝法进行定量并记录实验结果。BALF在450×g离心10 min,上清收集后用于测定细胞因子。按照ELISA试剂盒说明书操作,显色后酶标仪读数并记录结果。
2.7 血清中IL-6和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)的表达用小镊子剔除小鼠眼球,收集血液,4℃、12 000 r/min离心10 min,收集上清,按ELISA试剂盒说明书操作,显色后酶标仪读数。
2.8 肺组织匀浆的制备与髓过氧化物酶(myeloper-oxidase,MPO)活性测定迅速分离全肺(n=8),电子天平准确称取组织重量。迅速将组织转移到冰盒上,以试剂盒提供的试剂为匀浆介质,按重量体积比1∶19加匀浆介质。用眼科小剪尽快剪碎组织后充分匀浆,制备成5%的组织匀浆并按照试剂盒步骤检测MPO活性。
3 统计学处理
采用SPSS 16.0统计软件分析。数据以均数±标准差(mean±SD)表示,组间均数比较用单因素方差分析,以P<0.05为差异有统计学意义。
结果
1 肺组织病理学变化
光镜下见对照组和MSCs CdM组肺泡结构清晰,肺泡腔及支气管腔未见明显炎细胞及渗出物,可见少许红细胞(图1A、C)。LPS组镜下可见肺组织水肿,点、片状出血,大量炎症细胞浸润,肺泡间隔明显增厚,肺泡腔变窄,局灶性肺不张和肺气肿(图1B)。

Figure 1.HE staining of mouse lung tissues.A:control group;B:LPS group;C:LPS+MSCs CdM group.图1 各组小鼠肺组织病理变化
2 W/D变化
对照组的右肺W/D与MSCs CdM组之间无明显差别。LPS组右肺W/D与对照组相比较明显增加(P<0.01);而MSCs CdM组与LPS组相比右肺W/D显著减少(P<0.01),见图2。
3 支气管肺泡灌洗液蛋白含量的变化
LPS显著增加BALF中蛋白含量,表明肺通透性增加,导致血液中蛋白漏出增多;而在MSCs CdM组BALF中蛋白含量明显减少,与LPS组相比有显著差别,见图3。
4 MSCs CdM对LPS导致的小鼠肺MPO活力的影响
对照组与MSCs CdM治疗组小鼠肺组织匀浆中MPO活力无明显差别;LPS组中MPO活力明显增加,见图4。
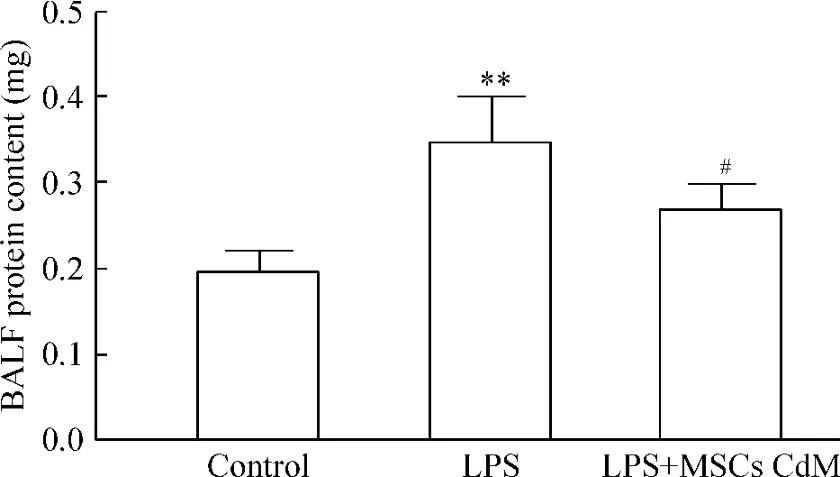
Figure 3.The changes of protein level in bronchoalveolar lavage fluid(BALF)in mice.Mean±SD.n=10.**P<0.01 vs control;#P<0.05 vs LPS.图3 BALF中蛋白含量的变化

Figure 4.The changes of MPO activity in the lung of mice.Mean±SD.n=10.**P<0.01 vs control;#P<0.05 vs LPS.图4 小鼠肺组织中MPO活性的变化
5 小鼠血液中IL-6及TNF-α的变化
与对照组和MSCs CdM治疗组相比,LPS损伤6 h后IL-6和TNF-α水平显著增高;在对照组和MSCs CdM治疗组间上述因子无明显差异,见图5。

Figure 5.The concentrations of TNF-α and IL-6 in serum of mice.Mean±SD.n=10.**P<0.01 vs control;##P<0.01 vs LPS.图5 小鼠血清IL-6和TNF-α变化
6 支气管肺泡灌洗液中KGF及IL-10含量
与对照组相比,LPS组和MSCs CdM治疗组KGF和IL-10显著增高;而MSCs CdM治疗组明显高于LPS组,见图6。

Figure 6.The concentrations of IL-10 and KGF in BALF of mice.Mean±SD.n=10.**P<0.01 vs control;##P<0.01 vs LPS.图6 小鼠BALF中IL-10及KGF变化
讨论
LPS是革兰阴性杆菌外膜的主要成分,引起炎症反应、休克甚至死亡。当LPS攻击肺部时,LPS可以造成肺泡毛细血管膜损害,导致多形核中性粒细胞(polymorphonuclear neutrophil,PMN)附着、激活与积压,引起肺组织炎症反应、肺出血和肺水肿等,继而影响气体交换并最终导致呼吸衰竭。肺组织中MPO 是PMN嗜天青颗粒释放的过氧化物酶类,其活性可作为PMN浸润的证据。本实验中发现,MSC-CdM能显著减轻肺组织炎症渗出,降低肺水肿参数(W/D)、BALF中蛋白含量及肺组织MPO活性,提示输入MSC-CdM能够减轻脂多糖致急性肺损伤程度,这结果与Zhu等[9]的研究一致。
ALI/ARDS的发生机制复杂,目前尚未完全明了。在脓毒症合并ALI/ARDS中,LPS是一重要介质,它通过激活NF-κB等多种转录因子,并与TNF-α 和IL-6等致炎因子基因启动子区反应元件结合,启动转录与表达,TNF-α和IL-6合成增多,导致组织损伤和结构破坏[10]。我们的实验表明MSCs CdM处理后可明显降低BALF中促炎细胞因子TNF-α和IL-6水平。现已公认ALI是一种介质病,内源性细胞因子在疾病的发生发展中有着重要的作用。除促炎细胞因子(IL-1β、IL-6、IL-8、TNF-α等)外,抗炎细胞因子(IL-1ra、sTNF-R、IL-4、IL-10、TGF等)的表达受抑会加重组织损伤程度。有研究证实,LPS即可诱生大量的炎症介质,也使抑炎因子IL-10分泌下降,使TNF-α/IL-10平衡失调[11]。我们的研究表明,MSCs CdM处理可有效提升肺组织IL-10水平,恢复TNF-α/IL-10平衡。这可能是MSCs CdM治疗ALI/ARDS的又一机制。
KGF是介导间质与上皮之间相互作用的一种生长因子,可以特异性地促进Ⅱ型肺泡上皮细胞增殖和分化。Curley等[12]在研究呼吸机造成的肺损伤模型中发现MSCs CdM通过旁分泌KGF机制减轻肺损伤。在我们的实验中也观察到:MSCs CdM尾静脉注射可使LPS诱导的ALI小鼠模型BALF中KGF明显增高,推测MSCs CdM会因此促进组织的修复进程,加快疾病恢复。但这一因子的增多是否与ALI/ ARDS后的肺纤维化形成相关仍需进一步探讨。
综上所述,我们的研究进一步证实了MSCs CdM能有效减轻LPS诱发ALI/ARDS小鼠模型的肺损伤程度,这可能与其抑制TNF-α、IL-6等致炎因子合成和上调抑炎因子IL-10等的表达相关。此外,MSCs CdM还能上调肺组织中KGF的含量,将有利于组织修复。
[1]Lee JW,Fang X,Krasnodembskaya A,et al.Concise review:Mesenchymal stem cells for acute lung injury:role of paracrine soluble factors[J].Stem Cells,2011,29(6): 913-919.
[2]李玉梅,卫洪昌.ALI/ARDS抗炎治疗研究的策略与展望[J].中国病理生理杂志,2009,25(4):813-816.
[3]Ortiz LA,Gambelli F,Mcbride C,et al.Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fibrotic effects[J].Proc Natl Acad Sci U S A,2003,100(14):8407-8411.
[4]Hayes M,Curley G,Laffey JG.Mesenchymal stem cells: a promising therapy for acute respiratory distress syndrome [J].F1000 Med Rep,2012,4:2.
[5]Afshari A,Brok J,M∅ller AM,et al.Inhaled nitric oxide for acute respiratory distress syndrome and acute lung injury in adults and children:a systematic review with metaanalysis and trial sequential analysis[J].Anesth Analg,2011,112(6):1411-1421.
[6]Lepperdinger G,Brunauer R,Jamnig A,et al.Controversial issue:is it safe to employ mesenchymal stem cells in cell-based therapies?[J].Exp Gerontol,2008,43(11): 1018-1023.
[7]Amariglio N,Hirshberg A,Scheithauer BW,et al.Donor-derived brain tumor following neural stem cell transplantation in an ataxia telangiectasia patient[J].PLoS Med,2009,6(2):e1000029.
[8]徐明举,利凯,崔红玉,等.H3N2猪流感病毒诱导的小鼠急性肺损伤与SOD、NO、MDA和OH·变化的相关性[J].中国病理生理杂志,2011,27(4):783-786.
[9]Zhu YG,Hao Q,Monsel A,et al.Adult stem cells for acute lung injury:remaining questions and concerns[J].Respirology,2013,18(5):744-756.
[10]Maggini J,Mirkin G,Bognanni I,et al.Mouse bone marrow-derived mesenchymal stromal cells turn activated macrophages into a regulatory-like profile[J].PLoS One,2010,5(2):e9252.
[11]郑绪阳,谢强敏,杜晓刚,等.吡拉米司特在大鼠急性肺损伤模型中降低PDE4活性与TNF-α/IL-10平衡有关[J].中国药理学通报,2006,22(12):1499-1504.
[12]Curley GF,Hayes M,Ansari B,et al.Mesenchymal stem cells enhance recovery and repair following ventilator-induced lung injury in the rat[J].Thorax,2012,67(6): 496-501.
Bone marrow-derived mesenchymal stem cell-conditioned medium attenuates LPS-induced acute lung injury in mice
XU Xin-ting1,DONG Ming-qing2,HU Mei1,XU Dun-quan2,LI Zhi-chao2,WU Changgui1
(1Department of Respiratory and Critical Care Medicine,Xijing Hospital,2Department of Pathology and Physiopathology,Fourth Military Medical University,Xi’an 710038,China.E-mail:changgui@fmmu.edu.cn)
AIM:To explore the effects of bone marrow-derived mesenchymal stem cells-conditioned medium (MSCs CdM)on lipopolysaccharide(LPS)-induced acute lung injury.METHODS:Lung injury was induced in mice by intraperitoneal injection of LPS.The mice were given a tail vein injection of MSCs CdM or normal saline 1 h after LPS administration.The mice were killed by an intraperitoneal injection of pentobarbital 6 h after LPS injection for either bronchoalveolar lavage fluid(BALF)and serum collection or lung histological analysis.RESULTS:Compared with control group,the BALF levels of protein,interleukin-10(IL-10)and keratinocyte growth factor(KGF),the serum levels of tumor necrosis factor α(TNF-α)and IL-6,and the myeloperoxidase(MOP)activity in the lung tissues were significantly higher in LPS group,and severe pathological damages in the lung tissues were also observed.Treatment with MSCs CdM significantly reduced the BALF prtein level,the seum TNF-α and IL-6 levels and the lung MPO activity,and attenuated the lung pathological damages,but further increased the levels of IL-10 and KGF in the BALF.CONCLUSION:Treatment with MSCs CdM attenuates the lung injuries induced by LPS,which may be via regulating the expression of TNF-α,IL-6,IL-10 and KGF.
Acute lung injury;Keratinocyte growth factor;Lipopolysaccharides;Mesenchymal stem cells
R363.2+2
A
10.3969/j.issn.1000-4718.2014.02.016
1000-4718(2014)02-0286-05
2013-09-27
2013-12-05
国家自然科学基金资助项目(No.81072642;No.81372129)
△通讯作者Tel:029-84771687;E-mail:changgui@fmmu.edu.cn

