参芎化瘀胶囊通过VEGF/Notch1信号通路改善大鼠缺血性脑卒中损伤
赵雅宁,刘文倩,牛 静,李建民,李淑杏,陈长香
(河北联合大学:1. 护理与康复学院;2.附属医院神经外科,河北唐山 063000)
◇中医药研究◇
参芎化瘀胶囊通过VEGF/Notch1信号通路改善大鼠缺血性脑卒中损伤
赵雅宁1,刘文倩1,牛 静1,李建民2,李淑杏1,陈长香1
(河北联合大学:1. 护理与康复学院;2.附属医院神经外科,河北唐山 063000)
目的 探讨参芎化瘀胶囊对全脑缺血再灌注损伤大鼠的治疗作用及对海马区VEGF/Notch1通路的影响。方法 SD大鼠分为假手术组、模型组及参芎化瘀胶囊高、低剂量组。采用改良的Pulsineli 4血管阻断(4-VO)法制作全脑缺血模型,分别在缺血24、48、72 h应用光镜观察海马区神经细胞形态的变化;应用免疫组化法检测海马区VEGF、Notch1表达。结果 与假手术组比较,模型组海马区各时间点的存活神经细胞率降低,差异有统计学意义(P<0.05);VEGF、Notch1表达升高,差异有统计学意义(P<0.05)。与模型组比较,参芎化瘀胶囊组各时间点的存活神经细胞率增加,差异有统计学意义(P<0.05);VEGF、Notch1表达进一步升高,差异有统计学意义(P<0.05)。上述变化在高剂量参芎化瘀胶囊组更为明显。模型组VEGF与Notch1表达呈正相关(r=0.846,P<0.01);参芎化瘀胶囊组VEGF与Notch1表达呈正相关(r=0.814,P<0.01)。结论 参芎化瘀胶囊对脑缺血损伤有很好的治疗作用,其机制可能与调控VEGF/Notch1信号途径有关。
参芎化瘀胶囊;脑缺血再灌注;血管内皮生长因子;Notch1
参芎化瘀胶囊是由人参、地鳖虫、川芎、乳香(制)、没药(制)、全蝎、紫河车、龙血竭、五味子、石菖蒲、郁金、桑葚子等多种成分组成的复方制剂,具有养血益气、化瘀通络等作用。药理学研究显示,川芎、郁金、人参皂甙等提纯物或活性成分具有抑制白细胞浸润、减轻缺血脑组织炎症反应、抗自由基、阻止钙离子内流、抑制脑缺血导致的神经细胞凋亡等作用。我们前期的研究也显示,参芎化瘀胶囊对脑缺血再灌注后脑组织内信号通路,如MAPKs、PI3K信号通路有调节作用[1-4]。血管内皮生长因子 (vascular endothelial growth factor, VEGF)不仅能促进血管的生成,同时对脑缺血缺氧损伤具有直接的神经保护作用,且可促进神经细胞新生[5]。Notch表达于多种组织和器官中,可调控细胞增殖、分化和凋亡。现已证实,哺乳动物体内Notch1受体可以在成人大脑中的海马区域表达,影响海马神经发育及神经可塑性[6]。本研究建立大鼠全脑缺血再灌注损伤模型,应用不同剂量参芎化瘀胶囊进行干预,观察海马区神经细胞形态结构,从VEGF/Notch1通路角度探讨参芎化瘀胶囊对缺血性脑卒中的治疗作用。
1 材料与方法
1.1 实验动物 清洁级健康雄性SD大鼠69只,体质量200~250 g,于河北联合大学动物实验室喂养。实验室环境:温度22~26 ℃,相对湿度40%~70%,空气压力梯度维持20 Pa。实验室每天上、下午进行紫外线消毒各1次,每次20 min,每周进行1次彻底消毒。大鼠适应性饲养7 d后进行动物模型制作。饲养期间大鼠饮食及其他情况正常,未出现意外伤害及死亡情况。
1.2 药品、试剂及仪器 参芎化瘀胶囊(Shen xiong hua yu capsule):主要由人参、川芎、地鳖虫、没药(制)、乳香(制)、全蝎等多种中药成分组成的复方制剂,由河北联合大学附属医院研制,批号为Z20051586,规格为每粒装0.4 g,实验时用蒸馏水配置成药液(质量浓度为48 mg/mL)备用。Notch1鼠单克隆抗体和SABC显色试剂盒购自武汉博士德生物工程有限公司;日本Olympus Ixto显微镜;德国Kontron IBAS 2.0全自动图像分析系统,由河北联合大学形态学实验室提供。
1.3 动物分组 实验动物分为3组:假手术组(15只)、脑缺血30 min/再灌注组(模型组,18只)、脑缺血30 min/再灌注+参芎化瘀胶囊组(24 mg/100 g,18只),脑缺血30 min/再灌注+参芎化瘀胶囊组(48 mg/100 g,18只)。药物组造模前10 d及造模期间灌胃给药,术后24、48、72 h取材。手术过程中模型组和2个给药组各死亡3只,最终各组有15只动物纳入统计。
1.4 模型制备 采用改良的Pulsineli 4血管阻断(4-VO)法[7]制作SD大鼠全脑缺血模型:动物常规麻醉,颈正中切口,分离双侧颈总动脉,在其下置线备用。枕后部正中切开,暴露双侧第1颈椎横突翼孔,直视下热凝其下通过的椎动脉,电凝每次时间约2~4 s,使翼小孔后双侧椎动脉永久闭塞。术后大鼠缝皮回笼,24 h后以无创性微动脉夹夹闭双侧颈总动脉,脑电检测缺血后呈一条直线、大鼠在缺血开始30~60 s内昏迷、翻正反射消失、双侧瞳孔放大为造模成功。缺血30 min后松开动脉夹,实行再灌注。假手术组分离暴露血管,但不电凝椎动脉、不夹闭颈总动脉。
1.5 给药方法 假手术组、模型组给予生理盐水10 mL/(kg·d),参芎化瘀胶囊组(用药组)给予参芎化瘀胶囊药液240 mg/(kg·d)和480 mg/(kg·d),每天上午9点灌胃给药1次,连续10 d。第10天给药1 h 后,100 g/L水合氯醛(300~350 mg/kg)腹腔注射麻醉后,制作脑缺血再灌注模型,术后继续给药至相应时间点后处死。
1.6 病理形态学观察 每组取5只大鼠,相应时间点断头取脑,视交叉后1~6 mm处冠状面切开,中间块入40 g/L多聚甲醛固定液固定,石蜡包埋,片厚5 μm。切片经脱蜡脱水后进行HE染色,光学显微镜下观察脑组织的病理变化。存活神经细胞密度定量分析:每个标本取5张切片,在有测微尺的光学显微镜(×200)下观察海马区神经元的形态变化(有明显细胞膜、细胞核、核仁为存活神经细胞)。具体方法:将海马区平均分为5个等份,每个等份选取一个相同部位,应用Motic-6.0图像采集及图像分析系统分别计数其中每个视野(×200)下存活神经元的数量及总细胞数量,以每个视野下平均存活细胞百分率[活细胞数量与总细胞数量比值(%)]表示。
1.7 VEGF和Notch1蛋白的免疫组化染色 切片常规脱蜡后置于枸橼酸盐微波修复,分别滴加VEGF(1∶150)和Notch1(1∶200),湿盒中4 ℃过夜,IgG抗体-HRP多聚体(PV二步法),37 ℃温箱30 min,DAB显色,脱水、透明、封片。以PBS代替一抗作阴性对照。镜下观察并摄片,阳性率的定量分析:每个标本取4张切片,400倍光镜下每张切片在海马随机选取4个视野,在有测微尺的光学显微镜(×200)下观察海马区阳性细胞变化并计数阳性细胞数量。
2 结 果
2.1 各组大鼠脑组织的病理改变 假手术组大鼠海马区神经细胞结构正常、排列整齐,细胞核清晰,核仁明显。模型组大鼠脑缺血再灌注24 h,海马区可见较多肿胀的神经元,间质水肿,结构疏松,神经元和胶质细胞出现核固缩、深染,也有部分神经元胞核完全消失,形成空泡状结构;缺血再灌注48 h,脑组织神经细胞严重破坏,可见较多变性坏死的神经细胞,神经细胞呈空泡状或海绵状,出现核固缩、碎裂和核仁消失现象,间质水肿明显;缺血再灌注72 h,模型组可见坏死神经细胞,脑组织结构破坏,结构疏松,核膜碎裂、核仁消失。与对照组比较,各时间点存活神经细胞率降低(P<0.05)。参芎化瘀胶囊组各时间点海马区受损神经元组织学变化均较模型组同时间点减轻,相对正常神经细胞占大多数,存活神经细胞率增高(P<0.05,表1)。上述变化在高剂量组中更为明显(图1)。
表1 各组大鼠海马区存活神经细胞率的比较

Tab.1 Comparison of the survival rate of nerve cells in the hippocampus of each group (%/visual field, ±s)
与假手术组比较,*P<0.05;与模型组比较,△P<0.05;与低剂量组比较,▲P<0.05。
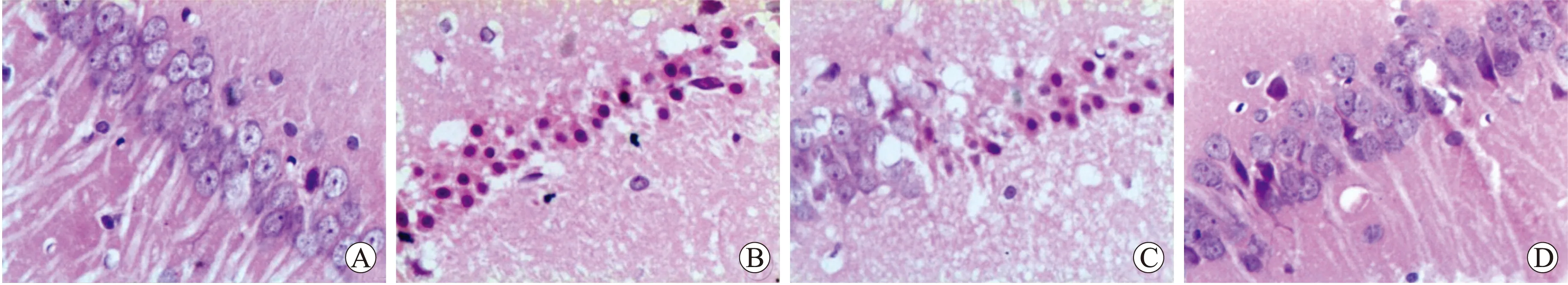
图1 各组大鼠术后72 h海马区神经元形态的变化
Fig.1 Morphological changes in the hippocampal region in each group at 72 h after surgery (HE, ×400)
A:假手术组;B:模型组;C:参芎化瘀胶囊低剂量组;D:参芎化瘀胶囊高剂量组。
2.2 VEGF和Notch1蛋白的表达情况 VEGF免疫组化染色呈棕黄色,定位于细胞质中。与假手术组比较,模型组相应时间点的VEGF表达明显增加,差异具有统计学意义(P<0.05)。参芎化瘀胶囊组与相应时间点的模型组比较,VEGF表达明显升高,差异有统计学意义(P<0.05)。上述变化在高剂量组中更为明显(P<0.05,图2,表2)。Notch1免疫组化染色呈棕黄色,定位于细胞胞质中。与假手术组比较,模型组相应时间点的Notch1表达明显增加,差异具有统计学意义(P<0.05)。参芎化瘀胶囊组与相应时间点的模型组比较,Notch1表达明显升高,差异有统计学意义(P<0.05)。上述变化在高剂量组中更为明显(P<0.05,表3、图3)。

图2 各组大鼠术后72 h海马区VEGF1的表达情况
Fig.2 Expression of VEGF in the hippocampal region of each group by immunohistochemistry (×400)
A:假手术组;B:模型组;C:参芎化瘀胶囊低剂量组;D:参芎化瘀胶囊高剂量组。
表2 各组大鼠海马区VEGF阳性神经细胞数量的比较

Tab.2 Comparison of the VEGF positive nerve cells in the hippocampus of each group (number/visual field, ±s)
与假手术组比较,*P<0.05;与模型组比较,△P<0.05;与低剂量组比较,▲P<0.05。
表3 各组大鼠海马区Notch1阳性神经细胞数量的比较

Tab.3 Comparison of the Notch1 positive nerve cells in the hippocampus of each group (number/visual field, ±s)
与假手术组比较,*P<0.05;与模型组比较,△P<0.05;与低剂量组比较,▲P<0.05。
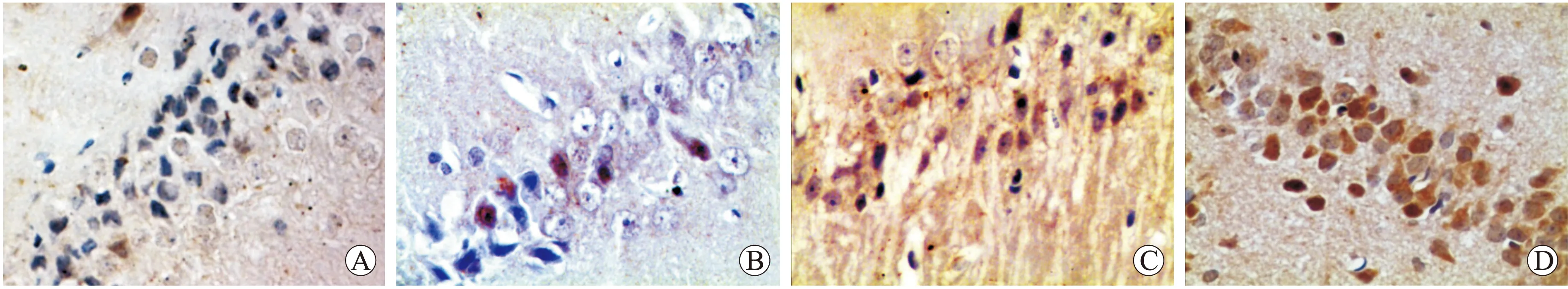
图3 各组大鼠术后72 h海马区Notch1的表达情况
Fig.3 Expression of Notch1 in the hippocampal region of each group by immunohistochemistry (×400)
A:假手术组;B:模型组;C:参芎化瘀胶囊低剂量组;D:参芎化瘀胶囊高剂量组。
2.3 VEGF和Notch1表达的相关分析结果 相关分析显示,模型组VEGF与Notch1呈正相关(r=0.846,P<0.01);低参芎化瘀胶囊组VEGF与Notch1呈正相关(r=0.789,P<0.01);高参芎化瘀胶囊组VEGF与Notch1呈正相关(r=0.814,P<0.01)。
3 讨 论
VEGF是一种内皮细胞特异的有丝分裂原。研究显示,脑缺血损伤病理环境中VEGF表达增多,外源性静脉注入VEGF以及皮质表面局部使用VEGF可减少短暂性局灶性脑缺血大鼠的缺血性脑损害[5]。陈懿等[8]应用脑泰方提取物对局灶性脑缺血动物进行干预,显示梗死灶周围VEGF阳性细胞及VEGF mRNA表达增多,动物神经运动功能损伤症状减轻。VEGF的神经保护机制:①促进微血管内皮细胞增殖、迁移,促使血管生成,改善局部血供,减少梗死体积,而减轻缺血性脑损伤;②直接营养神经细胞,促进神经细胞存活;③调控某些信号,如PI3K/Akt/NF-kB信号通路途径来抑制神经细胞凋亡;④促进神经发生和新神经元的存活,提高脑修复[9-11]。本研究结果显示,参芎化瘀胶囊干预组VEGF阳性细胞较模型组进一步增加,且在高剂量组表现更为明显。说明芎化瘀胶囊可增强脑缺血后VEGF活化效应,与前期的研究结果一致[12]。提示芎化瘀胶囊的脑保护作用与提高脑缺血后VEGF表达有关。
哺乳动物体内的Notch家族有4种受体:Nocth1、Notch2、Notch3和Notch4,是由Notch基因编码,约300 ku的单跨膜蛋白。目前,已证实中枢神经系统中能检测到Notch蛋白及其通路的基因蛋白。研究认为,脑缺血损伤后激活的Notch1通过作用于Akt,PI3-K/PKB/Akt信号通路,从而促进脑缺血损伤后神经细胞的存活[13]。此外,研究显示,Notch1参与缺血脑损伤后血管及神经元的新生过程[14-15]。有学者[16]采用高压氧预处理可以激活Notch信号通路,使其在24 h开始表达,72 h达到高峰,能有效减轻脑梗死后神经功能损伤和梗死面积。国内杨云霞等[17]研究发现,大鼠脑梗死后补充叶酸可以增加脑缺血后Notch1的表达,同时降低梗死体积、减轻脑梗所造成的神经细胞损伤。在本研究中,与假手术组比较,模型组中海马区Notch1阳性细胞增加,而参芎化瘀胶囊干预组中Notch1阳性细胞进一步增加,且在高剂量组表现更为明显,说明芎化瘀胶囊可增强脑缺血后Notch1的表达而发挥神经保护作用。我们发现,脑缺血后VEGF表达与Nocth1呈正相关,同时参芎化瘀胶囊可呈剂量依赖式调节二者变化,结合高低剂量参芎化瘀胶囊对脑缺血后神经细胞存活率的变化,我们认为参芎化瘀胶囊通过调控VEGF/Notch1信号通路改善大鼠缺血性脑卒中损伤。研究认为,组织缺血缺氧诱导VEGF等生长因子表达,可以诱导细胞受体Notch1表达,促进并调控局部血管的新生[18]。
综合本研究的结果,我们认为参芎化瘀胶囊通过调节并稳定脑缺血的微环境,强化脑缺血后VEGF活化效应,进而启动Notch1活化,促进缺血部位血管生成,从而减少再灌注后的神经细胞死亡。
[1] 钟瑜,张众,杨国汗. 川芎嗪对脑缺血再灌注损伤后细胞间黏附作用的影响[J].中西医结合心脑血管病杂志,2003,1(5):257-258.
[2] 胡霞敏,严常开,胡先敏. 人参皂甙Rg1对大鼠脑缺血再灌注损伤细胞凋亡的影响[J]. 中国临床药理学与治疗学, 2006, 11(2):192-195.
[3] 李建民,赵雅宁,陈长香. 参芎化瘀胶囊通过磷脂酰肌醇激酶/蛋白激酶B信号通路抑制全脑缺血大鼠神经细胞凋亡[J]. 解剖学杂志, 2011(34):500-502.
[4] 刘斌,马原源,毛文静,等. 参芎化瘀胶囊对血管性痴呆模型大鼠海马CA1区细胞凋亡及Bcl-2,Bax蛋白表达的影响[J]. 中国实验方剂学杂志, 2011, 17(6):176-179.
[5] WICK A, WICK W, WALTENBERGER J, et al. Neuroprotection by hypoxia preconditioning requires sequential activation of vascular endothelial growth factor receptor and Akt[J]. Neuro Sci, 2002, 22(15):6401-6407.
[6] ANDROUTSELLIS-THEOKIS A, LEKER RR, SOLDNER F, et al. Notch signaling regulates stem cell numbersinvitroandinvivo[J]. Nature, 2006, 442(7104):823-826.
[7] PULSINELI W A, BRIELEY J B. A new model of bilateral hemispheric ischemia in the unanesthetized rat[J]. Stroke, 1979, 10(3):267-272.
[8] 陈懿,王国佐,葛金文. 脑泰方提取物对局灶性脑缺血大鼠血管内皮生长因子表达的影响[J]. 中华中医药杂志,2009,24(2):205-208.
[9] JIN KL, ZHU YH, SUN YJ. Vascular endothelial growth factor(VEGF) stimulates neurogenesisinvitroandinvivo[J]. Neurobiology, 2002, 99(18):11946-11950.
[10] SCHANZER A, WACHS FP, WILHELM D, et al. Direct stimulation of adult neural stem cellsinvitroand neurogenesisinvivoby vascular endothelial growth factor[J]. Brain Pathol, 2004, 14(13):237-248.
[11] 刘斌,刘宁,李建民,等. 脂肪来源的神经干细胞移植对大鼠局灶性脑缺血后VEGF表达的影响[J]. 第二军医大学学报, 2010, 31(11):1247-1250.
[12] 李建民,赵雅宁,安朝旺,等. 参芎化瘀胶囊对全脑缺血再灌注大鼠神经细胞凋亡的影响[J]. 解剖学杂志,2010,33(6):774-776.
[13] 郭怡菁,张志珺,王少华,等. 缺血性卒中大鼠海马的NOTCH信号通路功能的动态变化[J]. 中国神经精神疾病杂志, 2009, 35(6):346-349.
[14] COSTA R M, HONJO T, SILVA AJ. Learning and memory deficits in Notch mutant mice[J]. Curr Biol, 2003, 13(15):1348-54.
[15] 吉亚杰,张博爱,刘荣丽,等. 慢性脑缺血大鼠海马Notch1表达的动态变化[J]. 第三军医大学学报, 2011, 30(24):2621-2624.
[16] HU YH, WU DQ, GAO F, et al. Notch signaling: a novel regulating differentiation mechanism of human umbilical cord blood-derived mesenchymal stem cells into insulin-producing cellsinvitro[J]. Chin Med J, 2010, 123(5):606-614.
[17] 杨云霞,黄国伟,张绪梅,等. 叶酸对脑梗塞大鼠神经细胞凋亡及Notch1mRNA表达的影响[J]. 卫生研究, 2008, 37(6):671-674.
[18] ZHANG GM, ZHANG YM, FU SB, et al. Effects of cloned tumstatin-related and angiogenesis-inhibitory peptides on proliferation and apoptosis of endothelial cells[J]. Chin Med J, 2008, 121(22):2324-2330.
(编辑 卓选鹏)
Shenxiong Huayu capsule attenuates cerebral ischemia injuryby regulating VEGF/Notch1 signal pathway in rats
ZHAO Ya-ning1, LIU Wen-qian1, NIU Jing1, LI Jian-min2,LI Shu-xing1, CHEN Chang-xiang1
(1. Nursing and Rehabilitation College, Hebei United University; 2. Department of Neurosurgery,the Affiliated Hospital of Hebei United University, Tangshan 063000, China)
Objective To investigate the effects of Shenxiong Huayu capsules in treating cerebral ischemia-reperfusion and on vascular endothelial growth factor (VEGF)/Notch1 signal pathway. Methods Male SD rats were divided randomly into four groups: sham operation group, model group, and Shenxiong Huayu capsule low-dose and high-dose treatment groups. Global cerebral ischemia model was created by improved four-vessel occlusion as described according to Pulsinelli’s method. Morphological changes in the hippocampal region were observed by HE staining at 24 h, 48 h and 72 h after ischemia; VEGF and Notch1 expressions were measured by immunohistochemistry. Results Compared with those in sham group, the survival rate of nerve cells decreased significantly at each time point (P<0.05) and VEGF and Notch1 expressions enhanced obviously in model group (P<0.05). Compared with model group, the survival rate of nerve cells increased obviously at each time point and VEGF and Notch1 expressions further increased in the two Shenxiong Huayu capsule groups (P<0.05). The above-mentioned changes were more significant in Shenxiong Huayu capsule high-dose group. VEGF and Notch1 expressions had a positive correlation with each other in model group (r=0.846,P<0.01) and Shenxiong Huayu capsule groups (r=0.814,P<0.01). Conclusion Shenxiong Huayu capsules have a good therapeutic effect on cerebral ischemia injury and the molecular mechanism is related to regulating VEGF/Notch1 signal pathway.
Shenxiong Huayu capsule; cerebral ischemia-reperfusion; vascular endothelial growth factor (VEGF); Notch1
2013-10-24
2014-03-26
河北省科技厅课题基金(No.H2012401007) Supported by Hebei Science and Technology Department Research Fund (No.H2012401007)
李建民,教授. E-mail: lijianmints@sina.com
赵雅宁(1974-),女(汉族),医学博士. 研究方向:脑损伤与脑保护. E-mail: zyning789@126.com
时间:2014-05-16 14∶50 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140918.1003.006.html
R743
A
10.7652/jdyxb201406023

