HPLC 法同时测定蒿甲醚合成液中的青蒿素、双氢青蒿素和β-蒿甲醚
王令兆, 吴洪达 , 刘 柳, 刘含智, 刘天时
(广西科技大学生物与化学工程学院,广西 柳州545006)
青蒿素(artemisinin,ART)是我国科研工作者发现的一种抗疟药,具有低毒、高效、见效快等特点,但它在水中的溶解度很低,故作为抗疟药,其生物利用度不理想,复发性高。因此,科学家们合成了一系列青蒿素的衍生物[1],其中蒿甲醚(artemether,ARM)的抗疟作用是青蒿素的6 倍,具有抗疟迅速、高效、安全、低毒且与大多数抗疟药无交叉抗性等优势,是世界卫生组织充分肯定和推广的特效抗疟药。
蒿甲醚可由青蒿素或双氢青蒿素(dihydroartemisinin,DHA)合成,在制备过程中涉及到青蒿素、双氢青蒿素和β-蒿甲醚的定量测定。目前,这3 种成分含有量的测定方法很多,主要有分光光度法[2-4]、HPLC 法[5-9]等。其中,HPLC 法因其精密度高、稳定性好,以及易于分析测定,因此为最常见的方法,但它又存在待测物前处理复杂、检测成分单一、色谱峰拖尾、分析时间长等不足。
本实验改进了《中国药典》报道的方法[10],建立了一种能同时测定蒿甲醚反应液中青蒿素、双氢青蒿素和β-蒿甲醚含有量的HPLC 法,解决了双氢青蒿素色谱峰拖尾的问题,同时还研究了其α和β 异构体在流动相中相互转化的问题。结果表明,该方法快速、准确,被测组分能在较大浓度范围内作定量分析。
1 仪器与试剂
1.1 仪器 LC-20AT HPLC 色谱仪、SPD-20A 紫外检测器(日本岛津公司);自动双重纯水蒸馏器(上海亚荣生化仪器厂)。
1.2 试剂 青蒿素、双氢青蒿素、β-蒿甲醚对照品(均为HPLC 级)。乙腈为色谱纯(美国Tedia公司);硼氢化钠等均为分析纯(国药集团化学试剂有限公司);二次蒸馏水(自制)。
2 方法和结果
2.1 色谱条件 ODS-C18色谱柱(4.6 mm ×250 mm,5 μm);流动相为磷酸盐(20 mmol/L,pH 为5.0)-乙腈水溶液(40 ∶60);柱温25 ℃;检测波长210 nm;体积流量1.0 mL/min;进样量20 μL。
2.2 标准品溶液的配制 分别精密称取青蒿素40.0 mg、双氢青蒿素20.0 mg 和β-蒿甲醚对照品20.0 mg,用乙腈溶解,配制成8.0 mg/mL 青蒿素、4.0 mg/mL 双氢青蒿素和4.0 mg/mL β-蒿甲醚溶液。然后,精密量取以上溶液适量,混匀,稀释成系列质量浓度的混合溶液,0.45 μm 微孔滤膜过滤,即得。
2.3 反应样品待测溶液的配制 精密吸取反应后的样品溶液1 mL,加NaHCO3溶液淬火以终止反应,再用乙腈定容至5 mL,待样品中的无机盐析出后,取上层清液,0.45 μm 微孔滤膜过滤,即得。
2.4 结果
2.4.1 线性关系 在“2.1”项色谱条件下,取“2.2”项下溶液适量,平行测定3 次,记录峰面积,再以对照品溶液质量浓度(y)分别对青蒿素峰面积、α-、β-双氢青蒿素峰面积之和以及β-蒿甲醚峰面积(x)进行线性回归,结果见表1。由表可知,在一定范围内,被测组分的质量浓度与峰面积均呈良好的线性关系。
2.4.2 精密度 在“2.1”项色谱条件下,取“2.2”项下溶液适量,平行测定3 次。结果,青蒿素、双氢青蒿素和β-蒿甲醚的相对标准偏差分别为1.2%、1.3%、1.2%,表明仪器精密度高,达到HPLC 分析的要求。
2.4.3 回收率 取低、中、高质量浓度的反应液样品各一份,测定其中青蒿素、双氢青蒿素和β-蒿甲醚的含有量,再按《中国药典》中的方法[10],分别精密加入这3 种成分的对照品溶液,制备成9 个供试液,在“2.1”项色谱条件下进行测定,计算回收率,结果见表2。由表可知,三者的平均回收率分别为98.8%、99.2%、101.1%,相对标准偏差RSD 均小于2.55%,表明该方法回收率良好。
2.4.4 反应液样品的分析 取在20℃下反应1.0、1.5 和2.0 h 后的反应液,预处理后分别制成待测溶液,在“2.1”项色谱条件下分析,色谱图见图1,结果见表3。
在图1A 中,双氢青蒿素对照品出现峰1 (6.4 min)和峰2 (8.1 min),这是由于β-双氢青蒿素在流动相中逐步转化为α-双氢青蒿素,表明在流动相中放置的时间越长,其α/β 构型的比值越大,在图中表现为峰1 面积增大,而峰2 面积减小,即前者是α-双氢青蒿素的响应峰,而后者是β-双氢青蒿素的响应峰,与文献[8-9]报道一致。另外,在图1B 中还发现,β-蒿甲醚色谱峰之前有两个新峰,统标为峰5 (t=15.4 min 和t=12.9 min),可能是尚未确定的副产物色谱峰。
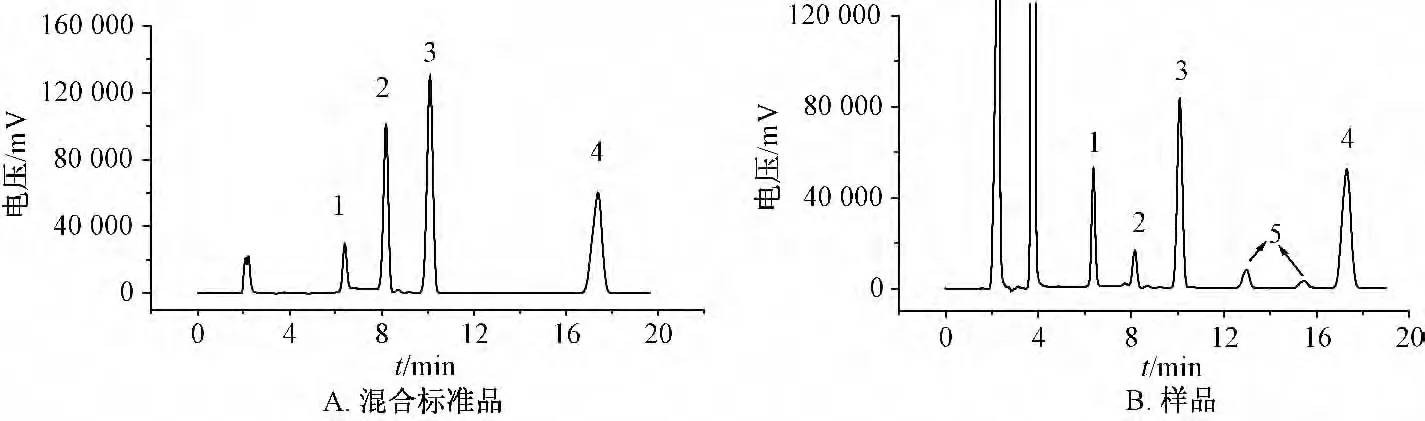
图1 混合标准品和样品的色谱图Fig.1 Chromatograms of mixed standard substances and samples
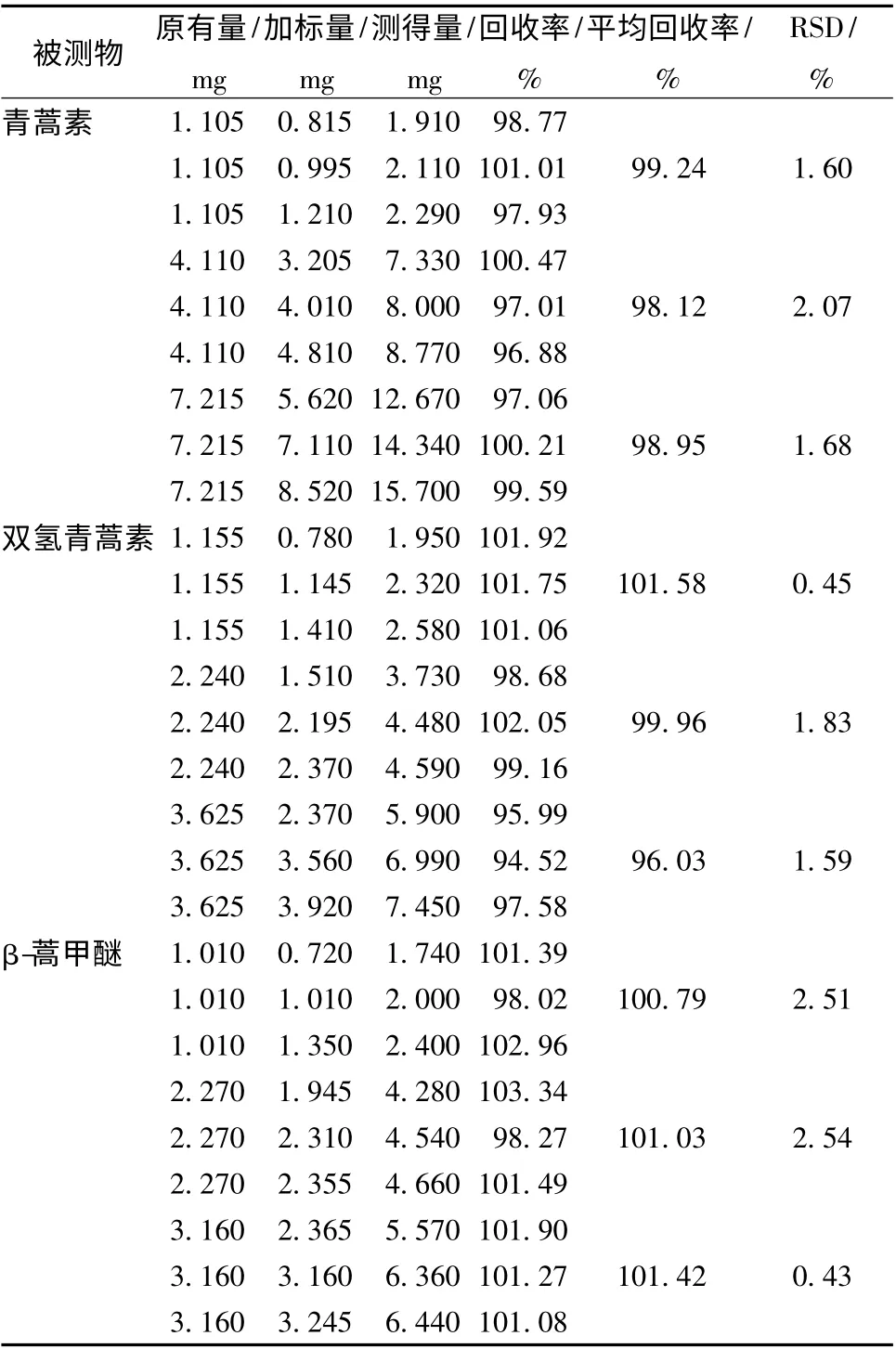
表2 青蒿素、双氢青蒿素和β-蒿甲醚的回收率(n=9)Tab.2 Recoveries of ART,DHA and β-ARM (n=9)
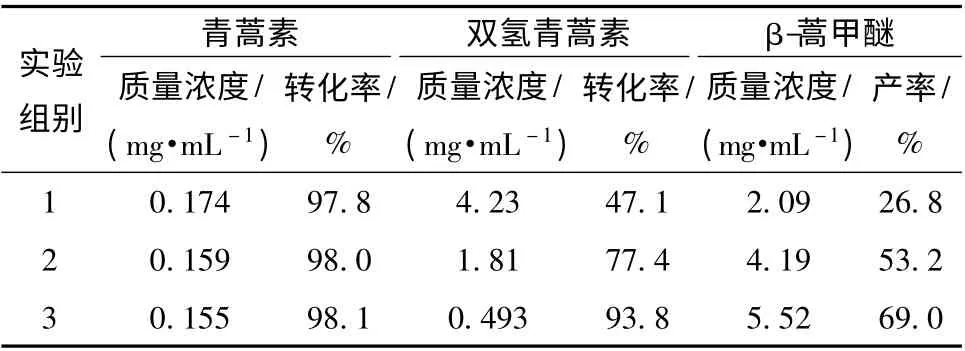
表3 样品的测定结果Tab.3 Determination result of samples
3 讨论
3.1 磷酸盐的作用 根据《中国药典》中的方法[10],HPLC 分析青蒿素和双氢青蒿素的流动相为乙腈-水(60 ∶40)。但是,本实验发现在该流动相下,双氢青蒿素的色谱峰出现拖尾现象,无法完全分离α-和β-双氢青蒿素,见图2,而如果选择磷酸盐缓冲液为流动相时,则峰形明显好转,分离度提高,见图1A。推测拖尾现象出现的原因可能是双氢青蒿素分子中存在羟基,与固定相中的硅羟基有较强的亲和力,导致不易脱附,形成拖尾峰,而当流动相中存在磷酸盐时,磷酸氢根离子减弱了双氢青蒿素与固定相的吸附作用,提高其脱附速率,从而抑制拖尾现象,改善了分离效果。同时,由于双氢青蒿素和蒿甲醚在弱酸性环境下均比较稳定[11-12],故选择NaH2PO4-Na2HPO4(pH 为5.0)-乙腈水溶液为流动相,可避免被测组分在洗脱分离过程中被分解或转化。
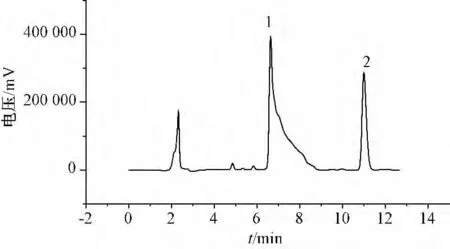
图2 乙腈-水(60 ∶40)为流动相时的HPLC 色谱图Fig.2 HPLC chromatogram of CH3CN ∶H2O (60 ∶40)as mobile phase
3.2 流动相配比的影响 本实验发现,当乙腈与缓冲盐的比例为40 ∶60 时,青蒿素、α-、β-双氢青蒿素和β-蒿甲醚的保留时间均过长,效果不理想。如果增加乙腈比例,则保留时间缩短,分离度提高,而当两者比例为60 ∶40 时,被测组分的色谱峰完全分开,峰型尖锐对称,理论塔板数均在7 000以上,保留时间较短,见图1A。然而,当两者比例为80 ∶20 时,β-双氢青蒿素和青蒿素的色谱峰出现重叠现象,分离度反而有所降低。
3.3 异构体相互转化对测定的影响 研究表明,双氢青蒿素在结晶状态时,以β 异构体存在,而在有机溶剂中,存在α 与β 异构体的相互转化,其反应速率受溶剂性质的影响,因此在对这两种异构体进行定量分析时,需考虑溶剂性质对其相对含有量的影响。文献[12-14]报道,在甲醇-水、乙醇-水以及乙腈-水等混合溶剂中,随着时间延长,α/β 比值不断增大,当最终达到平衡时,其比值与溶剂性质有关。陈有根等[15]报道,双氢青蒿素在乙腈中也存在转化现象,但转化速率较慢,在60 h 后才达到平衡(α/β=2.11 ∶1)。本实验研究了双氢青蒿素异构体在乙腈-磷酸盐水溶液(60 ∶40)中相互转化的速率,结果见图3。

图3 流动相中双氢青蒿素α/β 值随时间的变化Fig.3 Change of α/β ratio of DHA in mobile phase with time
由图3 可知,双氢青蒿素在最初90 min 内的异构化速率较大,而在230 min 时达到平衡,α/β为3.22,故难以通过HPLC 法分别准确测定α-、β-双氢青蒿素的含有量。但是,吴婧等[16]发现,这两个异构体色谱峰面积的比值虽然会随时间而变化,但其峰面积总和不变,即两者的响应值相等。因此,可选两者的峰面积总和作为双氢青蒿素的定量基础。
另外,蒿甲醚也存在α 和β 异构体,但研究显示,β-蒿甲醚在乙腈-磷酸盐水溶液中较稳定。考虑到该化合物是相关药物的有效成分,故本实验只针对β-蒿甲醚进行定量分析研究。
[1] 骆 伟,刘 杨,丛 琳,等. 青蒿素及其衍生物的研究进展[J]. 中国药物化学杂志,2012,22(2):155-166.
[2] 李春莉,王莎莉,王亚平,等. 紫外分光光度法测定青蒿素含量[J]. 重庆医科大学学报,2007,32(4):413-415.
[3] 刘世尧,白志川. UV-Vis 法测定重庆武隆县不同立地条件青蒿样品的含量[J]. 中国药房,2008,19(6):438-440.
[4] 肖文中,詹利之,张美义,等. 三波长分光光度法测定复方双氢青蒿素片中双氢青蒿素的含量[J]. 药学实践杂志,2003,21(2):92-94.
[5] 陈 靖,赵 瑞,陈 俊,等. HPLC-UV-ELSD 联用测定黄花蒿叶片中青蒿素及相关倍半萜的含量[J]. 沈阳药科大学学报,2008,25(11):896-890.
[6] 丁小莉,吴 强,陈小波,等. UV 法与HPLC 法测定青蒿中青蒿素含量的比较[J]. 中国药房,2011,22(3):246-248.
[7] Souppart C,Gauducheau N,Sandrenan N,et al. Development and validation of a high-performance liquid chromatography-mass spectrometry assay for the determination of artemether and its metabolite dihydroartemisinin in human plasma[J]. J Chromatogr B,2002,774(2):195-203.
[8] Chimanuka B,Gabriels M,Detaevernier M R,et al. Preparation of β-artemether liposomes,their HPLC-UV evaluation and relevance for clearing recrudescent parasitaemia in Plasmodium chabaudi malaria-infected mice[J]. J Pharm Biomed Anal,2002,28(1):13-22.
[9] Rajanikantha M,Madhusudananb K P,Guptaa R C,et al.Liquid chromatographic-mass spectrometric method for the determination of α-,β-arteether in rat serum[J]. J Chromatogr B,2003,783(2):391-399.
[10] 国家药典委员会. 中华人民共和国药典:2010 年版二部[S]. 北京:中国医药科技出版社,2010:70,420,1062.
[11] 吴 越,刘中秋,黄 娟,等. 蒿甲醚与亚铁盐合用的稳定性考察[J]. 中国医院药学杂志,2011,31 (6):467-469.
[12] 王仲山,曹秀玲. 二氢青蒿素的变旋作用与差向异构体转化研究[J]. 药学学报,1988,23(8):610-615.
[13] Navaratnam V,Mordi M N,Mansor S M. Simultaneous determination of artesunic acid and dihydroartemisinin in blood plasma by high-performance liquid chromatography for application in clinical pharmacological studies[J]. J Chromatogr B,1997,692(1):157-162.
[14] 刘 宁,杨腊虎,俞如英. 对双氢青蒿素异构体的一些研究和分析[J]. 现代科学仪器,2002(2):52-54.
[15] 陈有根,余伯阳. 蒿甲醚在模拟体内酸碱环境中的代谢动力学研究[J]. 色谱,2002,20(1):37-39.
[16] 吴 婧,王锐利,申薇薇,等. 高效液相—柱后衍生化法同时测定双氢青蒿素和哌喹[J]. 中国药物与临床,2009,9(3):178-181.

