替米沙坦对糖尿病高血压大鼠肾内小动脉重构的影响
黄鑫涛,洪华山,李小红,李鸿雁,闫晓景,李之恒,李中原
· 论著 ·
替米沙坦对糖尿病高血压大鼠肾内小动脉重构的影响
黄鑫涛,洪华山,李小红,李鸿雁,闫晓景,李之恒,李中原
目的探讨糖尿病高血压大鼠(DSHR)的肾内小动脉(IRSAs)的重构及替米沙坦对IRSAs重构的影响。方法40只12周自发性高血压大鼠(SHR)随机分成4组,SHR对照组、DSHR组、高剂量治疗组、低剂量治疗组,每组10只。同时20只12周龄、性别配对的京都威斯特(WKY)大鼠随机分2组,一组为正常对照组(WKY组),一组制成DWKY组,各组均为10只。低剂量治疗组、高剂量治疗组为SHR雄性大鼠STZ建模后,分别给予替米沙坦灌胃。其余仅给予蒸馏水灌胃。DSHR组及DWKY组仅注射链脲佐菌素(STZ)建模。8周后终止实验。取左侧肾脏经苏木素-伊红(HE)、苦味酸-天狼猩红(Sirius-red)、弹力纤维和胶原纤维双重染色(P/VB法),IRSAs按血管外径大小分20~49μm组、50~99μm组、100~200μm组,计算机辅助成像系统计算各组IRSAs血管壁面积(WA)、血管壁厚(WT)、血管腔径(ID)及壁腔比(WT/ID)。各组切片以α-平滑肌肌动蛋白(α-SMA)、鼠抗人巨噬细胞单克隆抗体(ED1)、Ⅲ型胶原(COLⅢ)抗体免疫组化染色,ED1阳性细胞计数,COLⅢ光密度IOD比较。原位末端标记(TUNEL)检测IRSAs血管壁细胞凋亡、增殖细胞核抗原PCNA免疫组化评估IRSAs血管壁细胞增殖,分别计算凋亡指数(AI)和增殖指数(PI)。结果①与WKY组比较,DWKY组血管WT增加,ID明显减小,差异有统计学意义(P均<0.05)。外径50~99μm组与100~200μm组的IRSAs重构相似,但50~99μm组WT/ID增加更为显著。与DWKY组和SHR组比较,DSHR组WT、WA、WT/ID均升高,差异有统计学意义(P均<0.05)。替米沙坦干预8周,高剂量治疗组和低剂量治疗组WT、WT/ID及WA均较DSHR组明显改善,差异有统计学意义(P均<0.05)。②SHR组和DWKY组血管PCNA阳性率比WKY组增高;与DSHR组比较,高剂量治疗组和低剂量治疗组PI均显著降低,但二者阳性差异有统计学意义(P<0.01)。高血压合并糖尿病时细胞PCNA阳性较单一糖尿病或高血压明显,虽然无论高剂量还是低剂量替米沙坦治疗8周均能明显减少血管壁PCNA阳性细胞数,但前者作用更为明显。③与WKY组比较,DSHR组、SHR组、DWKY组IRSAs中膜凋亡细胞指数减少,差异有显著统计学意义(P均<0.01)。④ 肾小球数目:与WKY组比较,DWKY组肾小球数目明显减少[(423.8±37.4)个 vs.(338.7±40.5)个],差异有显著统计学意义(P均<0.01),SHR组未见肾小球明显减少。DSHR组较DWKY组肾小球减少[(301.4±35.2)个 vs. (338.7±40.5)个],差异有统计学意义(P<0.05)。⑤ 血管外膜及周围COLⅢ光密度(IOD):与WKY组比较,SHR组和DWKY组血管外膜COLⅢ组化染色IOD值增加,差异有统计学意义(P均<0.05);与SHR组及DWKY组比较,DSHR外膜及血管周围COLⅢ组化染色IOD值增加,差异有统计学意义(P均<0.05)。高剂量治疗组较DSHR组IOD值显著减少,差异有统计学意义(P<0.01)。⑥ 替米沙坦治疗对DSHR的影响:高剂量替米沙坦能降低血压,低剂量不影响大鼠血压。治疗组能够减轻WT、WA、WT/ID增加、减少中膜细胞增殖,减轻肾小球减少及减少COLⅢ过度沉积,高剂量治疗组作用较低剂量治疗组明显。结论①DWKY、SHR、DSHR的IRSAs均发生明显重构,以DSHR重构最为显著。②RSAs重构的细胞学机制主要与中膜VSMC的增殖、凋亡失衡和COLⅢ过度沉积有关。③高剂量与低剂量替米沙坦治疗均能减轻IRSAs重构,高剂量更为有效。替米沙坦减轻血管重构(VR)可能与改善增殖凋亡平衡等作用有关。
糖尿病性高血压;肾内小动脉;血管重构;平滑肌细胞;替米沙坦;大鼠
近年来,对于高血压大鼠肾内小动脉(intrarenal small arteries,IRSAs)重构的研究明确了动脉重构的存在[1,2],但重构的具体部位及其细胞学机制尚未明确。国内外尚无文献报道血管紧张素Ⅱ受体拮抗剂(angiotensin receptor blocker,ARB)对自发性高血压合并糖尿病大鼠IRSAs重构的影响。自发性高血压大鼠(spontaneously hypertensive rats,SHR)腹腔一次性注射链脲佐菌素(STZ)制作糖尿病合并高血压模型,操作简单,相对CR糖尿病高血压大鼠(Cohen-Rosenthal diabetic hyperten-sive rats,CRDH)、肥胖Zucker大鼠成本较低,是研究高血压合并糖尿病较为理想的动物模型[3-5]。本研究旨在明确IRSAs重构的部位及其细胞学基础,替米沙坦对糖尿病高血压大鼠(diabetic SHR,DSHR)IRSAs重构的干预作用及其可能机制。
1 材料与方法
1.1 材料12周龄雄性清洁级SHR 40只、京都威斯特大鼠(Wistar-Kyoto,WKY)20只,体重250~300g,均购自上海斯莱克实验动物有限责任公司,合格证书号:SCXK(沪2006-0003);12 h光照/黑暗,饲料、垫料高压灭菌,自由摄食进水。所有动物研究全部符合国家《实验动物管理条例》和《福建省实验动物管理条例实施细则》。糖尿病组(diabetic Wistar-Kyoto,DWKY)及DSHR模型的建立:大鼠隔夜禁食至少8~10 h,称取链脲佐菌素(Sigma公司),临用前配制链脲佐菌素-柠檬酸-柠檬酸盐缓冲液(0.1M/L,pH4.4)按照50 mg/kg剂量一次性腹腔注射(ip),造成糖尿病模型。72 h后抽血查空腹血糖>16.67 mmol/L,为模型成功。
1.2 方法
1.2.1 分组及干预40只12周SHR雄性大鼠随机分成4组,SHR对照组、DSHR组、高剂量治疗组、低剂量治疗组,每组10只。同时20只12周龄、性别配对的WKY大鼠随机分2组,一组为正常对照组(WKY组),一组制成DWKY组,各组均为10只。低剂量治疗组、高剂量治疗组为SHR雄性大鼠STZ建模后,分别给予替米沙坦(河南天方药业股份有限公司,国药准字H20041746)0.5 mg·kg-1·d-1、5 mg·kg-1·d-1灌胃。其余仅给予蒸馏水灌胃。DSHR组及DWKY组仅STZ建模。8周后终止实验。
1.2.2 血糖、血压测定大鼠禁食8~10 h,于清醒状态下固定于鼠套内,75%酒精消毒后用2 ml针筒抽取大鼠尾静脉血1~2 ml,送本院生化室检验。建模前、建模后72 h及处死前各测一次血糖。大鼠于40℃预热15 min,用RBP-1B型大鼠血压仪测量大鼠清醒安静状态下尾动脉收缩压(SBP)。12周龄至16周龄,每周测一次血压,之后每两周测一次血压。
1.2.3 标本收集各组分别干预8周后终止实验。每只大鼠称重后用氯胺酮/地西泮混合(75/5 mg·kg-1)腹腔注射(ip)麻醉后固定于手术台上,常规手术区消毒、铺巾,迅速开胸,用外科剪在右心耳处剪一小孔。输液管针头刺入左心室,连接100 ml注射器针筒,迅速以生理盐水灌洗,待肾脏颜色呈浅红色或白色,以外科剪留取肾脏,标本沿最大冠状切面切开,之后置于10%的中性甲醛中保存。常规石蜡包埋后,每个组织块做连续切片(厚度5μm),苏木素-伊红(HE)染色、苦味酸-天狼猩红(Sirius-red)染色、弹力纤维和胶原纤维的双重染色(P/VB)、TUNEL染色及免疫组化染色。
1.2.4 染色切片的病理学测量应用显微镜计算机辅助图像分析系统,常规HE染色对肾脏和血管形态评价。Sirius-red染色,按Isoyama[6]描述的方法,将血管按外径大小分3组,20~49μm 组每切片计数2~3个,50~99μm 组每切片计数3~5个,100~200μm 组每切片计数2~3个取平均值。IRSAs壁横截面积依据Tanaka[7]介绍的方法略做改动:分别沿内膜与管腔,中膜与外膜接触面画圈,Image-pro Plus自行运算计算血管腔径平均值(ID),血管中膜面积(WA)、血管中层厚度(WT),壁/腔比(WT/ID),因外膜与血管周围纤维化连在一起不能准确区分,暂不计入。P/VB染色[7]可将内膜与中膜明显区分,结合HE染色及Sirius-red染色对血管重构(vascular remodeling,VR)及管壁增厚部位做出更好评价。在Sirius-red染色下,观察整张切片肾小球的总数量。
1.2.5 PV6001/6002两步法免疫组化染色的判断方法PCNA免疫组化染色每只大鼠随机选取1张切片,每张切片随机选择10条直径20~200 μm的IRSAs,计数血管壁增殖细胞核抗原(PCNA)阳性细胞数占血管细胞总数百分比,即增殖指数(PI);鼠抗人巨噬细胞单克隆抗体(ED1)免疫组化染色每只大鼠随机选取1张切片,每张切片随机取10个视野,计算每平方毫米ED1阳性细胞数(个/mm2)。
1.2.6 TUNEL染色标记IRSAs凋亡细胞判断方法TUNEL阳性细胞核呈红色。每张切片随机选择10根直径20~200μm的IRSAs,计数动脉壁TUNEL阳性细胞数占细胞总数百分比,即凋亡指数(AI)。
1.3 统计处理SPSS 13.0统计软件进行分析,计量资料以均数±标准差(±s)表示,组间比较采用方差分析(One-Way ANOVA),先确定样本是否符合正态分布,再行方差齐性检验,根据方差齐性选用检验方法,LSD-t和SNK-q检验或Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 IRSAs的重构及替米沙坦干预的作用与WKY组比较,DWKY组血管WT增加,ID明显减小,差异有统计学意义(P均<0.05)。外径50~99μm组与100~200μm组的IRSAs重构相似,但50~99μm组WT/ID增加更为显著。与DWKY组和SHR组比较,DSHR组WT、WA、WT/ID均升高,差异有统计学意义(P均<0.05)。替米沙坦干预8周,高剂量治疗组和低剂量治疗组WT、WT/ID及WA均较DSHR组明显改善,差异有统计学意义(P均<0.05)(表1)。
2.2 IRSAs中膜细胞增殖的变化采用PCNA免疫组化染色来识别增殖细胞。染色结果PCNA在血管壁的外膜、中膜、内膜均有表达。本实验仅计数位于IRSAs中膜的PCNA阳性细胞及中膜细胞总数。SHR组和DWKY组血管PCNA阳性率比WKY组增高;与DSHR组比较,高剂量治疗组和低剂量治疗组PI均显著降低,但二者阳性差异有统计学意义(P<0.01)。高血压合并糖尿病时细胞PCNA阳性较单一糖尿病或高血压明显,虽然无论高剂量还是低剂量替米沙坦治疗8周均能明显减少血管壁PCNA阳性细胞数,但前者作用更为明显(表2)。
2.3 IRSAs中膜细胞凋亡的变化为了研究细胞凋亡是否参与IRSAs重构,本实验采用TUNEL标记凋亡细胞。各组IRSAs全层均有TUNEL标记细胞,外膜及中膜处比较明显。本实验仅计数位于IRSAs中膜的TUNEL标记细胞及中膜细胞总数。与WKY组比较,DSHR组、SHR组、DWKY组IRSAs中膜凋亡细胞指数减少,差异有显著统计学意义(P均<0.01)(表2)。
2.4 IRSAs中膜处于增殖或凋亡状态的细胞类型判定为了判定处于PCNA或TUNEL标记阳性状态的细胞类型,α-平滑肌肌动蛋白(α-SMA)免疫组化染色。结果:IRSAs中膜呈阳性表达,说明为中膜血管平滑肌细胞(vascular smooth muscle cell,VSMC),而PCNA阳性细胞在血管壁全层表达。TUNEL阳性细胞主要位于血管的中膜及外膜,提示VSMC的增殖和凋亡参与IRSAs的重构,增殖与凋亡失衡可能是 IRSAs重构的重要机制(图1)。
2.5 各组大鼠肾小球数目变化在Sirius-red染色下,计数整张切片肾小球数目,比较肾小球数目的变化。与WKY组比较,DWKY组肾小球数目明显减少[(423.8±37.4)个 vs. (338.7±40.5)个],差异有显著统计学意义(P均<0.01),SHR组未见肾小球明显减少。DSHR组较DWKY组减少[(301.4±35.2)个 vs. (338.7±40.5)个],差异有统计学意义(P<0.05)。
2.6 血管外膜及周围Ⅲ型胶原(COLⅢ)变化前述Sirius-red染色下观察到血管外膜发生显著纤维化,免疫组化示COLⅢ在血管外膜及周围过度沉积。与WKY组比较,SHR组和DWKY组血管外膜COLⅢ组化染色IOD值增加,差异有统计学意义(P均<0.05);与SHR组及DWKY组比较,DSHR外膜及血管周围COLⅢ组化染色IOD值增加,差异有统计学意义(P均<0.05)。提示高血压、糖尿病二者对血管外膜及血管周围纤维化有协同作用。高剂量治疗组较DSHR组IOD值显著减少,差异有统计学意义(P<0.01)。
2.7 ED1阳性细胞在各组肾内表达DSHR组肾内ED1阳性表达均高于DWKY组、SHR组,差异有统计学意义(P均<0.05)。与DSHR组对比,低剂量治疗组降低了ED1的数量,高剂量治疗组下降更明显,差异有统计学意义(P均<0.05)(表2)。
2.8 IRSAs旁ED1阳性细胞与IRSAs重构相关分析WT/ID在各组VR中均升高,提示血管重构。WT/ID与ED1阳性细胞个数呈正相关,相关系数r=0.507(P<0.01)。
3 讨论

表1 各组大鼠IRSAs重构的参数比较
VR的指标包括血管壁增厚、血管壁腔比增高和小动脉的稀少,随之产生血管功能异常[8]。本研究观察到20周龄的SHR的IRSAs发生了明显的重构,其重构与Dzau等[9]所述小动脉,通过对IRSAs弹力纤维的染色,将中膜与内膜明显区分,可见增厚的部位主要为血管中膜,不同外径、不同疾病状况下VR有一定差异,主要表现在WT、WT/ID的增加,不伴有WA的改变,在糖尿病合并高血压时的协同效应主要表现在WT/ID比值增加。50~200μm的血管除了上述改变外,尚伴有内径的减小和壁面积的增加,各组重构血管中层VSMC计数,发现细胞增多,PCNA免疫组化阳性,提示IRSAs重构与VSMC增生有关;低剂量替米沙坦能显著降低WT、WA,增加WT/ID改善VR,但高剂量改变更明显。VR包括微细动脉和毛细血管的数目改变[10],肾小球是肾内最小的结构性血管团,本研究发现,8周后DWKY肾小球数量明显降低,8周内SHR肾小球的数目没有明显减少,但DSHR与DWKY肾小球数目存在差异,糖尿病对肾小球的损害可能较高血压发生时间早,高血压对糖尿病造成的肾小球减少有促进作用。低剂量替米沙坦可抑制肾小球减少,高剂量替米沙坦抑制肾小球减少的作用更为显著。

图1 各组大鼠α-SMA免疫组化染色,AEC显色,苏木素复染,阳性呈红色,为血管中层VSMC(A:WKY组;B:DWKY组;C:SHR组;D:DSHR组;E:高剂量治疗组;F:低剂量治疗组)
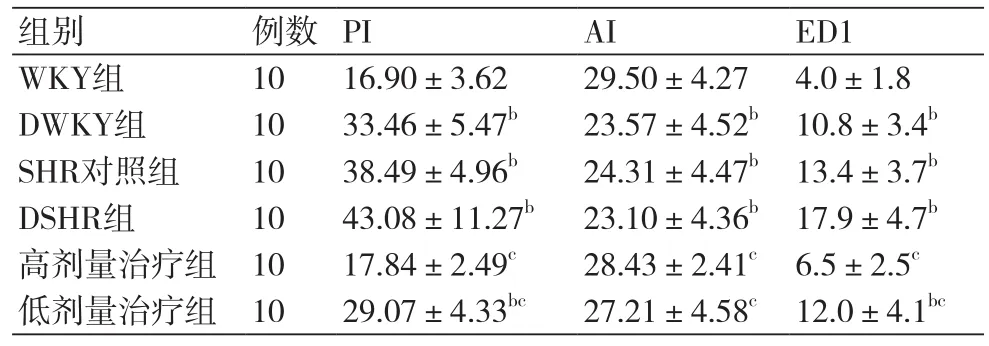
表2 不同种类大鼠肾IRSAs中膜PI、AI及ED1比较
肾内小血管中膜的α-SMA的免疫组化染色证实增厚的部位是中膜VSMC,VSMC增生与凋亡的不平衡是导致血管WT、WA以及WT/ID改变的直接原因。本研究发现不同外径的血管其VR方式不同,外径20~49μm血管WT、WT/ID增加,但WA无明显改变,细胞核计数也未发现组间差异。推测50μm以内的VR主要与VSMC重排有关。PCNA是一种核蛋白,与细胞增殖有密切关系。高血压、糖尿病TRSAs血管壁增殖细胞均明显增多,二者有协同作用。细胞核计数也观察到血管壁细胞总数的变化,可以证实VSMC增生是导致VR的重要原因。高剂量治疗组和低剂量治疗组PI的下降,提示替米沙坦治疗可通过减少IRSAs中膜VSMC的增殖减轻VR。细胞凋亡发生于VR过程中,VSMC的凋亡被认为是VR的一个基本控制因素[10]。在多种疾病状态下,VSMC虽然细胞凋亡增加,但与增生失调。本研究观察到20周龄的SHR、DWKY组IRSAs的VSMC凋亡指数下降,说明凋亡也参与IRSAs重构。替米沙坦剂量依赖性地改善凋亡与增殖平衡而维持血管的正常结构。高血压、高脂血症等VR首先看到的就是血管外膜的改变[11]。胶原是最重要的一类细胞外基质,本研究中观察到外膜COLⅢ的改变,SHR、DWKY、DSHR表达依次增强。表明高血压、糖尿病等多种状况下,血管外膜COLⅢ沉积,诸因素彼此有协同效应[12]。虽然低剂量替米沙坦能明显抑制COLⅢ过度表达,改善血管外膜及血管周围纤维化,但高剂量更为有效。在高血压VR中,炎症起着重要的作用[13],炎症对重构血管的生长、凋亡和纤维化均有影响[14]。IRSAs重构尚无相关报道。我们探索观察ED1阳性细胞是否与IRSAS重构有关。观察到SHR、DWKY、DSHR肾内巨噬细胞主要分布于血管周围及肾小球旁,数量明显增多。使用替米沙坦干预8周,巨噬细胞数目减少,伴随VR减轻,上述提示炎症可能与IRSAs的重构有关,替米沙坦除了通过降压机制发挥作用外,抑制血管炎症反应可能是不依赖于降低血压发挥抗VR的机制之一,但有待进一步研究证实。
激活的核转录因子过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor gamma,PPAR-γ)复合物影响调节游离脂肪酸代谢、胰岛素敏感性和脂肪分化基因的表达,在血管壁细胞上,PPAP-γ激动剂发挥了抗炎,抗氧化和抗增殖的效应[15]。替米沙坦与PPAR-γ配体吡格列酮在结构上有相同之处,可部分激活PPAR-γ。激活程度可达到吡格列酮、罗格列酮的25%~30%,改善糖脂代谢,还能避免体重增加、脂肪堆积、水钠潴留等副作用。PPAR-γ与激动剂结合后,可通过抑制IκB的激酶IKK活性,阻止IκB降解;减少与NF-κB相结合的P50/ P65烷基化二聚体水平或直接抑制NF-κBDNA合成等抑制炎症反应进程[16],本研究观察到低剂量替米沙坦治疗对改善血管重构发挥部分作用,是否与PPAR-γ部分激动有关有待研究。
综上所述,DWKY、SHR、DSHR的IRSAs均发生明显重构,而以DSHR重构最为显著;IRSAs重构的细胞学机制主要与中膜VSMC的增殖、凋亡失衡和COLⅢ过度沉积有关;高剂量替米沙坦降低血压,低剂量替米沙坦不影响血压。替米沙坦治疗能减轻IRSAs重构,可能与降血压及改善增殖凋亡平衡等有关。本研究因为要观察到高血压和糖尿病对IRSAs的慢性损害,造成实验周期过长,但形态学证据表明IRSAs发生了显著重构,高血压合并糖尿病存在,IRSAs重构程度加重,为多因素并存下VR的特点和机制提供了相应的证据。
[1] 陈剑玲,陈涛,商黔惠,等. 高盐饮食诱导Wistar大鼠颈动脉重塑的机制及替米沙坦的干预[J]. 中国动脉硬化杂志,2014,22(7):655-62.
[2] 曹相玫,孙金萍,景丽,等. 原发性高血压大鼠动脉血管重构的形态学研究[J]. 重庆医学,2012,41(27):2801-3.
[3] Takatori S,Fujiwara H,Zamami Y,et al. Decreased perivascular CGRP-containing nerves in Otsuka Long-Evans Tokushima Fatty rats with insulin resistance and hypertension[J]. Hypertens Res,2014,37(5):398-404.
[4] 刘洋,马强,杨光,等. 糖尿病大鼠肾小管间质早期病变及肾康注射液的干预治疗[J]. 中华医学杂志,2015,95(4):289-93.
[5] 李同华,田建伟,刘朝中,等. 糖尿病高血压大鼠动物模型的制备及稳定性观察[J]. 现代生物医学进展,2013,13(26):5022-4.
[6] Isoyama S,Ito N,Satoh K,et al. Collagen deposition and the reversal of coronary reserve in cardiac hypertrophy[J]. Hypertension,1992,20(4): 491-500.
[7] Tanaka M,Fujiwara H,Onodera T,et al. Quantitative analysis of narrowings of intramyocardial small arteries in normal hearts,hypertensive hearts,and hearts with hypertrophic cardiomyopathy[J]. Circulation,1987,75(6):1130-9.
[8] 崔豹,马露,曾源,等. 颈动脉血管重构与斑块稳定性关系的研究[J]. 中华老年心脑血管病杂志,2015,17(4):375-8.
[9] 绍勋,尹雪艳. 高血压性血管重构研究进展[J]. 医学信息,2015,28(12):344-5.
[10] 周希,李法琦,余江恒,等. 替米沙坦对高血压大鼠血管重构和AngⅡ1型受体表达的影响[J]. 中国老年学杂志,2013,33(6):1317-20.
[11] 李晓艳,岳文胜,陈艳,等. 代谢综合征颈动脉粥样硬化血管外膜重构的超声评价[J]. 中华医学杂志,2015,95(1):52-5.
[12] 路丹,丁文惠. 外膜炎症在血管重构中的作用[J]. 生理科学进展,2015,46(2):126-8.
[13] 吴进寿,洪华山. 自发性高血压大鼠心肌内小冠脉重构与炎症关系的观察[J]. 中国医药科学,2013,3(21):19-23,43.
[14] 刘斌. 氧化应激和肺动脉高压血管重构[J]. 中国动脉硬化杂志,2011,19(6):539-42.
[15] 杨源瑞,郑波,周振华,等. 猪颈动脉支架植入术后PPAR-γ的表达变化及对血管平滑肌表型转化的影响[J]. 第三军医大学学报,2014,36(4):321-5.
[16] 徐飞,乔万海,王立明. MODS患者外周血单个核细胞内PPARγ与NF-κB的表达和关系[J].中国急救医学,2015,35(3):230-3.
Remodeling of intrarenal small arteries in rats with diabetic hypertension and influence of telmisartan on the remodeling
HUANG Xin-tao*, HONG Hua-shan, LI Xiao-hong, LI Hong-yan, YAN Xiao-jing, LI Zhi-heng, LI Zhong-yuan.*Second Department of Cardiovasology, Central Hospital of Zhumadian City, Henan Province, Zhumadian 460000, China.
HONG Hua-shan, E-mail: 40088248@qq.com
ObjectiveTo investigate the remodeling of intrarenal small arteries (IRSAs) in diabetic spontaneous hypertension rats (DSHR), and the influence of telmisartan on IRSAs remodeling.MethodsMale SHR rats (12 weeks old, n=40) were randomly divided into SHR group, DSHR group, high-dose group and low-dose group (each n=10), and at the same time, WKY rats (12 weeks old, n=20) were randomly divided into normal controlgroup (WKY group) and diabetic WKY group (DWKY group, each n=10). The low-dose group and high-dose group were intragastrically given telmisartan, and other groups were intragastrically given distilled water after model establishment with STZ. IRSAs were divided, according to external diameters of vessels, into 20 μm-49 μm group (20-49 group), 50 μm-99 μm group (50-99 group) and 100 μm-200 μm group (100-200 group). The wall area (WA), wall thickness (WT) and internal diameter (ID) of IRSAs and ratio of WT to ID (WT/ID) were calculated by using computer-assisted image analysis system in all groups. IRSAs sections were stained with α-SMA, ED1 and COLIII immunohistochemistry technique for counting ED1 positive cells and comparing integrated optical density (IOD) of COLIII in all groups. The wall cell apoptosis of IRSAs was detected by using TUNEL, wall cell proliferating of IRSAs was reviewed by using PCNA immunohistochemistry technique, and apoptosis index (AI) and proliferating index (PI) were calculated respectively.Results①Compared with WKY group, WT increased, ID decreased significantly (all P<0.05). IRSAs remodeling was similar in 50-99 group and 100-200 group, but increased more significantly in 50-99 group. Compared with DWKY group and SHR group, WT, WA and WT/ID increased (all P<0.05) in DSHR group. After telmisartan intervention for 8 w, WT, WT/ID and WA were improved significantly in high-dose group and low-dose group compared with DSHR group (all P<0.05). ②The positive rate of PCNA increased in SHR group and DWKY group compared with WKY group. PI decreased significantly in high-dose group and low-dose group compared with DSHR group (P<0.01). PCNA positive was more significant in SHR than that in rats with only diabetes or hypertension. Telmisartan in high-dose or low-dose decreased significantly PCNA positive cells after 8 w, but high-dose telmisartan had more significant effect. ③Compared with WKY group, AI decreased in DSHR group, SHR group and DWKY group (all P<0.01). ④Compared with WKY group, the number of glomeruli decreased significantly in DWKY group [(423.8±37.4) vs. (338.7±40.5), all P<0.01], and there was no glomeruli decrease in SHR group. Compared with DWKY group, the number of glomeruli decreased in DSHR group [(301.4±35.2) vs. (338.7±40.5), P<0.05]. ⑤Compared with WKY group, IOD of COLⅢ increased in SHR group and DWKY group (all P<0.05). Compared with SHR group and DWKY group, IOD of COLⅢ increased in DSHR group (all P<0.05). IOD of COLⅢ decreased in high-dose group compared with DSHR group (P<0.01). ⑥High-dose telmisartan reduced blood pressure, and low-dose telmisartan had no effect on blood pressure. The increases of WT, WA and WT/ID were relieved, proliferation was reduced, decrease of glomeruli number was alleviated and COLⅢ overdeposition was decreased in treatment groups, which was more significant in high-dose group.Conclusion①The remodeling of IRSAs occurred in DWKY group, SHR group and DSHR group, and was more significant in DSHR group. ②The remodeling of RSAs is mainly related to the proliferation of VSMC, abnormal apoptosis and COLⅢ overdeposition. ③High-dose telmisartan and low-dose telmisartan all can alleviate the remodeling of RSAs, and high-dose telmisartan is more effective. The relieving effect of telmisartan on vascular remodeling maybe related to the improvement of proliferation and apoptosis balance.
Diabetic spontaneous hypertension; Intrarenal small arteries; Vascular remodeling; Smooth muscle cell; Telmisartan; Rats
R587.1
A
1674-4055(2015)06-0821-06
2015-07-06)
(责任编辑:姚雪莉)
460000 驻马店,河南省驻马店市中心医院心血管内二科(黄鑫涛,李小红,李鸿雁,闫晓景,李之恒,李中原);福建医科大学附属协和医院干部病房科(洪华山)
洪华山,E-mail:40088248@qq.com
10.3969/j.issn.1674-4055.2015.06.31

