仿病毒基因递送系统研究进展
李 硕,蔡晓军,李 敢,顾忠伟
(1.四川大学 国家生物医学材料工程技术研究中心,四川 成都 610064)(2. 重庆理工大学化学化工学院,重庆400054)(3. 胜利油田石油工程技术研究院 修井与完井技术研究中心,山东 东营257000)
特约专栏
第一作者:李硕,男,1984年生,博士,讲师
仿病毒基因递送系统研究进展
李硕1,2,蔡晓军1,李敢3,顾忠伟1
(1.四川大学 国家生物医学材料工程技术研究中心,四川 成都 610064)(2. 重庆理工大学化学化工学院,重庆400054)(3. 胜利油田石油工程技术研究院 修井与完井技术研究中心,山东 东营257000)
摘要:基因治疗作为一种极富潜力、可用于替代传统化学治疗的方法,为先天遗传性疾病和严重后天获得性疾病的治疗提供了一条新途径。成功的基因治疗依赖于开发高效、低毒的多功能基因传递系统。目前的非病毒基因载体在转染效率方面低于病毒载体,而通过自组装方式构建的仿病毒基因载体系统可大幅提高转染效率与生物兼容性,将为基因治疗提供更为有效的策略和方案,具有广阔的应用前景。仿病毒载体主要目标是模拟病毒蛋白衣壳包裹、运输核酸的转染方式,根据其构建模式可分为3类: 环境响应型仿病毒“壳-核”结构载体系统;自组装型仿病毒载体;纳米颗粒作为组装基元组构成的仿病毒载体。综述了近年来涌现的仿病毒载体的最新研究进展,并对仿病毒研究的现状与发展趋势进行了评述。
关键词:自组装;仿病毒载体;基因治疗;肽类树状大分子;仿病毒衣壳
Advance in Research of Virus-Mimic Gene Delivery Systems
1前言
基因治疗是利用分子生物学方法将目的基因导入患者体内,使之表达后发挥相应功能,从而抑制或治疗疾病。作为现代医学和分子生物学相结合而诞生的新技术,基因治疗可用于治疗先天性遗传疾病和严重后天获得性疾病[1]。到2013年为止,全球基因治疗的临床方案共有1 853例,基因治疗逐渐向主流医疗模式发展。对癌症进行靶向治疗,是基因治疗领域最重要的研究项目之一,目前研究、应用较多的如p53等肿瘤抑制基因[2]。2003年10月16日,国家食品药品监督管理局批准了重组人p53腺病毒注射液的新药证书,意味着世界上第一个针对癌症的基因治疗药物在中国诞生。2012年11月2日,欧洲药监机构首次批准荷兰生物技术公司UniQure生产的基因治疗药物Glybera成为临床药物,该药被用来治疗遗传性疾病-脂蛋白脂酶缺乏症(LPLD),这对基因治疗来说,具有里程碑意义[3]。目前至少有11个使用 siRNA 的临床试验已获批准,如QuarK/Pfizer公司的PF-04523655已进入Ⅱ期临床试验。对于双链RNA药物的研究也方兴未艾[4-5]。
2基因治疗的实施方式
基因治疗的实施方式多种多样,但都离不开将外源基因高效地导入细胞。DNA分子通常以带负电的疏松状态存在,体积较大、负电荷与细胞表面之间存在排斥作用,难于进入细胞;另外,血液及细胞内存在大量的水解酶尤其是核酸酶,能破坏裸DNA分子,因此单独使用DNA转染效率较低,需要借助物理方法或使用基因载体辅助DNA转染。物理方法需要使用专门的设备,不能进行全身性使用,并且会对组织和细胞产生严重损害。目前运载基因效率最高的仍然是病毒载体,常见的病毒载体有反转录病毒载体、慢病毒载体和腺病毒载体。病毒载体尽管能够高效的进入特定的细胞,但是存在许多的缺点:免疫原性、致癌性、传染性、宿主DNA插入整合、未知的长期效应等[6]。2007年,利用重组腺病毒为载体的临床基因治疗试验中发生患者死亡事件引起了广泛的关注,使美国食品与药品监督局(FDA)要求停止此类试验。目前有研究报道将病毒载体与人工制备载体混合使用,引入靶向基团与聚乙二醇,增强病毒载体的靶向性以及改善生物兼容性[7],但其安全性仍受到质疑。
非病毒基因载体无免疫原性,便于大规模生产,但转染效率低于病毒载体。主要的非病毒载体系统分为两类:脂质体与阳离子聚合物载体,但目前只有脂质体用于临床基因治疗的报道。脂质体一般由亲水端、疏水端以及连接部分组成,是利用与细胞膜的成融特性将核酸运载进入细胞。带电荷的亲水端对脂质体的转染性质起决定性作用,对于给定的带电荷头部,烷烃链对转染效率的影响具有不确定性[8]。脂质体按照结构差异,可分为阳离子脂质体、阴离子脂质体、pH敏感型脂质体与融合脂质体。其中阳离子脂质体应用最为广泛,目前已有多种商业化的脂质体上市:DOTMA、DOTAP、DOSPA以及DOGS,结构如图1所示。阳离子脂质体除了可以用季铵盐、季鏻盐与砷盐为头部外,还可以用多胺、树枝状分子、多糖以及双阳离子基团作为亲水端。将氨基甲酸酯键、缩醛基团等嵌入到脂质体中可制备pH敏感型脂质体,利用肿瘤细胞内低pH值环境,使脂质体解体释放出基因。此外,将pH敏感基团与具有膜融合功能的基团联合使用,可制备具有pH敏感功能的融合脂质体[9]。通常情况下,阳离子脂质体毒性较大,在血清存在条件下容易失效,体内效果较差。因此阴离子脂质体、核酸型脂质体(diC16-3’-dT)、磷脂脂质体(DPPA、DPPG)等被相继开发、利用起来,结构如图2所示。

图1 阳离子脂质体DOTMA、DOTAP、DOSPA以及DOGS结构示意图Fig.1 The schematic diagram of sturctures of cationic liposome DOTMA,DOTAP,DOSPA and DOGS

图2 阴离子脂质体及核酸脂质体结构示意图Fig.2 The schematic diagram of sturctures of anionic liposome DPPA, DPPG and anionic nucleotide liposome diC16-3’-dT
阳离子聚合物作为非病毒载体同样具有优异的核酸结合、保护与运输能力,易于进行靶向性及生物适用性修饰,是基因载体研究中的一个重要研究对象。文献中报道了很多合成阳离子聚合物基因载体如聚赖氨酸(PLL)[10]、聚乙烯亚胺(PEI)[11]、聚酰胺基胺(PAA)[12]、聚氨基酯(PAE)[13]、聚脒(PA)[14]、壳聚糖(Chitosan)[15]、带有阳离子侧基的聚烯烃(PDMAEMA)等类型[16],结构如图3所示。这些聚合物大多不易降解,在反复的给药治疗过程中存在体内累积毒性的风险。其毒性源来自其结构和分子量,还有些则由于与细胞膜相互作用导致其上的细胞蛋白流失,使细胞膜变得通透致其坍塌。降解型聚合物在降低聚合物毒性方面具有潜在的优势,更有利的是降解性聚合物可促进DNA在细胞质内释放,将聚合物制备成为降解型材料是阳离子聚合物载体的发展方向[17]。

图3 阳离子聚合物结构示意图 Fig.3 The schematic diagram of sturctures of cationic polymers
非病毒基因载体复合物进入细胞后,要经过两个步骤:细胞的内吞与表达,这都基于复合物与目标细胞表面的结合。对于非靶向性的阳离子聚合物,证据表明复合物首先经过与细胞表面带负电荷的蛋白聚糖类化合物通过静电作用相互结合。1996年,Baldeschwieler等[18]证明对于PLL/DNA复合物体系,使用NaCl溶液阻碍蛋白聚糖的硫酸化,用氨基葡聚糖裂解酶去除细胞表面的氨基葡聚糖或在转染体系中添加额外的氨基葡聚糖就可极大的阻碍基因转染。细胞对纳米复合物的吸收经过多种内吞路径。2004年,Behr等[19]发现Hela细胞对PEI/DNA复合物的内吞作用可被降低细胞表面胆固醇含量的星状孢子、蛋白激酶C抑制剂(PKC)或β-环糊精所阻碍。此外,将抗-β-肌动蛋白连接到异硫氰酸荧光素(FITC)上或将罗丹明连接到PEI上,在细胞内吞过程中发现这些复合物沿着激酶纤维分布。该课题组推测PEI/DNA复合物的内吞过程经过以下的历程:复合物与细胞膜中被称为共结合聚糖(syndecans)的类肝素硫酸化蛋白聚糖绑定在一起,这些化合物在细胞表面集结成富含胆固醇的复合物,其中的共结合聚糖通过连接蛋白与肌动蛋白绑定在一起,并诱发蛋白激素酶C(PKC)的磷酸化。这一系列绑定使纳米复合物通过细胞吞噬作用进入细胞内,但具体过程仍不清晰。在HepG2细胞中,Pichon等[20]发现PLL-DNA复合物的内吞既经历了需网格蛋白参与的过程,同时也有大胞饮作用(可被佛波醇豆蔻酸酯(PMA)促进)。在萤光素酶活性实验中,通过PMA促进的大胞饮作用导致的荧光蛋白的表达较少,主要还是需网格蛋白参与的内吞过程。
除了细胞内吞过程本身的机制,复合物大小对细胞的内吞也很重要。Amidon等[21]发现对于PLGA共聚物与DNA的复合物,Caco-2细胞就表现出对粒径大小的选择性,对粒径为100 nm的复合物有最大的内吞作用。Labhasetwar等[22]发现COS-7和HEK-293细胞对粒径为70 nm复合物的吸收高于粒径为200 nm的复合物。Yao等[23]利用光-芬顿反应制备了不同粒径的纳米凝胶:38 ,75,87,121,132,167 nm,并保证都具有相似的表面电位。4种不同的细胞均对75 nm与 87 nm的复合物有最强的内吞作用[24]。以上结果表明,对于非靶向性阳离子复合物的最佳粒径范围为70~90 nm。对于非靶向性复合物的改进,大量的研究集中于连接受体来促进对特殊细胞和组织的转染。这些配体包括脱唾液酸糖蛋白、表皮生长因子(EGF)、叶酸、整联蛋白、乳糖、甘露糖和转铁蛋白等[25]。绑定在细胞表面的受体,细胞的内吞都是经过需网格蛋白的路径进入细胞内。非靶向性复合物与细胞表面通过静电相互作用,虽然细胞对更小的复合物吸收更好,但是更大的复合物有更大的表面积,同样有利于与细胞相互作用,这也解释了在某些大粒径的复合物效果好于小粒径的复合物,但这种现象在靶向性的基因转染中却没有出现过。因此复合物大小对于靶向性复合物的影响大于非靶向性的复合物。2003年,Aoyama等[26]研究发现在糖纳米复合物的内吞作用中,粒径对效果的影响很大,其最佳粒径为50 nm。Cao等[27]通过理论计算也证实最佳粒径为54~60 nm。同样的结论也在含脱唾液酸糖蛋白[28]和转铁蛋白[29]的靶向复合物中得到验证。
ATP的调节作用使得溶酶体等细胞器内更加酸化(pH 5.0~6.2),而细胞质和细胞间的pH大约为7.4[30]。一些病毒已经进化能够利用这一变化,例如西门利克森林病毒(SFV)的表面蛋白在低pH条件下会发生结构变化,促进与内涵体膜的融合[31]。非病毒DNA载体也可以利用内涵体与溶酶体内的酸性环境促进转染。在DNA复合物中加入氯喹可以改变溶酶体或内涵体的pH,提高转染效果。氯喹是一种很有用的亲溶酶体试剂[32],可以提高溶酶体内的pH,以此阻碍酶的活性导致溶酶体的降解,防止DNA被降解,同时改变内涵体的pH值,促进DNA的释放。同样加入破坏酶的多肽,如合成的N端修饰的鼻病毒多肽(VP-1)或者流行感冒病毒多肽(HA-2)也能调节内涵体释放。在酸性条件下,这些多肽重新排列形成一种两亲性α-螺旋结构,能够与内涵体膜相互作用,促进复合物的逃逸[33]。多种大分子含有低pKa值的氨基基团,显示出了“质子海绵”效应。当这些复合物进入到细胞内,在内涵体内形成缓冲作用,使得内涵体溶胀破裂,导致DNA进入细胞液。一旦DNA进入到细胞液中,必须越过细胞质中的障碍,进入到细胞核内[34]。
细胞液中对DNA复合物到达细胞核有着多重障碍。忽略自由质粒DNA在细胞液中的散布[35],细胞液中的细胞支架作为分子筛可以阻止大分子的自由活动[36]。腺病毒[37]与疱疹病毒[38]在细胞质内是通过微管调节的运输。载体必须继续包裹DNA以协助其抵达细胞核,因为DNA容易被降解[39]。为了使DNA能够顺利表达,还需要跨过细胞核膜进入细胞核。物质在细胞质与细胞核间运输,是通过细胞核膜上的小孔复合物进行转运。一般粒径为9~11 nm的物质可以通过核孔复合物(NPC)进入核内[40]。大于20 KDa的蛋白质要进入细胞核需要ATP的参与,还需要短肽结构重组来触发,这一过程能被特种抗核孔蛋白抗体和小麦胚芽凝集素(WGA)阻碍[41]。外源DNA的表达也能够被小麦胚芽凝集素所抑制,这说明DNA的运输与蛋白质的运输相同[42]。分裂细胞的转染效果好于不在分裂期的细胞,这是因为在细胞分裂时基因可以更好的进入细胞核[43]。转染研究发现对于进入细胞的DNA,呈复合物状态的效果好于裸露的DNA,这显示出带正电荷的载体有一定的核定位效果[44]。为了增加进入细胞核的效率,细胞核定位肽也用于辅助转染。非病毒基因载体在体外通常表现出很好的转染能力,但在生理条件下,系统的转染效果会由于复合物的不稳定性而大大降低。在生理盐浓度下(150 nm)常常会造成聚合物的聚集,导致血管的堵塞[45]。另一方面,阳离子聚合物会很快与血清中的蛋白质(如:血清白蛋白)绑定在一起导致聚集并影响细胞吸收,导致吞噬作用[46]。一系列研究显示,体内的转染可以通过降低盐与血清作用得到提高,通常的做法是通过亲水性修饰抑制以上作用,如PEG修饰。
临床基因治疗在细胞内吞与细胞内运输的基础上,还需考虑载体复合物在组织水平上面临的一系列障碍:血液中酶的降解、通过毛细血管上皮细胞进行的渗透,在细胞外物质间的扩散以及细胞的吸收[47],以上过程都需要载体进行调控。病毒作为一类天然的载体系统,具备在血清蛋白面前“隐身”的优势,在目标组织处则可高效的“激活”。因此,开发具有病毒类似功能的“仿病毒”载体系统是将基因治疗推向临床的潜在手段之一。
蛋白质衣壳作为病毒的重要组成部分,具有高级的自组装结构,对遗传物质具有保护、传递等作用;从模仿病毒衣壳的结构和功能出发,人工设计和构建仿病毒衣壳具有重要意义。病毒衣壳结构的高度有序性是仿生构筑的优秀典范,其功能特性更为生物材料的发展提供了重大启示。多肽链间通过疏水、静电作用,以及氢键、范德华力等组装成病毒衣壳的亚基,进而通过弱相互作用组装成具有生物功能的蛋白衣壳。本文依据病毒衣壳组装的基本规律和特点,综述了通过物理、化学手段将不同的组装单元构建形成具有特定结构和生物功能的仿病毒载体。
3环境响应型仿病毒“壳-核”结构载体系统
环境响应型仿病毒载体多属于“壳-核”式组装结构,主要目的在于模仿病毒衣壳包裹遗传物质的方式。通过人工设计,整合不同自组装基元(衣壳与内核)间的弱相互作用,实现在纳米尺度上有序自组装体的构建。其环境响应功能主要体现在仿病毒衣壳表面的功能性修饰上,功能性基团的引入可赋予自组装体特定的响应特性。由于核酸带负电荷,常见的阳离子载体大多可与核酸复合后制成表面带正电荷的仿病毒内核。衣壳可通过静电相互作用附着在核酸复合物的外层,因此,衣壳通常带负电荷。仿病毒衣壳的负电性通常由羧酸根离子产生,羧基可以是天然聚合物自身所带有的[48],也可以是作为侧臂修饰在骨架上[49],电荷相反的内核与衣壳在缓冲溶液中可自发组装形成“壳-核”结构的仿病毒载体。当以带负的电荷两亲性嵌段复合物作为衣壳时,组装过程需要一些技巧。使用HYA-b-PBLG聚合物为衣壳时,两亲性材料在水溶液中会直接形成胶束。为了能够包裹PEI/siRNA复合物内核,需通过两步法避免形成胶束并完成组装:第一步将共聚物与PEI/siRNA复合物溶解在DMSO中,保持其静电相互作用但不发生组装;第二步在溶液中加入水,两组分发生组装并形成“壳-核”结构[50](如图4所示)。

图4 两亲性材料作为仿病毒载体衣壳组装示意图[50]Fig.4 The schematic diagram of self-assembly virus-like carrier constructed by amphiphilic copolymer as capsid[50]
“壳-核”组装体也存在电荷翻转的情况,既外层为正电荷,内核带负电。PLGA包裹SOX9蛋白质后形成带负电的内核后,以PEI作为衣壳,利用仿病毒载体的壳层表面运载Cbfa-1靶向的siRNA,对人间充质干细胞((hMSCs)进行转染实验,诱导软骨的形成[51]。除了通过正、负相互吸引组装成“壳-核”结构外,在PEG链的一端连接上阳离子片段,可以部分嵌入到内核复合物中,同样也能形成类似的的“壳-核”结构。Lee等[52]将具有促进复合物从内涵体中逃逸功能的融合蛋白(KALA)耦合到PEG 上形成带正电荷的嵌段,与 PEI/DNA 的复合物进一步混合、组装,可以得到直径为200~400 nm 的微粒,转染效率与细胞存活率相对于PEI25KDa大幅提高。也可用脂质体作为仿病毒载体的衣壳,组装出相似的壳-核结构。王坚成课题组[53]将聚胺基胺修饰的壳聚糖包裹siRNA后作为内核,将PEG-DSPE或T7肽修饰的T7-DSPE-PEG形成的脂质体作为衣壳,制备出了仿病毒“壳-核”结构,运载siEGFR后可对裸鼠体内MCF-7肿瘤模型起到了很好的抑制效果。使用无机磷酸钙材料作为内核负载siRNA,外层包裹PEG修饰的聚阴离子,也能构成“壳-核”结构的仿病毒载体[54]。
此外,一些病毒(例如流感病毒和其他一些动物病毒)具有包裹在蛋白质衣壳外的一层包膜-病毒包膜,这层包膜主要来源于宿主细胞膜(磷脂层和膜蛋白),但也包含有一些病毒自身的糖蛋白。病毒包膜的主要功能是帮助病毒进入宿主细胞,完成感染过程,起到靶向作用。环境响应型材料具备了病毒包膜的部分功能,其优势在于能对外界条件的变化很快做出反应、调控释放时间与组织部位。载体在体内可能接受到的物理、化学环境刺激信号有pH、温度[55]、光与磁场等。肿瘤细胞内细胞质pH为6.75左右,相对于正常组织细胞(pH 7.4)偏低,在一些细胞器中(晚期内涵体、溶酶体等),纳米颗粒面临的pH范围在5.0~5.5之间。这些都可以用于诱发载体结构的变化与基因的释放。从该思路出发,衍生出了大量的化学连接基团去应对细胞环境的pH值变化,如缩醛、腙、酯键等。此外,肿瘤细胞中的蛋白二硫化物还原酶 (NADPH)能够将氧化态的谷胱甘肽转变为还原型的谷胱甘肽。因此,肿瘤细胞中还原型谷胱甘肽含量较高,胞内浓度高于细胞外浓度,内、外浓度差高达1 000倍,并且癌细胞表面往往还有较高浓度的金属基质蛋白酶表达。与这些肿瘤细胞特异性刺激相对应的基团分别为二硫键以及对金属基质蛋白酶敏感的多肽连接基团,都可用于构建相应的环境敏感仿病毒衣壳。肿瘤细胞膜表面还有大量特异性的受体,与之相对应的靶向基团可以诱导仿病毒载体复合物在肿瘤处聚集,提高载体的利用率,降低对正常细胞的影响。常见的靶向基团有多肽、叶酸、蛋白、多糖等。
3.1具有靶向功能性衣壳的仿病毒载体
病毒具有感染特异性细胞的特性,而起到靶向功能的基团往往分布在病毒的蛋白衣壳上。因此,在“壳-核”自组装体的衣壳上修饰靶向基团,不仅可使仿病毒载体在结构上具有与病毒类似的衣壳,还在功能上进一步模仿病毒衣壳的靶向性。Arg-Gly-Asp(RGD)肽被广泛用于靶向基因转染系统,可识别整联蛋白受体αvβ3/αvβ5,该受体在肿瘤的血管内皮细胞中有过量表达。Saltzman课题组[56]使用PLGA、PEI与iRGD肽构成多层复合载体,其内核不是传统的PEI复合物,而是PLGA与喜树碱(CPT)构成的纳米小球,通过胺基氢与聚乳酸上的羰基间形成的氢键包裹上PEI后,形成带正电荷的纳米微粒,再通过层层组装形成“壳-核”结构,实现药物与基因的协同运输。该体系被用于运载阿霉素与pTRAIL基因,使用周-特氏联合指数法证实,对于不同细胞系的联合作用指数在0.31~0.53之间。联合治疗时使用的剂量分别为CPT与pTRAIL单独使用剂量的3.1~15与4.7~8.0分之一。体内转染实验表明,联合用药可有效抑制HCT116肿瘤的生长。此外,还有多种靶向肽,如TAT、精氨八聚体(R8)、黄体荷尔蒙-释放荷尔蒙(LHRH)等。其中转录活性因子TAT多提含有核定位序列,具有优异的穿膜能力,并能克服核膜障碍。将TAT肽包裹在金属核外部形成纳米复合物(NPs@PEI-TAT),可实现对干细胞的高效基因传递[57]。γ-聚谷氨酸(PGA)的端基能够有效与细胞膜表面γ-谷氨酰转肽酶的相互作用,促进纳米复合物进入细胞内。γ-聚谷氨酸自身具有羧基,可直接与带正电荷的DNA复合物内核发生组装行为。PEI与γ-聚谷氨酸形成的复合载体(PPGA)对HEK293、Hela 以及 HepG2细胞的体外转染效果为 PEI 的 2.7~7.0 倍,体内转染实验结果显示:在脾、心脏组织中检测出较高的基因表达,展现出很好的应用前景[58]。γ-聚谷氨酸包裹壳聚糖/DNA内核后,可使大部分复合物通过细胞质膜微囊介导模式内吞,提高组转染效率[59]。叶酸也是一种常见的靶向基团,叶酸受体存在于多种肿瘤细胞中。将叶酸连接到PEG化的聚谷氨酸上作为衣壳,再与PCL-g-PDMAEMA/DNA纳米复合物组装成具有靶向的“壳-核”结构仿病毒复合物。PGA-g-mPEG可以使复合物的表面电位呈中性而不干扰对DNA的绑定能力,包裹上衣壳后,毒性明显下降。对转染后的肿瘤进行体内图像测试与组织化学分析,证实在肿瘤中的表达效果明显增强[60]。对PEG进行修饰,还可以通过点击化学反应在侧臂修饰上羧基,在PEG的一端修饰叶酸后形成阴离子衣壳,包覆在PEI/DNA复合物的外层形成“壳-核”结构,组装过程如图5所示,可有效转染DNA,是环境响应型材料中最经典的组装模型[61]。

图5 叶酸修饰含羧酸侧臂PEG作为仿病毒载体衣壳组装示意图[61]Fig.5 The schematic diagram of self-assembly virus-like carrier constructed by FA-PEG-poly(AGE-Suc) as capsid[61]
转铁蛋白(TR)是另一种含铁糖蛋白,当与细胞表面转铁蛋白受体结合时可用于调节铁离子的转运,该受体在肿瘤细胞中的浓度为正常细胞中的10倍[62]。将转铁蛋白与丁二酸修饰的聚缩水甘油醇复合在一起,包裹在脂质体复合物外层,起到靶向衣壳的作用(结构如图6所示)。对于Hela与KB细胞转染效果增强很明显,因为这两种细胞对转铁蛋白受体的内化非常敏感且迅速,而对于内化作用缓慢的HT1080、HepG2以及K562细胞则增强效果不明显[63]。

图6 转铁蛋白修饰含羧酸侧臂聚缩水甘油醇(SucPG)作为仿病毒载体衣壳组装示意图[63] Fig.6 The schematic diagram of preparation of complex with transferrin modified succinylated poly(glycidol) (SucPG) as capsid[63]
透明质酸(HA)能与透明质酸受体结合,HA受体在多种恶性肿瘤细胞中均有过量表达[64]。HA含有羟基与羧基,能够很方便的进行修饰,制成高效、低毒的载体[65]。而将HA作为衣壳,利用其靶向性与生物兼容性是目前研究的趋势。Park课题组[66]用HA/ss-PEI载体运载可抑制血管生成的siRNA与抗转运生长因子(TGF)-β-siRNA,在治疗肝硬化方面取得了很好的疗效,在实验中发现,纳米粒子可持续作用于病变的肝脏,减少了非特异性结合且延长了体内循环时间。Choi等[67]在HA包裹载体的基础上加入引入疏水片段5β-胆酸,增强包裹作用。与此同时,使用Cy-5.5使其变为可视化的复合物,便于观察体内分布情况。芽霉菌糖可用于增强体内血液循环时间,修饰上甲氨蝶呤后制成衣壳,包裹PBAE/DNA内核,DNA复合对芽霉菌糖的吸附可能是通过PBAE上的羰基与芽霉菌糖上羟基间的氢键相互作用[68]。
3.2基于pH敏感型衣壳的仿病毒载体
王均课题组[69]报道了使用二甲基富马酸修饰的膦酸酯聚合物形成带负电荷“衣壳”,包裹含还原降解的二硫键的PEI与siRNA形成的复合物,形成酸敏感的电荷翻转基因载体系统(结构如图7所示)。二甲基富马酸形成的酰胺在肿瘤组织偏酸性(pH=6.5)条件下断裂,露出氨基后“衣壳”带正电,内核与其分离后进入肿瘤细胞内起到抑制肿瘤效果。体内、体外实验表明对MDA-MB-231肿瘤细胞有很好的抑制效果,大幅提升了含二硫键PEI载体的转染效果。
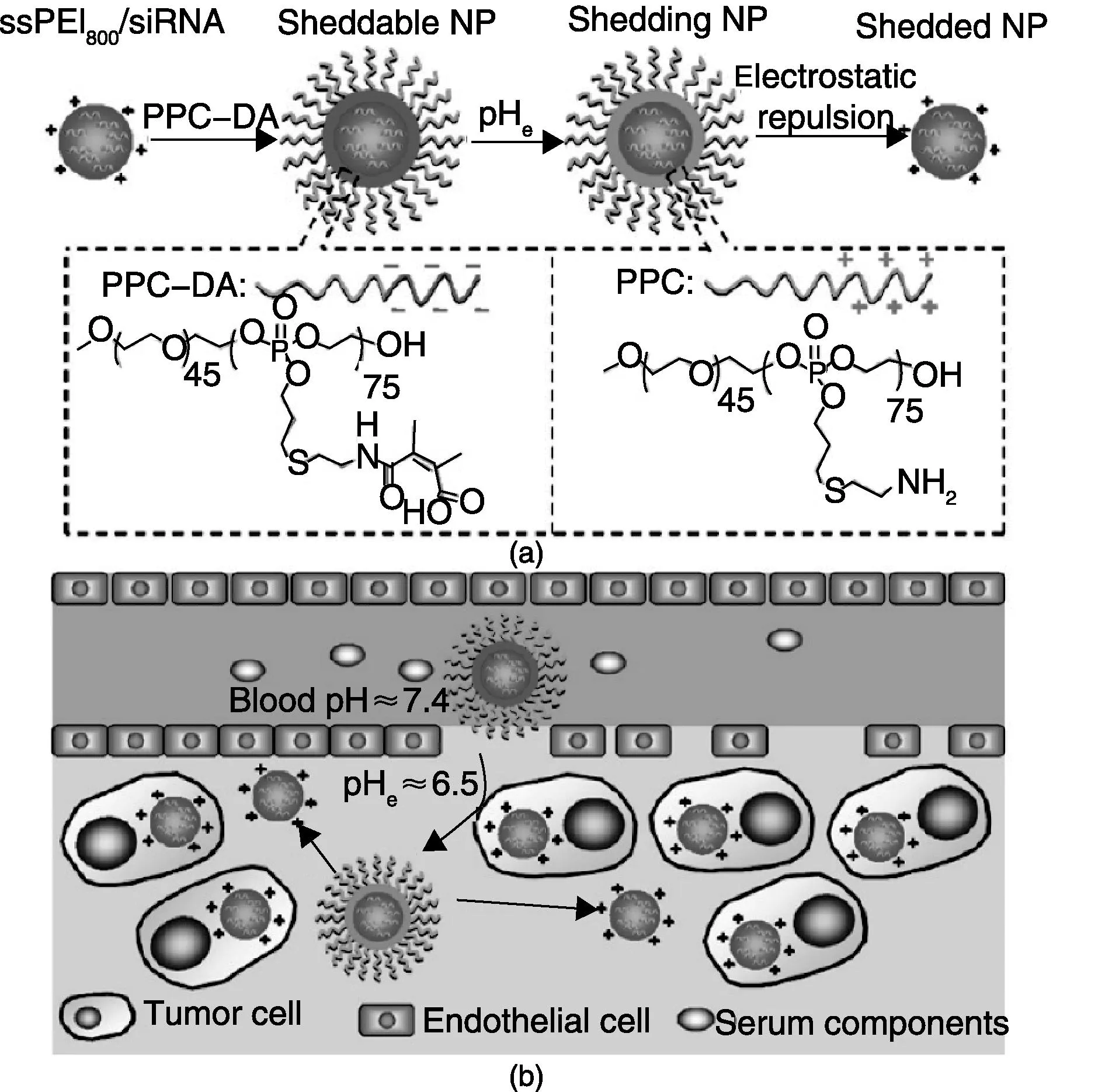
图7 酸敏感、电荷翻转二元载体的组成示意图(a)和肿瘤酸性条件下,去PEG“衣壳”后ssPEI 800 /siRNA纳米颗粒进入肿瘤细胞示意图(b)[69] Fig.7 Schematic structure of the PEG shell for binary delivery system re-exposing positive charge within acidic environment (a) and schematic diagram of the deshielding of the PEG shell for the positively charged ssPEI 800 /siRNA nanoparticles in the acidic environment of the tumor(b)[69]
3.3基于还原敏感型衣壳的仿病毒载体
在环境诱导断裂的基团中,二硫键被广泛用于还原敏感型基因载体的构建。顾忠伟课题组[70]最近发现二硒键也具有很好的还原敏感特性,可用于交联低分子量的聚乙烯亚胺,交联产物在B16F10与Hela细胞中都具有较好的基因转染能力。该研究还发现二硒键虽具有还原敏感性,但其只能在细胞内高浓度谷胱甘肽作用下发生降解,该特性使其更适合作为体内长循环基因传递载体[71]。HA修饰含有二硫键的胱胺后,可作为一类还原敏感型衣壳,用于带正电荷的DNA复合粒子的表面包覆,进而构建新颖的仿病毒载体。利用以上思路,制备了一系列“衣壳脱落型”仿病毒基因载体,在体内、体外均取得了很好的效果,转染过程如图8所示[72]。顾忠伟课题组将含有二硒键的降解性PEI用于仿病毒载体内核的制备,对BALB/c裸鼠的HepG2肿瘤模型进行pEGFP, pORF-lacz与pCMV-Luc基因的转染,结果显示体内转染能力与体外实验一样高效[73]。并利用FRET荧光方法,比较了二硫键与二硒键在细胞内断裂的速度,为后续的载体设计提供了理论参考,转染过程如图9所示。该类仿病毒载体用于功能基因P53的运载实验也取得了很好的效果,体内抗肿瘤效果显著[74]。

图8 三元复合物(DPS)基因转染示意图[72]Fig.8 Schematic representation of coated ternary complexes(DPS)complexes for gene delivery[72]

图9 DOS三元复合物用于基因转染示意图:(1) HA-SS-COOH复合在OEI-SeSex/DNA(DO)二元复合物上,形成三元复合物;(2)HA受体调节内吞;(3) 还原性促使HA-SS-COOH离去;(4) 二硒键断裂,DNA释放[74]Fig.9 Schematic representation of DOS ternary polyplexes for gene delivery:(1) ternary polyplexes formation by introduction of HA-SS-COOH to OEI-SeSex/DNA(DO) binary polyplexes;(2) HA-receptor mediated endocytosis;(3) reduction-triggered deshielding of HA-SS-COOH;(4) diselenide (Se-Se) cleavage and DNA release in reductive conditions[74]
3.4基于酶敏感型衣壳的仿病毒载体
基质金属蛋白酶(MMP)是一类与肿瘤发生、侵袭和转移密切相关的蛋白水解酶,众所周知,肿瘤细胞的侵袭程度及淋巴结转移与癌症的生物学行为和预后密切相关。肿瘤发生侵袭和转移的重要步骤是肿瘤细胞突破细胞外基质及基膜,而Ⅳ型胶原为基膜的组成成分之一,Ⅳ型胶原为具有独特螺旋结构的蛋白质,只有Ⅳ型胶原酶能降解Ⅳ型胶原等成分,破坏基膜的完整性。Ⅳ型胶原有两种分子类型:分子量为72 KDa的MMP-2和92 KDa的MMP-9。在肿瘤侵袭和转移过程中MMP-2作用更加重要[75]。对MMP酶敏感的基团多为多肽,如PLGLA肽、PLGVR肽[76]与GPLGVRG[77]等,在MMP酶作用下在甘氨酸(G)与亮氨酸(L)间发生断裂。最近对MMP酶敏感的载体被用于siRNA与药物的联合运输,含MMP酶敏感键的共聚物(PEG-pp-PEI-PE)通过自组装的方式实现siRNA与药物的共载,同时实现了肿瘤靶向性、高效内吞以及药物与siRNA协同抑制肿瘤的功能[78]。利用GPLGVRG肽连接PEG与聚天冬氨酸(PAsp)制成酶敏感材料(PEG-GPLGVRG-PAsp),对Hela细胞进行转染实验。结果显示高浓度MMP酶存在下,基因复合物具有更高的细胞内吞效率、内涵体逃逸能力及转染效率[77]。用MMP酶敏感的脂质体(PPC)包裹腺病毒(PPC-AL-Ad),形成二元复合的“壳-核“结构后,可增强对肿瘤细胞的转染能力,并降低免疫原性,体内转染时肝毒性很低[79]。
以上几类环境响应型仿病毒系统是针对肿瘤细胞的特异性来设计的,面对不同的肿瘤细胞有时需要将多种靶向、多种环境敏感等特性整合到一个传递系统,仍存在普适性不强的缺陷。癌症治疗有时需要与化学药物联用,构成协调、统一的系统,“壳-核”仿病毒载体在该方面的研究还不够广泛与深入。
4自组装型仿病毒载体
自组装型仿病毒载体与“壳-核”结构的环境响应型仿病毒载体存在结构与组装顺序上的差异。自组装型仿病毒载体通过组装基元预先自组装后包复核酸,或在核酸诱导下发生组装,形成与病毒粒径相仿的有序结构,进入细胞后通过载体的解组装释放核酸。肽类材料无论从组装潜能、还是同源性角度出发,都具有类似天然蛋白的多种弱相互作用力。通过人工设计合成不同序列、不同分子构造及不同分子量的多肽研究其组装行为,可形成各种尺寸和形态的组装体。Stupp等[80]最先报道了两亲性短肽组装成棒状结构,通过二硫键使之进一步稳定,该类超分子体系还具有诱导生物矿化的功能。特定序列肽通过弱相互作用形成二级结构,如α螺旋、β折叠、β转角等;二级结构通过亲疏水作用、氢键、离子键等形成特定空间构象的3级结构;具有3级结构的亚基进一步形成具有生物功能的4级结构,包括病毒衣壳在内的蛋白质都具有以上组装结构特征。
Lee研究组[81]报道了设计合成的含β折叠序列的多肽,肽链上具有同siRNA作用的片段,通过亲疏水作用和静电作用与siRNA形成了具有β转角的有序螺旋型棒状仿病毒结构,实现了运载基因的功能,结构及组装过程如图10所示。

图10 (a)四嵌段多肽型自组装型仿病毒载体的结构,(b)与RNA组装后结构示意图,(c)多肽/RNA组装体的SEM照片,(d)多肽/RNA组装体的圆二色谱图[81]Fig.10 (a) Structure of the self-assembly peptide with four segments,(b) Molecular model of the artificial virus incorpo-rating small interfering RNAs,(c) TEM image of self-assembly peptide/RNA ribbon,and (d) CD spectrum of self-assembly peptide/RNA ribbon (15 mm in PBS)[81]
Chau课题组[82]制备了含有β折叠的三嵌段多肽(含有16个氨基酸片段的多肽K3C6SPD),利用正电荷部分与基因产生相互作用,疏水部分即具有β折叠的多肽部分可起到稳定整个仿壳体的功能,亲水部分使整个仿病毒在溶液中保持稳定。可以与DNA形成大小为65×47 nm大小的仿病毒载体,自组装体呈螺旋球状,每个片层间间隔4 nm,结构及组装过程如图11所示。

图11 含有亲水端与疏水端的三嵌段多肽型自组装型仿病毒载体的结构(a), 与DNA形成的纳米茧的TEM照片(b)及 DNA形成的纳米棒的TEM照片(c)[82] Fig.11 Structure of the self-assembly peptide with cationic region and hydrophilic segment(a),TEM image of self-assembly peptide/DNA nanococoon (b),and TEM image of self-assembly peptide/DNA nanoribbon (c)[82]
顾忠伟课题组[83]利用以硅氧烷(POSS)为核的二代赖氨酸树状分子为组装体,赖氨酸的外层氨基与端基为谷氨酸的聚氨基酸通过氢键并疏水分子协同组装成粒径成不同粒径及形态的粒子,可高效转染HEK293细胞。该类型自组装仿病毒载体,还具有pH敏感性[84](其结构及组装示意图如图12所示),在pH为7.4的条件下能够保持自组装体的形貌稳定,而在pH为6.2的条件会迅速解体,以上结果可以作为释放机理,阐述该类仿病毒载体高效转染的原因。
自组装型仿病毒载体目前报道较少,且几乎没有涉及到靶向性修饰,这都是自组装型仿病毒载体需要突破的方向。

图12 L-赖氨酸树枝状分子与聚L-亮氨酸自组装成多肽球示意图,步骤A: 在混合溶剂中多肽树枝状分子与线性聚多肽结合;步骤B: 在水溶液中自组装成球状物[83]Fig.12 Schematic illustration of the cooperative self-assembly of poly(L-lysine) dendrimers and linear poly(L-leucine) into hierarchical peptidesomes,Step A: peptide dendrimers were linked with linear polypeptides to form amphiphiles through weak interactions in cosolvent; Step B: the amphiphiles self-assembled into hierarchical peptidesomes in aqueous phase[83]
5纳米颗粒作为组装基元组构成的仿病毒载体
纳米组装基元本身是体积较小的纳米颗粒,用于模仿病毒蛋白衣壳的蛋白组装基元。在核酸的诱导下,与核酸混合、杂化组装成为球状,并覆盖在复合物表面成为衣壳,在结构上类似于病毒。因为仿病毒纳米组装颗粒的粒径均一,且组装后复合物分散性也较为单一,因此每个组装体包含的仿病毒纳米组装颗粒数目较为一致,与病毒衣壳中蛋白质基元有明确的数目相对应。与环境敏感型仿病毒系统及自组装型仿病毒载体相比,在组装模式的有序性上更加接近病毒的真实结构,是一种高级的仿病毒模式。
在PAMAM树枝分子上修饰荧光基团后还可制成诊疗一体化载体系统[85]。顾忠伟课题组[86]最近将赖氨酸树状分子一端精氨酸修饰后通过巯基连接到量子点上,其结构及转染示意图如图13所示,形成一类新颖的生物启发型超分子杂化树枝状分子(SHD)。其作为仿病毒纳米颗粒组装成仿病毒载体后,转染效率为树枝状分子单体的5万倍。与此同时,材料的毒性与血清耐受性都得到了提高,且可以通过荧光实时跟踪复合粒子细胞内吞、内涵体逃逸与基因释放等细胞内运输过程。体内实验结果进一步表明,该杂化树枝状分子具有很好的基因转染能力(肌肉组织或植入的HepG2肿瘤中)。

图13 生物启发式杂化树枝状分子(SHD)自组装及生物医学应用示意图:(a)双功能树枝状分子结构图, (b) 在量子点表面自组装及 (c) 球状SHD的纳米结构及在体内、体外进行基因转染及示踪[86]Fig.13 Schematic illustrations for self-assembly and biomedical applications of SHDs: (a) molecular structure of the dualfunctionalized PDs, (b) self-assembly of PDs onto quantum dots via coordination interactions and (c) SHDs with hierarchical nanostructures for gene delivery and biological tracking in vitro and in vivo[86]
Monteiro课题组[87]受流感病毒启发,设计了一种含PDMAEA/PImPAA/PBA的嵌段式自组装聚合物,能够形成20 nm左右的纳米组装基元,通过静电相互作用与RNA复合后组装成175 nm左右的仿病毒纳米颗粒。该类型载体也具有pH敏感性,在pH为5.5的内涵体中组装体会塌陷、解组装。此外,由于PDMAEA的降解性,自组装体会发生表面电荷翻转变为负电,释放出siRNA。
顾忠伟课题组[88]将精氨酸、组氨酸及赖氨酸修饰壳聚糖形成了一类新颖的仿病毒基因载体,与DNA形成100 nm左右纳米复合物。通过SEM观测复合物形貌可以发现,其表面有直径小于10 nm的球状颗粒物存在,明显小于DNA的直径,由此可以推断,氨基酸修饰的壳聚糖在DNA表面形成了一层类似于病毒包膜的球壳。体外、体内转染实验表明,精氨酸修饰的材料转染效果优于PEI25 kDa。

图14 两亲性糖纳米颗粒结构示意图[89]Fig.14 The schematic diagram of sturctures of amphipathic Glycocluster nanoparticles [89]
Aoyama课题组[89]将杯芳烃与多糖结合在一起,制备了宽约2 nm、长约3 nm的两亲性糖纳米颗粒作为组装基元,与DNA组装后形成直径约54 nm的仿病毒颗粒,结构如图14所示,在该结构中糖基(4-O-β-D-吡喃葡萄糖氧基-D-葡萄糖)即起到维持组装体完整的作用,也起到入胞后促进释放的功能。后续实验证明,对于该类型仿病毒糖载体,胺基并非是基因释放所必须的前提条件[27],且结构大小对于转染效率的影响甚至大于细胞表面受体介导的作用。通过将仿病毒糖载体与量子点相结合,研究粒径大小对内吞的影响,发现细胞对该类仿病毒载体具有大小选择性(50 nm>>15 nm>>5 nm),对于大于100 nm的微粒进入细胞的数量非常有限[90]。该类型仿病毒载体能够很好地转染Hela等细胞系。该类仿病毒自组装体的发现为仿病毒纳米材料的开发开启了大门。此外,Klymchenko课题组[91]将杯芳烃的亲水段换成咪唑,疏水段换成长链烷烃,同样实现了仿病毒自组装,但粒径偏大,为80~100 nm左右,在添加DOPE后转染效果明显增加。Menito课题组[92]对环糊精进行修饰,表面修饰有二乙烯三胺的衍生物同样可与DNA组装成螺旋状复合物,构成仿病毒载体,可有效运输DNA。如在该类型载体外侧修饰甘露糖,则可得到甘露糖受体靶向的仿病毒载体[93]。Renieke课题组[94]则引入PEG修饰的金刚烷,通过再次组装在该类型仿病毒载体的外围包裹上一层阴离子衣壳,有效提高了转染效率。
此外,聚丙烯季鏻盐载体也能很好地运输siRNA,且材料能自组装成5 nm的微球,具有模仿病毒衣壳的潜力[95]。将10 nm厚的可剥落金属氢氧化物片层作为仿病毒纳米颗粒组装基元组装成纳米衣壳,包裹DNA后形成100 nm左右的纳米粒子,其包裹与释放DNA可由PH调控,也是一种潜在的仿病毒纳米颗粒[96]。
直接利用病毒衣壳作为仿病毒纳米组装基元进行再次组装,也是制备仿病毒载体的思路。Herrmann研究组[97]通过以双亲性DNA组装体为模板调控豇豆褪绿斑驳病毒(Cowpea Chlorotic Mottle Virus)衣壳组装成纳米粒子,具有单分散的结构和装载客体分子的功能。基于天然病毒衣壳仿生组装构建自组装体的策略在于利用天然衣壳已有的性能,通过人工组装调控使仿病毒衣壳的组装体具有新的结构特性和功能。
虽然该类型自组装仿病毒是最接近病毒原型的仿生结构,但在生理活性上仍与病毒存在较大差异,特别是在靶向性识别方面的报道较少,这将是研究人员努力的方向。
6结语
人工设计自组装是以自然界中的自组装现象和规律为基础,实现特定功能的组装行为。仿病毒自组装体在生物医学领域具有重要的应用前景,随着研究的深入,越来越多的仿病毒载体被研制出来,各种新颖的组装机理被应用于仿病毒自组装,仿病毒组装体的结构与功能越来越接近真实病毒,因而受到化学、材料科学、生物医学等领域研究者的高度关注。仿病毒衣壳自组装体在功能方面仍有待优化:①如何将载体的基因传递效率提高到病毒的级别;②如何通过化学修饰实现仿病毒自组装体的选择性靶向功能;③如何将人工智能(如pH响应、温度敏感等)与病毒的仿生结构相结合实现特异性响应等等。我们相信以天然病毒结构的仿生组装为出发点,通过人工设计构建和功能优化,仿病毒自组装体在生物医学领域的基础和应用研究将取得突破性进展。
参考文献References
[1]Merdan T, Kopecek J, Kissel T. Prospects for Cationic Polymers in Gene and Oligonucleotide Therapy Against Cancer[J].Advanceddrugdeliveryreviews, 2002, 54(5): 715-758.
[2]Zeng X, Sun Y X, Qu W,etal. Biotinylated Transferrin/Avidin/Biotinylated Disulfide Containing PEI Bioconjugates Mediated p53 Gene Delivery System for Tumor Targeted Transfection[J].Biomaterials, 2010, 31(17): 4 771-4 780.
[3]Ylä-Herttuala S. Endgame: Glybera Finally Recommended for Approval as The First Gene Therapy Drug in the European Union[J].MolecularTherapy,2012, 20(10): 1 831-1 832.
[4]Watts J K, Corey D R. Clinical Status of Duplex RNA[J].Bioorganic&MedicinalChemistryLetters, 2010, 20(11): 3 203-3 207.
[5]Wang Weiwei(王薇薇),Hu Kanghong(胡康洪). RNA 药物抗乙型肝炎病毒的研究进展[J].JournalofWuhanUniversity(NaturalScienceEdition)(武汉大学学报(理学版)),2010, 56(1): 63-68.
[6]Wu Chuanbao(吴传保), Hao Jianyuan(郝建原), Deng Xianmo(邓先模)etal. 阳离子聚合物基因转染载体的研究进展[J].PolymerBulletin(高分子通报), 2007, 4: 34-46.
[7]Oh I K, Mok H, Park T G. Folate Immobilized and PEGylated Adenovirus for Retargeting to Tumor Cells[J].BioconjugateChemistry, 2006, 17(3): 721-727.
[8]Remy J S, Sirlin C, Vierling P,etal. Gene Transfer with a Series of Lipophilic DNA-Binding Molecules[J].BioconjugateChemistry, 1994, 5(6): 647-654.
[9]Kobayashi S, Nakase I, Kawabata N,etal. Cytosolic Targeting of Macromolecules Using a pH-Dependent Fusogenic Peptide in Combination with Cationic Liposomes[J].BioconjugateChemistry, 2009, 20(5): 953-959.
[10]Ahn C H, Chae S Y, Bae Y H,etal. Synthesis of Biodegradable Multi-Block Copolymers of Poly(L-Lysine) and Poly(Ethylene Glycol) as a Non-Viral Gene Carrier[J].JournalofControlledRelease, 2004, 97: 567-574.
[11]Boussif O, Lezoualc’h F, Zanta M A,etal. A Versatile Vector for Gene and Oligonucleotide Transfer into Cells in Culture and in Vivo: Polyethylenimine[J],ProceedingsoftheNationalAcademyofSciencesU.S.A, 1995, 92(16): 7 297-7 301.
[12]Ferruti P, Marchisio M A, Barbucci R. Synthesis, Physico-Chemical Properties and Biomedical Applications of Poly(Amidoamine)s[J].Polymer, 1985, 26: 1 336-1 348.
[13]Lynn D M, Langer R. Degradable Poly(β-amino esters): Synthesis, Characterization, and Self-Assembly wth Plasmid DNA[J].JournaloftheAmericanChemicalSociety,2000, 122: 10 761-10 768.
[14]Hwang S,Bellocq N,Davis M.Effects of Structure ofα-Cyclodextrin-Containing Polymers on Gene Delivery[J].Bioconjugate.Chemistry. 2001, 12(2): 280-290.
[15]Hanou M, Florea B I, Geldof M,etal. Quaternized Chitosan Oligomers as Novel Gene Delivery Vectors in Epithelial Cell Lines[J].Biomaterials, 2002, 23: 153-159.
[16]Cherng J Y, Van de Wetering P, Talsma H,etal. Effect of Size and Serum Proteins on Transfection Efficiency of Poly ((2-Dimethylamino)Ethyl Methacrylate)-Plasmid Nanoparticles[J].PharmaceuticalResearch, 1996, 13: 1 038-1 042.
[17]Li Shuo(李硕), Yu Lan(俞兰), Li Fangzhen(李方珍),etal. 含酯键的可降解聚合物基因载体研究进展[J].PolymerBulletin(高分子通报), 2014, 6: 40-55,
[18]Mislick K A, Baldeschwieler J D. Evidence for the Role of Proteoglycans in Cation-Mediated Gene Transfer[J].ProceedingsoftheNationalAcademyofSciencesU.S.A, 1996, 93: 12 349-12 354.
[19]Kopatz I, Remy J S, Behr J P J. A Model for Non-Viral Gene Delivery: Through Syndecan Adhesion Molecules and Powered by Actin[J].Gene.Medicine, 2004, 6: 769-776.
[20]Goncalves C, Mennesson E, Fuchs R,etal. Macropinocytosis of Polyplexes and Recycling of Plasmid via the Clathrin-Dependent Pathway Impair the Transfection Efficiency of Human Hepatocarcinoma Cells[J].MolecularTherapy, 2004, 10: 373-385.
[21]Desai M P, Labhasetwar V, Walter E,etal. The Mechanism of Uptake of Biodegradable Microparticles in Caco-2 Cells is Size Dependent[J].PharmaceuticalResearch, 1997, 14: 1 568-1 573.
[22]Prabha S, Zhou W Z, Panyam J,etal. Size-Dependency of Nanoparticle-Mediated Gene Transfection: Studies with Fractionated Nanoparticles[J].InternationalJournalofPharmaceutics, 2002, 244: 105-115.
[23]Xu D, Hong J, Sheng K,etal. Preparation of Polyethyleneimine Nanogels via Photo-Fenton Reaction[J].RadiationPhysicsAndChemistry, 2007, 76: 1 606-1 611.
[24]Xu D M, Yao S D, Liu Y B,etal. Size-Dependent Properties of M-PEIs Nanogels for Gene Delivery in Cancer Cells[J].InternationalJournalofPharmaceutics, 2007, 338: 291-296.
[25]Molas M, Gomez-Valades A G, Vidal-Alabro A,etal. Receptor-Mediated Gene Transfer Vectors: Progress Towards Genetic Pharmaceuticals[J].CurrentGeneTherapy, 2003, 3: 468-485.
[26]Aoyama Y, Kanamori T, Nakai T,etal. Artificial Viruses and Their Application to Gene Delivery. Size-Controlled Gene Coating with Glycocluster Nanoparticles[J].JournaloftheAmericanChemicalSociety, 2003, 125: 3 455-3 457.
[27]Nakai T, Kanamori T, Sando S,etal. Remarkably Size-Regulated Cell Invasion by Artificial Viruses. Saccharide-Dependent Self-Aggregation of Glycoviruses and Its Consequences in Glycoviral Gene Delivery[J].JournaloftheAmericanChemicalSociety, 2003, 125: 8 465-8 475.
[28]Gao H, Shi W, Freund L B. Mechanics of Receptor-Mediated Endocytosis[J].ProceedingsoftheNationalAcademyofSciencesUSA, 2005, 102: 9 469-9 474.
[29]Rensen P C N, Sliedregt L A J M, Ferns M,etal. Determination of the Upper Size Limit for Uptake and Processing of Ligands by the Asialoglycoprotein Receptor on Hepatocytes in Vitro and in Vivo[J].JournalofBiologicalChemistry, 2001, 276: 37 577-37 584.
[30]Wagner E, Cotten M, Foisner R,etal. Transferrin-Polycation-DNA Complexes: the Effect of Polycations on the Structure of the Complex and DNA Delivery to Cells[J].ProceedingsoftheNationalAcademyofSciencesU.S.A, 1991, 88: 4 255-4 259.
[31]Ohkuma S, Poole B. Fluorescence Probe Measurement of the Intralysosomal pH in Living Cells and the Perturbation of pH by Various Agents[J].ProceedingsoftheNationalAcademyofSciencesUSA, 1978, 75: 3 327-3 331.
[32]Kielian M C, Marsh M, Helenius A. Kinetics of Endosome Acidification Detected by Mutant and Wild-Type Semliki Forest Virus[J].EMBOJournal, 1986, 5: 3 103-3 109.
[33]De Duve C, De Barsy T, Poole B.etal. Lysosomotropic Agents[J].BiochemicalPharmacology, 1974, 23: 2 495-2 531.
[34]Wagner E. Application of Membrane-Active Peptides for Nonviral Gene Delivery[J].AdvancedDrugDeliveryReviews, 1999, 38: 279-289.
[35]Behr J P.A Trick to Enter Cells the Viruses Did Not Exploit[J].Chimia, 1997, 51: 34-36.
[36]Dowty M E, Williams P, Zhang G,etal. Plasmid DNA Entry into Postmitotic Nuclei of Primary Rat Myotubes[J].ProceedingsoftheNationalAcademyofSciencesUSA, 1995, 92: 4 572-4 576.
[37]Luby-Phelps K, Castle P E, Taylor D L,etal. Hindered Diffusion of Inert Tracer Particles in the Cytoplasm of Mouse 3T3 Cells[J].ProceedingsoftheNationalAcademyofSciencesUSA, 1987, 84: 4 910-4 913.
[38]Leopold P L, Kreitzer G, Miyazawa N,etal. Dynein-and Microtubule-Mediated Translocation of Adenovirus Serotype Occurs after Endosomal Lysis[J].GeneTherapy, 2000, 11: 151-165.
[39]Sodeik B, Ebersold M W, Helenius A. Microtubule-Mediated Transport of Incoming Herpes Simplex Virus 1 Capsids to the Nucleus[J].JournalofCellBiology, 1997, 136: 1 007-1 021.
[40]Lechardeur D, Sohn K J, Haardt M,etal. Metabolic Instability of Plasmid DNA in the Cytosol: a Potential Barrier to Gene Transfer[J].GeneTherapy, 1999, 6: 482-497.
[41]Bonner W M J. Protein Migration into Nuclei. I. Frog Oocyte Nuclei in Vivo Accumulate Microinjected Histones, Allow Entry to Small Proteins, and Exclude Large Proteins[J].CellBiology, 1975, 64: 421-30.
[42]Featherstone C, Darby M K, Gerace L A. Monoclonal Antibody Against the Nuclear Pore Complex Inhibits Nucleocytoplasmic Transport of Protein and RNA in Vivo[J].JournalofCellBiology, 1988, 107: 1 289-1 297.
[43]Wilke M, Fortunati E, Van Den Broek M,etal. Efficacy of a Peptide-Based Gene Delivery System Depends on Mitotic Activity[J].GeneTherapy, 1996, 3: 1 133-1 142.
[44]Pouton C W, Seymour L W. Key Issues in Non-Viral Gene Delivery[J].AdvancedDrugDeliveryReviews, 2001, 46: 187-203.
[45]Ogris M, Brunner S, Schuller S,etal. PEGylated DNA /Transferrin-PEI-Complexes-: Reduced Interaction with Blood Components Extended Circulation in Blood[J].GeneTherapy, 1999, 6: 595-605.
[46]Dash P R, Read M L, Barrett L B,etal. Factors Affecting Blood Clearance and in Vivo Distribution of Polyelectrolyte Complexes for Gene Delivery[J].GeneTherapy, 1999, 6: 643-650.
[47]Debbage P, Thurner G C. Nanomedicine Faces Barriers[J].Pharmaceuticals, 2010, 3: 3 371-3 416.
[48]Kuo Y C, Yu H W. Transport of Saquinavir Across Human Brain-Microvascular Endothelial Cells by Poly(Lactide-co-Glycolide) Nanoparticles with Surface Poly-(γ-Glutamic Acid) [J].InternationalJournalofPharmaceutics, 2011, 416: 365-375.
[49]Lejardi A, Etxeberria A, Meaurio E,etal. Novel Poly(Vinyl Alcohol)-g-Poly(Hydroxy Acid) Copolymers: Synthesis and Characterization[J].Polymer, 2012, 53: 50-59.
[50]Bui L, Abbou S, Ibarboure E,etal. Encapsidation of RNA-Polyelectrolyte Complexes with Amphiphilic Block Copolymers: Toward a New Self-Assembly Route[J].JournaloftheAmericanChemicalSociety, 2012,134: 20 189-20 196.
[51]Jeon S Y, Park J S, Yang H N,etal. Co-Delivery of Cbfa-1-Targeting siRNA and SOX9 Protein Using PLGA Nanoparticles to Induce Chondrogenesis of Human Mesenchymal Stem Cells[J].Biomaterials, 2014, 35: 8 236-8 248.
[52]Lee H, Jeong J H, Park T G. A New Gene Delivery Formulation of Polyethylenimine/DNA Complexes Coated with PEG Conjugated Fusogenic Peptide[J].JournalofControlledRelease, 2001, 76(1-2): 183-192.
[53]Gao L Y, Liu X Y, Chen C J,etal. Core-Shell Type Lipid/rPAA-Chol Polymer Hybrid Nanoparticles for in Vivo siRNA Delivery[J].Biomaterials, 2014, 35: 2 066-2 078.
[54]Pittella F,Zhang M Z,Lee Y,etal. Enhanced Endosomal Escape of siRNA-Incorporating Hybrid Nanoparticles from Calcium Phosphate and PEG-Block Charge-Conversional Polymer for Effcient Gene[J].Biomaterials, 2011, 32: 3 106-3 114.
[55]Hinrichs W,Schuurmans-Nieuwenbroek N,Van De Wetering P,etal. Thermosensitive Polymers as Carriers for DNA Delivery[J].JournalofControlledRelease,1999, 60: 249-259.
[56]Ediriwickrema A, Zhou J, Deng Y,etal. Multi-Layered Nanoparticles for Combination Gene and Drug Delivery to Tumors[J].Biomaterials, 2014, 35: 9 343-9 354.
[57]Peng L H,Niu J,Zhang C Z,etal. TAT Conjugated Cationic Noble Metal Nanoparticles for Gene Delivery to Epidermal Stem Cells[J].Biomaterials, 2014, 35: 5 605-5 618.
[58]Tripathi S K, Goyal R, Ansari K M,etal. Polyglutamic Acid-Based Nanocomposites as Efficient Non-Viral Gene Carriers in Vitro and in Vivo [J].EuropeanJournalofPharmaceuticsandBiopharmaceutics, 2011, 79: 473-484.
[59]Peng S F, Tseng M T, Ho Y C,etal. Mechanisms of Cellular Uptake and Intracellular Traffcking with Chitosan/DNA/Poly(g-Glutamic Acid) Complexes as a Gene Delivery Vector[J].Biomaterials, 2011, 32: 239-248.
[60]Guo S T, Huang Y Y, Zhang W D,etal. Ternary Complexes of Amphiphilic Polycaprolactone-Graft-Poly (N,N-Dimethylaminoethyl Methacrylate), DNA and Polyglutamic Acid-Graft-Poly(Ethylene glycol) for Gene Delivery[J].Biomaterials, 2011, 32: 4 283-4 292.
[61]Li H M, Sun X, Zhao D,etal. A Cell-Specific Poly(Ethylene Glycol) Derivative with a Wheat-Like Structure for Efficient Gene Delivery[J].MolecularPhamarceutics, 2012, 9: 2 974-2 985.
[62]Zeng X,Sun Y X,Qu W,etal. Biotinylated Transferrin/Avidin/Biotinylated Disulfide Containing PEI Bioconjugates Mediated p53 Gene Delivery System for Tumor Targeted Transfection[J].Biomaterials,2010, 31:4 771-4 780.
[63]Sakaguchi N, Kojima C, Harada A,etal. Effect of Transferrin As a Ligand of pH-Sensitive Fusogenic Liposome-Lipoplex Hybrid Complexes[J].BioconjugateChemistry. 2008, 19: 1 588-1 595.
[64]Assmann V, Kern H F, Elsasser H P. Differential Expression of the Hyaluronan Receptors CD44 and RHAMM in Human Pancreatic Cancer Cells[J].ClinicalCancerResearch. 1996, 2: 1 607-1 618.
[65]Kim E J, Shim G, Kim K,etal. Hyaluronic Acid Complexed to Biodegradable Poly L-Arginine for Targeted Delivery of siRNAs[J],JournalofGeneMedicine, 2009, 11: 791-803.
[66]Park K, Hong S W, Hur W,etal. Target Specifc Systemic Delivery of TGF-Beta siRNA/(PEI-SS)-g-HA Complex for the Treatment of Liver Cirrhosis[J].Biomaterials, 2011, 32: 4 951-4 958.
[67]Choi K Y, Chung H, Min K H,etal. Self-Assembled Hyaluronic acid Nanoparticles for Active Tumor Targeting[J].Biomaterials,2010, 31: 106-114.
[68]Liu Y Y, Wang Y, Zhang C,etal. Core-Shell Nanoparticles Based on Pullulan and Poly(β-Amino) Ester for Hepatoma-Targeted Codelivery of Gene and Chemotherapy Agent[J].ACSApplMaterInterfaces,2014, 6:18 712-18 720.
[69]Yang X. Z, Du J. Z, Dou S,etal. Sheddable Ternary Nanoparticles for Tumor Acidity-Targeted siRNA Delivery [J].ACSnano, 2012, 6(1): 771-781.
[70]Cheng G,He Y,Xie L,etal. Development of a Reduction-Sensitive Diselenide-Conjugated Oligoethylenimine Nanoparticulate System as a Gene Carrier[J].InternationalJournalofNanomedicine,2012(7): 3 991-4 006.
[71]Yue D,Cheng G,He Y,etal. Influence of Reduction-Sensitive Diselenide Bonds and Disulfide Bonds on Oligoethylenimine Conjugates for Gene Delivery[J].JournalofMaterialsChemistryB, 2014, 2(41): 7 210-7 221.
[72]He Y,Cheng G,Xie L,etal. Polyethyleneimine/DNA Polyplexes With Reduction-Sensitive Hyaluronic Acid Derivatives Shielding for Targeted Gene Delivery[J].Biomaterials,2013, 34(4): 1 235-1 245.
[73]He Y,Nie Y,Cheng G,etal. Viral Mimicking Ternary Polyplexes: A Reduction‐Controlled Hierarchical Unpacking Vector for Gene Delivery[J].AdvancedMaterials,2014,26(10):1 534-1 540.
[74]He Y,Nie Y,Xie L,etal. p53 Mediated Apoptosis by Reduction Sensitive Shielding Ternary Complexes Based on Disulfide Linked PEI Ternary Complexes[J].Biomaterials,2014, 35(5): 1 657-1 666.
[75]Song Nan(宋南),Yang Lin(杨林). 基质金属蛋白酶-2的研究进展[J].ClinicalRationalDrugUse(临床合理用药), 2012, 5(2): 152-153.
[76]Zhang J, Yuan Z, Wang Y,etal. Multifunctional Envelope-Type Mesoporous Silica Nanoparticles for Tumor-Triggered Targeting Drug Delivery[J].JournaloftheAmericanChemicalSociety, 2013, 135: 5 068-5 073.
[77]Li J, Ge Z, Liu S. PEG-Sheddable Polyplex Micelles as Smart Gene Carriers Based on MMP-Cleavable Peptide-Linked Block Copolymers[J].ChemicalCommunication, 2013, 49: 6 974-6 976.
[78]Zhu L, Perche F, Wang T,etal. Matrix Metalloproteinase 2-Sensitive Multifunctional Polymeric Micelles for Tumor-Specific co-Delivery of siRNA and Hydrophobic Drugs[J].Biomaterials, 2014, 35(13):4 213-4 222.
[79]Wan Y, Han J, Fan G,etal. Enzyme-Responsive Liposomes Modified Adenoviral Vectors for Enhanced Tumor Cell Transduction and Reduced Immunogenicity[J].Biomaterials,2013,34: 3 020-3 030.
[80]Hartgerink J D, Beniash E, Stupp S I. Self-Assembly and Mineralization of Peptide-Amphiphile Nanofibers[J].Science, 2001, 294: 1 684-1 688.
[81]Lim Y B, Lee E J, Yoon Y R,etal. Filamentous Artificial Virus from a Self-Assembled Discrete Nanoribbon[J].AngewandteChemieInternationalEdition, 2008, 47(24): 4 25-4 528.
[82]Ni R, Chau Y. Structural Mimics of Viruses Through Peptide/DNA Co-Assembly[J].JournaloftheAmericanChemicalSociety, 2014, 136: 17 902-17 905.
[83]Xu X, Yuan H, Chang J,etal. Cooperative Hierarchical Self-Assembly of Peptide Dendrimers and Linear Polypeptides into Nanoarchitectures Mimicking Viral Capsids[J].AngewandteChemieInternationalEdition, 2012, 51(13): 3 130-3 133.
[84]Xu X, Li Y, Li H,etal. Smart Nanovehicles Based on pH-Triggered Disassembly of Supramolecular Peptide-Amphiphiles for Efficient Intracellular Drug Delivery[J].Small, 2014, 10(6): 1 133-1 140.
[85]Ke W, Shao K, Huang R,etal. Gene Delivery Targeted to the Brain Using an Angiopep-Conjugated Polyethyleneglycol-Modified Polyamidoamine Dendrimer[J].Bimaterials, 2009, 30: 6 976-6 985.
[86]Xu X, Jian Y, Li Y,etal. Bio-Inspired Supramolecular Hybrid Dendrimers Self-Assembled from Low-Generation Peptide Dendrons for Highly Efficient Gene Delivery and Biological Tracking[J].ACSnano, 2014, 8(9): 9 55-9 264.
[87]Gu W, Jia Z, Truong N P,etal. Polymer Nanocarrier System for Endosome Escape and Timed Release of siRNA with Complete Gene Silencing and Cell Death in Caner Cells[J].Biomacromolecules, 2013, 14: 3 386-3 389.
[88]Chang J, Xu X, Li H,etal. Components Simulation of Viral Envelope via Amino Acid Modified Chitosans for Efficient Nucleic Acid Delivery: in Vitro and in Vivo Study[J].AdvancedFunctionalMaterials, 2013, 23: 2 691-2 699.
[89]Aoyama Y, Kanamori T, Nakai T,etal.Artificial Viruses and Their Application to Gene Delivery. Size-Controlled Gene Coating with Glycocluster Nanoparticles[J].JournaloftheAmericanChemicalSociety, 2003,125: 3 455-3 457.
[90]Osaki F, Kanamori T, Sando S,etal. A Quantum Dot Conjugated Sugar Ball and Its Cellular Uptake. On the Size Effects of Endocytosis in the Subviral Region[J].JournaloftheAmericanChemicalSociety, 2004, 126: 6 520-6 521.
[91]Rodik R V, Klymchenko A S, Jain N,etal.Virus-Sized DNA Nanoparticles for Gene Delivery Based on Micelles of Cationic Calixarenes[J].Chemistry-AEuropeanJournal. 2011, 17, 5 526-5 538.
[92]Díaz-Moscoso A, Gourriérc L L, Gómez-García M,etal. Polycationic Amphiphilic Cyclodextrins for Gene Delivery: Synthesis and Effect of Structural Modifications on Plasmid DNA Complex Stability, Cytotoxicity, and Gene Expression[J].Chemistry-AEuropeanJournal. 2009, 15: 12 871-12 888.
[93]Díaz-Moscoso A, Guilloteau N, Bienvenu C,etal. Mannosyl-Coated Nanocomplexes from Amphiphilic Cyclodextrins and pDNA for Site-Specific Gene Delivery[J].Bimaterials, 2011, 32: 7 263-7 273.
[94]Buckwalter D J, Sizovs A, Ingle N P,etal. MAG Versus PEG: Incorporating a Poly(MAG) Layer to Promote Colloidal Stability of Nucleic Acid/“Click Cluster”Complexes[J].ACSMacroLetters, 2012, 1: 609-613.
[95]Ornelas-Megiatto C,Wich P R,Frechet J M,etal. Polyphosphonium Polymers for siRNA Delivery:an Efficient and Nontoxic Alternative to Polyammonium Carriers[J].JournaloftheAmericanChemicalSociety, 2012, 134: 1 902-1 905.
[96]Park D H, Kim J E, Oh J M,etal. DNA Core@Inorganic Shell[J].JournaloftheAmericanChemicalSociety, 2010, 132, 16 735-16 736
[97]Kwak M, Minten I J, Musser A J,etal. Virus-like Particles Templated by DNA Micelles: A General Method for Loading Virus Nanocarriers[J].JournaloftheAmericanChemicalSociety, 2010, 132: 7 834-7 835.
(编辑盖少飞王方)
LI Shuo1,2,CAI Xiaojun1,LI Gan3,GU Zhongwei1
(1.National Engineering Research Center for Biomaterials, Sichuan Universtiy,Chengdu 610064,China)
(2.School of Chemical Engineering, Chongqing Universty of Technology, Chongqing 400054,China)
(3. Workover & Completion Research Center, Research Institution of Petroleum Engineering,
SINOPEC Shengli Oilfield Company, Dongying 257000,China)
Abstract:Gene therapy, as a promising therapeutics to treat genetic or acquired diseases, has received significant attention in the past several decades due to its advantages over traditional therapies. And successful gene therapy was based on high-performance delivery system. Meanwhile, the delivery efficiencies of non-virus gene carriers were lower than that of virus. However, virus-mimic carrier constructed by self-assembly could enhance the delivery efficiency and biocompatibility, and provide effective strategy and method for gene therapy. The aim of virus-mimic carrier is to simulate the gene encapsulation and delivery model of virus by protein capsid. Further more, there are three mimic models: the first was the environmental-stimulus responsive “shell-core” structure virus-mimic carrier, the second was self-assembly virus-mimic carrier, and the third was virus-mimic carrier constructed by nano particles. In this paper, the recent progress of various virus-mimic gene carrier systems was summarized and commented.
Key words:self-assembly; virus-mimic carrier; gene therapy ; peptide dendrimer; virus-mimic shell
中图分类号:R346
文献标识码:A
文章编号:1674-3962(2015)03-0177-14
DOI:10.7502/j.issn.1674-3962.2015.03.01
通讯作者:顾忠伟,男,1949年生,教授,博士生导师,Email:zwgu@scu.edu.cn
基金项目:重庆市基础与前沿研究计划(cstc2013jcyjA50012);重庆市教委科学技术研究项目(KJ130820);重庆理工大学科研启动基金(2012ZD24);四川省科技厅支撑计划项目(2013FZ0003);中国博士后面上项目(2014M562326,2014M552359)
收稿日期:2015-03-02

