基于纳微米颗粒和凝胶佐剂的新型疫苗传递体系
岳 华,马光辉
(中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190)
特约专栏
第一作者:岳华,女,1984年生,助理研究员
Email:ghma@.ipe.ac.cn
基于纳微米颗粒和凝胶佐剂的新型疫苗传递体系
岳华,马光辉
(中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190)
摘要:新型疫苗的飞速发展对佐剂或递送体系的研究提出了巨大的挑战。针对传统佐剂在细胞免疫应答方面不足的问题,选取生物相容性好的高分子材料为主要基质,设计并制备出一系列尺寸均一且具有不同颗粒性质(粒径、电荷或表面基团)的纳微米颗粒佐剂。研究表明,新型颗粒佐剂表现出良好的增加抗原内化、促进抗原提呈和T淋巴细胞增殖等优势,有望满足重要传染性疾病甚至恶性肿瘤的防治需求。此外,针对目前仍无有效黏膜免疫佐剂的难题,以具有生物粘附性的壳聚糖为基质,开发了温度敏感性凝胶作为疫苗佐剂。该凝胶佐剂不仅可以使鼻黏膜制剂有效铺展和停留,还可以借助材料本身特性增加抗原渗透性并活化T细胞,从而诱导高效的免疫应答,拓展了传统以注射为主的免疫递送方式。上述基于纳微米颗粒和凝胶佐剂的疫苗传递体系的系统性研究,为新型疫苗传递系统的开发提供了有意义的探索。
关键词:纳微米颗粒;凝胶;佐剂;疫苗传递系统;微孔膜乳化法
1前言
疫苗领域重要的难题之一是选择合适的佐剂和递送体系。传统疫苗经常直接来源于细菌或病毒,即使不添加佐剂也具有较高的免疫原性,但由于大量病原性组分的存在会导致安全性问题,此类疫苗正逐渐被替代。随着生物技术的发展,成分明确、安全稳定的新型亚单位疫苗开始出现,但其免疫原性较差,难以诱导良好的免疫应答效果,必须添加佐剂才能发挥疫苗抗感染的特性[1-2]。铝佐剂是应用最为广泛的佐剂,不过其局限性在于仅诱导体液免疫应答,无法产生细胞免疫应答,目前多用于特定传染性疾病的预防方面,对亚单位疫苗(如H5N1裂解疫苗)效果不明显,并且无法满足其它新型疫苗尤其是治疗性疫苗的发展需求。后续开发的油乳佐剂、弗氏佐剂、脂多糖等在免疫效果方面有所提升,但多数制剂在注射后会引起注射部位结块,甚至系统性过敏性休克等反应,导致疫苗产品无法被FDA批准(继铝佐剂70余年后才有一种MF59佐剂获批)。此外,很多感染性病原(包括禽流感病毒及手足口病EV71病毒等在内)都是通过呼吸道黏膜表面侵入机体的,仅依靠传统的疫苗注射方式递送抗原,在提高机体保护力方面十分有限。新型的黏膜递送系统将很大程度上改善这一缺陷,遗憾的是现有的佐剂起初均针对注射式抗原而开发,忽略了黏膜特殊的生理结构和功能,无法有效地刺激黏膜抗体的产生。因此,疫苗的开发受到了严重限制,而研制高效而安全的新型佐剂或递送体系,从某种程度上将决定新型疫苗的诞生。
本研究小组长期以来一直致力于生物材料及生物剂型工程等领域的发展,并围绕颗粒和凝胶佐剂的研究和应用开展了一系列工作。与传统的佐剂相比,纳微米颗粒(如胶束、聚合物颗粒、脂质体等)由于同自然界中的病原性细菌、真菌等尺寸或维度相近,容易被机体识别为外源性物质,激活机体的免疫应答[3]。纳微米颗粒的优势使其有望成为高效、安全的疫苗佐剂,但如何使之发挥所期待的效果是当前研究的重要难题。基于纳微米颗粒对生物学效应影响的理论研究基础,通过调控颗粒的物理或化学性质,开发出具有优良理化性质的颗粒佐剂,可满足疫苗对机体特异性应答的需求。针对黏膜免疫的应答特点,开发出温度敏感性水凝胶佐剂,通过调整组分性质制备出具有合适相转变时间和温度的凝胶制剂,可满足呼吸道传播疾病的预防性疫苗需求。对上述新型颗粒佐剂和凝胶佐剂的系统性研究,不仅为借助疫苗对抗病原体的早期感染甚至发挥更深层次的治疗杀伤效果提供了借鉴,也为新型疫苗传递系统的免疫应答机理进行了有力补充。
2新型颗粒佐剂疫苗的研究进展
2.1尺寸均一乳液和颗粒佐剂的制备
在诸多的纳微米颗粒中,聚合物颗粒基于其独特的优势成为近年来的研究热点。制备聚合物颗粒的材料按其来源可以分为天然和合成高分子材料两大类。天然高分子材料如淀粉、壳聚糖、海藻酸盐、明胶以及白蛋白等具有良好的生物相容性,几乎都可降解而且降解产物无毒。其中壳聚糖、海藻酸盐因材料廉价、易得并具有较好的生物安全性,在生物医药领域受到广泛关注。常见的合成高分子如聚乳酸(PLA)、聚乳酸乙醇酸(PLGA)、聚乙二醇-聚乳酸(PELA)、聚酸酐和聚己内酯等具有结构和性能可人为调控等优点,近几十年来发展迅速。PLA和PLGA是最典型的合成高分子材料,具有很好的生物降解性和生物相容性,已被FDA批准作为可生物降解材料用于药物辅料。
传统高分子聚合物颗粒制备方法如超声、搅拌、均质等,由于剪切场不均一和Oswald熟化现象,无法形成均一液滴,造成乳液的稳定性差,体内分布不具有规律性。虽然有少量研究工作尝试将纳微米颗粒作为佐剂,评价其免疫学效果,然而由于评价中所使用的颗粒可能存在粒径分布宽、个体差异性大的问题,导致结果出现不一致甚至截然相反的现象[4]。为解决上述难题,作者团队发展了一种独特的微孔膜乳化技术,通过选取合适的膜孔径来实现颗粒尺寸的控制(100 nm~100 μm范围内可控),在膜孔均一剪切和合适压力的作用下,制备得到粒径均一的液滴,固化成球后进而得到粒径均一的颗粒(图1),从而保证了实验的准确性和可重现性。基于该项核心技术,通过过程控制手段可以获得具有不同结构和不同性质的纳微米颗粒[5-6],进而满足疫苗多样化和抗原释放的需求,最大程度地发挥佐剂疫苗的免疫应答效果。

图1 微孔膜乳化法原理示意图(a)及利用该技术制备的PLA微球(b)和壳聚糖微球(c)Fig.1 Schematic diagram of membrane emulsification process (a) and PLA microparticles (b) and chitosan microparticles (c) prepared by this process
2.2纳微米颗粒佐剂的设计及应用举例
在制备出均一颗粒的前提下,我们对颗粒佐剂引发的免疫应答体系进行了系统的探索,一方面是对免疫知识体系的补充,另一方面也期待能为颗粒佐剂的设计提供思路。例如,借助微孔膜乳化优势技术,制备出粒径均一且具有不同粒径的3种颗粒,从单因素水平分析粒径效应,保证评价结果的可重现性和准确性。与粒径较大的微米球(如4.8 μm、1.9 μm)相比,纳米球更容易被巨噬细胞(抗原提呈细胞APCs)大量而快速地摄取(图2,颗粒为灰白色)。纳米球被内吞后其颗粒表面积最大,适合作为有效的抗原吸附和运输载体,而微米球展示出较大的内吞颗粒体积,在包埋抗原方面可能更具有优势[7]。此外,粒径影响了细胞因子表达水平,纳米球更有助于促进细胞免疫相关因子(如IL-12等)的分泌。

图2 J774A.1细胞对不同粒径大小的纳微球摄取的显微照片 :(a) 430 nm, (b) 1.9 μm和(c) 4.8 μmFig.2 Micrographs of different sized micro/nanoparticles absorbed by macrophages :(a) 430 nm,(b) 1.9 μm,and (c) 4.8 μm
除粒径之外,我们还研究了颗粒其他理化性质对生物学效应的影响[8-10]。以亲疏水性为例,选取主体结构为聚乳酸的3种材料(PLA、PLGA、PELA),并借助膜乳化技术可制备出疏水性不同且粒径均为1 μm的颗粒(PLGA和PELA因分别含有羟基乙酸和聚乙二醇而亲疏水性不同)。通过比较三者在细胞摄取、细胞活化、细胞迁移行为后发现,随着颗粒表面疏水性的增强,颗粒的佐剂效果也随之增强。为揭示相关作用机制,通过巧妙地将3种微球修饰于原子力显微镜探针上,原位分析了细胞与颗粒间的相互作用,发现颗粒疏水性的增强将增大颗粒与细胞(尤其是疏水细胞膜)的相互作用力,进而推动细胞的摄取行为,最终提升免疫应答。
上述研究提示我们,颗粒的粒径大小及表面性质等不仅会影响抗原负载行为,还对后续的细胞学、免疫学效应有重要影响。传统的预防性疫苗,主要激活CD4 T细胞,刺激抗体分泌,中和血液中游离的病毒,引发体液免疫应答。后续发展的治疗性疫苗或肿瘤疫苗,通过激活CD8 T(CTL)细胞,释放穿孔素等,特异性地杀伤和裂解已经被病原体感染的细胞,而引发细胞免疫应答。基于对颗粒性质影响佐剂免疫效果的知识体系,通过设计和调控颗粒性质,有望满足不同类型疫苗对免疫激活和应答方面的需求。
2.2.1预防性疫苗
单独H5N1流感裂解疫苗作为新型疫苗具有安全性高、易于大批量生产的优势,但其免疫原性较弱,需要疫苗佐剂保护疫苗不被降解,同时增强其免疫原性。为解决上述难题,作者团队将前期构建的一种温敏性壳聚糖凝胶体系与快速膜乳化技术相结合,利用颗粒37 ℃发生自固化现象,制备出一种新型颗粒作为H5N1流感裂解疫苗佐剂[11]。首先将溶有壳聚糖或其衍生物的弱酸溶液与甘油磷酸盐水溶液在低温下(4 ℃)混合,混合后溶液为中性(pH 7.4),经过快速膜乳化得到油包水型乳液后升温至37 ℃,乳滴将发生自固化形成颗粒。与传统的壳聚糖颗粒相比,该温敏性颗粒制备和固化过程温和,避免了因使用化学交联剂导致的抗原失活,提高了生物利用度。研究发现,该颗粒注射制剂能显著提高H5N1疫苗诱导的体液免疫应答,血清中特异性总IgG抗体效价和血凝中和抗体显著高于商品化Al佐剂组和LPS组,表现出很好的预防效果。更重要的是,该颗粒还具有pH敏感性,可以促进抗原被树突细胞(DC)摄取并从溶酶体逃逸到细胞质,显著提高H5N1疫苗诱导的细胞免疫反应,在提高体液免疫应答的同时发挥交叉保护能力。

图3 CS-NH2(伯胺颗粒,左)和CS-CL(叔胺颗粒,右)表面基团示意图Fig.3 Schematic diagrams of the structure of different chemical groups on the particles surface of CS-NH2(left) and CS-CL(right)
炭疽是由炭疽杆菌所致的一种人畜共患的急性传染病,作为一种大规模杀伤性武器,至今仍然对人类构成重大威胁。目前的减毒灭活疫苗和铝佐剂基因重组疫苗虽有效力,具有一定副作用或效力不稳定,亟需新的疫苗佐剂。通过利用壳聚糖和海藻酸钠,结合快速膜乳化技术和层层自组装技术,制备出含有不同表面基团的1 μm颗粒(CS-NH2和CS-CL)(图3),然后与重组炭疽抗原(rPA)复配可得到疫苗制剂[12]。细胞试验表明,两种颗粒对抗原的吸附率一致,并且被APCs的摄取的情况相当(均高于单纯抗原组且二者间无显著差异)。但与表面富含叔胺的CS-CL颗粒相比,富含伯胺的CS-NH2颗粒诱导机体产生了快速的但可恢复的炎症激发反应(显示出良好的生物安全性),并显著增强了抗原特异性的血清抗PA抗体分泌水平,提高疫苗的免疫保护能力。CS-NH2颗粒之所以表现出上述优势,主要因其表面富含亲核反应性很强的伯胺基团,能与补体系统中的C3b分子共价结合,从而引发补体反应。提高APCs抗原摄取量通常是免疫效果提升的前提条件,该研究通过引入特定的表面基团,在摄取量一致时,通过诱导APCs摄取活化之外的激活途径同样也可以获得高效的免疫应答,为预防性颗粒佐剂开发的开辟了一个新的视角。
2.2.2治疗性疫苗
由于外源性抗原通常经溶酶体降解,引起CD4 T细胞为主的体液免疫应答,因此激发机体产生高效的细胞免疫应答是治疗性疫苗最大的挑战。虽然铝佐剂能够诱导高效的体液免疫反应,但由于其本身固有的局限性,对细胞免疫应答无能为力。如果借助新型佐剂改善抗原的提呈或降解途径,将有可能激活CD8 T,杀伤感染细胞,辅助疫苗发挥治疗效果。
前期与微米颗粒的比较表明,纳米颗粒有利于促进APCs分泌与细胞免疫应答相关的细胞因子。借助纳米球佐剂的理论成果,尝试将PLA纳米球(350 nm)与HBsAg复配制得疫苗制剂,对纳米球作为治疗性乙肝疫苗佐剂进行了应用探索[13]。与商品化铝佐剂相比,该纳米球颗粒体系不仅可以增加乙肝抗原被细胞的摄取,提高抗原(灰白色)与细胞相互作用的机率,而且能够拓展抗原的运输途径,使其逃脱溶酶体(灰色)游离于胞质中(图4a)。在APCs摄取和提呈抗原效率同时得到提升的基础上,纳米球佐剂有效上调了细胞免疫应答的两个关键评价指标,直接对靶细胞发挥细胞因子IFN-γ(图4b)和细胞毒性T细胞CTL(图4c)的特异性裂解作用。该研究说明,纳米颗粒在引起细胞免疫方面具有独到的优势,为治疗性疫苗打破乙肝病毒导致的免疫耐受提供了理论上的可行性。

图4 纳米颗粒促进抗原从溶酶体逃逸(a)从而提升IFN-γ分水平(b)和CTL杀伤活性(c)Fig.4 Nanoparticles promote the antigen to escape from lysosomes (a) ,induce higher IFN-γ level (b) and CTL lysis activity (c)
为了得到更高水平的细胞免疫效果,分别采用3种多聚阳离子聚合物(壳聚糖CS、壳聚糖盐酸盐CSC和聚乙烯亚胺PEI)对PLA颗粒表面进行镀层修饰[14]。修饰后的微球颗粒表面电势由负到正翻转(其中PEI-PLA颗粒荷电水平最高),并且对HBsAg抗原的吸附量也随之增加。其中,荷正电最多的PEI-PLA体系可以使抗原最大程度地被APCs细胞内化,提高炎症相关细胞因子的表达,在体内诱导产生了接近甚至超过铝佐剂的高水平乙肝IgG特异性抗体。特别地,镀层后的PLA颗粒更容易促进抗原逃逸出溶酶体,其中PEI-PLA颗粒还能同时提升IgG2a(偏向细胞免疫)比例,显示出良好的细胞免疫效果。因此,增加颗粒的正电性能够进一步提高颗粒活化APCs的效果,最终获得高水平的体液和细胞双重免疫应答。由此可见,通过调控颗粒性质拓展抗原的运输途径,是治疗性疫苗发挥细胞免疫应答的有效途径。
2.2.3肿瘤疫苗
相比于放疗、化疗等传统治疗肿瘤的方法,免疫治疗(如肿瘤疫苗)因其特异性高、副作用低等优势引起了广泛关注。然而,肿瘤抗原免疫原性低,难以引起有效的肿瘤杀伤效果。为了增加肿瘤抗原被机体免疫系统识别的机会,作者团队设计并制备了修饰有细胞穿膜肽(CPP)的尺寸均一的PLGA纳米颗粒(CNP)[15]。借助肿瘤细胞对纳米颗粒的摄取作用,将两种细胞因子佐剂(粒细胞/巨噬细胞集落刺激因子GM-CSF和白细胞介素2 IL-2)高效导入肿瘤细胞内,经灭活后制成多佐剂复合型肿瘤全细胞疫苗(图5)。修饰CPP后的纳米颗粒,不仅可以使免疫因子快速导入肿瘤细胞内,而且避免了溶酶体对外源性物质的降解以保证免疫因子的活性。体内的治疗效果研究表明,疫苗中的复合成分,可以针对不同免疫应答环节起效,使大量CTL迁移到肿瘤病灶部位,有效地抑制了肿瘤的生长,延长了小鼠的生存时间。此外,疫苗免疫后的小鼠血清中反映肝、肾和心肌毒性指标值均处于正常范围内,证明了该疫苗具有良好的安全性。通过在颗粒表面嫁接配体,可以避开靶向至肿瘤细胞,
前面所述的绝大多数颗粒佐剂主要以球型为主,随着新材料新技术的出现,开发与传统颗粒形状甚至维度不同的新型颗粒佐剂也将成为可能。例如,通过对二维平面粒子氧化石墨烯(GO)的生物学效应进行系统性评价,揭示了新型二维粒子与三维球型颗粒截然不同的性质[16]。与微米级GO相比,纳米级GO更能够引起APCs强烈的应激性行为,分泌与免疫激活相关的细胞因子。基于该结果,借助二维GO粒子所特有的疏水多环平面结构和高比表面积性质,采用简便而快速的吸附策略,制备出具有超高抗原负载量的肿瘤疫苗制剂。初步的动物实验表明,基于GO的肿瘤疫苗体系,可同时提升APCs细胞募集、抗原加工提呈以及T细胞免疫应答的效果。该研究丰富了以传统球型颗粒为主的知识体系,并拓展了新型颗粒在疫苗领域应用的多样化设计范畴。

图5 基于纳米颗粒的多佐剂复合型全细胞肿瘤疫苗示意图Fig.5 Schematic diagram of nanoparticles-based multi-adjuvant whole cell tumor vaccine for cancer immunotherapy
2.3纳微米颗粒佐剂作用机理
2.3.1增加APCs对抗原的摄取和提呈
传统铝佐剂以及新型颗粒佐剂的作用机制如图6所示。单纯抗原制剂经肌肉注射后,会被机体快速清除[17],而铝盐佐剂可以显著提高其在注射部位的停留(储库效应),诱导严重的炎症反应,募集大量的免疫细胞(如中性粒细胞、DC等)[18]。颗粒佐剂因其材料来源和表面性质的不同,作用机制有所区别。如壳聚糖凝胶颗粒在注射后也发挥了类似募集APCs的作用,但PLA微球佐剂却并未延长抗原在注射部位的停留,而是略微加速了抗原被APCs的清除。然而,两种颗粒佐剂共同的特点是可以促使大量抗原进入APCs,其中表面带正电荷的颗粒更有利于被细胞内化摄取,促进细胞分泌与免疫激活相关的细胞因子。
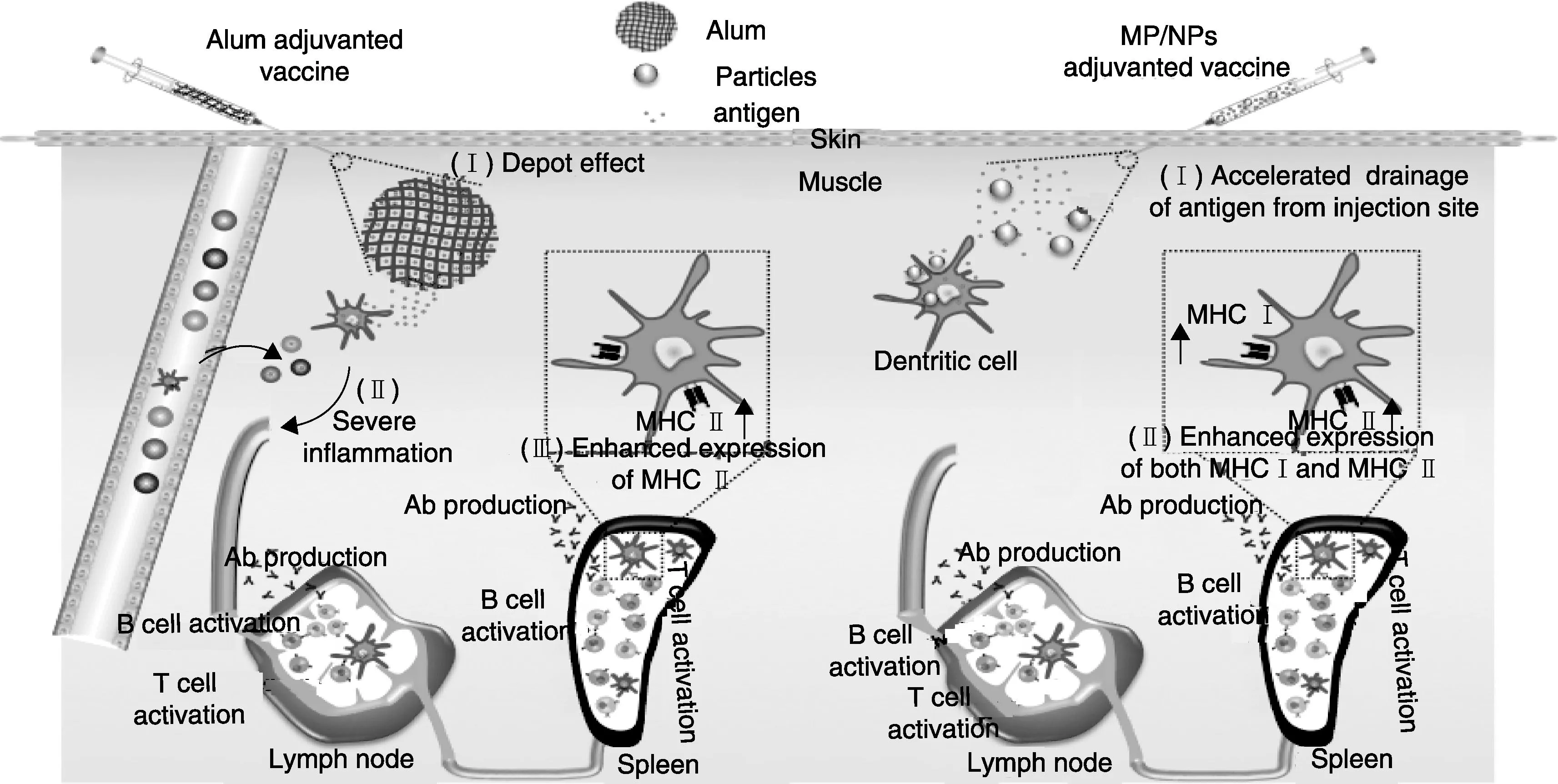
图6 铝佐剂和纳微米颗粒佐剂的不同作用机制图示Fig.6 Graphic representing of mechanisms of alum and MP/NPs adjuvanted vaccine.
2.3.2提升抗体滴度水平
铝盐佐剂可以促使外源性疫苗抗原以MHC II的途径提呈到APCs表面,从而为CD4 T细胞提供特异性的抗原识别信号。这也是铝佐剂可以诱导IgG抗体水平,发挥高效体液免疫应答的原因之一。与铝佐剂相比,颗粒佐剂也可以提升APCs(如脾细胞DC)的MHCⅡ分子的表达量,诱导产生接近甚至超越铝佐剂的IgG滴度水平,以及更高水平的中和抗体(HI)滴度和IgM滴度(免疫应答初期)。由此可见,在以预防为主的体液免疫方面,颗粒佐剂具有匹配或略微强于铝盐的佐剂效果。
2.3.3提高细胞免疫应答
商品化铝佐剂无法有效提升细胞免疫应答的可能原因是T细胞识别信号MHC I和CD80/CD86共刺激因子表达水平的下调[13]。与之相反,颗粒佐剂可以同时提升APCs的MHC I分子和共刺激因子的表达水平,从而为特异性CD8 T细胞提供识别(第1信号)和激活(第2信号)。特别地,外源性抗原从溶酶体逃逸至胞质中降解,循MHC I分子途径提呈(即“交叉提呈”)激活CD8+CTL,是以颗粒为佐剂的治疗性疫苗或肿瘤疫苗发挥作用的关键。激活后的CTL通过释放穿孔素和颗粒酶裂解靶细胞,达到杀伤清除靶细胞的目的。因此,在以治疗为主的细胞免疫应答方面,颗粒佐剂发挥着独特的优势,远优于当前商品化佐剂的效果。
3新型凝胶佐剂疫苗的研究进展
3.1凝胶佐剂的制备
目前仍没有针对黏膜系统的免疫佐剂,多数是将传统的佐剂体系制成溶液、喷雾或粉末等,其黏膜粘附性差,容易被清除,无法有效携带抗原跨越黏膜系统屏障。而高分子水凝胶,具有良好的粘附性,有助于延长抗原与黏膜的接触时间,可作为黏膜免疫抗原的良好递送载体,弥补目前黏膜免疫佐剂的不足。天然多糖壳聚糖是近年来被广泛关注的高分子凝胶材料,通过将壳聚糖改性合成得到壳聚糖季铵盐材料,一方面可以改善壳聚糖的水溶性,另一方面增加其正电荷量以增强黏膜粘附性[19]。研究发现,季铵盐壳聚糖(HTCC)与甘油磷酸钠(GP)通过电荷相互作用后能够形成一种具有明显的溶液(Sol)-凝胶(Gel)转换特性温度敏感的水凝胶(图7)。在此过程中,HTCC含量、GP含量以及季铵取代度(QD)都会影响凝胶体系的黏度和凝胶转变时间。以QD为例,取代度越高(>79.5%)时,在37 ℃下加热后,体系需要较长时间发生从溶液到凝胶的转变。一方面是因为季铵基团引入越多,空间位阻作用越大,分子链不容易卷曲而聚集;另一方面,季铵基团的阳离子性较强,增大了链间的静电斥力,阻碍了分子链的相互靠近;同时,季铵基团具有较强的亲水性,在周围形成一层规整的水合层,增加了溶液稳定性。

图7 季铵盐壳聚糖温敏性水凝胶机理图(a)及溶液-凝胶状态照片(b)Fig.7 The mechanism of thermo-sensitive HTCC gel (a) and sol-gel image (b)
通过一系列条件优化,可筛选出适宜鼻黏膜免疫水凝胶载体的配方,使凝胶体系在室温下为流动性良好的液体,而37 ℃时,能在一定时间内转变为不流动的凝胶。借助上述特性,凝胶系统与抗原混合后以液体方式滴鼻免疫,可以使抗原在鼻腔能充分铺展,并与鼻黏膜紧密接触。在鼻腔温度下一定时间后,转变为难以流动的凝胶,从而为后续免疫应答的发挥奠定基础。
3.2凝胶作为疫苗佐剂的应用探索
流感病毒变异快,人体接种或感染后经常对变异后新病毒不具有免疫力。而黏膜免疫应答诱导产生的分泌性IgA (sIgA) 抗体能产生针对不同亚型病毒的免疫,起到交叉保护作用,在应对流感病毒的感染上具有独特的优势。针对流感病毒感染的特殊性,以所开发的壳聚糖水凝胶作为佐剂[20-21],采用MF59商业化佐剂作为阳性对照,肌肉注射组作为传统免疫方式对照进行了动物实验评价。与鼻黏膜免疫其他各组比较,温敏水凝胶组诱导产生了最高的IgG抗体水平和HI效价,表明凝胶疫苗在机体发生流感病毒感染时,能快速中和病毒表面,减弱其与细胞膜结合而感染细胞的能力。更重要的是,温敏凝胶组诱导产生了最高的黏膜IgA抗体效价(显著高于MF59)。虽然抗原肌肉注射组产生的抗体和HI效价较高,但是几乎未能诱导产生鼻腔和肺部的IgA抗体反应。该结果揭示了凝胶佐剂诱导系统和黏膜共同免疫应答的优势,同时也反映出针对特定抗原选择合适疫苗传递系统的重要性。
埃博拉病毒也是一种能经过呼吸道传播的烈性病原体,感染后具有高达90%的死亡率。以HTCC水凝胶作为黏膜免疫佐剂,与埃博拉膜蛋白抗原(Ad-Gpz)混合均匀制得疫苗制剂。小鼠滴鼻免疫试验表明,凝胶抗原体系在1 h内能维持鼻腔高浓度的抗原量(>80%),而单独抗原滴鼻则仅有25%抗原在鼻腔停留。特定HTCC取代度的水凝胶诱导产生高水平的血清IgG和鼻黏膜IgA抗体水平。特别地,凝胶组肠系膜淋巴细胞分泌的抗原特异性的IL-4水平显著增强,表明鼻腔免疫引起了远端肠道黏膜的体液免疫反应,这对从肠道黏膜和鼻黏膜两个方面共同防止病原体的感染具有显著的优势。
3.3凝胶佐剂作用机理
3.3.1延长抗原停留时间
鼻黏膜纤毛清除鼻腔异物的半衰期是15 min 左右,因此经鼻的抗原或药物要达到高的生物利用度需要克服这一生理因素,否则抗原或药物在鼻腔内还未进入到鼻黏膜下层即被清除体外或进入胃内被强酸环境代谢降解。例如,以MF59为佐剂的疫苗制剂在滴鼻后段时间内即被小鼠吞咽进胃部代谢失活,不能持续刺激黏膜的免疫细胞,只能诱导产生较低的黏膜IgA抗体水平。而水凝胶佐剂可以显著延长抗原在鼻腔的组织的停留时间。黏膜上皮细胞膜带负电荷,带大量正电荷的壳聚糖凝胶溶液可充分铺展在黏膜表面并借助其电荷相互作用紧密地黏附在鼻黏膜表面。另外,凝胶具有温度敏感性的特点,在体系从溶液向凝胶转变后,可有效限制鼻黏膜纤毛的摆动,极大地减缓黏膜的清除速率。
3.3.2增加抗原在黏膜的渗透
单独抗原仅在1 h内有少量停留。水凝胶和抗原体系在鼻腔发生胶凝后,抗原从水凝胶的网状结构内逐步扩散到鼻黏膜表面,1 h后抗原进一步渗透至鼻黏膜下层开始弥散均匀的分布,渗透深度为50 μm后到达鼻中隔软骨组织层,显示出了凝胶一定的抗原缓释效果。这种增强作用与凝胶独特的温敏性和正电荷性是分不开的。借助壳聚糖季铵盐强的正电荷效应,有助于刺激细胞之间的紧密连接蛋白ZO-1的聚集和重排,打开黏膜上皮细胞间通路,增强抗原的渗透量(图8)。而抗原以磷酸盐(PBS)溶液形式免疫后,主要经鼻黏膜M细胞转运进入黏膜下层,其通过胞内途径转运抗原的效率明显低于水凝胶细胞间隙途径。
图8 水凝胶使得抗原通过细胞间隙进入黏膜下层的显微照片Fig.8 Micrographs of hydrogel leading to antigen penetrating to down layer of mucous membrane through cellular gap
3.3.3T细胞的活化
水凝胶协助大量抗原进入到黏膜下层后,可有效地激活鼻黏膜相关淋巴结中T细胞(提升T细胞活化标志CD127),并加快CD8 T细胞功能成熟并向其他淋巴结和淋巴器官引流。注射免疫不仅不能产生鼻黏膜IgA的抗体反应,对黏膜部位T细胞的抗原特异性激活也处于失效状态。另外,MF59佐剂并未诱导CD8 T细胞高表达CD127,这可能是因为MF59抗原复合物在鼻腔与黏膜层细胞接触时间短,对黏膜相关免疫细胞刺激较弱造成。
4结语
随着生物材料技术的发展,集靶向递送和联合刺激于一体的智能型体系将成为新型疫苗传递系统的发展方向。首先,基于对佐剂性质对免疫学效果的理论结果,可以在尺寸均一颗粒的基础上通过对材料的控制、共价偶联改性或者嫁接靶向配体,进一步引入多个组份,使体系具有特定的功能(运输或靶向)和活性(免疫刺激或调节)。其次,如何获得高效而安全的“最优组合”,使引入的各组分不只是简单相加,而是充分发挥协同作用达到“1+1>2”的提高效果,亟需对免疫学机理进行更深入的探讨。对疫苗制剂免疫学效应的考察,可以从细胞层面上的研究向更宏观和微观的层面上拓展,从分子-细胞-组织-动物-临床整体跨层次多尺度地动态研究各组分之间的相互制约和协同作用,将为疫苗递送体系的设计提供更准确而全面的理论依据和指导。最后,绝对安全的佐剂是不存在的,但可以根据其作用机制尽可能保持微妙的平衡。如通过选择黏膜、口服或者微针等其它递送方式,利用佐剂对抗原的特异性靶向(如甘露糖受体)到达APCs细胞,或者通过局部淋巴结达到组织特异性,将有利于保持上述平衡,以达到最大的免疫刺激作用和最小的毒副作用。
参考文献References
[1] Coffman RL, Sher A, Seder RA. Vaccine Adjuvants: Putting Innate Immunity to Work[J].Immunity,2010, 33 (4):492-503.
[2]Petrovsky N, Aguilar JC. Vaccine Adjuvants: Current State and Future Trends [J].ImmunologyandCellBiology,2004, 82(5):488-496.
[3]Singh M, Chakrapani A, O′Hagon D. Nanoparticles and Microparticles as Caccine-Delivery Systems[J].ExpertReviewofVaccines,2007, 6 (5):797-808.
[4]Oyewumi MO, Kumar A, Cui ZR. Nano-Microparticles as Immune Adjuvants: Correlating Particle Sizes and the Resultant Immune Responses [J].ExpertReviewofVaccines,2010, 9 (9):1095-1107.
[5]Ma Guanghui (马光辉),Su Zhiguo(苏志国). 微球材料尺寸和结构控制的过程工程 [J].JournalofChemicalIndustryandEngineering(化工学报),2014, 65 (7):2 575-2 587.
[6]Ma G. Microencapsulation of Protein Drugs for Drug Delivery: Strategy, Preparation, and Applications[J].JControlRelease, 2014,193(9):324-340.
[7]Yue H, Wei W, Yue ZG,etal. Particle Size Affects the Cellular Response in Macrophages[J].EuropeanJournalofPharmaceuticalSciences, 2010, 41 (5):650-657.
[8]Mitragotri S, Lahann J. Physical Approaches to Biomaterial Design[J].Naturematerials, 2009, 8 (1):15-23.
[9]Yue ZG, Wei W, Lv PP,etal. Surface Charge Affects Cellular Uptake and Intracellular Trafficking of Chitosan-Based Nanoparticles[J].Biomacromolecules,2011, 12 (7):2 440-2 446.
[10]Liu Y, Yin Y, Wang LY,etal. Surface Hydrophobicity of Microparticles Modulates Adjuvanticity [J].JournalofMaterialsChemistryB, 2013, 1 (32):3 888-3 896.
[11]Wang YQ, Wu J, Fan QZ,etal. Novel Vaccine Delivery System Induces Robust Humoral and Cellular Immune Responses Based on Multiple Mechanisms [J].AdvancedHealthcareMaterials, 2014, 3 (5):670-681.
[12]Liu Y, Yin Y, Wang LY,etal. Engineering Biomaterial-Associated Complement Activation to Improve Vaccine Efficacy [J].Biomacromolecules, 2013, 14 (9):3 321-3 328.
[13]Yue H, Wei W, Fan B,etal. The Orchestration of Cellular and Humoral Responses is Facilitated by Divergent Intracellular Antigen Trafficking in Nanoparticle-Based Therapeutic Vaccine [J].PharmacologicalResearch, 2012, 65 (2):189-197.
[14]Chen X, Liu Y, Wang L,etal. Enhanced Humoral and Cell-Mediated Immune Responses Generated by Cationic Polymer-Coated PLA Microspheres with Adsorbed HBsAg[J].MolecularPharmaceutics,2014, 11 (6):1 772-1 784.
[15]Liu SY, Wei W, Yue H,etal. Nanoparticles-Based Multi-Adjuvant Whole Cell Tumor Vaccine for Cancer Immunotherapy[J].Biomaterials, 2013, 34 (33):8 291-8 300.
[16]Yue H, Wei W, Yue Z,etal. The Role of the Lateral Dimension of Graphene Oxide in the Regulation of Cellular Responses [J].Biomaterials, 2012, 33 (16):4 013-4 021.
[17]Zhang W, Wang L, Liu Y,etal. Immune Responses to Vaccines Involving a Combined Antigen-Nanoparticle Mixture and Nanoparticle-Encapsulated Antigen Formulation [J].Biomaterials,2014, 35 (23):6 086-6 097.
[18]Zhang WF, Wang LY, Liu Y,etal. Comparison of PLA Microparticles and Alum as Adjuvants for H5N1 Influenza Split Vaccine: Adjuvanticity Evaluation and Preliminary Action Mode Analysis [J].PharmaceuticalResearch, 2014, 31 (4):1 015-1 031.
[19]Wu J, Wei W, Wang LY,etal. A Thermosensitive Hydrogel Based on Quaternized Chitosan and Poly(Ethylene Glycol) for Nasal Drug Delivery System [J].Biomaterials, 2007, 28 (13):2 220-2 232.
[20]Wu YB, Wu SP, Hou LH,etal. Novel Thermal-Sensitive Hydrogel Enhances Both Humoral and Cell-Mediated Immune Responses by Intranasal Vaccine Delivery [J].EuropeanJournalofPharmaceuticsandBiopharmaceutics, 2012, 81 (3):486-497.
[21]Wu YB, Wei W, Zhou M,etal. Thermal-Sensitive Hydrogel as Adjuvant-Free Vaccine Delivery System for H5N1 Intranasal Immunization[J].Biomaterials,2012, 33 (7):2 351-2 360.
(编辑易毅刚)

专栏特约编辑顾忠伟
顾忠伟:男,1949年生,教授,博士生导师。国家“973”计划生物材料领域连续三届首席科学家,国际生物材料科学与工程Fellow,四川省学术与技术带头人。1981年毕业于北京大学化学系高分子专业,师从我国高分子学科创始人冯新德院士,1994年被评聘为教授。曾在美国北卡州RTI研究所、犹他大学生物工程系学习工作,2005年被引进四川大学。现任国家生物医学材料工程技术研究中心主任、四川大学生物材料工程研究中心主任;中国生物材料学会副理事长、中国材料研究学会常务理事、中国生物医学工程学会常务理事、四川省生物医学工程学会理事长等;聚合物分子工程国家重点实验室(复旦大学)学委会委员、国家纳米药物工程技术研究中心(华中科技大学)工程技术委员会委员、南开大学生物活性材料教育部重点实验室学委会副主任、天津市材料复合与功能化重点实验室学委会副主任、武汉大学生物医用高分子教育部重点实验室学

特约撰稿人胡金莲
委会委员、中科院生态环境高分子材料重点实验室学委会委员、中科院宁波材料技术与工程研究所高分子与复合材料事业部学术与工程技术指导委员会委员等。长期从事生物医用高分子、基因/药物高效传递系统、功能纳米生物材料与有序组装等研究,从可控合成、结构调控、新功能与多功能构筑等方面做了一系列开创性工作。在AdvMater,AngewChemIntEd,ACSNano,AdvFunctMater,Biomaterials,JControlRel,Small等国际著名学术期刊上共发表论文~300篇,以及100余篇国际及全国学术会议报告摘要;授权国家发明专利20余项;编写及翻译13部专著及章节(含英文专著/章节);主持和参与生物材料国际及全国学术会议20余次;多次参与讨论并撰写关系我国生物材料发展的规划和建议。主要研究方向:生物医用高分子;药物/基因递送与控释系统;纳米生物医用材料;仿生与自组装生物材料。

特约撰稿人杨 军
胡金莲:女,1961年生,香港理工大学纺织及制衣学系教授,博士生导师;智能高分子材料领域活跃和多产的研究者之一,国际著名的形状记忆高分子材料科技领域的领航者之一,引导了世界形状记忆纺织品科技研究的潮流。主要从事智能聚合物研究,包括形状记忆聚合物在纺织品、服装、生物医学领域的基础研究和应用研究;纺织材料的检测、仪器测试、纺织结构/动力学;纤维复合材料研究以及织物外观、织物悬垂性的数字化评估和模拟。2003年成立形状记忆纺织品研究中心,担任中心主任。2004年全球首创形状记忆纤维素面料,并且奠定了形状记忆聚合物在纺织上应用的理论基础。首次提出了形状记忆聚合物性能如何与纺织品性能相结合的概念,在生物医学领域上研发新物料及产品。
杨军:女,1968年生,工学博士,教授,博士生导师。主要从事生物材料与再生医学研究。近年来着眼于融合生物学、材料学及生物工程学的原理与技术,开发基因工程生物合成融合蛋白生物材料及其与天然多糖的复合材料;研究三维动态仿生细胞外微环境构建的基本机制与技术;进一步揭示材料与细胞之间的相互作用及生物材料在体内外促进诱导组织再生的基本原理和规律;探索肝脏、血管相关组织工程支架材料及其在再生医学领域的应用开发。发表SCI收录论文30余篇,被SCI论文引用500余次,授权国家发明专利2项。

特约撰稿人马光辉
马光辉:女,1964年生,研究员,博士生导师。1988年获得日本群马大学纤维高分子工学科学士学位,1990年和1993年分别获东京工业大学高分子工学科硕士和博士学位。1994~2001年任东京农工大学生物系统应用科学研究科的Assistant Professor。2001年回国后入选中科院“百人计划”,国家杰出青年获得者(2001 年),“百千万人才工程”国家级人选(2003 年),生化工程国家重点实验室主任、国家生化工程技术研究中心主任、中国颗粒学会副理事长、中国化工学
会生物化工专业委员会副主任委员、中国生物工程学会理事等,国际期刊JMicroencapsulation,FrontierofChemicalScienceandEngineering编委。主要从事高分子微球和微囊的制备及其在生化工程和医药工程的应用研究。发明了均一高分子微球和微囊的制备方法,解决了传统搅拌分散法尺寸不均一、尺寸难以控制且需要筛分的关键难题。通过与GE、辉瑞、联合利华、华兰生物等企业合作将专利成果产业化,微球和微囊技术及设备在200多家单位获推广;在生物化工分离介质、细胞培养微载体、药物载体等领域获得重要应用。主持国家科技重大专项2项,自然科学基金重点项目、“973”、“863”等重要课题多项;在JACS,AdvMater,AdvFunctMater,Biomaterials,Nanomedicine,JControlRelease等期刊发表论文210余篇,他引700余次;撰写英文专著10部。申请中国发明专利75项,国际专利3项;中国发明专利授权42项、国际专利授权3项(美国2、欧洲1)。获国家技术发明二等奖(2009年)及省部级科技进步奖10余项。主要研究方向:生化反应及生化分离用新型微球介质的制备和应用;新型纳微米颗粒疫苗佐剂的制备和应用;蛋白质/多肽药物缓控释制剂以及抗癌药物载体的制备和应用。
The Development of Micro/Nano Particles and HydrogelBased Vaccine Delivery System
YUE Hua, MA Guanghui
(State Key Laboratory of Biochemical Engineering, Institute of Process Engineering,
Chinese Academy of Sciences, Beijing 100190, China)
Abstract:The development of novel vaccines posed several challenges for the study of adjuvant. To overcome the incapability of conventional adjuvant on cellular immune response, a series of uniform sized micro/nano-particles (MP/NPs) with different physio-chemical properties (size, charge or surface group) were prepared by using the polymer materials with good biocompatibility. MP/NPs could improve the antigen internalization, antigen presentation and T cell proliferation, which were catering for the preventive or therapeutic effect against the infectious diseases or cancer. To complement the nasal immune adjuvant, a novel thermal-sensitive hydrogel, which can undergo sol-gel transition at body temperature were developed by using the chitosan with good bioadhesion. This hydrogel could significantly prolong the antigen residence time, enhance the antigen penetration, and activate the immune cells, thus inducing strong immune responses and expanding the conventional vaccination by injection. The MP/NPs and hydrogel based adjuvant exhibited a promising era for the novel vaccine delivery system.
Key words:micro/nano particles; hydrogel; adjuvant; vaccine delivery system;membrane emulsification process
中图分类号:R944
文献标识码:A
文章编号:1674-3962(2015)03-0216-08
DOI:10.7502/j.issn.1674-3962.2015.03.04
通讯作者:马光辉,女,1964年生,研究员,博士生导师,
基金项目:国家科技重大专项(2014ZX09102045);科技部“973”计划项目(2013CB531500);国家自然科学基金资助项目(51302265)
收稿日期:2014-10-29

