快速成型制备凝胶支架在组织工程中的应用及进展
潘 婷,曹晓东
(国家人体组织功能重建工程技术研究中心,广东 广州 510006)
快速成型制备凝胶支架在组织工程中的应用及进展
潘婷,曹晓东
(国家人体组织功能重建工程技术研究中心,广东 广州 510006)
摘要:对于组织工程而言,如何将种子细胞、细胞外基质和生物刺激信号这3大要素完美结合,对于植入体的植入成败至关重要。对于解决这一关键问题,器官打印或组织打印作为一种新兴的制备组织工程支架的技术,具有巨大的应用前景。这种技术可以将包载生物活性因子(细胞及其他生物活性刺激信号)的凝胶层层组装,得到精确的三维结构,并可控制生物活性因子的打印位置。而凝胶材料因其高含水率、优异的细胞相容性及可控的降解速率等性能,成为最有应用前景的生物打印材料。另一方面,通过快速成型技术这一强大的工具,可以制备得到具有精确内外结构,并包载多种活细胞或其它生物因子(生长因子、基因等)的组织工程支架。然而,并非所有的快速成型方法均适用于凝胶成型。简单总结了可用于制备包载细胞凝胶支架的快速成型方法,进一步讨论了每种方法可用的凝胶材料类型。凝胶材料较低的力学性能是限制其在生物打印方面应用的一个重要缺陷,关于这一问题及改进的方法也做了初步讨论。
关键词:凝胶;快速成型;生物打印;组织工程;支架
1前言
迄今为止,组织器官的病变、缺损和移植一直以来都是临床医学亟需解决的一大难题[1]。传统的修复方法是自体组织移植术,虽然可以取得满意疗效,但它是以牺牲自体健康组织为代价的方法,会导致很多并发症及附加损伤;异体组织移植又面临着供体器官来源极为有限、致命的免疫排斥反应及一系列的并发症等重重困难。自20世纪80年代科学家首次提出“组织工程学”概念以后[2],为众多的组织缺损、器官功能衰竭病人的治疗带来了曙光。组织工程是一个新兴的正在成长中的多学科交叉领域,结合生物医学和工程学的方法,通过活体细胞或诱使内源细胞来帮助组织形成或再生,从而恢复、维持或提高组织功能。
对于组织工程与再生医学而言,如何将种子细胞、组织工程支架和生物刺激信号这3大要素完美结合对于植入体的植入成败至关重要。对于无机材料和含水率较低的高分子材料,支架与细胞结合的方式只能通过支架成型后接种细胞。但研究证明这种结合方式的缺陷在于细胞的接种率较低,且无法控制细胞在空间上的分布[3-4]。为了提高细胞的接种率,并控制细胞的空间分布,可以将细胞包裹在支架材料中同时成型。该方法要求一个高含水量的细胞外微环境。
天然或合成的凝胶材料因其较高的水含量、优良的生物相容性、可控的降解速率等,被认为是最适合用于细胞外基质(ECM)或包载细胞的生物材料之一[5]。因此,近几十年来,这类凝胶在组织器官的修复与重建方面得到了广泛的研究与应用。由于凝胶的亲水性,它们可以吸收比自身干态重量高达千倍的水分,形成化学稳定或者可生物降解的胶态。然而,尽管凝胶有种种诱人的优势,它在应用方面还是存在诸多限制。其中主要的一个缺陷在于使用传统的方法很难将凝胶加工成预设计好的形状和结构[6],而快速成型制备技术的出现可以很好解决这一难题。
快速成型技术(又称3D打印技术或增材制造技术) 是20世纪80年代后期开始逐渐兴起的一项新兴制造技术,它采用离散/堆积原理,先由三维CAD软件设计出组织工程支架的三维多孔结构,然后将材料逐层沉积在平台上[7-8]。3D 打印技术的应用领域也在随着技术的进步而不断扩展,包括生活用品、机械设备、生物医用材料,甚至是活体器官。在生物医学领域,目前3D 打印技术在国际上已开始被应用于器官模型的制造与手术分析策划、个性化组织工程支架材料和假体植入物的制造、以及细胞或组织打印等方面。该技术应用于组织工程领域的主要优势在于,可以得到具有100%连通性的多孔支架,且不仅支架的外型结构,而且包括内部连通孔的孔隙率和孔结构,都可通过CAD-CAM软件系统精确控制,从而可以保证细胞的生长、迁移和增殖,以及氧气及营养物质的输送[9]。再者,通过计算机辅助设备的精确控制,支架制备工艺的重复性好。
本文将重点阐述各类适用于凝胶成型且能较为精确控制外部形状和内部结构的快速成型方法。文章不仅分析了各种方法的优势,同样指出了当前存在的一些问题。
2制备凝胶支架的快速成型方法
快速成型技术根据其成型原理可大致分为3类:①激光成型原理;②挤出成型原理;③喷印成型原理。激光成型原理利用光固化成型技术,通过激光引发聚合物交联成型构成组织工程支架。挤出成型原理是将具有一定黏度的熔融体材料在计算机控制下挤出、沉积,固化成型。喷印成型原理是在基底表面铺上薄层粉体材料,通过喷印液态粘结剂将粉体融化粘结;或利用喷墨技术直接喷印材料成型。凝胶材料的成型要求较为温和的工艺条件。因此,不是所有的快速成型方法均适用于凝胶材料的成型。本文主要介绍了上述3类成型原理中适用于制备凝胶支架的快速成型技术。
2.1激光成型技术
2.1.1激光成型技术的工作原理及目前趋势
除了选择性激光烧结技术(SLS),其它激光成型技术均适用于凝胶成型。与挤出成型和喷射成型体系连续沉积材料不同,激光成型技术是将光能量连续打印在预设的图案上。由此可知,只有使用可光交联的预聚物才能得到交联的凝胶网络。
光固化立体印刷技术(SLA)SLA技术使用的原料为液态光敏树脂,也可在其中加入其他材料形成复合材料。它是采用计算机控制下的紫外激光束以计算机模型的各分层截面为路径逐点扫描,使被扫描区内的树脂薄层产生光聚合或光交联反应后固化,当一层固化完成后,在垂直方向移动工作台,使先前固化的树脂表面覆盖一层新的液态树脂,逐层扫描、固化,最终获得三维原型[10](图1)。工作台的移动高度要略小于每层的固化厚度,以保证接下来的一层能够很好地与上一次粘接。后续处理步骤包括洗去多余的树脂,大多数情况下还需要用紫外光束进一步交联固化。Arcaute等人[11]研究了通过改变激光强度、光交联材料(PEG-DMA)和光交联引发剂的浓度来调控层固化厚度。
微光固化立体印刷技术(μ-SLA)μ-SLA技术的原理可认为与普通的SLA技术相同,不同之处在于两种技术的精确度上的区别,μ-SLA精度更高,可制备从几微米到厘米级别不等的构件[12-13]。
图1a为自下而上制备工艺原理图。构件在浸泡在树脂液体下面的制造工艺平台上自下而上逐层堆积成型,新的一层通过激光照射在前一层的上面固化。尽管这种制造工艺目前应用最为广泛[11,14],但自上而下的制造方法也引起了越来越广泛的研究兴趣[10, 15-16](图1b)。自上而下的制备装置有一个透明的平板作为储液器的底部。激光从装置的底部引发光敏材料聚合,制造平台朝激光照射的反方向移动,逐层固化成型。通过这一方式,每一新固化层都出现在上一层的下部。将新成型的每一层从底部平板上分离要使构件承受更大的机械力,但另一方面,引发聚合的表面不会直接暴露在空气中(氧气的存在会降低交联率),且不需要在构件上覆盖新的树脂层,同时光照面可以一直保持光滑[10]。在SLA领域另一个应用越来越广泛的技术是数位光源式投射技术(DLP)[16-17],工作原理如图1b中自上而下制备工艺示意图所示。该原理同样也可用于自下而上的成型方法。DLP技术可使一整层的树脂一次性固化,可以极大地提高加工速率。它包括一个数字微反射镜装置(DMD),DMD由一系列镜面组成,每个镜面都可独立地调整为开或关闭状态。这样DMD可以作为动态的光罩在表面投射出2D的图案(可由微软演示文稿文件设计)。除了DMD,LCD也可作为动态光罩[17-18]。但是考虑到光学填充因素和光透射,DMD的效果要更好一些[14]。
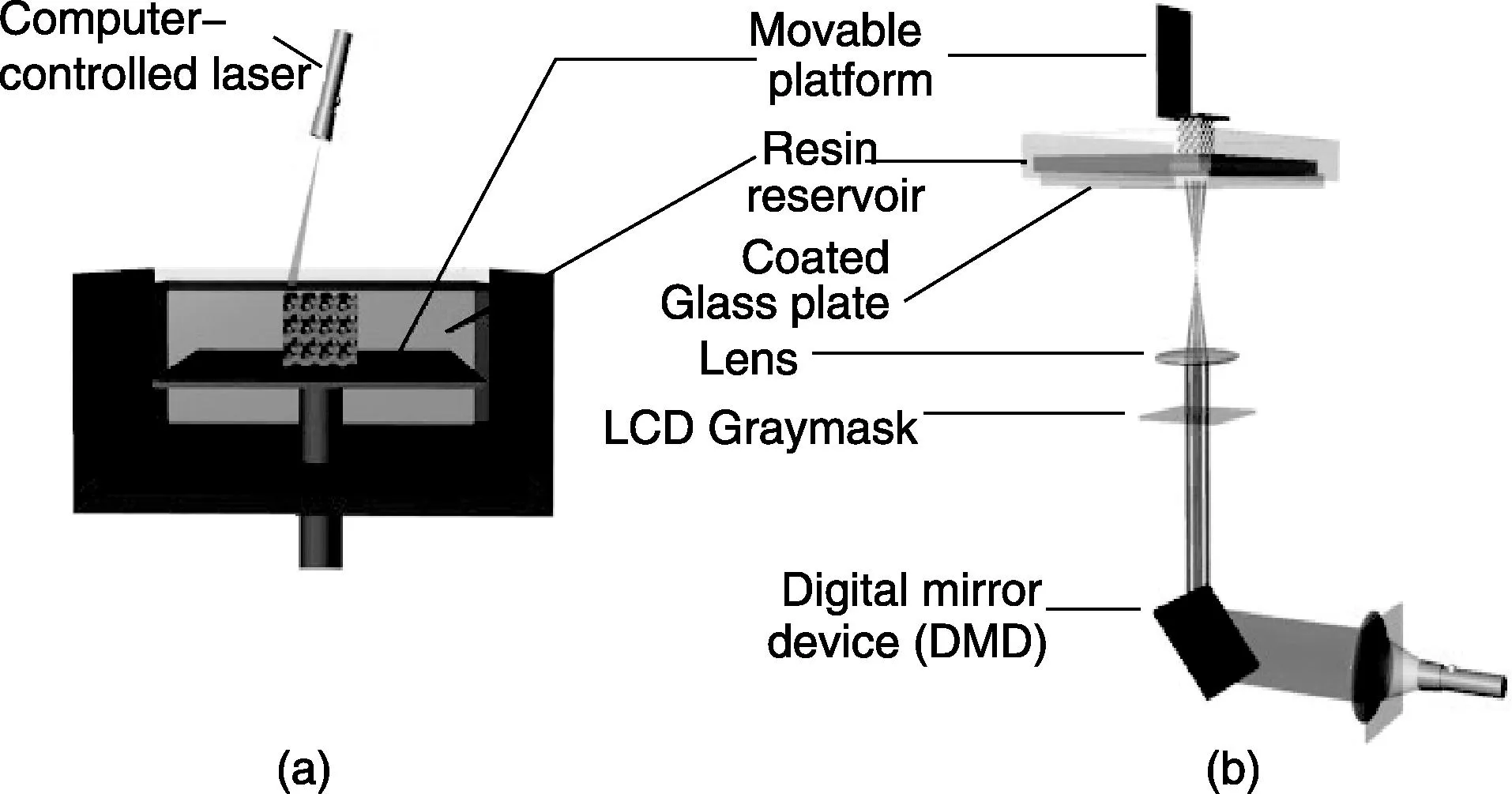
图1 光固化立体印刷技术自下而上(a)和自上而下(b)制备工艺示意图[10]Fig.1 Schematic diagram of bottom-up (a) and top-down (b) stereo- lithography setups. The bottom-up setup shown is an example of a system whereby the laser scans the surface for the curing of the photosensitive material. In the example of the top-down setup, dynamic light projection technology is used to cure a complete 2D layer at once[10]
双光子聚合(2PP)2PP技术是目前越来越热的一项激光成型技术。该技术同样是利用光引发光敏材料发生交联聚合。但与一般的单光子聚合技术不同,2PP技术通过波长为800 nm的近红外飞秒激光脉冲引发材料的聚合反应[19](如图2所示)。在聚焦点,光引发剂同时吸收波长800 nm的双光子,这样双光子可作为一个波长在400 nm的单光子,从而引发聚合反应[16]。这种非线性的激发特性只会激发聚焦点处的聚合反应,其它区域并不会参与反应,因此可以降低光源衍射对固化精度带来的影响。移动激光聚焦点可以构建出3D结构。该技术可以重复生产出微米尺寸的构件,其精度可达到100 nm以下,这是其它快速成型工艺所不能实现的[20]。

图2 双光子聚合激光成型技术工作原理示意图[19]Fig.2 Working principle of two-photon photo-polymerization. In the focal point of the near-IR laser beams, the photosensitive polymer is cross-linked. A ‘true’ 3D object is obtained[19]
2.1.2激光成型技术的缺陷及适用的凝胶材料
SLA技术常用于制备多孔的凝胶支架。Yu等人[21]研究了图案化羟乙基甲基丙烯酸酯(HEMA),通过干燥后再水化处理提高细胞的粘附性。起初该项技术用于制备单层凝胶结构,目前也可以制备多层的多孔凝胶支架。Liu等人[22]用感光乳剂作为光罩,制备聚乙二醇二丙烯酸酯(PEG-DA)三维凝胶支架。他们制备出了层数为3层、分辨率为几百微米的三维网络结构。连通的孔隙可使培养介质传送,有利于细胞的存活。但是这项工作耗时较长,需要大量预先制备的光罩,而且并不完全自动化。也有许多研究小组用PEG-DA作为初始材料[23-24]。Yasar等人[17]成功制备了尺寸为100 μm的复杂支架结构。然而PEG-DA的溶胀性能限制了生产尺寸小于100 μm的构件的可重复性。近期,很多工作致力于研究包载细胞的凝胶光固化成型。一些研究组报道了使用可光交联的PEG包载细胞成型[22, 25]。
除了合成凝胶,一些天然凝胶也可通过SLA技术成型,如透明质酸(HA)[26]和明胶[15]。然而,激光固化成型技术的主要缺陷包括必须要使用可光交联的材料,限制了可使用的材料;且紫外光束会对细胞产生一些影响[27]。
因为SLA技术制备凝胶支架后处理步骤会带来支架的收缩,因此该项技术的一大缺点就在于制备精度较低[28]。而且由于激光束的散射现象,当制备尺寸较小的构件时会发生较为严重的变形,制备的凝胶支架在移动时易被损坏,而且必须要后期再光固化。为了解决SLA制备精度较低这一缺陷,通过改进引进了μ-SLA技术。例如,Barry等人[29]将直写成型技术与原位光引发交联技术结合,制备了微米级别的凝胶支架。利用该技术,另一个课题组实现了精度在亚微米范围的PEG-DA凝胶支架[30]。
为了得到分辨率小于细胞尺寸的三维支架,可以用2PP技术替代SLA技术得以实现。鉴于2PP技术研究时间并不长,因此在凝胶支架制备方面的研究报道并不多。例如,Schade等人[31]用该技术制备了结构较好的类凝胶支架。该支架由甲基丙烯酸化的聚氨酯和PEG-DA作为初始材料。Ovsianikov等人[32]同样选择PEG-DA作为初始材料制备了2PP三维支架。T.Billiet等人[33]用甲基丙烯酰胺修饰的明胶作为初始材料,通过2PP技术制备凝胶支架。
2.2挤出成型技术
2.2.1挤出成型技术的工作原理及目前趋势
挤出成型技术包含很多成型技术,如熔融沉积技术(FDM)、多相喷射固化技术(MJS)、精确挤出成型技术(PEM)等等。这些技术都需要一个升温熔融的过程,这不利于支架的生物活性,并不适用于凝胶材料的成型[7]。因此,研究者们提出了一些其它的成型技术来克服这一缺陷。下面介绍几种在凝胶制备中应用较多的挤出成型技术。
三维绘图技术(3D-BioplotterTM)该技术由Landers等人于2000年提出[34](如图3所示)。这一技术特别适用于软组织工程支架的成型,并且简化了凝胶的成型加工过程。三维结构的构建是通过计算机控制针头在平台上扫描、挤出材料,层层沉积成型。该技术不光能够沉积成型连续的纤维,也可以成型不连续的点状微粒。

图3 三维绘图成型技术(3D-BioplotterTM)工作原理图[9]Fig.3 Schematic diagram of 3D-Bioplotter dispensing principle. In the 3D-Bioplotter system, the nozzle works pneumatically or via volume-driven injection. This also illustrates the principle of nozzle-based systems in general, where a nozzle is used for the deposition of material. Key difference with other nozzle-based systems is the ability to plot into a liquid medium with matching density, thus introducing buoyancy compensation[9]
液体的流出是通过气压挤出(气动针头)或步进电机(体积驱动注射针头)控制的。该技术的一大特色在于可以将一种黏性材料挤出沉积在密度相匹配的液态介质当中。低粘度的材料尤其适用这种基于浮力补偿原理的沉积方式。因为避免了加热升温的过程,该技术可应用于热敏感的生物活性组分,也可以应用于细胞的打印。纤维的直径可以通过调整材料的黏度、沉积速度、针头直径和施加压力等参数控制。大多数由该沉积方法制备的构件都具有较为光滑地表面,这并不利于细胞的粘附及生长。因此,进一步地表面处理从而增强支架的细胞粘附性是必要的。Kim等人[35]改进了Bioplotter设备,增加了一个可以在打印过程中产生振动的压电式转换器。这样打印出的PCL支架表面更加粗糙,细胞粘附性能更好。
压力辅助微量调节注射技术(PAM)这一技术与FDM类似,但没有加热的过程,由Vozzi等人提出[36]。设备包括一个5~20 μm的气动玻璃毛细注射器,可以在垂直面上下移动,将材料沉积在基底上面。基底可以在水平面上相对于注射器平行移动。材料的黏度、沉积速度、针头直径和施加压力都会影响最终得到的沉积纤维的直径。PAM技术打印支架的研究已经有一些文献报道[37-38]。近期,也有报道使用PAM技术成型凝胶支架的相关研究工作[39-40]。
低温沉积成型技术(LDM)该技术由Xiong等人[41]于2002年构想提出,并在生物医药领域有很好的应用。此技术最大的优势在于不需要对材料进行加热熔融处理[41]。利用低于0 ℃的温度,可将材料溶液沉积在加工平台上。材料可通过一个可以在XY-平面移动的针头挤出到可以在Z轴移动的接收平面上[42]。LDM技术可以使用多个不同设计的低温针头,因此可以成型多相材料或梯度分层的多孔结构[43]。LDM技术同样可以加工生物活性分子,从而直接制备具有生物活性的支架。
直写成型技术(DIW)直写成型技术可以加工很多种类的材料,且几乎可以成型任意预设的结构和外形[44-45]。胶体状的“墨水”可以二维或者三维图案化成型,且横向分辨率比喷印成型技术或其他3D打印技术得到的结构小至少一个数量级[46]。胶体凝胶装载在一个安装在z方向臂轴上的注射器中,通过一个圆锥形的针头(φ100 μm~1 mm)挤出,在可移动的x-y平台上沉积成型。该技术所使用的墨水必须满足两个重要的条件:①墨水材料必须具有可控的粘弹响应,当材料从针头中流出,要能立即在平台上固化沉积,以保证能维持预设的形状,即使遇到下层纤维之间的空隙也可维持自身的结构;②使用的墨水必须要有足够高的胶体体积比例,以减小成型结束后干燥带来的体积收缩[47-48]。
2.2.2适用于挤出成型技术的凝胶材料及存在的缺陷
海藻酸钠[48-49]、明胶[50]、透明质酸[51]、纤连蛋白[52]、基质胶[49]、Pluronic®F127[53]等天然或人工合成凝胶都适用于挤出成型技术。目前,很多研究工作使用该技术研究凝胶包载细胞直接打印成型凝胶-细胞混合支架[54-56]。当然各个技术也存在着一些缺陷。3D-Bioplotter制备的凝胶支架精确度较低且机械性能较差。Wong等人[57]证实材料的硬度可以影响细胞的铺展和迁移速度。细胞在较硬的区域铺展性更好,而在硬度较低表面迁移更快。另外,3D-Bioplotter对于不同的材料都要摸索优化其打印参数,因此相较而言是一种比较耗时的成型技术。而DIW技术所使用的“墨水”,即凝胶体系必须要满足前面提到的两个重要的原则,在一定程度上限制了材料的选择。
Khalil等人[58]组装了一个使用4种不同微型喷管的多针头低温成型系统:气动微型阀、压电式针头、螺线管阀和精确挤出沉积(PED)针头。该系统还包括一个气压供给装置,并联的气动阀可同时工作,从而在制备三维支架的同时达到多相沉积的目的。使用这个装置可以制备多层的细胞-凝胶混合结构[59]。PAM技术也可用于凝胶成型,且该技术是快速成型制备凝胶支架中横向精确度最高的方法。研究证明这一技术的精准性可与软光刻蚀技术相媲美[60]。但是,如果要使用直径很小的毛细注射管需要非常小心操作以免损坏注射管。而且要从很小的孔径中挤出材料需要较大的压力。
2.3喷印成型技术
2.3.1喷印成型技术的工作原理及目前趋势
喷墨打印技术可以分为按需滴定法和连续喷印法。按需滴定体系使用电信号控制单个液滴的喷射。在连续喷印体系中,喷管在压力的控制下将墨水连续喷出。喷出的液体分散成一系列小液滴,喷射方位由电信号控制[61]。两种方法都可控制液滴粒径在15 μm到几百微米的范围内[61]。与挤出成型原理类似,喷印成型技术也是通过计算机辅助控制材料在平台上层层沉积成型。
3DPTM美国麻省理工学院的Sachs教授开发了3DPTM技术[62]。该技术是固相快速成型技术的典例。3DP技术可成型的材料的范围很广泛,包括陶瓷、金属、金属-陶瓷复合物和高分子材料。在固相快速成技术中,3DP技术是唯一可以用于凝胶材料的技术。3DPTM技术的原理如图4所示。工作流程可分为3个连续的步骤:①粉体供给平台升高,制备平台降低;②滚轴推动聚合物粉体在平台上铺展成一薄层;③喷头喷射液体粘接剂,将粉体颗粒粘接。粘接剂可溶解或溶胀粉体颗粒,通过聚合物链段相互向内扩散或粘接剂直接渗透到粉体内从而达到粘接的目的。重复循环这一连续步骤可层层组装得到三维构件。3DP技术一个很重要的因素就是要使用生物相容性良好的粘接剂。使用的粘接剂可以是纯相的或者表面涂覆的,取决于成型支架的要求[63]。当然,也可以使用单一组分的粘接剂或者多种粘接剂的混合物。当制备过程完成,移除多余粉体,便可得到结构复杂的三维支架。粘接体系必须要满足的基本要求如下:①粘接剂溶液中粘接剂的含量要足够高,但同时黏度不能太大以保证能从喷头中喷出;②连续喷印要求喷头最小化的导电性;③粘结剂必须能够快速干燥或固化,这样才能进行下一层粉体的粘接。基于粉体的成型体系有一个很大的优势在于制备的支架表面比较粗糙,更适于细胞的粘附[61]。

图4 典型的3DPTM制备装置结构示意图[63]Fig.4 Schematic representation of a typical 3DP setup. A roller spreads a thin layer of polymer powder over the previously formed layer, and is subsequently solidified by the spatially controlled delivery of a liquid binder[63]
Zcorp公司研发了一种3D打印机(Z402),可以使用天然高分子材料,使用的粘结剂是一种水溶性墨水[64-65]。这为凝胶材料的打印创造了更大的发展空间。Utela等人[66]对粉体材料3DPTM技术成型做了详尽的综述,包括成型过程的各个步骤和粉体粘接剂的选择及发生的反应。
3DPTM技术可以从两个不同的方面来实现构件的形貌结构:一是所能达到的最小单位尺寸;二是局部维度的可调整性[63]。这两个方面很大程度上都依赖于粘接剂液滴和粉体颗粒间的相互作用。控制粉体与粘接剂之间反应的参数包括:粉体材料本身的性质、粉体表面处理工艺、粉体颗粒粒径大小及粒径分布、粉体颗粒的形状、粉体堆积密度、粘接剂的性质、粘接剂的黏度、粘接剂表面张力、液滴尺寸、液滴喷射速率、粉体和粘接剂的温度以及周围环境的温度[61]。决定构件最终精密度的因素包括:固化的每一层厚度的精确性,粘接剂液滴沉积位置的精准程度,喷射的液滴分散铺展的可重复性,伴随着粉体粘接局部结构改变的可重复性。有时会提到仪器的分辨率,这里分辨率指最小孔的孔径和可得到最薄的层厚度[63]。
喷墨打印技术(Inkjet Printing)这一喷印成型技术包括所有液相喷墨打印成型技术。其中一些设备与3DPTM技术所用设备基本相同,将粉床换为液态凝胶前驱体即可[67]。还有一些与直写成型技术所用设备相同[68],若是直写成型技术,则无需粘接剂,液态材料自身沉积成型即可。
2.3.2喷印成型技术的缺陷及适用的凝胶材料
喷印成型技术被认为是最不适用于凝胶支架成型的快速成型方法。但也有不少工作尝试使用凝胶或凝胶与其他高分子材料的混合物三维成型,并取得了很多成果。
Landers等人[34]研究了使用水溶性高分子作为支架材料,用水溶性糖类胶水粘接。尽管似乎可供选择的粉体的种类较多,但这项技术需要经过烧结或固化的后处理过程,以提高支架的机械性能和稳定性。
Lam等人[65]使用以淀粉为主体的混合粉体作为成型材料,混合粉体的组分为:玉米淀粉(50%)、葡聚糖(30%)和明胶(20%),均为质量分数。而粘接剂材料使用的是去离子水。制备得到的支架为圆柱形(φ12.5 mm×12.5 mm),内部孔结构为圆柱形(φ2.5 mm)或矩形(2.5 mm×2.5 mm)。使用水作为粘接剂可以避免有毒性的制备环境和支架残留毒性的可能性。另一个使用水作为粘接剂的优势在于可以加入生物活性物质(如生长因子)或活细胞。支架成型后需要后处理操作,以提高支架的力学性,并且提高抗水溶性。支架在100 ℃干燥1 h后,浸泡入不同含量的共聚物溶液,含75%聚乙交酯和25%PCL的二氯甲烷溶液。
Xu等人[69]利用喷墨成型技术制备三维支架,所用的凝胶材料为纤连蛋白凝胶。纤连蛋白作为一种适用于三维打印的凝胶材料,用于构建神经修复的三维支架。纤连蛋白凝胶化通过加入凝血酶和CaCl2引发纤维蛋白原发生酶聚合反应实现。首先在平台上铺敷一层很薄的纤维蛋白原薄膜,之后通过喷头在纤维蛋白原薄膜上喷印凝血酶。凝血酶可将纤维蛋白原快速凝胶化形成纤连蛋白凝胶。接下来在凝胶化的纤连蛋白上喷印一层NT2神经细胞。整个过程重复5次,最终得到一个三维的神经细胞-凝胶混合薄膜。
3DP技术制备凝胶支架目前亟需解决的问题是提高精度和力学强度。3DP支架的分辨率很大程度上被支架的层厚所限制,层厚由设备在Z轴的分辨率和粉体的粒径大小共同决定[63]。要提高3DP支架的精度,一方面要提高设备的分辨率,另一面与粉体的粒径有很大的关系。然而,粉体的粒径还会影响到粉体的流动性,从而影响粉体在粉床上铺展的均匀程度。因此一味地减小粉体的粒径也不可行,粒径太小的粉体的流动性变差,在粉床上的铺展也不好。要找到粉体粒径和流动性的平衡点,或是在保证较小粒径尺寸下提高粉体的流动性。Spillmann等人[70]用等离子体处理方法来提高粉体的流动性,可以保证在较小粒径尺寸(5 μm)的前提下得到铺展更为均匀的粉层(如图5所示)。而提高支架材料的力学性能一方面要从成型工艺入手,更重要的是要提高凝胶材料本身的性质。成型工艺方面,可以通过优化支架的结构和使用合适的粘接剂来提高支架的力学性能。如何提高凝胶材料本身的力学性能在下面做一讨论。

图5 等离子体方法处理过的高流动性的凝胶材料粉体照片(a)和均匀铺展的粉层照片(b)[70]Fig.5 The images of high flowability of plasma treated 5 μm powders (a) and a homogeneous bed of the same powder (b)[70]
3提高打印凝胶的力学性能
对于组织工程支架而言,一个基本要求就是要有与所要修复的组织器官相匹配的力学强度,以在组织器官重建前能够持续提供一个三维的空间支撑细胞的迁移及生长、营养物质及代谢废物的运输等[9]。例如,硬组织修复要求的力学强度在10~1 500 MPa范围内,而软组织修复要求的力学强度为0.4~350 MPa[9]。
如前所述,凝胶材料的一大应用缺陷就在于其较低的力学性能,这对临床处理和体内应用带来了极大的限制,因此提高凝胶材料的力学性能是至关重要的。对于快速成型制备的凝胶支架而言,通过使用光敏基团修饰凝胶材料而后交联处理是较常使用的方法。因此,有科研人员研究了可逆热敏(在某一温度范围内为凝胶态,高于或低于该温度范围为液态)和光敏凝胶在3D打印构建骨组织工程支架方面的应用[71-72]。该研究工作所使用的方法为挤出成型技术,优势在于温敏的凝胶可以在挤出后很快固化成型,而后光交联的过程可以很好提高支架的力学性能和稳定性(如图6所示)。凝胶组分中其中一种为Lutrol F127 AlaL,是一种可光交联的热敏凝胶,由Schacht等人通过修饰Pluronic F127研发而得[71]。Lutrol F127 AlaL是由聚环氧乙烷和聚环氧丙烷聚合而成的三嵌段共聚物,并由可光交联聚合的甲基丙烯酰胺基团修饰。在聚合物溶液中加入光引发剂Irgacure 2959并光照引发聚合,可以提高凝胶的力学强度。而凝胶的降解性能也可通过改变化学组分而改变。更为重要的是,该凝胶材料还可以包载细胞同时成型。

图6 挤出成型的Lutrol-TP 支架:(a) 组装的三维结构,(b) 成型的未光交联处理的支架和 (c) 光交联处理后的支架[71] Fig.6 Printed Lutrol-TP scaffolds:organized 3D structure (black arrowhead: vertical pores; white arrowhead: fused horizontal pores), inset: total printed scaffold (a) , printed unphotopolymerized structure (b) and handling after photopolymerization (c)[71]
4结语
本文重点总结了可用于制备包载细胞的凝胶支架的快速成型方法,且进一步讨论了每种方法适用的凝胶材料类型及目前应用的趋势及存在的缺陷。鉴于凝胶材料自身存在力学性能较弱的缺陷,本文在如何提高凝胶支架的力学性能方面做了一些讨论。使用凝胶材料作为支架材料在于看好它可以较好地模拟细胞外基质,可以包载细胞的同时成型。这样更有利于研究细胞外基质(ECM)对细胞的作用,如细胞如何与ECM相互作用、改变ECM的构型以及如何在ECM中迁移等。快速成型的方法可以更好地控制凝胶支架的内外结构,相较于传统成型方法更具有应用前景。但各种不同的快速成型技术仍然存在着一些应用方面的缺陷,需要进一步的改进。
例如,可以结合多种不同的成型技术,以发挥各技术的优势、弥补不足。Moroni等人[73]将静电纺丝技术(~纳米级孔径)和生物绘图技术(~微米级孔径)相结合,可以构建含有多级孔径结构的支架。
另外,ECM是一个结构、组分都很复杂的体系,单一网络结构和化学组分很难很好地模拟ECM。因此,更多的工作要致力于研究多种凝胶材料包载多种生物活性物质(生长因子、细胞等)同时成型,制备混合组分的支架。这样才能更好地作为组织工程支架模拟细胞外基质,促进细胞的生长及组织的重建与修复。
参考文献References
[1]Wolfe R A, Roys E C, Merion R M. Trends in Organ Donation and Transplantation in the United States, 1999-2008[J].AmericanJournalofTransplantation:OfficialJournaloftheAmericanSocietyofTransplantationandtheAmericanSocietyofTransplantSurgeons, 2010,10:961-972.
[2]Langer R, Vacanti J P. Tissue Engineering[J].Science, 1993,260:920-926.
[3]Martin I, Wendt D, Heberer M. The Role of Bioreactors in Tissue Engineering[J].TrendsinBiotechnology, 2004,22:80-86.
[4]Stephens J S, Cooper J A, Phelan F R,etal. Perfusion Flow Bioreactor for 3D In Situ Imaging: Investigating Cell/Biomaterials Interactions[J].BiotechnologyandBioengineering, 2007,97:952-961.
[5]Slaughter B V, Khurshid S S, Fisher O Z,etal. Hydrogels in Regenerative Medicine[J].AdvancedMaterials, 2009,21:3 307-3 329.
[6]Van Vlierberghe S, Dubruel P, Lippens E,etal. Toward Modulating the Architecture of Hydrogel Scaffolds: Curtains Versus Channels[J].JournalofMaterialsScienceMaterialsinMedicine, 2008,19:1 459-1 466.
[7]Yeong W Y, Chua C K, Leong K F,etal. Rapid Prototyping in Tissue Engineering: Challenges and Potential[J].TrendsinBiotechnology, 2004,22:643-652.
[8]Seol Y J, Kang T Y, Cho D W. Solid Freeform Fabrication Technology Applied to Tissue Engineering with Various Biomaterials[J].SoftMatter, 2012,8:1 730-1 735.
[9]Hollister S J. Porous Scaffold Design for Tissue Engineering[J].NatureMaterials, 2005,4:518-524.
[10]Melchels FPW, Feijen J, Grijpma D W. A Review on Stereolithography and Its Applications in Biomedical Engineering[J].Biomaterials, 2010;31:6 121-6 130.
[11]Arcaute K, Mann B K, Wicker R B. Stereolithography of Three-Dimensional Bioactive Poly(ethylene glycol) Constructs with Encapsulated Cells[J].AnnalsofBiomedicalEngineering, 2006,34:1 429-1 441.
[12]Seung-Jae L, Jong-Won R, Dong-Woo C. Development of Three-Dimensional Alginate Encapsulated Chondrocyte Hybrid Scaffold Using Microstereolithography[J].JournalofManufacturingScienceandEngineering, 2008,130:1-5.
[13]Seung-Jae L, Hyun-Wook K, Jung Kyu P,etal. Application of Microstereolithography in the Development of Three-Dimensional Cartilage Regeneration Scaffolds[J].BiomedicalMicrodevices, 2008,10:233-241.
[14]Lu Y, Mapili G, Suhali G,etal. A Digital Micro-Mirror Device-Based System for the Microfabrication of Complex, Spatially Patterned Tissue Engineering Scaffolds[J].JournalofBiomedicalMaterialsResearchPartA, 2006,77A:396-405.
[15]Schuster M, Turecek C, Weigel G,etal. Gelatin-Based Photopolymers for Bone Replacement Materials[J].JournalofPolymerSciencePartA-PolymerChemistry, 2009,47:7 078-7 089.
[16]Liska R, Schuster M, Infuehr R,etal. Photopolymers for Rapid Prototyping[J].JournalofCoatingsTechnologyandResearch, 2007,4:505-510.
[17]Jae-Won C, Wicker R, Seok-Hee L,etal. Fabrication of 3D Biocompatible/Biodegradable Micro-Scaffolds Using Dynamic Mask Projection Microstereolithography[J].JournalofMaterialsProcessingTechnology, 2009,209:5 494-5 503.
[18]Sun C, Fang N, Wu D M,etal. Projection Micro-Stereolithography Using Digital Micro-Mirror Dynamic Mask[J].SensorsandActuatorsA-Physical, 2005,121:113-120.
[19]Maruo S, Nakamura O, Kawata S. Three-Dimensional Microfabrication with Two-Photon-Absorbed Photopolymerization[J].OpticsLetters, 1997,22:132-134.
[20]Jin-Feng X, Xian-Zi D, Wei-Qiang C,etal. Improving Spatial Resolution of Two-Photon Microfabrication by Using Photoinitiator with High Initiating Efficiency[J].AppliedPhysicsLetters, 2007,90:131106-1-3.
[21]Tianyue Y, Chiellini F, Schmaljohan D,etal. Microfabrication of Hydrogels for Biomedical Applications[C]//ProceedingsoftheSPIE-TheInternationalSocietyforOpticalEngineering. 2002,4 690:854-860.
[22]Liu V A, Bhatia S N. Three-Dimensional Photopatterning of Hydrogels Containing Living Cells[J].BiomedicalMicrodevices, 2002,4:257-266.
[23]Liu Tsang V, Chen A A, Cho L M,etal. Fabrication of 3D Hepatic Tissues by Additive Photopatterning of Cellular Hydrogels[J].FASEBJournal:OfficialPublicationoftheFederationofAmericanSocietiesforExperimentalBiology,2007,21:790-801.
[24]Yasar O, Lan S-F, Starly B. A Lindenmayer System-Based Approach for the Design of Nutrient Delivery Networks in Tissue Constructs[J].Biofabrication, 2009,1(4):1 281-1 286.
[25]Koh W G, Revzin A, Pishko M V. Poly(ethylene glycol) Hydrogel Microstructures Encapsulating Living Cells[J].Langmuir, 2002,18:2 459-2 462.
[26]Khademhosseini A, Eng G, Yeh J,etal. Micromolding of Photocrosslinkable Hyaluronic Acid for Cell Encapsulation and Entrapment[J].JournalofBiomedicalMaterialsResearchPartA, 2006,79:522-532.
[27]Khademhosseini A, Langer R. Microengineered Hydrogels for Tissue Engineering[J].Biomaterials, 2007,28:5 087-5 092.
[28]Hutmacher D W, Sittinger M, Risbud M V. Scaffold-Based Tissue Engineering: Rationale for Computer-Aided Design and Solid Free-Form Fabrication Systems[J].TrendsinBiotechnology, 2004,22:354-362.
[29]Barry R A, Shepherd R F, Hanson J N,etal. Direct-Write Assembly of 3D Hydrogel Scaffolds for Guided Cell Growth[J].AdvancedMaterials, 2009,21:2 407.
[30]Dajun Y, Lasagni A, Peng S,etal. Rapid Prototyping of Microstructured Hydrogels Via Laser Direct-Write and Laser Interference Photopolymerisation[J].VirtualandPhysicalPrototyping, 2008,3:221-229.
[31]Schade R, Weiss T, Berg A,etal. Two-Photon Techniques in Tissue Engineering[J].InternationalJournalofArtificialOrgans,2010,33:219-227.
[32]Ovsianikov A, Gruene M, Pflaum M,etal. Laser Printing of Cells into 3D Scaffolds[J].Biofabrication, 2010,2(1):014 104.
[33]Ovsianikov A, Deiwick A, Van Vlierberghe S,etal. Laser Fabrication of Three-Dimensional CAD Scaffolds from Photosensitive Gelatin for Applications in Tissue Engineering[J].Biomacromolecules, 2011,12:851-858.
[34]Landers R, Mulhaupt R. Desktop Manufacturing of Complex Objects, Prototypes and Biomedical Scaffolds by Means of Computer-Assisted Design Combined with Computer-Guided 3D Plotting of Polymers and Reactive Oligomers[J].MacromolecularMaterialsandEngineering, 2000,282:17-21.
[35]Geun Hyung K, Joon Gon S. 3D Polycarprolactone (PCL) Scaffold with Hierarchical Structure Fabricated by A Piezoelectric Transducer (PZT)-Assisted Bioplotter[J].AppliedPhysicsA:MaterialsScience&Processing, 2009,94:781-785.
[36]Vozzi G, Ahluwalia A. Microfabrication for Tissue Engineering: Rethinking the Cells-on-a Scaffold Approach[J].JournalofMaterialsChemistry, 2007,17:1 248-1 254.
[37]Vozzi G, Previti A, De Rossi D,etal. Microsyringe-Based Deposition of Two-Dimensional and Three-Dimensional Polymer Scaffolds with A Well-Defined Geometry for Application to Tissue Engineering[J].TissueEngineering,2002,8:1 089-1 098.
[38]Vozzi G, Previti A, Ciaravella G,etal. Microfabricated Fractal Branching Networks[J].JournalofBiomedicalMaterialsResearchPartA, 2004,71A:326-333.
[39]Tirella A, Vozzi G, Ahluwalia A. Biomimicry of PAM Microfabricated Hydrogel Scaffold[C]//Proceedingsof24thInternationalConferenceonDigitalPrintingTechnologiesDigitalFabrication2008. 2008:496-500.
[40]Tirella A, Orsini A, Vozzi G,etal. A Phase Diagram for Microfabrication of Geometrically Controlled Hydrogel Scaffolds[J].Biofabrication, 2009,1(4):251-260.
[41]Liu L, Xiong Z, Yan Y,etal. Multinozzle Low-Temperature Deposition System for Construction of Gradient Tissue Engineering Scaffolds[J].JournalofBiomedicalMaterialsResearchPartB-AppliedBiomaterials, 2009,88B:254-263.
[42]Xu W, Wang X, Yan Y,etal. Rapid Prototyping of Polyurethane for the Creation of Vascular Systems[J].JournalofBioactiveandCompatiblePolymers, 2008,23:103-114.
[43]Zhuo X, Yongnian Y, Shenguo W,etal. Fabrication of Porous Scaffolds for Bone Tissue Engineering via Low-Temperature Deposition[J].ScriptaMaterialia, 2002,46:771-776.
[44]Smay J E, Gratson G M, Shepherd R F,etal. Directed Colloidal Assembly of 3D Periodic Structures[J].Advancedmaterials, 2002,14:1 279.
[45]Gratson G M, Xu M J, Lewis J A. Microperiodic Structures-Direct Writing of Three-Dimensional Webs[J].Nature, 2004,428:386.
[46]Van Osch THJ, Perelaer J, De Laat AWM,etal. Inkjet Printing of Narrow Conductive Tracks on Untreated Polymeric Substrates[J].AdvancedMaterials, 2008,20:343.
[47]Jiyou Guo J, Lewis J A. Aggregation Effects on the Compressive Flow Properties and Drying Behavior of Colloidal Silica Suspensions[J].JournaloftheAmericanCeramicSociety, 1999,82:2 345-2 358.
[48]Cohen D L, Lipton J I, Bonassar LJ,etal. Additive Manufacturing for In Situ Repair of Osteochondral Defects[J].Biofabrication, 2010,2(3):3 808-3 812.
[49]Snyder J E, Hamid Q, Wang C,etal. Bioprinting Cell-Laden Matrigel for Radioprotection Study of Liver by Pro-Drug Conversion in a Dual-Tissue Microfluidic Chip[J].Biofabrication, 2011,3(3):034 112.
[50]Wang X H, Yan Y N, Pan Y Q,etal. Generation of Three-Dimensional Hepatocyte/Gelatin Structures with Rapid Prototyping System[J].TissueEngineering, 2006,12:83-90.
[51]Shim J H, Kim J Y, Park M,etal. Development of A Hybrid Scaffold with Synthetic Biomaterials and Hydrogel Using Solid Freeform Fabrication Technology[J].Biofabrication, 2011,3.
[52]Xu W, Wang X, Yan Y,etal. Rapid Prototyping Three-Dimensional Cell/Gelatin/Fibrinogen Constructs for Medical Regeneration[J].JournalofBioactiveandCompatiblePolymers, 2007,22:363-377.
[53]Franco J, Hunger P, Launey M E,etal. Direct Write Assembly of Calcium Phosphate Scaffolds Using A Water-Based Hydrogel[J].ActaBiomaterialia, 2010,6:218-228.
[54]Fedorovich N E, De Wijn J R, Verbout A J,etal. Three-Dimensional Fiber Deposition of Cell-Laden, Viable, Patterned Constructs for Bone tissue Printing[J].TissueEngineeringPartA,2008,14:127-133.
[55]Cheng J, Lin F, Liu H,etal. Rheological Properties of Cell-Hydrogel Composites Extruding through Small-Diameter Tips[J].JournalofManufacturingScienceandEngineering, 2008,130:021 014.
[56]Huang Y, He K, Wang X. Rapid Prototyping of A Hybrid Hierarchical Polyurethane-Cell/Hydrogel Construct for Regenerative Medicine[J].Materialsscience&engineeringC,Materialsforbiologicalapplications, 2013,33:3 220-3 229.
[57]Wong JY, Velasco A, Rajagopalan P,etal. Directed Movement of Vascular Smooth Muscle Cells on Gradient-Compliant Hydrogels[J].Langmuir, 2003,19:1 908-1 913.
[58]Khalil S, Nam J, Sun W. Multi-Nozzle Deposition for Construction of 3D Biopolymer Tissue Scaffolds[J].RapidPrototypingJournal, 2005,11:9-17.
[59]Wonhye L, Debasitis J C, Lee V K,etal. Multi-Layered Culture of Human Skin Fibroblasts and Keratinocytes through Three-Dimensional Freeform Fabrication[J].Biomaterials,2009,30:1 587-1 595.
[60]Vozzi G, Flaim C, Ahluwalia A,etal. Fabrication of PLGA Scaffolds Using Soft Lithography and Microsyringe Deposition[J].Biomaterials, 2003,24:2 533-2 540.
[61]Sachs E, Williams P, Brancazio D,etal. Three Dimensional Printing: Rapid Tooling and Prototypes Directly from A CAD Model[C]//ProceedingsofManufacturingInternational'90. 1990:131.
[62]Sachs E M, Haggerty J S, Cima M J,etal. Three-Dimensional Printing Techniques. Google Patents; 1993.
[63]Butscher A, Bohner M, Hofmann S,etal. Structural and Material Approaches to Bone Tissue Engineering in Powder-Based Three-Dimensional Printing[J].ActaBiomaterialia,2011,7:907-920.
[64]Pfister A, Landers R, Laib A,etal. Biofunctional Rapid Prototyping for Tissue-Engineering Applications: 3D Bioplotting Versus 3D Printing[J].JournalofPolymerSciencePartA-PolymerChemistry, 2004,42:624-638.
[65]Lam CXF, Mo X M, Teoh S H,etal. Scaffold Development Using 3D Printing with A Starch-Based Polymer[J].MaterialsScience&EngineeringC-BiomimeticandSupramolecularSystems, 2002,20:49-56.
[66]Utela B R, Storti D, Anderson R L,etal. Development Process for Custom Three-Dimensional Printing (3DP) Material Systems[J].JournalofManufacturingScienceandEngineering-TransactionsoftheAsme, 2010,132.
[67]Boland T, Tao X, Damon B J,etal. Drop-on-Demand Printing of Cells and Materials for Designer Tissue Constructs[J].MaterialsScience&EngineeringC-BiomimeticandSupramolecularSystems, 2007,27:372-376.
[68]Sun J, Ng J H, Fuh Y H,etal. Comparison of Micro-Dispensing Performance Between Micro-Valve and Piezoelectric Printhead[J].MicrosystemTechnologies-Micro-andNanosystems-InformationStorageandProcessingSystems, 2009,15:1 437-1 448.
[69]Boland T, Tao X, Gregory C A,etal. Viability and Electrophysiology of Neural Cell Structures Generated by the Inkjet Printing Method[J].Biomaterials, 2006,27:3 580-3 588.
[70]Spillmann A, Sonnenfeld A, Von Rohr PR. Flowability Modification of Lactose Powder by Plasma Enhanced Chemical Vapor Deposition [J]. Plasma Processes and Polymers,2007,4:S16-S20.
[71]Fedorovich N E, Swennen I, Girones J,etal. Evaluation of Photocrosslinked Lutrol Hydrogel for Tissue Printing Applications[J].Biomacromolecules,2009,10:1 689-1 696.
[72]Vermonden T, Fedorovich N E, van Geemen D,etal. Photopolymerized Thermosensitive Hydrogels: Synthesis, Degradation, and Cytocompatibility[J].Biomacromolecules, 2008,9:919-926.
[73]Moroni L, Schotel R, Hamann D,etal. 3D Fiber-Deposited Electrospun Integrated Scaffolds Enhance Cartilage Tissue Formation[J].AdvancedFunctionalMaterials, 2008,18:53-60.
(编辑惠琼)
《中国材料进展》征稿启事
《中国材料进展》(CN61-1473/TG ISSN 1674-3962)为中国材料研究学会会刊,由中国材料研究学会主办,中国工程院化工、冶金与材料工程学部协办,西北有色金属研究院承办,化学工业出版社出版。主编由中国材料研究学会名誉理事长周廉院士担任。
《中国材料进展》每期不同的材料专栏出版形式,使期刊特色鲜明;宽泛的材料领域前沿报道,使杂志成为一个国内各材料领域研究人员进行交叉学习、合作交流的良好平台。现已编辑出版了60多个材料专栏,涵盖了近48个材料及其交叉科学研究领域。
《中国材料进展》在国内是中国期刊全文数据库(CJFD)、中文科技期刊数据库(全文版)、中国科技期刊综合评价数据库(CAJED)、中国学术期刊(光盘版)(CAJ-CD)、中国学术期刊网络出版总库、中国核心期刊(遴选)数据库、中国科学引文数据库(CSCD)、中国科技论文统计源期刊(核心版)等重要数据源来源期刊。在国际上被美国《化学文摘》(CA)、俄罗斯《文摘杂志》(AJ) 、荷兰《摘要及引文数据库》(SCOPUS)等世界著名检索数据库收录。
本刊现面向国内及国际华人材料科学家,围绕材料科学领域的最新研究成果及热点,广泛征集材料科学与工程、新材料创新应用研究等领域学术领先、具有独创性及行业重要指导意义的原创性研究论文、文献综述及研究快讯。
【版权约定】
◆ 文责自负,编辑部拥有对投稿进行编辑出版规范化处理的权利。必要时,在征得作者同意的情况下,可实施实质内容的修改。
◆ 稿件一经刊出,即表明作者已经认可其版权归属《中国材料进展》杂志社(包括上网版权)。本刊在国内外文献数据库或检索系统进行交流合作时,不再征询作者意见 ,不另付稿酬。
◆ 从2011年1月1日起,发表费1000元/4版。如果超出规定版面,另计费用。
(投稿须知请登录杂志网站 :www.mat-china.com)
地址:陕西省西安市未央路96号(710016)单位:《中国材料进展》杂志社
查询电话:029-86226599传真:029-86282362收稿邮箱:rml@c-nin.com
第一作者:郑玉荣,男,1974年生,化学学士
特约专栏
第一作者:潘婷,女,1990年生,博士研究生
Progress in the Development of Hydrogel-Rapid Prototyping for Tissue Engineering
PAN Ting,CAO Xiaodong
(National Engineering Research Center for Tissue Restoration and Reconstruction, Guangzhou 510006, China)
Abstract:For tissue engineering, the combined actions of seeding cells, matrix and bioactive factors determine the eventual performance of the implant. Organ or tissue printing, a novel approach in tissue engineering, creates layered, biofactors (including cells and other bioactive stimuli)-laden hydrogel scaffolds with a defined three-dimensional (3D) structure and organized biofactors placement, which is seen as a great promise. To this end, hydrogels represent to be the most promising materials for bioprinting because of their high water content, excellent cytocompatibility and tunable biodegradability. On the other hand, rapid prototyping (RP) techniques have become a powerful tool to produce a scaffold of the desired shape and internal structure with encapsulation of multiple living cell types or other biofactors, such as growth factors and genes. However, not all kinds of RP techniques are suitable for generation of hydrogel scaffolds or cell encapsulation. Therefore, in this review, we give a brief summary of different rapid prototyping techniques suitable for the production of hydrogel scaffolds. Each technique is further discussed in terms of the different hydrogels used. One major limitation has yet to be addressed is the poor mechanical strength of hydrogel scaffolds. This problem and probable solution are also discussed in this review paper.
Key words:hydrogels; rapid prototyping; bioprinting; tissue engineering; scaffold
中图分类号:R318
文献标识码:A
文章编号:1674-3962(2015)03-0236-10
DOI:10.7502/j.issn.1674-3962.2015.03.06 10.7502/j.issn.1674-3962.2015.03.07
通讯作者:曹晓东,男,1965年生,博士,教授,Email:caoxd@scut.edu.cn 吴新年,男,1968年生,理学博士、研究员,Email:wuxn@lzb.ac.cn
收稿日期:2014-07-25 2014-04-10

