基于融合蛋白的生物材料及其在组织工程中的应用
张 妍,许 可,高 超,杨 军
(南开大学生命科学学院 生物活性材料教育部重点实验室,天津 300071)
特约专栏
第一作者:张妍,女,1988年生,博士研究生
基于融合蛋白的生物材料及其在组织工程中的应用
张妍,许可,高超,杨军
(南开大学生命科学学院 生物活性材料教育部重点实验室,天津 300071)
摘要:模似生物体组织的结构与状态、研制细胞与支架材料三维复合体,将有望开发出用于修复受损组织和器官的生物替代品。细胞的正常生物活动需要来自细胞外微环境中的信号分子持续刺激。作为人工细胞外基质的重要组成部分,材料的物理及化学信号能够影响细胞基因及蛋白表达,但远不足以达到体外重建组织器官的长远目标。利用基因与蛋白质工程技术对天然蛋白结构进行融合改造,设计并生物合成具有多重结构与功能的融合蛋白生物材料,可用于改善天然或化学合成生物材料的生物活性。综述了国内外基于融合蛋白的生物材料发展动态,概括了融合蛋白的设计思路与制备技术,重点详述了与细胞生长因子以及细胞粘附因子相关的融合蛋白在组织工程领域的应用。
关键词:融合蛋白;组织工程;细胞外基质;细胞外微环境;血管化;干细胞
1前言
组织工程的核心是建立由细胞和生物材料构成的功能化三维复合体[1]。生物材料作为人工细胞外基质,形成了组织工程种子细胞的细胞外微环境模板。材料本体及其表面理化性质诱导产生的生物学效应不仅决定了生物材料的安全性,也对细胞的形态、增殖与分化以及组织结构、功能的修复与重建具有重要的调控作用[2]。随着组织工程和再生医学的快速发展,设计开发具有良好生物相容性、结构与功能仿生天然细胞外基质的生物材料,正在成为材料科学和生命科学共同关注的研究热点。
纵观生物材料的发展,经历了第一代惰性材料,第二代具有活性或降解性质的材料,现已发展到兼具可降解和生物活性的第三代生物材料,并开始从生命科学的角度研究和设计生物材料的分子结构与功能[3]。其中,蛋白质是以氨基酸为基本单位构成的具有一定空间结构的天然高分子,是生命活动的主要承担者。机体内细胞外微环境中各种细胞外基质蛋白、酶以及多种细胞因子等蛋白组分,通过协同调控多个细胞信号通路,参与组织器官的发生、发育以及功能表达、修复等一系列生命活动,是人体组织更新和修补的主要物质基础。通过组织和细胞水平上的生物操作,模拟自然组织的结构与状态,将细胞与天然或人工合成的支架材料结合起来,将有望研发出用于修复或改善缺损组织和器官的生物替代品(图1)[4]。目前,已有多种蛋白(如胶原、纤维蛋白、细胞生长因子等)广泛用于组织工程支架的研究,表现出改善组织工程支架与种子细胞的相互作用,促进并诱导组织再生及其结构与功能的重建的优良性质。然而天然蛋白多由动物组织分离提纯获得,且病毒感染、抗原反应、结构与功能的稳定性和机械强度不足等问题,仍始终制约着天然蛋白在组织工程中的进一步开发与应用[5]。

图1 仿生构建细胞外基质调控细胞行为示意图[4]Fig.1 Schematic diagram of biomimetic extracellular matrix regulating cell behavior[4]
近年,基于基因和蛋白质工程原理与技术,人们根据特定组织的需要(如目标蛋白的分子量大小、序列、功能组成等)将编码目标蛋白的DNA分子进行“剪切”、“拼接”设计重组基因序列,不仅实现了生物合成具有可控结构与多重功能的融合蛋白,并且其用于制备具有特定生物学功能的仿生人工细胞外基质的研究,也取得了很大进展,为人们体外构建功能性组织或器官提供了新的发展机遇[6]。如今已经得到学者普遍关注的的融合蛋白主要有结构蛋白构成的融合蛋白(如具有弹性蛋白、丝蛋白特性的重组蛋白)、细胞生长因子的融合蛋白、以及细胞粘附因子(如整合素、Ca粘素等)的融合蛋白[7]。本文将重点介绍基于细胞生长因子以及细胞粘附因子融合蛋白的生物材料及其在组织工程中的应用。
2基于融合蛋白的生物材料结构设计与制备
用于组织工程的材料不仅为组织再生提供结构支持,还要综合考虑体内温度、pH及细胞粘附、增殖、迁移等因素,并应满足细胞增殖与材料降解的动态平衡[8]。基于蛋白的生物材料能够以生物化学信号引导细胞行为,因而其生物活性片段的种类、结构、结合及释放的调控在材料开发过程中均至关重要。蛋白材料用于生物材料的生物功能化改性方法主要有物理吸附、共价固定、材料包封等,但这些方法均有明显的缺陷。在自组装和生物技术领域,重组DNA的方法为新一代蛋白质生物材料的发展奠定了基础(图2)[9]。目前常用的融合蛋白生物材料主要有以下3种设计思路:①改变粘附蛋白及多肽片段的种类;②调整蛋白及多肽片段的密度和空间分布;③优化蛋白及多肽片段的时间可控性。
2.1融合蛋白的结构设计
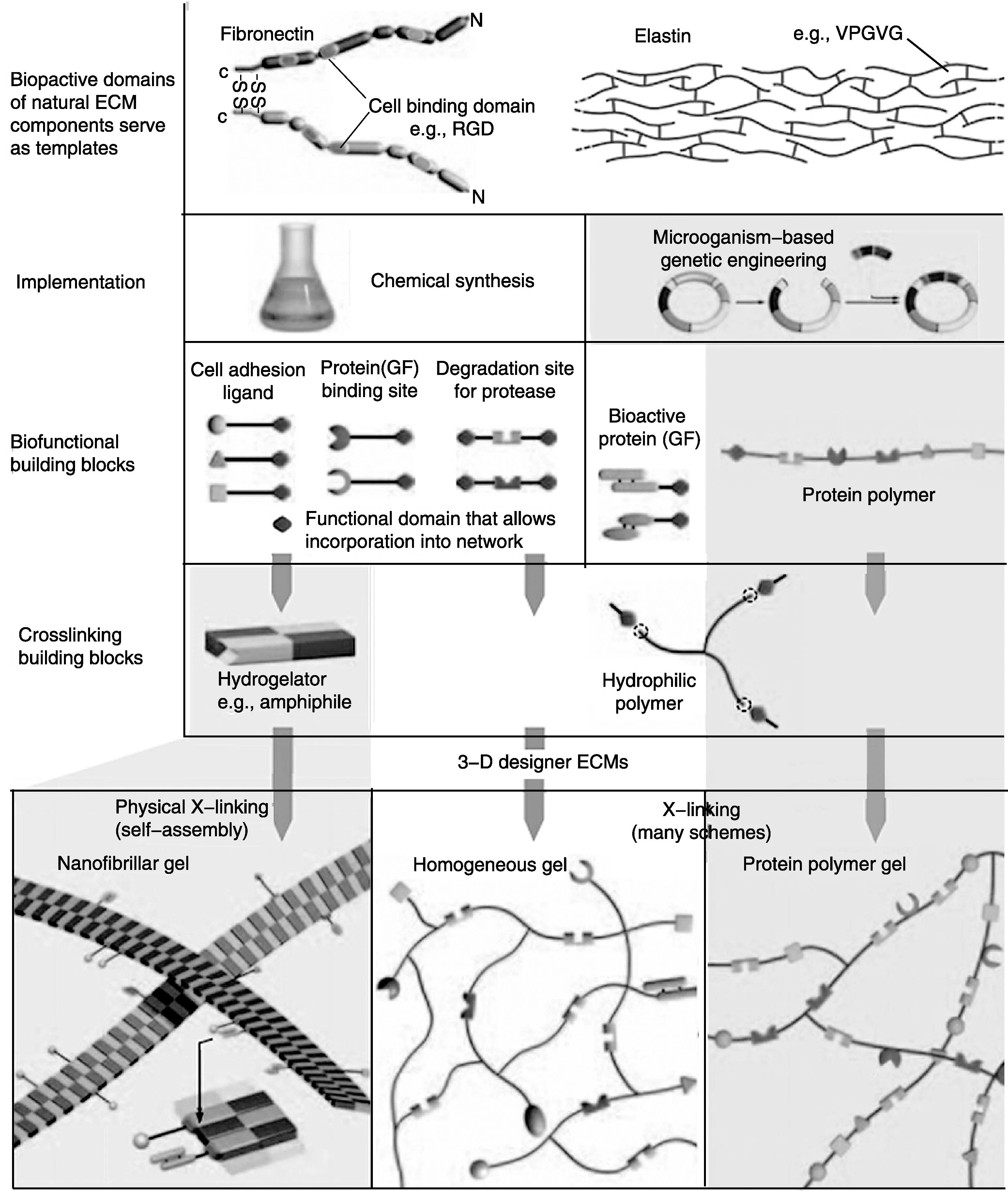
图2 模拟天然ECM构建复杂生物材料的设计策略[9]Fig.2 Design strategies for the creation of synthetic biomolecular materials that mimic the complexity of natural ECMs[9]
构建融合蛋白的基本方法是将具有特定功能的天然或人工编码的多肽序列模块化,并使用基因编码的DNA序列模板合成[10],随后将第1个蛋白的终止密码子删除,再接上带有终止密码子的第2个蛋白基因,以实现两个基因的共同表达。通过控制每一个功能肽模块在整体蛋白材料中的确切位置和密度,人们便能够根据实际需要改变融合蛋白的组成。融合蛋白的设计大致分为基于重复结构、基于生长因子以及基于细胞粘附分子3类(表1[11])。第1类融合蛋白中最典型的是来源于弹性蛋白(Elastin-Like Polymers,ELPs)及丝素蛋白(Silk-Like Polymers,SLPs)的融合蛋白。ELPs是一种由数个重复的氨基酸序列组成的细胞外基质蛋白,由两种短肽段交替排列构成,主要包括VPGZG、VPGVG、APGVGV、VPGFGCGAG以及VPGG等5种[12]。最著名的当属VPGZG
融合蛋白(Z可换为除了脯氨酸外任意氨基酸)。重复的VPGVG序列能够使融合蛋白具有温敏特性[13],将温敏性ELP与化学、酶、物理等多种交联方式的水凝胶结合起来能够衍生出多种应用方式。ELPs主要由甘氨酸、丙氨酸和丝氨酸组成,极易形成反向平行的β-折叠片层结构,具有多样侧链化学修饰位点,良好的热稳定性和机械性能,在生物医学上常用作手术缝合线,人工皮肤及软骨修复材料[14]。对于此类融合蛋白,只需通过调节其氨基酸序列和分子链长度,便能够精确控制其对温度、pH、离子强度的响应敏感性,从而实现可逆的溶解转变[15]。

表1 蛋白质工程生物材料中常用的肽段序列[11]
目前对于生长因子及细胞粘附因子功能域多肽的筛选研究尚未取得突破,因此基于全长蛋白分子的融合蛋白,通过具有特异材料亲和性的蛋白片段赋予其新功能的设计理念仍属主流。例如,将蛋白分子连接在胶原蛋白结合域[16]和免疫球蛋白Fc段[17]上制备的融合蛋白,不仅能提高蛋白与多种支架材料亲和性,还能够大大延长这些因子的半衰期,并使其长期发挥效用。胶原蛋白是细胞外基质的主要成分,作为细胞生长的依附与支架,能诱导上皮细胞等的增殖和分化。在胶原酶的胶原结合区中有一段肽序列为 TKKTLRT,具有特异的胶原结合能力,被命名为胶原结合区 (Collagen Binding Domain, CBD)。采用基因工程的方法,在生长因子上融合CBD能够赋予生长因子更强的特异结合胶原蛋白的能力。从而制备适用于不同组织损伤修复的功能性胶原生物材料[18]。基于以上原理,戴建武教授课题组[19]进一步开发出能够特异性结合细胞外间质中一种非胶原性结构蛋白——层连蛋白的多肽片段(Laminin Binding Domain, LBD)用以融合蛋白设计,并将其应用于大鼠坐骨神经损伤模型,表明该片段能够维持神经生长因子(NGF)的活性,并定位于天然神经细胞外基质成分的层粘连蛋白且持续集中在神经损伤部位,以提高周围神经再生(图3)。免疫球蛋白(IgG),由4条肽链组成的对称结构组成。4条肽链有两条重链和两条轻链,链间具有二硫键,根据各结构的氨基酸组成和功能的不同,分为可变区和恒定区,位于肽链N端的是可变区结合抗原,恒定区在肽链C端,称为Fc段。Fc段可与其他多种蛋白结合,构建基于Fc的融合蛋白,可作为纯化标签使用,半衰期持久,可介导ADCC及CDC作用 ,在药物和疫苗研发、蛋白纯化等诸多领域有着十分广泛的应用[20]。
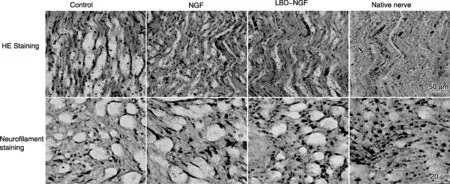
图3 坐骨神经损伤大鼠植入材料7 d后神经恢复情况[19]Fig.3 Recovery of sciatic injury rat after biomaterials implanted for 7 d[19]
2.2融合蛋白的制备
基于重复结构的融合蛋白大多为短肽,不具有复杂的空间结构,因此只需简单的多肽合成过程即可获得目标蛋白。由单个氨基酸合成多肽主要通过两个氨基酸之间脱水形成肽键来实现,主要包括以下基本步骤:首先对两性离子结构的氨基酸进行相应的氨基或梭基保护,其次将羧基活化为活性中间体,待耦合过程结束后,对肽链上氨基酸的保护基团选择相应的方式进行选择性的脱除或者是全脱除。目前常用的多肽合成方法为液相合成和固相合成两种。液相合成法是将所需的氨基酸配制成溶液,并对其中一个氨基酸的氨基、其余氨基酸的羧基和不参与反应的侧链基团进行化学基团保护,只活化参加反应的氨基酸的羧基,待耦合反应完成后再将没有参加反应的原料、活化剂等分离除去,得到纯化多肽产物。这种方法虽然操作繁琐,却具有目标产物纯度高的优势。而固相合成法,则是将多肽序列C端的第1个氨基酸的羧基通过酯化反应固定于不溶性的树脂上,进而以此氨基酸作为氨基组分,脱除其氨基保护基团并同过量的活化后的羧基组分耦合形成肽键,重复脱保护、缩合、洗涤过程持续合成,获得所需的肽链。合成完成后,再试用三氟乙酸将产物从树脂上切割下来,同时脱除所有保护基团,纯化回收获得所需多肽[21]。
相对来说,具有一定空间结构且序列复杂的其他两种融合蛋白的合成过程则复杂得多。精确构建所需DNA模版是保证融合蛋白多样性及稳定性的基础。在获得目标DNA序列后,将其连接进入特定的载体之中,以获得充足融合蛋白质粒,见图4[22]。由于遗传基因的简并性,同一种融合蛋白可对应着多种DNA序列,但序列合成蛋白效率却与扩增时选取的宿主种类有关(大肠杆菌、酵母菌及真核细胞等)。例如,“AAG及AGA”片段如果出现在需要使用大肠杆菌表达体系的质粒中便会大大影响蛋白产率[23]。当然,重组质粒中密码子的优化还有许多影响因素——密码子偏倚、tRNA可用性、mRNA稳定性和mRNA结构都在基因表达中起重要作用,而且选择DNA片段时也应尽量避免在重组基因载体中存在高度重复的部分以避免发生错配,影响mRNA转录[24]。

图4 重组融合蛋白制备与应用流程[22]Fig.4 Flow chart of the preparation and application of recombinant fusion protein[22]
最优化后的DNA序列需要引入到合适的生物体中表达。大肠杆菌是目前最常用的表达系统,相对便宜、扩增迅速,并且可以通过基因修饰提高蛋白表达水平。但由于大肠杆菌为原核生物,没有高尔基体和内质网结构,无法对重组蛋白进行转录后修饰(糖基化),且重组蛋白过表达会产生包涵体,需进一步处理以恢复蛋白活性。酵母菌也是广泛应用于重组蛋白表达的宿主,同样具有易于扩增、费用低廉的优势,属真核表达体系,能够对重组蛋白进行修饰。但酵母菌的蛋白糖基化仍与哺乳动物有较大差异,使用昆虫细胞及哺乳动物细胞表达的重组融合蛋白往往与天然蛋白的结构和功能更为接近[25]。一般来说,重组融合蛋白的表达效果越好,所需的转染及细胞扩增过程便越复杂,所需时间和成本也就越高。
3基于融合蛋白的生物材料在组织工程中的应用
3.1基于细胞生长因子的融合蛋白生物材料在组织工程中的应用
正常细胞的生物活动受到细胞外微环境中信号分子的持续刺激与调控,同时细胞也会通过分泌多种因子,使其微环境更利于其增殖、分化及功能表达[26]。生长因子作为细胞之间的信号传导分子调控多种细胞行为,其由多种细胞分泌,并与靶细胞表面的特异性受体结合而发挥作用,能够促进细胞增殖、分化和功能表达,在伤口愈合和组织再生过程中具有重要作用[27]。然而,大多数生长因子在体内均具有容易自由扩散且难以长期保持稳定的特点,在机体内存在潜在的风险,并影响组织修复[28]。如图5所示,将生长因子固定于生物材料的本体或表面,能够显著改善其稳定性并控制其定量持续对细胞形成刺激[29]。

图5 材料表面固定化生长因子与细胞相互作用示意图[29] Fig.5 Schematic diagram of cell interactions with surface immobilized growth factors[29]
3.1.1EGF融合蛋白
EGF(表皮细胞生长因子)是由53个氨基酸组成的单链多肽,能够启动DNA复制,促进细胞增殖及蛋白合成,促进伤口愈合及上皮组织角质化[30]。由于表皮生长因子受体(EGFR)在肿瘤生长、侵袭和转移过程中起着重要作用,并在相当一部分人类肿瘤中均有表达,其配体EGF更多地应用在抗癌药物靶标,应用于肿瘤靶向治疗。Yang Xiaoping[31]等将EGF与改性白喉毒素(Diphtheria Toxin,DT)通过组-丙氨酸相连,所得融合蛋白能够对早期膀胱癌细胞进行靶向定位和治疗,经由动物实验证明有效且无全身毒性反应。Lan Keng-Li[32]等构建了具有放射性标记的VEGF-EGF融合蛋白并作为双靶向剂用于癌症诊断和治疗,也取得了相似结论。
3.1.2FGF融合蛋白
bFGF(碱性成纤维细胞生长因子)是由150~200个氨基酸组成的多肽,相互之间的氨基酸序列有20%~50%是相同的,其中心区域有大约120个氨基酸序列存在高度的同源性。它是一种重要的信号分子,参与调控许多胚胎发育和器官形成过程,如原肠胚时期细胞迁移,中胚层形成,以及脑、肺、肾、肢体等器官发育[33]。同时,它也具有促进纤维原细胞和内皮细胞增殖的作用,调控组织创伤修复。Hashi H实验室[34]构建了由纤连蛋白和碱性成纤维细胞生长因子的细胞结合结构域的融合蛋白,并将其固定于培养皿表面以及胶原水凝胶中,用于HUVEC细胞培养,实验结果表明,该融合蛋白能够刺激HUVEC的生长并刺激鸡胚中绒毛尿囊膜的血管生成。有学者将胶原蛋白结合域(Collagen Binding Domain,CBD)与bFGF结合起来制备CB-bFGF融合蛋白,能够在体外培养中促进骨髓间充质干细胞增殖,且在与可注射的胶原蛋白粉末混合后用以治疗鼠骨折,较单纯使用bFGF用量更低,效果更佳[35-36]。
3.1.3HGF融合蛋白
HGF(肝细胞生长因子)是一种旁分泌细胞因子,是具有调节细胞存活、形态、粘附、迁移等功能的多效生长因子,参与胚胎器官发育、成人组织再生及伤口愈合过程。此外,HGF与其受体c-Met与癌细胞增殖、转移也高度相关[37]。日本Takashi Kitajima实验室[38]将HGF与胶原结合域结合起来构建CBD-HGF融合蛋白。实验表明,相较于液态添加HGF,固定化CBD-HGF可稳定融合生长因子结构、延长因子活性、更长时间地促进内皮细胞(ECs)生长。此外,该课题组还将该融合蛋白应用于大鼠颈动脉球囊损伤的治疗,发现结合有CBD-HGF的胶原支架能够更好地促进体内损伤部位内皮化及内膜形成[39]。同样地,赤池敏宏课题组[40]将HGF与IgG的Fc段融合构建而成的HGF-Fc融合蛋白不仅能够促进Hepg2细胞在材料表面的粘附及伸展(图6),还可调控细胞PI3-k及AKT、ERK磷酸化信号通路活化。
3.1.4VEGF融合蛋白
VEGF(血管内皮细胞生长因子)是一种具有肝素结合活性的同源二聚体糖蛋白,能够特异性作用于血管内皮细胞。VEGF165是其最常见的亚型,具有诱导内皮细胞增殖、迁移、功能表达等作用,并参与体内创伤愈合、慢性炎症、肿瘤的血管增生过程。它主要从两个方面参与血管新生:①作为血管内皮细胞分裂素,促进NO释放,提高血管渗透性和扩张性;②产生细胞趋化作用,募集游离细胞形成细胞群[41]。于美华等[42-43]利用基因重组技术构建了具有VEGF165与免疫球蛋白IgG的Fc功能域基因序列的质粒载体,经真核细胞体系表达、纯化得到了VEGF-Fc融合蛋白。研究结果表明,VEGF-Fc经Fc的疏水结合可在聚苯乙烯平板表面稳定形成VEGF蛋白层,不仅显著改善聚苯乙烯平板的表面亲水性,而且有效提高了平板表面HUVEC细胞粘附,并促进HUVEC增殖以及vWF和VE-cadherin的表达;细胞骨架染色结果显示:细胞丝状伪足丰富,肌动蛋白纤维转化为较大的应力纤维,有利于微血管网络的形成(图7)。此后,祝传顺等[44]进一步将VEGF-Fc用于PCL多孔支架表面改性,发现其能够显著改善PCL支架表面亲水性,提高支架吸水速度及吸水量,同时诱导细胞快速增殖、均匀地浸入支架内部,并保持良好细胞活性。

图6 HGF-Fc固定化平板及普通板培养的表面HepG2细胞骨架染色的显微照片,图(b),(c)是图(a)中方框区的放大[40] Fig.6 Micrographs of cells skeleton staining of HepG2 cells cultured on HGF-Fc immobilized plate and normal plate,figure (b),(c)are magnification of square zone in figure (a)[40]

图7 VEGF-Fc基质化平板培养HUVEC细胞的vWF表达:培育1 h(a), 48 h(b)[42-43]Fig.7 The vWF expression of HUVECs cultured on VEGF-Fc coated plate:cultured for 1 h (a) and 48 h (b) [42-43]
3.2基于细胞粘附因子的生物材料在组织工程中的应用
细胞-细胞、细胞-细胞外基质间相互作用也是细胞外微环境的重要组成部分,主要包括Ca粘素蛋白家族、整合素家族等,其可介导细胞-细胞间特异性链接以及细胞-基质间非特异性连接[45]。目前,细胞粘附分子可以分为5类,分别为整合素家族、Ca粘素家族、免疫球蛋白超家族、选择素家族及其他家族(如透明质酸粘素、血管附着素族粘附分子、H-细胞粘附分子超家族等)[46]。整合素是细胞表面受体的一大家族,包含由14种α及8种β两大类亚单元构成的20多种杂二聚体跨膜蛋白,参与细胞选择性粘附及信号传递,进而调控细胞的生长、增殖和凋亡。目前较为成熟的一类重组蛋白材料RGD短肽的主要受体便是整合素家族。RGD序列由精氨酸、甘氨酸和天冬氨酸组成,是细胞外基质中与细胞粘附相关的多种糖蛋白共同含有的高度保守序列,也是整合素受体可以识别的最小多肽序列。RGD序列于20世纪80年代发现并实现了人工合成,至今已在多种生物材料改性中应用,其可在短期内促进细胞的粘附、迁移和生长。但在长期体外培养及体内实验中,RGD肽的变性、脱落以及肽链的构象改变仍有待进一步研究解决[47]。
细胞Ca粘素蛋白是粘着连接的重要组成成分,最早被认为是一种Ca2+依赖性的粘附蛋白分子,以多种形式分布于不同组织中[48]。Ca粘素蛋白为I型跨膜蛋白,其胞外域由5个结构域组成,胞外近N端为Ca2+结合部位,其胞内域与α,β,p120连环蛋白等分子结合,并与骨架蛋白相结合[49],其不仅通过蛋白胞外域的同源结合介导细胞间连接,并参与调控细胞的分化和迁移,在细胞组织化过程中起着重要作用(图8)[50]。以下将重点介绍Ca粘素融合蛋白在组织工程中的研究及应用现状。

图8 Ca粘素胞内信号通路示意图[50]Fig.8 Schematic diagram of cadherin intracellular signaling pathways[50]
3.2.1Ca粘素融合蛋白对功能细胞的影响
AKaike T课题组[51]率先构建了鼠源E-cadherin胞外域和IgG蛋白Fc结构域的重组蛋白mE-cadherin-Fc。实验结果表明,与胶原对照,鼠肝原代细胞能够在细胞膜蛋白E-cadherin介导下更好地粘附于mE-cadherin-Fc涂膜的平板表面,且细胞DNA合成活性降低、色氨酸合酶的表达保持不变。Fauke等[52]同样通过构建重组质粒转化表达得到了E-cadherin-Fc重组蛋白,并将此重组蛋白制备成基质材料,考察MDCK细胞粘附和形态的影响。Johana等[53]将N-cadherin-Fc融合蛋白通过固定剂PHMAA-g-PEGNHS固定于聚苯烯酰胺水凝胶及丙烯酰胺取代的玻璃表面,发现N-cadherin能够调控皮层及胶质细胞粘附,同时对神经突的生长有明显促进作用.此外,Koki等[54]还将N-cadherin利用杆状病毒-脂质体膜融合方法与脂质体相结合应用于药物传递系统,发现N-cadherin脂质体能均匀粘附于LN-229胶质瘤细胞膜表面,展示了N-cadherin脂质体作为纳米载体生物材料用于肿瘤治疗的潜能。由于细胞微环境的复杂性,还有不少研究者考察了多种细胞粘附因子融合蛋白材料对细胞功能的影响。如Behiati等[55]将L-selectin-Fc和VE-cadherin-Fc共同固定于Ti材料表面,大大提高了EPC和HUVEC细胞的粘附、细胞活性、细胞增殖潜能。Jorge等[56]首先制备了具有控制神经细胞粘附和生长功能的聚(3.4-乙烯二氧噻吩):聚(4-硫磺酸)-co-顺丁烯二酸(PEDOT:PSS-co-MA),固定在金基质和碳微纤维表面,随后将N-cadherin和L1重组蛋白修饰在PEDOT:PSS-co-MA上,结果表明,该材料能显著促进神经生长和迁移。由此可见,基于Ca粘素家族构建的融合蛋白能够稳定吸附于多种基质材料表面,应用形式丰富,均表现出与体内相似的功能特性,对不同细胞的粘附、增殖及功能表达起到良好的促进作用。
3.2.2Ca粘素融合蛋白对干细胞分化的影响
干细胞是具有高度自我更新及多向分化潜能的细胞,具有构建复杂组织器官的可能。将分离的干细胞在某种刺激下形成新的组织用于替代损失的器官或组织,即干细胞治疗法已进入临床实验阶段,但在干细胞治疗过程的不确定性和不可控性仍然是这一技术的主要瓶颈[57]。因此,开发能够“控制”干细胞命运的生物活性材料具有极高的临床价值和应用前景。
Bian等[58]将N-cadherin加入到丙烯酰胺-透明质酸水凝胶中培养间充质干细胞(MSC),发现N-cadherin在体外培养及体内实验中均表现出促进MSC向软骨分化及产生特异软骨基质的作用。Zhang等[59]利用纤连蛋白III7-10片段与cadhrin11胞外域1和2片段构建融合蛋白rFN/CDH,并将其固定在磷酸氢钙陶瓷表面,发现该融合蛋白能够促进MSC在活性材料表面的粘附、增殖及成骨分化。而后,他们又利用层层(lbl)自组装的方法构建了BCP/lbl/Chi-rFN/CDH缓释材料,探究骨髓间充质干细胞在材料表面的粘附和增殖能力,发现MSC的成骨分化能力明显提高[60]。AKaike课题组[61]使用mE-cadherin-Fc基质培养鼠源胚胎干细胞,诱导其向肝实质细胞定向分化,所得分化后细胞形态与功能上均与肝原代细胞十分接近。此外,他们还将E-cadherin-Fc和N-cadherin-Fc共同涂膜,获得了表达βⅢ-tubulin,pax6和Tyrosine Hydroxylase等神经元阳性标志蛋白,而不表达神经胶质指标蛋白,获得了具有高同源性的原始外胚层和神经祖细胞[62]。由此可见,基于Ca粘素家族融合蛋白的基质材料能够模拟细胞与细胞间相互作用,刺激细胞产生分子水平的响应性变化,最终达到调控干细胞增殖与分化的目的。
与胚胎干细胞相比,间充质干细胞具有来源广泛、免疫原性低、无伦理问题等独特优点,现已成为再生医学领域最受关注的细胞[63]。然而随着体外培养的MSC细胞不断传代扩增,其增殖及分化潜能也会逐渐降低[64]。因此要真正将MSC细胞在临床治疗中应用并推广,则必须开发能够获得大量维持干性的MSC的体外培养体系。已有研究发现在纤维粘连蛋白涂膜的培养皿中培养MSC能够更好地维持细胞多向分化潜能[65]。因此,模拟体内干细胞生长微环境,构建人工细胞外基质,将会成为解决这一问题的最有效手段之一。通过生物材料的分子设计,仿生调控组织工程支架的生物、化学及力学信号,构建三维细胞外微环境,可实现组织工程支架对细胞粘附、增殖、迁移、分化及相关功能表达的诱导与调控[66]。
作者课题组通过基因工程手段,将人源E-cadherin与免疫球蛋白IgG1的Fc结构域融合构建了hE-cadherin-Fc融合蛋白,并探讨了其对人骨髓间充质干细胞增殖及定向分化的影响。实验结果表明[67],材料表面hE-cadherin-Fc基质化后,通过与细胞表面E-cadherin形成同亲性结合,显著提高了hMSCs的粘附。与一般的细胞培养基质TC-PS平板及Gelatin涂膜平板相比(图9,10),在hE-cadherin-Fc改性平板表面培养hMSC细胞形态为长梭状,更接近成纤维状态,并在保持较高增殖速率的同时维持了良好的细胞未分化性。此外,在hE-cadherin-Fc平板表面进行hMSCs向肝细胞的定向诱导分化,所得肝样细胞更多,CD117高表达,且肝样细胞白蛋白分泌、尿素合成能力均高于对照组(图11)。在后期实验中,本课题组还尝试将hE-cadherin-Fc融合蛋白用于PCL三维纳米纤维支架的表面

图9 聚苯乙烯培养板(PS)、组织培养处理培养板(TC-PS)、明胶涂膜(Gelatin)及hE-cadherin-Fc涂膜对间充质干细胞(MSC)增殖活性的影响(CCK-8法)(a); TC-PS(曲线1)、Gelatin(曲线2)及hE-cadherin-Fc(曲线3)涂膜对MSC细胞CD105表达的影响(流式细胞分析)(b)[67]Fig.9 The proliferative activity of hMSCs on the PS-, TC-PS-, Gelatin- and hE-cadherin-Fc-coated surfaces(a); Flow cytometry analysis of undifferentiated state for hMSCs using the definitive undifferentiated state marker CD105. TC-PS(curve 1), gelatin-coated surface (curve 2)and hE-cadherin-Fc-coated surface(curve 3) (b) [67]

图10 TC-PS(a)、Gelatin(b)及hE-cadherin-Fc(c)涂膜对MSC细胞形态的影响(细胞骨架蛋白荧光染色)[67]Fig.10 Morphological analysis of hMSCs cultured at 4, 24 and 48 h on TC-PS (a), gelatin-coated surface (b) and hE-cadherin-Fc-coated (c) surface .FITC-phalloidin labeled F-actin (gray) and PI nuclear staining (incanus) were used for immunofluorescence staining[67]
改性,发现该融合蛋白在纳米纤维支架表面形成了稳定的Ca粘素单分子层,促进hMSCs粘附、增殖及成骨分化(图12)[68]。上述结果表明:hE-cadherin-Fc融合蛋白改性组织工程支架可显著改善hMSCs的体外增殖能力,并与相关细胞分化诱导因子和支架的物理结构特性协同调控hMSCs的定向分化,进一步显示了基于Ca粘素融合蛋白的组织工程支架在再生医学领域的应用前景。

图11 hE-cadherin-Fc融合蛋白基质化平板上MSC细胞向肝细胞定向诱导分化图:(a)CD117染色,(b)白蛋白分泌和(c)尿素分泌Fig.11 Hepatocyte-like cells differentiated from MSCs on hE-cadherin-Fc-coated plate: (a) CD117 staining,(b) albumin secretion,and (c) urea secretion

图12 hE-cadherin-Fc修饰的取向/非取向电纺丝(左)及培养MSC细胞成骨分化潜能(右)的形貌:(a) rPCL, (b) E-rPCL,(c) aPCL,(d) E-aPCL[68]Fig.12 Morphology of hE-cadherin-Fc-coated nanofibrous scaffolds (left)and differentiation potential of hMSCs cultured on them(right):(a) rPCL,(b) E-rPCL,(c) aPCL, and (d) E-aPCL[68]
4结语
进入21世纪,生命科学发展日新月异,随着国家综合国力的增强,经济的稳步提升,人们对个人生活质量越来越重视,特别是对健康问题尤为关注。我国生物材料在国家重点扶持之下,历经了近40年的发展,取得了累累硕果,其中生物材料科学在整个生命科学中起到了举重若轻的作用,为人们研究生命科学提供了一个全新的平台与手段。
作为材料科学与生命科学的交叉学科,生物材料研究内容已逐渐涉及到医学、生物学、工程学等诸多领域,并且从单一考察材料的化学、物理和力学加工性能逐步深入到植入材料对受体细胞和分子层面上的影响。通过基因重组技术,精确筛选具有特定分子量、氨基酸组成及序列、空间结构和功能的蛋白,连接融合形成具有多结构域的人工蛋白,并与高分子支架材料结合,仿生构建具有生物功能的新型复合人工细胞外基质的方法,逐渐展现出引人注目的应用前景。
参考文献References
[1]Hench L L, Polak J M. Third-Generation Biomedical Materials [J].Science, 2002, 295(5 557): 1 014-1 017.
[2]Humes H D. Tissue Engineering of a Bioartificial Kidney: a Universal Donor Organ [J].TransplantProc, 1996, 28(4):2 032-2 035.
[3]Langer R, Vacanti J P. Tissue Engineering [J].Science, 1993, 260(5 110): 920-926.
[4]Mager M D, LaPointe V, Stevens M M. Exploring and Exploiting Chemistry at the Cell Surface [J].NatChem, 2011, 3(8):582-589.
[5]Goldberg M, Langer R, Jia X. Nanostructured Materials for Applications in Drug Delivery and Tissue Engineering [J].JBiomaterSciPolymEd, 2007, 18(3): 241-268.
[6]Meyer D E, Chilkoti A. Genetically Encoded Synthesis of Protein-Based Polymers with Precisely Specified Molecular Weight and Sequence by Recursive Directional Ligation: Examples from the Elastin-Like Polypeptide System [J].Biomacromolecules, 2002, 3(2):357-367.
[7]Gomes S, Leonor I B, Mano J F,etal. Natural and Genetically Engineered Proteins for Tissue Engineering [J].ProgPolymSci, 2012, 37(1):1-17.
[8]Anderson D G, Burdick J A, Langer R. Smart Biomaterials [J].Science. 2004, 305(5 692): 1 923-1 924.
[9]Lutolf M P, Hubbell J A. Synthetic Biomaterials as Instructive Extracellular Microenvironments for Morphogenesis in Tissue Engineering [J].NatBiotechnol, 2005, 23(1):47-55.
[10]Straley K,Heilshorn S. Designer Protein-Based Scaffolds for Neural Tissue Engineering [J].ConfProcIEEEEngMedBiolSoc, 2009:2 101-2 102.
[11]Sengupta D, Heilshorn S C. Protein-Engineered Biomaterials: Highly Tunable Tissue Engineering Scaffolds [J].TissueEngPartBRev, 2010, 16(3):285-293.
[12]Sandberg L B, Leslie J G, Leach C T,etal. Elastin Covalent Structure as Determined by Solid Phase Amino Acid Sequencing [J].PatholBiol(Paris), 1985, 33(4):266-274.
[13]Urry D W. Molecular Machines: How Motion and Other Functions of Living Organisms Can Result from Reversible Chemical Changes [J].AngewChemIntEdEng, 1993, 32(6):819-841.
[14]Gosline J M, DeMont M E, Denny M W. The Structure and Properties of Spider Silk [J].Endeavour, 1986, 10(1):37-43.
[15]Nagarsekar A, Crissman J, Crissman M,etal. Genetic Engineering of Stimuli-Sensitive Silkelastin-Like Protein Block Copolymers [J].Biomacromolecules, 2003, 4(3):602-607.
[16]Hayashi M, Tomita M, Yoshizato K. Production of EGF-Collagen Chimeric Protein which Shows the Mitogenic Activity [J].BiochimBiophysActa, 2001, 1 528(2-3):187-195.
[17]Ogiwara K, Nagaoka M, Cho C S,etal. Construction of a Novel Extracellular Matrix Using a New Genetically Engineered Epidermal Growth Factor Fused to IgG-Fc [J].BiotechnolLett, 2005, 27(20):1 633-1 637.
[18]Zhang J, Ding L, Zhao Y,etal.Collagen-Targeting Vascular Endothelial Growth Factor Improves Cardiac Performance after Myocardial Infarction [J].Circulation, 2009, 119(13):1 776-1 784.
[19]Sun W J, Sun C K, Zhao H,etal. Improvement of Sciatic Nerve Regeneration Using Laminin-Binding Human NGF-Beta [J].PLoSOne, 2009, 4(7):e6 180.
[20]Czajkowsky D M, Hu J, Shao Z,etal. Fc-Fusion Proteins: New Developments and Future Perspectives [J].EMBOMolMed. 2012, 4(10):1 015-1 028.
[21]Cherkupally P, Ramesh S, Torre B G. Immobilized Coupling Reagents: Synthesis of Amides/Peptides [J].ACSCombSci, 2014, 16(11):579-601.
[22]Cai L, Heilshorn S C. Designing ECM-mimetic Materials Using Protein Engineering [J].ActaBiomater, 2014, 10(4):1 751-1 760.
[23]Gustafsson C, Govindarajan S, Minshull J. Codon Bias and Heterologous Protein Expression [J].TrendsBiotechnol, 2004, 22(7):346-353.
[24]Welch M, Govindarajan S, Ness J E,etal. Design Parameters to Control Synthetic Gene Expression in Escherichia Coli [J].PLoSOne., 2009, 4(9):e7 002.
[25]Wurm F M. Production of Recombinant Protein Therapeutics in Cultivated Mammalian Cells [J].NatBiotechnol, 2004, 22(11):1 393-1 398.
[26]Adams J C, Watt F M. Regulation of the Development and Differentiation by Extracellular Matrix [J].Development, 1993, 117(4):1 183-1 198.
[27]Werner S, Grose R. Regulation of Wound Healing by Growth Factors and Cytokines [J].PhysiolRev, 2003, 83(3):835-870.
[28]Whitaker M J, Quirk R A, Howdle S M,etal. Growth Factor Release from Tissue Engineering Scaffolds [J].Pharm.Pharmacol, 2001, 53 (11): 1 427-1 437.
[29]Tada S, Kitajima T, Ito Y. Design and Synthesis of Binding Growth Factors [J].IntJMolSci, 2012,13(5):6 053-6 072.
[30]Cohen S. The Epidermal Growth Factor (EGF) [J].Cancer, 1983, 51(10):1 787-1 791.
[31]Yang X, Kessler E, Su L J,etal. Diphtheria Toxin-Epidermal Growth Factor Fusion Protein DAB389EGF for the Treatment of Bladder Cancer [J].ClinCancerRes, 2013, 19(1):148-157.
[32]Lan K L, Li J J, Tsai W C,etal. Biological Evaluation of 111In-DTPA-VEGF-EGF Fusion Protein in a Human Breast Cancer Cells Expressing EGFR/VEGFR [J].JNuclMed, 2012, 53(1):1 719.
[33]Squires C H, Childs J, Eisenberg S P,etal. Production and Characterization of Human Basic Fibroblast Growth Factor from Escherichia Coli [J].JBiolChem, 1988, 263(31):16 297-16 302.
[34]Hashi H, Hatai M, Kimizuka F,etal. Angiogenic Activity of a Fusion Protein of the Cell-Binding Domain of Fibronectin and Basic Fibroblast Growth Factor [J].CellStructFunct, 1994, 19(1):37-47.
[35]Saito W, Uchida K, Ueno M,etal. Acceleration of Bone Formation During Fracture Healing by Injectable Collagen Powder and Human Basic Fibroblast Growth Factor Containing a Collagen-Binding Domain from Clostridium Histolyticum Collagenase [J].JBiomedMaterResA, 2014, 102(9):3 049-3 055.
[36]Uchida K, Matsushita O, Naruse K,etal. Acceleration of Periosteal Bone Formation by Human Basic Fibroblast Growth Factor Containing a Collagen-Binding Domain from Clostridium Histolyticum Collagenase [J].JBiomedMaterResA, 2014, 102(6):1 737-1 743.
[37]Lesko E, Majka M. The Biological Role of HGF-MET Axis in Tumor Growth and Development of Metastasis [J].FrontBiosci, 2008, 13:1 271-1 280.
[38]Kitajima T, Terai H, Ito Y. A Fusion Protein of Hepatocyte Growth Factor for Immobilization to Collagen [J].Biomaterials, 2007, 28(11):1 989-1 997.
[39]Ohkawara N, Ueda H, Shinozaki S. Hepatocyte Growth Factor Fusion Protein Having Collagen-Binding Activity (CBD-HGF) Accelerates Re-endothelialization and Iintimal Hyperplasia in Balloon-Injured Rat Carotid Artery [J].JAtherosclerThromb,2007, 14(4):185-191
[40]Azuma K, Nagaoka M, Cho C S,etal. An Artificial Extracellular Matrix Created by Hepatocyte Growth Factor Fused to IgG-Fc [J].Biomaterials, 2010, 31(5):802-809.
[41]Kelinheinz J, Jung S, Wermker K,etal. Release Kinetics of VEGF165 from a Collagen Matrix and Structural Matrix Changes in a Circulation Model [J].HeadFaceMed, 2010, 19, 6:17.
[42]Yu M H, Du F Y, Hirohiko I,etal. Preparation and Characterization of a Fusion Protein Matrix VEGF-Fc for Enhancing HUVECs growth [J].BiotechnolLett, 2012, 34(9):1 765-1 771.
[43]Yu Meihua(于美华) , Du Fengyi(杜凤移) , Rao Xia(饶霞),etal. 人工细胞外基质对血管内皮细胞生存的影响[J].ChemicalJournalofChineseUniversities(高等学校化学学报), 2013, 3: 746-750.
[44]Zhu C S, Xu J B, Yu M H,etal. The Immobilization of VEGF-Fc for Promoting Endothelial Cells Proliferation in Porous PCL Scaffolds. Advanced Materials Research [J].AdvancedMaterialsResearch, 2012, 554:1 721-1 724.
[45]Rosso F, Giordano A, Barbarisi M,etal. From Cell-ECM Interactions to Tissue Engineering [J].JCellPhysiol, 2004, 199(2); 174-180.
[46]Edelman G M, Crossin K L. Cell Adhesion Molecules: Implications for a Molecular Histology [J].AnnualReviewofBiochemistry, 1991, 60(1): 155-190.
[47]Punet X, Mauchauffé R, Giannotti M I,etal. Enhanced Cell-Material Interactions Through the Biofunctionalization of Polymeric Surfaces with Engineered Peptides [J].Biomacromolecules, 2013,14(8):2 690-2 702.
[48]Thiery J P, Engl W, Viasnoff V,etal. Biochemical and Biophysical Origins of Cadherin Selectivity and Adhesion Strength [J].CurrOpinCellBiol, 2012, 24(5):614-619.
[49]Nelson W J. Regulation of Cell-Cell Adhesion by the Cadherin-Catenin Complex [J].BiochemSocTrans, 2008, 36(Pt 2):149-155.
[51]Nagaoka M, Ise H, Akaike T. Immobilized E-Cadherin Model Can Enhance Cell Attachment and Differentiation of Primary Hepatocytes but not Proliferation [J].BiotechnologyLetters, 2002, 24(22):1 857-1 862.
[52]Drees F, Reilein A, Nelson W J. Cell-Adhesion Asays: Fabrication of an E-Cadherin Substratum and Isolation of Lateral and Basal Membrane Patches [J].MethodsMolBiol, 2005, 294:303-320.
[53]Vega L J C, Lee M K, Jeong J H,etal. Recapitulating Cell-Cell Adhesion Using N-Cadherin Biologically Tethered to Substrates [J].Biomacromolecules, 2014, 15(6):2 172-2 179.
[54]Kamiya K, Tsumoto K, Yoshimura T,etal. Cadherin-Integrated Liposomes with Potential Application in Adrug Delivery System [J].Biomaterials, 2011, 32(36):9 899-9 907.
[55]Behjati M, Kazemi M, Hashemi M,etal. Double-Chimera Protein to Enhance Recruitment of Endothelial Cells and Their Progenitor Cells [J].IntJCardiol, 2013, 167(4):1 560-1 569.
[56]Collazos-Castro J E, Hernández-Labrado G R, Polo J L,etal. N-cadherin and LI-functionalised Conducting Polymers for Synergistic Stimulation and Guidance of Neural Cell Growth [J].Biomaterials, 2013, 34(14):3 603-3 617.
[57]Place E S, Evans N D, Stevens M M. Complexity in Biomaterials for Tissue Engineering [J].NatureMaterials, 2009, 8:457-470.
[58]Bian L, Guvendiren M, Mauck R L,etal. Hydrogels that Mimic Developmentally Relevant Matrix and N-Cadherin Interactions Enhance MSC Chondrogenesis [J].ProcNatlAcadSci, 2013, 110(25):10 117-10 122.
[59]Zhang Y, Xiang Q, Dong S,etal. Fabrication and Characterization of a Recombinant Fibronectin/Cadherin Bio-inspired Ceramic Surface and Its Influence on Adherin and Ossification in Vitro [J].ActaBiomater, 2010, 6(3):776-785.
[60]Zhang Y, Li L, Zhu J,etal. In Vitro Obsevation of Self-assembled ECM-Mimetic Bioceramic Nanoreservoir Delivering rFN/CDH to Modulate Osteogenesis [J].Biomaterials, 2012, 33(30):7 468-7 477.
[61]Haque A, Hexig B, Meng Q,etal. The Effect of Recombinant E-Cadherin Substratum on the Differentiation of Endoderm-Derive Hepatocyte-Like Cells from Embryonic Stem Cells [J].Biomaterials, 2011, 32(8):2 032-2 042.
[62]Haque A, Yue X S, Motazedian A. Characterization and Neural Differentiation of Mouse Embryonic and Induced Pluripotent Stem Cells on the Cadherin-Based Substrata [J].Biomaterials, 2012, 33(20):5 094-5 106.
[63]Elnakish MT, Hassan F, Dakhlallah D,etal. Mesenchymal Stem Cells for Cardiac Regeneration: Translation to Bedside Reality[J].StemCellsInt, 2012: 646 038.
[64]Wagner W, Horn P, Castoldi M,etal. Replicative Senescence of Mesenchymal Stem Cells a Continuous and Organized Process [J].PLoSOne, 2008, 3(5):e2 213.
[65]Zangi L, Rivkin R, Kassis I,etal. High-Yield Isolation, Expansion, and Differentiation of Rat Bone Marrow-Derived Mesenchymal Stem Cells with Fibrin Microbeads[J].TissueEng, 2006, 12(8):2 343-2 354.
[66]Zhong S, Zhang Y, Lim C T. Fabrication of Large Pores in Electrospun Nanofibrous Scaffolds for Cellular Infiltration: A Review [J].TissueEngPartBRev, 2012, 18(2):77-87.
[67]Xu J, Zhu C, Zhang Y,etal. hE-cadherin-Fc Fusion Protein Coated Surface Enhances the Adhesion and Proliferation of Human Mesenchymal Stem Cells [J].ColloidsSurfBBiointerfaces, 2013, 1(109):97-102.
[68]Xu J, Li S, Hu F,etal. Artificial Biomimicking Matrix Modifications of Nanofibrous Scaffolds by hE-Cadherin-Fc Fusion Protein to Promote Human Mesenchymal Stem Cells Adhesion and Proliferation [J].JNanosciNanotechnol, 2014, 14(6):4 007-4 013.
(编辑盖少飞)
Recombinant Fusion Protein Based Biomaterialsfor Tissue Engineering
ZHANG Yan, XU Ke, GAO Chao, YANG Jun
(State Key Laboratory of Medicinal Chemical Biology, College of Life Science, Nankai University,
Tianjin 300071, China)
Abstract:The construction of 3D biological substitutes consisting of cells and scaffolds is an expected approach for tissue repair and organ restoration. Normal biological activities of cells requires the continuous stimulation of signaling molecules from the extracellular microenvironment. As an important part of the artificial extracellular matrix, both chemical signals and physical forces of the biomaterials remodeling regulate cell gene and protein express but far not enough to extracorporealy re-sculpt tissue structure. Using gene and protein engineering technology, a fusion protein could be designed with multiple functions and improved the biological activities of natural or synthetic materials. In this article, we summarize the developments of biomaterials based on the fusion protein, as well as the concepts of fusion protein design and preparation. Meanwhile, we highlight the applications of fusion proteins that related to cell growth factors and cell adhesion factors in tissue engineering.
Key words:fusion protein; tissue engineering; extracellular matrix; extracellular microenvironment; vascularization; stem cells
中图分类号:R318.08
文献标识码:A
文章编号:1674-3962(2015)03-0204-12
DOI:10.7502/j.issn.1674-3962.2015.03.03
通讯作者:杨军,女,1968年生,教授,博士生导师,Email:yangjun106@nankai.edu.cn
基金项目:国家自然科学基金资助项目(31370965 ); 科技部“973”计划项目(2011CB606202 )
收稿日期:2014-11-18

