MiRNA-106a通过作用RUNX3基因诱导胃癌细胞多药耐受
张 翌,蔡 逊,金炜东
广州军区武汉总医院普通外科,武汉 430070
MiRNA-106a通过作用RUNX3基因诱导胃癌细胞多药耐受
张 翌,蔡 逊△,金炜东
广州军区武汉总医院普通外科,武汉 430070
目的 探讨胃癌细胞中人类相关转录因子3(RUNX3)对miRNA-106a(miR-106a)表达的影响以及与多药耐药的关系。方法 采用免疫印迹法及细胞凋亡检测来观察miR-106a在两个人类胃癌细胞多药耐药细胞系上的表达情况。运用免疫印迹及多聚酶链式反应检测miR-106a的表达来观察癌细胞对抗癌药物的敏感性。通过荧光素酶活性测定观察miR-106a与RUNX3的关系。结果 miR-106a在多药耐药胃癌细胞中表达增加,并抑制胃癌细胞对抗癌药物的敏感性;通过作用于RUNX3调节多药耐药。结论 通过作用于RUNX3基因,miR-106a诱导胃癌多药耐药性。
胃癌; 多药耐药性; miRNA-106a; 人类相关转录因子3
胃癌(gastric cancer,GC)是世界上致死率第2高的癌症[1],化疗是目前临床治疗胃癌的最常用的方法,但是治疗过程中出现的多药耐药性(MDR)限制了治疗效果[2],MDR的作用机制仍未明确[34]。近些年研究发现在MDR的发生机制中miRNAs发挥重要作用[5]。有报道已证明miRNA-106a(miR-106a)在胃癌中的表达具有临床意义[6];但是,miR-106a在胃癌MDR中的确切机制尚不明确。
本实验拟观察miR-106a在两个人类胃癌细胞多药耐药细胞系上的表达情况,检测miR-106a抑制胃癌细胞对抗癌药物的敏感性,观察miR-106a是否能增加胃癌细胞的多药耐受。最后观察miR-106a是否作用于RUNX3基因而在胃癌细胞多药耐受过程中发挥至关重要的作用。
1 材料与方法
1.1 实验材料
SGC7901人类胃腺癌细胞株(军事医学科学院);miRNA萃取试剂盒[天根生化科技(北京)有限公司];Trizol试剂、脂质体2000(Invitrogen公司);TOYOBO试剂[东洋纺(上海)生物科技有限公司];广州锐博生物制剂;膜联蛋白Ⅴ-FITC凋亡检测试剂盒(BD Biosciences公司,NY,USA);裂解缓冲液(碧云天生物技术公司);阿霉素(ADR)、长春新碱(VCR)及氟尿嘧啶等化疗药物(浙江海正制药公司)。
1.2 实验方法
SGC7901人类胃腺癌细胞株保持在含10%胎牛血清RPMI 1640培养液中,为维持药物抗性表型,分别加入ADR和VCR。使用miRNA萃取试剂盒将miRNA单独分离;从复能基因中获得miR-106a和U6的引物。通过Trizol试剂萃取RNA中的miRNA,以及使用TOYOBO试剂将miRNAs转录成cDNA以检测RUNX3基因。通过实时荧光定量系统分析miRNA和RUNX3的表达。应用广州锐博生物制剂获得miR-106a的模拟/抑制剂以及进行相应的控制。将靶细胞和miR-106a中的模拟/抑制剂一起转染,或使用脂质体2000进行相应的控制,并收集细胞在48h后转染。转染后24h,将细胞和化疗药物顺铂(CDDP)和5-氟尿嘧啶(5-FU)一起培养48h。然后,收集细胞,通过膜联蛋白Ⅴ-FITC凋亡检测试剂盒进行细胞凋亡检测。使用ModFit软件(BD Biosciences公司)对数据进行分析。
通过流式细胞仪检测细胞内ADR浓度。在裂解缓冲液中对细胞进行转染和均质化48h后收获细胞。用ECL试剂盒检测条带。使用psiCHECK-2-RUNX3和miR-106a变种DNA转染SGC7901细胞。使用非荧光素酶作为对照。采用双荧光素酶报告基因检测系统(普洛麦格)检测海肾和萤火虫荧光素酶的活性。
1.3 统计学方法
统计分析采用SPSS 16.0软件。计量资料以¯x ±s表示,组间均数比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 miR-106a在多药耐药胃癌细胞中表达增加
为确定miR-106a是否参与了胃癌细胞的多药耐药过程,我们对胃癌细胞多药耐药SGC7901/ADR,SGC7901/VCR及其亲本细胞株SGC7901进行了实时荧光定量PCR检测。我们发现与SGC7901细胞相比较(图1A),SGC7901/ADR和SGC7901/VCR细胞中的miR-106a(miR-106a mimic)有增加。SGC7901细胞中的miR-106a变种DNA起了作用,miR-106a表达显著增加(图1B)。miR-106a抑制剂的作用也很显著(图1C)。我们的研究结果表明miR-106a可能参与了胃癌细胞的多药耐药性发展。

图1 miR-106a在多药耐药胃癌细胞中表达增加Fig.1 miR-106awas increased in GC cells with MDR
2.2 miR-106a抑制胃癌细胞对抗癌药物的敏感性
为探索miR-106a是否对胃癌细胞的多药耐药有直接作用,我们研究了由miR-106a变种DNA或抑制剂转染的SGC7901或SGC7901/VCR细胞。MTT法检测发现,miR-106a变种DNA转染了的SGC7901细胞对ADR、CDDP和5-FU的敏感度大大降低,IC50值大幅增加(图2A)。与此相反,在SGC7901/VCR细胞抑制miR-106a水平导致了对ADR、CDDP和5-FU(图2B)的敏感性提高。这些数据表明,调节miR-106a的表达改变了胃癌细胞对化疗药物的敏感性。

图2 miR-106a抑制胃癌细胞对抗癌药物的敏感性Fig.2 miR-106asuppressed the sensitivity of GC cells to anticancer drugs
2.3 miR-106a通过上调P-gp促进ADR外排
为探索miR-106a在胃癌细胞药物外排中的作用,我们检测了被miR-106a变种DNA转染的SGC7901胃癌细胞中的ADR指数权。miR-106a变种DNA转染后的ADR流出明显增加(图3A)。与ADR释放指数一致的是,实时荧光定量PCR结果显示多药耐药相关蛋白1(MDR1)mRNA水平(图3B)和高架P-糖蛋白(P-gp)的蛋白水平也在增加,它们都是由MDR1基因编码的,在miR-106a变种DNA转染的胃癌细胞内表达增强(图3C、D)。为进一步研究miR-106a是否通过增加P-gp水平,促进药物外排来增强胃癌细胞的多药耐药,我们使用了P-gp抑制剂维拉帕米来处理转染的SGC7901细胞。加入维拉帕米减少了miR-106a变种DNA转染的SGC7901/ADR细胞(图3E)的ADR释放指数。与此相反,与抑制剂转染的SGC7901/ADR细胞(图3F)相比,miR-106a变种DNA转染的SGC7901/ADR细胞转染的ADR指数权显著降低。这些结果表明了miR-106a可能通过上调P-gp促进ADR外排。
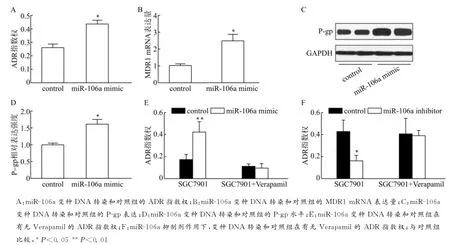
图3 miR-106a通过上调P-gp促进ADR的外排Fig.3 miR-106apromoted the efflux of ADR by upregulating P-gp
2.4 miR-106a抑制药物诱导的细胞凋亡
我们进一步研究了miR-106a对胃癌细胞药物诱导细胞凋亡的影响。在使用顺铂和5-FU孵化后,检测了miR-106a变种DNA转染的胃癌细胞凋亡情况。流式细胞术检测结果表明在使用顺铂孵育后,miR-106a变种DNA转染的胃癌细胞凋亡百分比(图4A)显著下降。使用5-FU孵育的细胞中也有类似的结果(图4B)。此外,蛋白质印迹(图4C)表明在miR-106a变种DNA转染的胃癌细胞中,Bcl-2蛋白升高,Bax得到了抑制。这些结果表明miR-106a能降低SGC7901细胞对药物诱导的细胞凋亡的敏感度。
2.5 miR-106a通过指向RUNX3调节多药耐药
我们使用了miRNA靶标分析工具Target Scan6.2来筛选miR-106a的潜在目标。预测RUNX3基因是miR-106a的目标(图5A)。为了验证RUNX3基因是miR-106a的目标,我们进行了荧光素酶活性测定。在SGC7901中,使用miR-106a变种DNA或控制变种DNA共转染了野生型RUNX3 3′非编码区(WT)的荧光素酶报告质粒或突变(Mut)。与控制变种DNA对照组相比,使用WT和miR-106a变种DNA共转染的SGC7901细胞中荧光素酶的活性显著降低,但Mut荧光素酶活性没有变化(图5B)。SGC7901细胞中的miR-106a变种DNA转染显著降低了RUNX3的蛋白水平(图5C)。这些结果表明了miR-106a抑制了RUNX3表达。
为探讨RUNX3是否调节了miR-106a的功能,我们检测了多药耐药胃癌细胞SGC7901/ADR和SGC7901/VCR以及亲代细胞系SGC7901中的RUNX3蛋白水平。发现与SGC7901相比,SGC7901/ADR和SGC7901/VCR细胞中的RUNX3表达显著降低(图5D)。此外,我们发现,RUNX3基因的过度表达可以逆转miR-106a降低胃癌细胞对抗癌药物敏感性的作用(图5E)。这些结果表明了miR-106a可能通过抑制RUNX3表达来诱导胃癌细胞的多药耐药。

图4 miR-106a抑制药物诱导的细胞凋亡Fig.4 miR-106asuppressed drug-induced cell apoptosis
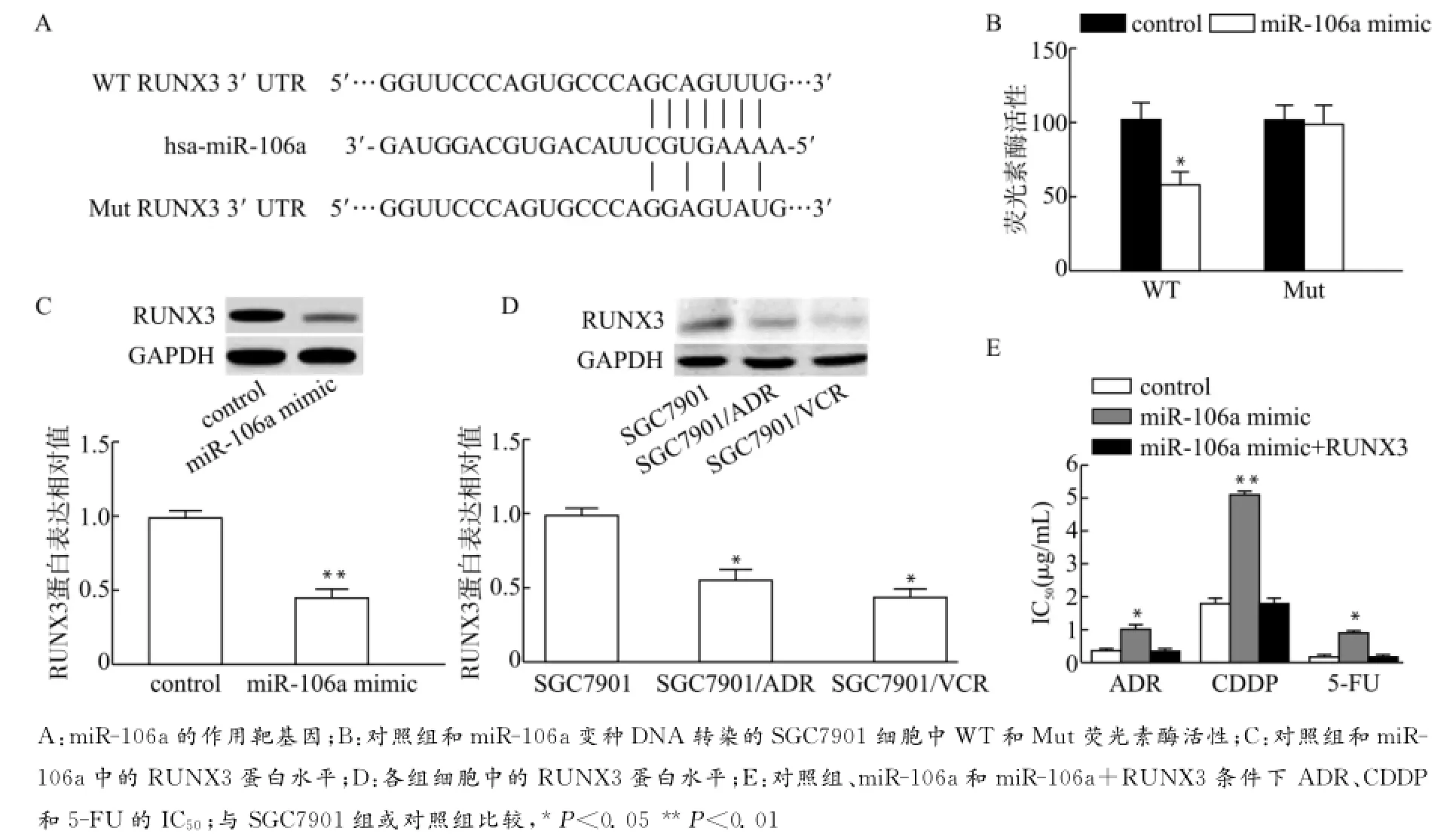
图5 miR-106a指向RUNX3调节多药耐药Fig.5 miR-106amodulated MDR by targeting RUNX3
3 讨论
多药耐药是胃癌化疗失败最常见的原因之一。最近,一些研究已经确定大量miRNA参与了胃癌细胞的多药耐药发展[711]。目前已有数据也证明了miR-106a是miR-106a~363群[1213]中最重要的促致癌成分之一,可以通过靶向RUNX3调节人类胃癌细胞的多药耐药。
人类多药耐药细胞系SGC7901/ADR和SGC7901/VCR被广泛用作胃癌细胞多药耐药研究的体外模型,它们是从人类胃腺癌细胞株SGC7901中逐步筛选而来的。mRNA和蛋白表达谱已经在SGC7901/VCR及其亲本细胞系[1415]之间得到了证实。通过本研究发现,与SGC7901细胞相比,SGC7901/ADR和SGC7901/VCR细胞中的miR-106a表达增加。此外,受miR-106a变种DNA或抑制剂调节的miR-106a可以改变胃癌细胞对化疗药物,如ADR、CDDP和5-FU的敏感性。
P-gp是ATP结合盒(ABC)转运体之一,由MDR1基因编码,在胃癌细胞系和肿瘤中表达增加,并且通过增加毒性药物的外排对胃癌细胞的多药耐药发展起到了至关重要的作用。抑制P-gp的表达可逆转多药耐药[16]。本研究结果揭示了miR-106a的转染能显著提高P-gp的表达。此外,补充P-gp抑制剂维拉帕米逆转了miR-106a诱导的ADR释放指数的增加,表明P-gp的上调可能是miR-106a导致药物外排的原因之一。
多药耐药也参加了胃癌细胞逃避凋亡的过程。细胞凋亡的改变可能会影响化疗药物的效率。本研究证实了miR-106a抑制了药物诱导的胃癌细胞凋亡,在增加抗凋亡分子Bcl-2表达的同时抑制促凋亡分子Bax的表达。这些结果表明了miR-106a可能通过降低癌细胞对凋亡分子的敏感性来促进胃癌细胞的多药耐药。
RUNX3是TGF-β家族通路的下游效应物,具有多种功能。RUNX3基因在细胞增殖、粘附和凋亡的调控中发挥了重要作用。RUNX3基因缺失的小鼠表现出胃黏膜增生的性状。此外,在各种恶性肿瘤细胞,如乳腺癌、结肠直肠癌和神经胶质瘤细胞中观察到RUNX3的表达降低[1719]。此外,在某些类型的人类中也观察到了RUNX3的点突变[20]。这些观察结果表明,RUNX3基因可能是多种人类肿瘤细胞的抑制因子。Guo等[2122]的报告中指出,RUNX3通过抑制Bcl-2蛋白、MDR1和多药耐药相关蛋白-1(MRP-1)的表达来实现抑癌和化疗药物对胃癌细胞的致敏。Horiguchi等[23]也发现RUNX3的下调也通过诱导MRP-1的表达导致胰腺肿瘤对吉西他滨的耐药。本研究证实了miR-106a抑制RUNX3表达。RUNX3基因在胃癌细胞异位表达可以抑制miR-106a对胃癌细胞多药耐药的调节作用。这些数据表明了miR-106a可能通过指向RUNX3来调节胃癌细胞多药耐药。
本研究发现miR-106a在胃癌细胞株多药耐药中表达增加,通过加速药物外排,减少细胞凋亡抑制胃癌细胞对化疗药物的敏感性。此外,本实验验证了RUNX3基因是miR-106a在胃癌细胞中的目标,表明了miR-106a可能通过调节胃癌细胞中的RUNX3来调节多药耐药,为多药耐药机制研究及胃癌治疗提供新思路。
[1] Baba H,Kuwabara K,Ishiguro T.Prognostic factors for stageⅣgastric cancer[J].Int Surg,2012,98(2):181-187.
[2] Szakacs G,Paterson J K,Ludwig J A.Targeting multidrug resistance in cancer[J].Nat Rev Drug Discov,2006,5(3):219-234.
[3] Li K,Chen B A,Xu L,et al.Reversal of multidrug resistance by cisplatin-loaded magnetic Fe3O4nanoparticles in A549/DDP lung cancer cells in vitro and in vivo[J].Int J Nanomedicine,2013,8:1867-1877.
[4] Kuss S,Polcari D,Geissler M,et al.Assessment of multidrug resistance on cell coculture patterns using scanning electrochemical microscopy[J].Proc Natl Acad Sci U S A,2013,110(23):9249-9254.
[5] Baer C,Claus R,Plass C.Genome-wide epigenetic regulation of miRNAs in cancer[J].Cancer Res,2013,73(2):473-477.
[6] Xiao B,Guo J,Miao Y,et al.Detection of miR-106ain gastric carcinoma and its clinical significance[J].Clin Chim Acta,2009,400(1/2):97-102.
[7] Wang F,Li T,Zhang B,et al.MicroRNA-19a/b regulates multidrug resistance in human gastric cancer cells by targeting PTEN[J].Biochem Biophys Res Commun,2013,434(3): 688-694.
[8] Wang Y,Gu X,Li Z,et al.microRNA expression profiling in multidrug resistance of the 5-Fu induced SGC7901human gastric cancer cell line[J].Mol Med Rep,2013,7(5):1506-1510.
[9] Xia L,Zhang D,Du R,et al.miR-15band miR-16modulate multidrug resistance by targeting BCL2in human gastric cancer cells[J].Int J Cancer,2008,123(2):372-379.
[10] Zhu W,Xu H,Zhu D,et al.miR-200bc/429cluster modulates multidrug resistance of human cancer cell lines by targeting BCL2and XIAP[J].Cancer Chemother Pharmacol,2012,69(3):723-731.
[11] Zhu W,Zhu D,Lu S,et al.miR-497modulates multidrug resistance of human cancer cell lines by targeting BCL2[J].Med Oncol,2012,29(1):384-391.
[12] Catela I T,Aralica G,Cacev T,et al.miR-106aoverexpression and pRB downregulation in sporadic colorectal cancer[J].Exp Mol Pathol,2013,94(1):148-154.
[13] Dylla L,Jedlicka P.Growth-promoting role of the miR-106a approximately 363cluster in ewing sarcoma[J].PLoS One,2013,8(4):630-632.
[14] Zhao Y,You H,Liu F,et al.Differentially expressed gene profiles between multidrug resistant gastric adenocarcinoma cells and their parental cells[J].Cancer Lett,2002,185(2):211-218.
[15] Yang Y X,Xiao Z Q,Chen Z C,et al.Proteome analysis of multidrug resistance in vincristine-resistant human gastric cancer cell line SGC7901/VCR[J].Proteomics,2006,6(6): 2009-2021.
[16] Zhang Y F,Fan D M.Proteasome inhibitor MG132reverses multidrug resistance of gastric cancer through enhancing apoptosis and inhibiting P-gp[J].Cancer Biol Ther,2008,7(4): 540-546.
[17] Chimge N O,Frenkel B.The RUNX family in breast cancer: relationships with estrogen signaling[J].Oncogene,2013,32(17):2121-2130.
[18] Kang K A,Zhang R,Kim G Y,et al.Epigenetic changes induced by oxidative stress in colorectal cancer cells:methylation of tumor suppressor RUNX3[J].Tumour Biol,2012,33(2):403-412.
[19] Mei P J,Bai J,Liu H,et al.RUNX3expression is lost in glioma and its restoration causes drastic suppression of tumor invasion and migration[J].J Cancer Res Clin Oncol,2011,137(12):1823-1830.
[20] Kim T Y,Lee H J,Hwang K S,et al.Methylation of RUNX3 in various types of human cancers and premalignant stages of gastric carcinoma[J].Lab Invest,2004,84(4):479-484.
[21] Guo C,Ding J,Yao L,et al.Tumor suppressor gene Runx3 sensitizes gastric cancer cells to chemotherapeutic drugs by downregulating Bcl-2,MDR-1and MRP-1[J].Int J Cancer,2005,116(1):155-160.
[22] 师海蓉.靶向CIP2A的shRNA对人胃癌BG-823细胞增殖、凋亡及侵袭的影响[J].华中科技大学学报:医学版,2014,43(5):528-531,536.
[23] Horiguchi S,Shiraha H,Nagahara T,et al.Loss of runt-related transcription factor 3induces gemcitabine resistance in pancreatic cancer[J].Mol Oncol,2013,73(3):713-718.
(2014-09-28 收稿)
MiRNA-106a Induces Multidrug Resistance of Gastric Cancer Cells by Targeting RUNX3
Zhang Yi,Cai Xun△,Jin Weidong
Department of General Surgery,Wuhan General Hospital of Guangzhou Military Command,Wuhan 430070,China
Objective To explore the effect of miRNA-106a(miR-106a)expression on multidrug resistance(MDR)of gastric cancer(GC)cells and the involvement of runt-related transcription factor 3RUNX3.Methods The expression of miR-106awas detected in two human gastric adenocarcinoma cell lines with MDR by immunoblotting and apoptosis assay.The sensitivity of GC cells to anticancer drugs was observed by detecting the expression of miR-106aby using immunoblotting and PCR,and the relationship between miR-106aand RUNX3was determined by luciferase activity assay.Results miR-106awas significantly increased in GC cells with MDR,and it suppressed the sensitivity of GC cells to anticancer drugs.It could modulate MDR by targeting RUNX3.Conclusion miR-106acan induce the MDR by targeting RUNX3in GC.
gastric cancer; multidrug resistance; miRNA-106a; runt-related transcription factor 3
R735.2
10.3870/j.issn.1672-0741.2015.01.008
张 翌,男,1980年生,主治医师,E-mail:50823363@qq.com
△通讯作者,Corresponding author,E-mail:78228013@qq.com

