手术切除联合放化疗治疗恶性胶质瘤的疗效观察
陆泳宇, 朱颂华, 虞 聪
临床与基础研究
手术切除联合放化疗治疗恶性胶质瘤的疗效观察
陆泳宇, 朱颂华, 虞 聪
目的 分析手术切除联合放化疗治疗恶性胶质瘤的临床疗效。方法 选取2010年10月至2012年10月在海门市人民医院经手术治疗的50例恶性胶质瘤患者作为研究对象,随机平均分为对照组和观察组。对照组术后行常规放疗,观察组术后放疗和化疗同步进行。比较两组患者间的临床疗效、生存率、复发时间及不良反应发生情况。结果 观察组有效率(76.0%)高于对照组(48.0%)(P<0.05);观察组术后2年生存率(32.0%)高于对照组(12.0%)(P<0.05);观察组中位复发时间为12个月,对照组为7个月,差异无统计学意义;两组间不良反应发生率比较差异也无统计学意义。结论 手术切除联合放化疗治疗恶性胶质瘤有效率更高,明显延长患者生存期。
恶性胶质瘤; 手术; 放疗; 化疗
胶质瘤是一种常见的危害人类健康的疾病,由于其呈浸润性生长,与脑组织无明确分界,难以彻底切除,所以复发率高,预后差[1]。目前胶质瘤的治疗方法是手术切除联合放化疗等综合疗法。许多临床研究已经证明术后放化疗能延长胶质瘤的复发时间并提高患者生存率[2-3]。我院在2010年10月至2012年10月期间对50例恶性胶质瘤患者进行分组对照研究,探讨手术切除联合单纯放疗与联合放化疗对恶性胶质瘤的临床疗效,现将结果报道如下。
1 资料和方法
1.1 一般资料
选取2010年10月至2012年10月在我院进行恶性胶质瘤切除手术的50例患者为研究对象,随机分为对照组(手术+放疗)和观察组(手术+放疗+化疗),每组各25例。所有患者术后病理均证实为恶性脑胶质瘤(WHO 2007年标准)Ⅲ~Ⅳ级。对照组:男12例,女13例,年龄25~71岁,平均年龄(45.6±9.8)岁,Ⅲ级胶质瘤16例,Ⅳ级胶质瘤9例。肿瘤部位:额叶14例、颞叶5例、顶叶4 例、枕叶2例。观察组:男13例,女12例,年龄21~67岁,平均年龄(47.2±10.6)岁,Ⅲ级胶质瘤15例,Ⅳ级胶质瘤10例。肿瘤部位:额叶13例、颞叶6例、顶叶5例、枕叶1 例。两组患者在年龄、性别、病理分型以及病变部位等方面差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
对照组患者在手术切除后常规进行放疗,观察组患者在手术切除后放疗和化疗同步进行,所有治疗方案均获得家属同意并签署知情同意书。
1.2.1 对照组 所有患者术后3~4周进行放射治疗,采用6MV-X线直线加速器,三维适形放疗技术:患者仰卧于体部真空固定袋,头部用面膜固定,行螺旋CT增强扫描头颅,根据扫描图像常规分割,以肿瘤水肿带(GTV)外放2.5~3.0 cm为临床靶体积(CTV),CTV 外放0.5 cm 为计划靶体积(PTV),使用等剂量曲线100%完全将肿瘤区包绕,等剂量曲线90%将PTV包绕,每次照射剂量为2 Gy,每天1次,每周照射5次,至 DT 60~66 Gy时结束放疗。
1.2.2 观察组 术后放疗方法同对照组。放疗期间同时进行化疗,患者于放疗前口服替莫唑胺150 mg/d,连续口服5天,4周为一疗程,治疗6个疗程。
1.3 疗效评价
根据WHO疗效评定标准对患者的治疗效果进行评估。治疗效果分为四个等级:(1)完全缓解,肿瘤完全消失,且1月内无新发病灶;(2)部分缓解,肿瘤减小50%以上,且1月内无新发病灶;(3)稳定,肿瘤减小小于50%或增大小于25%;(4)病变进展,肿瘤增大超过50%。有效率= (完全缓解例数+部分缓解例数) /总例数×100%。
1.4 观察指标
治疗结束后,采用电话随访或门诊复查等方式,每3个月随访1次,统计对照组与观察组之间生存期差异;分别统计两组患者的治疗后并发症情况,主要包括恶心呕吐、骨髓抑制等。
1.5 统计学方法
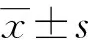
2 结果
2.1 两组的疗效比较
随访截至2014 年10月1日,中位随访时间22个月(10~32个月),无失访病例,随访率100%。治疗后6个月复查头颅CT或MRI,结果显示观察组的临床疗效明显优于对照组(表1),两组间的差异有统计学意义(P<0.05)。
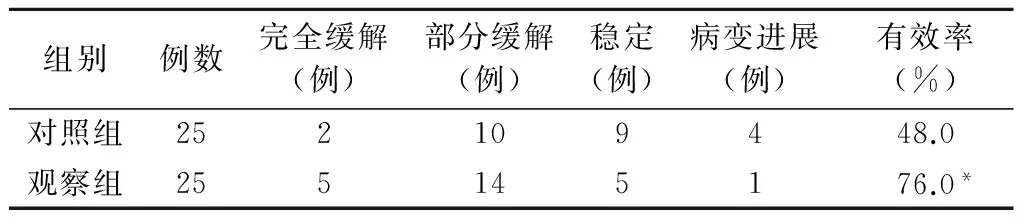
表1 两组患者临床疗效比较
*:与对照组比较,P<0.05。
对照组和观察组的1年生存率分别为44.0%(11/25)和68.0%(17/25),两组差异无统计学意义(P>0.05);对照组和观察组的2年生存率分别为12.0%(3/25)和32.0%(8/25),差异有统计学意义(P<0.05)。对照组中位复发时间6个月(3~13个月),观察组中位复发时间12个月(7~24个月),差异无统计学意义(P>0.05)。
2.2 两组不良反应发生情况的比较
观察组和对照组放化疗不良反应情况见表2,以恶心呕吐及骨髓抑制为主,经对症治疗后均好转。对照组1例患者出现腹痛症状,观察组1例患者出现脱发症状,1例患者出现皮肤色素沉着。两组间差异无统计学意义(P>0.05)。
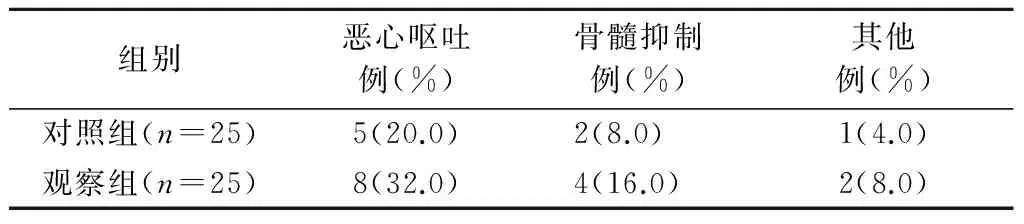
表2 两组患者不良反应比较
3 讨论
脑胶质瘤是最常见的颅内原发性肿瘤,占颅脑肿瘤的40%~50%[4]。按照WHO中枢祌经系统肿瘤分类标准,Ⅰ~Ⅱ级胶质瘤主要包括星形细胞瘤、毛细胞型星形细胞瘤、多形性黄色星形细胞瘤、神经节胶质瘤、少枝胶质瘤和混合性少枝星形细胞瘤等,生物学习性倾向良性,有很好的预后。Ⅲ~Ⅳ级胶质瘤主要包括星形细胞瘤、胶质母细胞瘤、恶性间变性星形细胞瘤等,属高度恶性[5]。恶性胶质瘤瘤体生长快,病程短,死亡率高,预后差[6]。
目前治疗胶质瘤的主要手段是手术、放疗和化疗。手术治疗在保存神经功能的前提下尽可能切除肿瘤,但虽然手术切除了可见的肿瘤灶,但其浸润性生长的病灶仍无法根除,放疗和化疗成为杀灭这些浸润灶的重要治疗手段[7]。一些研究认为化疗药物的选择性不强,化疗效果的判断标准不一,且患者容易出现药物不良反应,所以尽可能多的切除肿瘤并辅以放疗即可有效改善疾病症状并延长生存期,其后是否辅助化疗有待商榷[8]。国内段宝奇等[7]研究手术结合术后放化疗对恶性胶质瘤的疗效,结果显示1年生存率达72.8%,2年生存率为42.9%。本研究结果显示,手术切除联合放化疗治疗恶性胶质瘤的临床疗效明显高于术后单纯放疗,观察组的术后1年生存率68.0%,2年生存率为32.0%,复发时间中位数为12个月;而对照组(手术后单纯放疗)的患者2年生存率仅为10.7%,复发时间中位数为6个月。此结果证明手术切除联合放化疗治疗恶性胶质瘤效果显著。在术后单纯进行放疗时,由于对放射剂量存在限制,且部分患者可能对放疗不敏感,造成疗效较差,而放疗联合化疗可弥补该缺陷,使临床疗效更加明显[9]。
本研究选用的化疗药物是替莫唑胺,替莫唑胺是一种新型的口服化疗药,在体内不经肝脏代谢广泛分布于全身,无需酶催化即自动转变为活性产物MTIC,抗瘤谱广,血脑屏障通透性好,在中枢神经系统中也能达到有效的药物浓度[10-13]。替莫唑胺的不良反应主要包括恶心、呕吐、头痛和血液学反应等[14]。在本研究中也显示观察组的不良反应例数多于对照组,考虑与服用替莫唑胺有关,但对症治疗后症状均能得到缓解,不影响继续治疗,且两组间的不良反应发生率无统计学差异(P>0.05)。
综上所述,手术切除联合放化疗能够提高恶性胶质瘤患者的临床疗效,延长患者生存期及复发时间,可在临床上推广应用。
[1] 许志强,徐伦山,蒋小江,等. 脑胶质瘤的临床治疗进展[J]. 中国临床神经科学, 2010,18(4): 431-435.
[2] 刘嘉霖,马晓东,郭胜利,等. 术后综合治疗高级别胶质瘤89例分析[J]. 中国药物与临床, 2012,12(4) : 491-493.
[3] 周开宇, 王广涛, 罗永康,等. 恶性胶质瘤术后放疗同步化疗疗效初步分析[J]. 中华肿瘤防治杂志,2010,17(1):70-72.
[4] 王俊杰,王刚,周章明,等. 神经胶质瘤的治疗研究进展[J]. 癌症进展, 2011, 9(1):63-67.
[5] Muragaki Y, Akimoto J, Maruyama T, et al. Phase Ⅱ clinical study on intraoperative photodynamic therapy with talaporfin sodium and semiconductor laser in patients with malignant brain tumors[J]. J Neurosurg,2013,119(4):845-852.
[6] 马赛男,蔡炜嵩,曾越灿,等. 放疗联合替莫唑胺治疗术后恶性胶质瘤的Meta分析[J]. 实用药物与临床,2014,17(5):532-536.
[7] 段宝奇,高觉明,李海林,等.恶性脑胶质瘤手术联合化疗与放疗的疗效分析[J].中国肿瘤外科杂志,2009,1(2):78-80.
[8] Thomas AA, Brennan CW, DeAngelis LM, et al. Emerging therapies for glioblastoma[J]. JAMA Neurol,2014 ,71(11):1437-1444.
[9] Bae SH, Park MJ, Lee MM, et al. Toxicity profile of temozolomide in the treatment of 300 malignant glioma patients in Korea[J]. J Korean Med Sci,2014,29(7):980-984.
[10] 梁惠,董士丽. 国内恶性脑胶质瘤术后放疗联合替莫唑胺化疗疗效与安全性的Meta分析[J]. 现代肿瘤医学, 2010,18(12): 2345-2348.
[11] 武新虎,朱锡旭,沈泽天. 替莫唑胺与福莫司汀治疗恶性脑胶质瘤的临床观察[J]. 现代肿瘤医学, 2012,20( 6): 1165-1168.
[12] Weller M. Novel diagnostic and therapeutic approaches to malignant glioma[J].Swiss Med Wkly,2011,24(141): 132-135.
[13] Theeler BJ, Groves MD. High-grade gliomas[J]. Curr Treat Options Neurol, 2011, 13(4):386-399..
[14] 李红,高德荣,温珍平,等. 高级别胶质瘤同步放化疗中替莫唑胺化疗的不良反应分析[J]. 立体定向和功能性神经外科杂志, 2014,27(2): 79-82.
226100 江苏 海门,海门市人民医院 神经外科
陆泳宇,男,本科学历,主治医师,研究方向:神经外科临床,E-mail:drluluy@163.com
10.3969/j.issn.1674-4136.2015.02.009
1674-4136(2015)02-0099-03
2014-11-19][本文编辑:李筱蕾]

