猪丹毒杆菌SpaA基因的生物信息学分析
卢 琴,李明波,彭先文,宋忠旭,雷 彬,梅书棋
(湖北省农业科学院畜牧兽医研究所/动物胚胎工程及分子育种湖北省重点实验室,湖北武汉430064)
猪丹毒(Swine erysipelas)是由猪丹毒杆菌(Erysipelotrixrhusiopathiae)引起的一种人畜共患传染病,人感染后主要表现为皮肤红疹的类丹毒,猪为皮肤有“打火印”疹块和非化脓性关节炎。本病无明显的季节性,各种年龄段的猪均易感,主要发生在3月龄~6月龄的架子猪。随着规模化养殖业的发展,近年来,在安徽、黑龙江、广州、江西、武汉等地均有猪丹毒散发流行性发生的报道[1-5]。
猪丹毒杆菌共有26个血清型,主要为1型和2型。猪丹毒杆菌的致病力的大小与血清型存在一定关系。Makino S等[6-8]认为SpaA蛋白对多种血清型的猪丹毒杆菌具有良好的免疫保护作用,还有许多学者[9-12]同时认为SpaA蛋白具有良好的保护作用,是研制猪丹毒杆菌亚单位疫苗的良好抗原,它所编码的表面保护性抗原A由N端的免疫保护区域和C端的细胞结合区域组成。研究SpaA蛋白已成为研制猪丹毒疫苗的一个热点。本文对病料组织的SpaA基因进行PCR检测,再借助EXPASY软件对测序结果进行翻译,进行氨基酸同源性比对,将其中保守片段用于生物信息学分析,最终为研制猪丹毒杆菌新型疫苗及制备单抗提供数据支撑。
1 材料与方法
1.1 材料
1.1.1 菌株 从来源于湖北某猪场病猪的肺脏、心脏等病料分离。
1.1.2 主要试剂 DNA Marker DL 2 000、DNA提取试剂盒、琼脂糖凝胶、TaqDNA聚合酶,宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 猪丹毒杆菌保护性抗原SpaA基因PCR引物合成 猪丹毒SpaA基因引物F-5′-AGAGTTTGATCCTGGCTCAG-3′, R-5′-GGTACCTTGTTACGACTT-3′。预期扩增片段为1 531bp。引物由上海生工生物工程技术服务有限公司合成。
1.2.2 猪丹毒杆菌DNA的提取 将组织用液氮研磨后加PBS悬浮,用DNA提取试剂盒提取。所有操作按照DNA提取说明书提取细菌DNA,置-20℃保存备用。
1.2.3 猪丹毒杆菌SpaA基因的PCR检测 以提取的基因组DNA为模板进行PCR反应,PCR反应条件:95℃ 5min;94℃1min,50 ℃ 40s,72 ℃1.5min,30个循环;72℃5min。PCR产物用10 g/L琼脂糖凝胶电泳。胶回收后将纯化的PCR产物送上海生工生物工程技术服务有限公司测序。
1.2.4 生物信息学分析 运用相应的生物信息学软件进行预测。
2 结果
2.1 猪丹毒SpaA基因的PCR扩增结果
以所提取的菌株DNA为模板,进行SpaA基因的PCR扩增。取5μL PCR产物经10g/L的琼脂糖凝胶电泳后,得到了预期的1 531bp的目的条带(图1)。
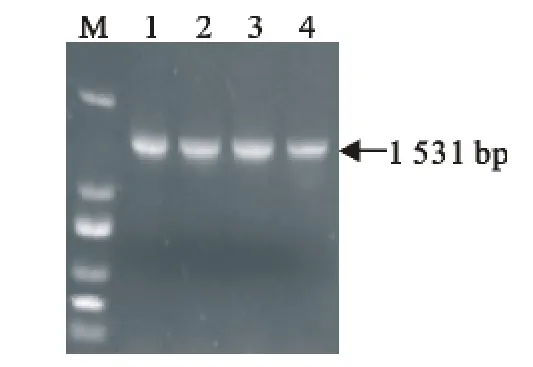
图1 SpaA基因的PCR扩增结果Fig.1 PCR amplification of SpaA gene
2.2 猪丹毒SpaA蛋白的理化性质分析
登录 http://us.expasy.org/tools/protparam.html,对SpaA蛋白理化性质分析:分子质量(pW)为10.843 4ku、分子式C752H1216N212O218S4、等电点(pI)为8.08、消光系数(aliphatic index)为104.4,为脂溶蛋白、不稳定系数为37.08,该蛋白分类为稳定蛋白等理化特性。
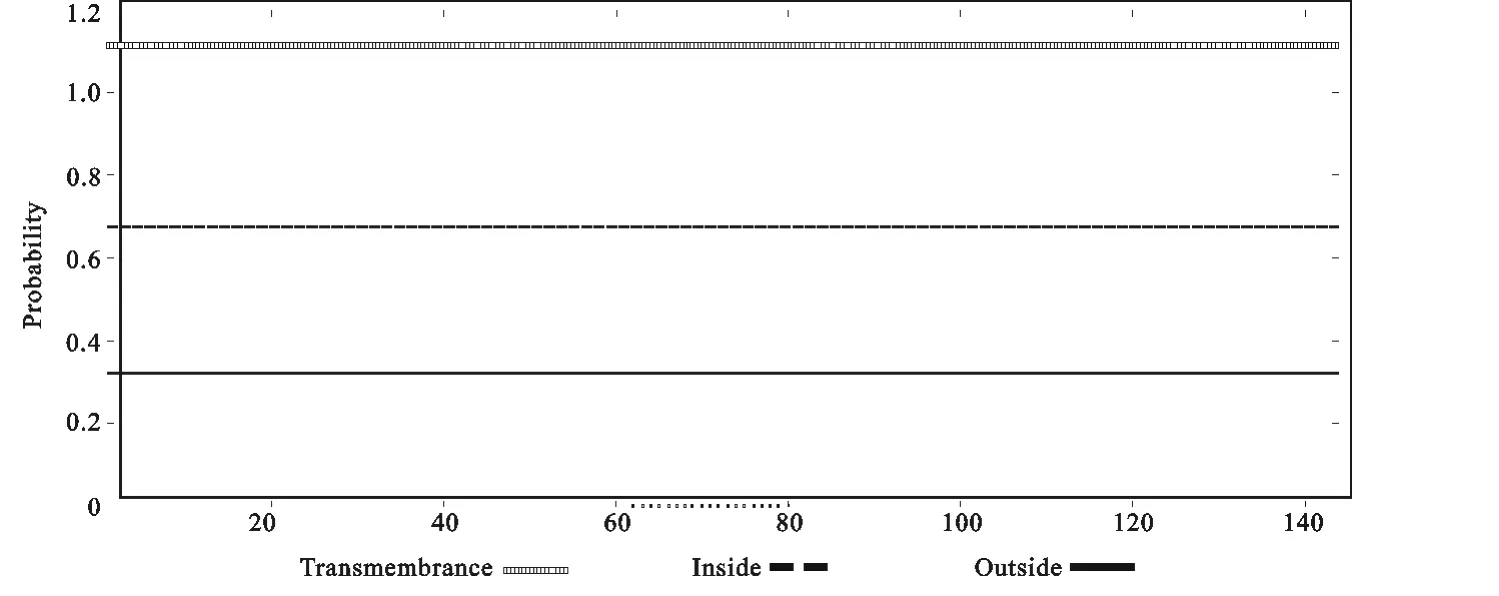
图3 SpaA蛋白跨膜区结果Fig.3 Transmembrane domain of SpaA protein
2.3 疏水性分析
登录http://web.expasy.org/protscale/,利用Bio Edit软件分析,结果显示总平均疏水指数为-0.443,为亲水性蛋白(图2)。

图2 SpaA蛋白疏水性结果Fig.2 Hydrophobicity of SpaA protein
2.4 跨膜区分析
使用 TMHMM Server v.2.0 在 线 分析(http://www.cbs.dtu.dk/services/TMHMM/),显示SpaA蛋白无跨膜区(图3)。
2.5 信号肽预测
使用SignalP在线分析(http://www.cbs.dtu.dk/services/SignalP/),无信号肽(图4)。
2.6 跨膜螺旋区分析
使用COILS服务器分析(http://www.ch.embnet.org/software/COILS_form.html),有两处跨膜螺旋位点:64、80(图5)。
2.7 蛋白质二级结构预测
使用 SSPro4.0 服 务 器 预 测(http://scratch.proteomics.ics.uci.edu/),二级结构中有108个螺旋,6个伸展链和30个卷曲结构(图6)。
2.8 蛋白质磷酸化位点预测
登录 http://www.cbs.dtu.dk/services/Net-PHos/,对SpaA蛋白磷酸化位点用NetPHos2.0软件进行预测。结果显示,该蛋白有5个磷酸化位点,其中丝氨酸磷酸化位点有3个、苏氨酸磷酸化位点有1个、酪氨酸磷酸化位点有1个(图7)。
2.9 SpaA蛋白质三级结构
登录http://www.expasy.org/swissmod/SWISSMODEL.html中,在线分子建模服务器SWISS-MODEL,利用其已进行的PDB建模结果,用RASWIN软件,对SpaA蛋白进行三级结构预测(图8)。

图4 SpaA蛋白信号肽结果Fig.4 Signal peptide of SpaA protein

图5 SpaA蛋白磷酸化位点预测Fig.5 Phosphorylation site prediction of SpaA protein
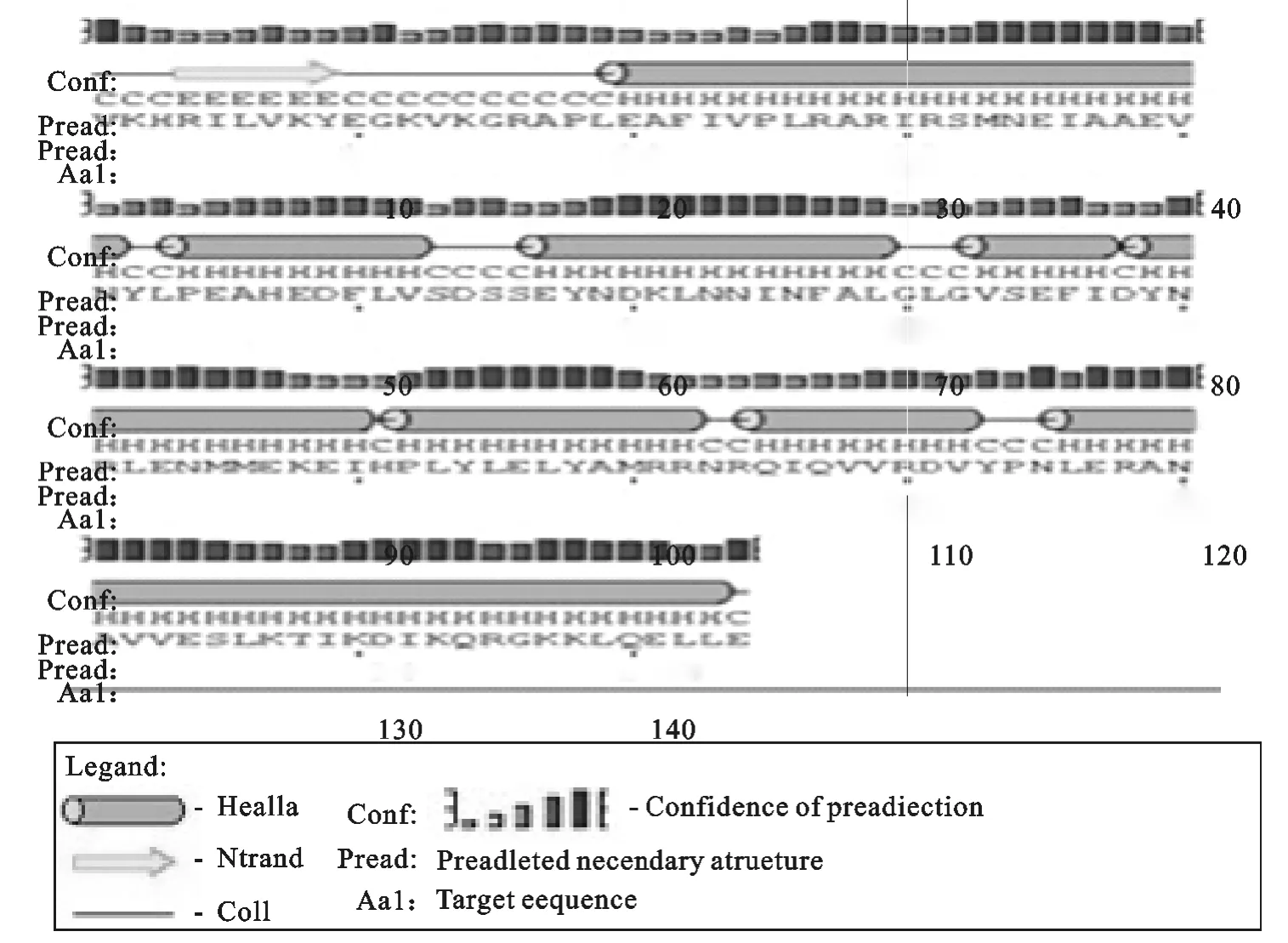
图6 SpaA蛋白二级结构Fig.6 Secondary structure of SpaA protein
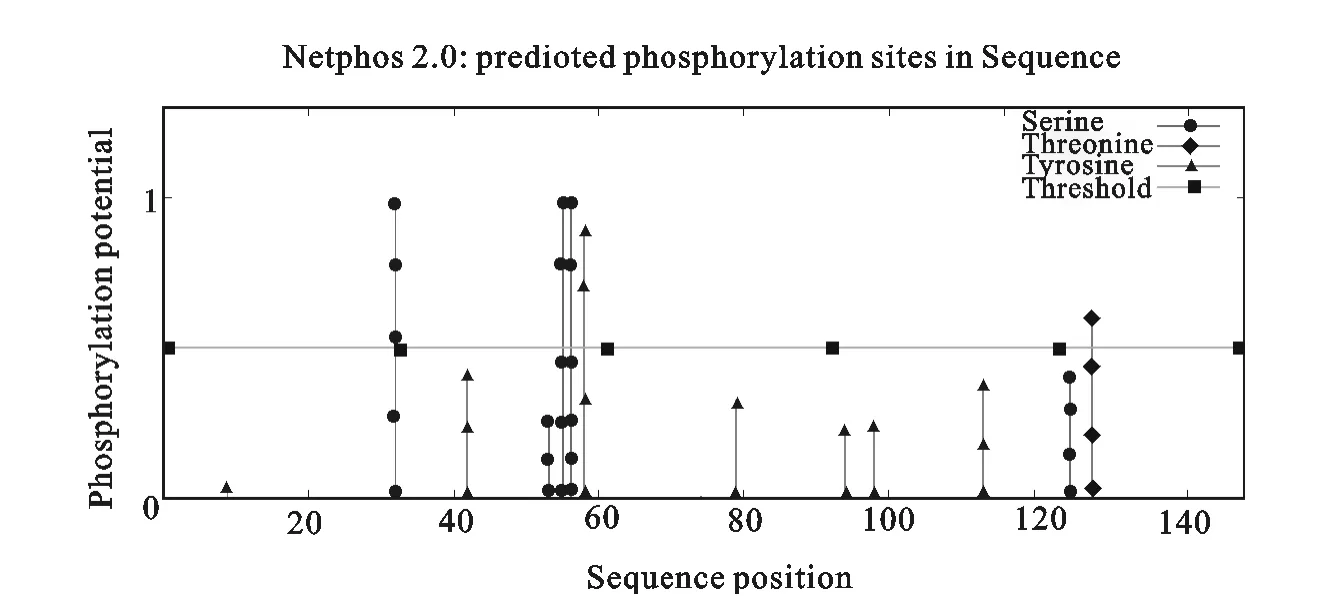
图7 SpaA蛋白磷酸化位点预测Fig.7 Phosphorylation site prediction of SpaA protein

图8 SpaA蛋白质三级结构预测Fig.8 Tertiary structure prediction of SpaA protein
2.10 B细胞抗原表位预测分析
使用神经网络等方法进行预测;Bcepred和Protean程序使用(http://www.imtech.res.in/raghava/bcepred/bcepred_submission.html),B细胞抗原表位显示:7~14、49~56、97~103、131~138。
3 讨论
晏鹏飞等[13]发现猪丹毒杆菌表面保护性蛋白A起主要保护功能的核心区段为氨基端且是由抗体介导的免疫保护。Marani P等[14]克隆和表达了编码SpaA蛋白N端的基因片段通过 Western blot检测其免疫功能,结果表明该片段能够防止猪丹毒杆菌对猪的感染。Sette A等[15]也通过表达猪丹毒杆菌SpaA蛋白N端区域免疫小鼠后小鼠可产生较强的免疫保护力。SpaA蛋白具有良好的免疫保护功能,是B细胞抗原表位分析的单参数方案:亲水性、表面可及性、柔韧性、抗原性、二级结构预测及抗原指数,本试验采用是多参数进行综合分析,运用SSPro4.0服务器预测蛋白质的二级结构,综合可及性、亲水性、抗原性、表位、柔韧性和极性等参数分析,发现SpaA蛋白的二级结构主要是以螺旋和卷曲为主,只有少量的伸展链,使得蛋白的分子构象紧密。SpaA蛋白含有5个磷酸化位点,这也说明猪丹毒杆菌能通过自我磷酸化并将下游调控蛋白磷酸化从而发挥致病作用;而亲水区有助于稳定球蛋白的构象并增加蛋白质的水溶性,使药物能透过细胞膜,使膜的通透性升高,从而发挥药效。含有2个跨膜螺旋区,说明蛋白质含有跨膜区提示它可能作为膜受体起作用,也可能是定位在膜上的锚定蛋白或离子通道蛋白。本研究预测无跨膜区,这可能说明蛋白的编码顺序是不连续的,无信号肽、无跨膜区等参数表明该蛋白性质较稳定,提示蛋白可能实现较高量的可溶性表达,这与脂溶性的特性一致。综合以上的结果,SpaA蛋白的分子质量(pW)为10.843 4ku。等电点(pI)为8.08,为脂溶蛋白、不稳定系数为37.08,总平均疏水指数为-0.443,为亲水性蛋白,无跨膜区、无信号肽、有2个跨膜螺旋位点,二级结构中有108个螺旋,6个伸展链和30个卷曲结构。含有5个磷酸化位点,其中丝氨酸磷酸化位点有3个、苏氨酸磷酸化位点有1个、酪氨酸磷酸化位点有1个,B细胞抗原表位主要有4处,即7~14、49~56、97~103、131~138。以上预测结果为今后开发猪丹毒杆菌表位疫苗和研究猪丹毒SpaA蛋白功能提供了新的思路。
[1]陆 萍,黄晓慧,李春芬,等.安徽部分地区猪丹毒杆菌的分离鉴定及生物学特性研究[J].微生物学通报,2014,5(9):1822-1828.
[2]万培伟,熊莉娟,储玉双,等.猪丹毒杆菌的分离鉴定及药敏试验[J].动物医学进展,2014,35(6):160-163.
[3]徐 淮,许梦怡,刘慧谋,等.一株猪丹毒杆菌的分离及鉴定[J].黑龙江畜牧兽医,2014,9(18):55-56.
[4]王千菊,陈 坚,巫月生,等.一株猪丹毒杆菌的分离鉴定及其对活疫苗免疫猪的攻毒试验[J].广东畜牧兽医科技,2014,4(2):29-33.
[5]胡晓芬,王 静,熊剑锋,等.一起猪丹毒杆菌临床分离鉴定及诊治[J].养猪,2014,4(2):107-109.
[6]Makino S,Yamamoto K,Asskura H,et al.Surface antigen SpaA ofErysipelothrixrhusiopathiaebinds to Gram-positive bacterial cell surface[J].FEMS Microbiol Lett,2000,18(6):313-317
[7]Cheun H I,Kawamoto K,Hiramatsu M,et al.Protective immunity of SpaA-antigen producing lactococcuslactis againstErysipelothrixrhusiopathiaeinfection[J].J Appl Microbiol,2004,96(6):1347-1353.
[8]Yoshihiro S.Pathogenicity ofErysipelothnixrhusiopathiae:virulence factors and protective immunity[J].Microbes Infect,2000,2(8):965-972
[9]Galan J E,Timoney J F.Cloning and expression in Escherichia coli of a protective antigen ofErysipelothrixrhusiopathiae[J].Infect Immun,1990,58(9):3116-3121.
[10]Makino S,Yamamoto K,Murakammi S,et al.Properties of re-peat domain found in a novel protective antige,SpaA ofErysipelothrixrhusiopathiae[J].Microbial Pathogene,1998,25(2):101-109.
[11]Shimoji y,Mori Y,Foscjetti V A.Immnological characterization of a protective antigen ofErysipelothrixrhusiopathiaeidentification of the region responsible for protective immunity[J].Infect Immun,1999(67):11646-1651
[12]Imada Y,Goji N,Ishikawa H,et al.Truncated surface protective antigen(SpaA)ofErysipelohrixrhusiopathiaeserotype 1aand 2bin pigs[J].Infect Immun,1999,67(9):4376-4382.
[13]晏鹏飞,苏幼红,赵银霞,等.猪丹毒杆菌C43150株表面保护性抗原 A的免疫功能区分析[J].新疆农业科学,2010,47(6):1224-1230.
[14]Marani P,Wanger S,Baars L,et al.NewEscherichiacoliouter membrane proteins identified through prediction and experimental verification[J].Protein Sci,2006,15(4):884-889.
[15]Sette A,Fikesy J.Epitope-based vaccines:an update on epitope identification,vaccine design and delivery[J].Curr Opin Immunol,2003(15):461-470.

