韩国透明质酸类填充剂产品发展趋势及对我国的影响
张建民, 骆 叶, 冯 莺, 朱全超
1.上海昊海生物科技股份有限公司,上海 200000
2.天津医科大学,天津 300000
3.广州中医药大学,广东 广州 510032
4.邵逸夫医院整形外科,浙江 杭州 310026
韩国透明质酸类填充剂产品发展趋势及对我国的影响
张建民1, 骆 叶2, 冯 莺3, 朱全超4
1.上海昊海生物科技股份有限公司,上海 200000
2.天津医科大学,天津 300000
3.广州中医药大学,广东 广州 510032
4.邵逸夫医院整形外科,浙江 杭州 310026
预计2013年到2020年全球面部微整市场仍将以每年11.63%的复合增长率速度发展,其中面部填充剂产品将从12亿美元增加到27亿美元,年复合增长率12.28%。近年来韩国的非手术面部微创美容设备及材料得到了快速发展,透明质酸类填充剂产品的发展同样毫不例外。
透明质酸 填充剂 透明质酸类填充剂 韩国
1.概述
尽管韩国是传统整形的领头羊,但随着世界整形美容微创设备及生物材料应用技术的不断发展,韩国在非手术微创整形设备及材料的开发生产应用上也有了很大发展。除了在面部年轻化设备的开发应用上具有很大优势,近年透明质酸软组织填充剂的开发生产应用同样得到了快速的发展。
2.韩国透明质酸类软组织填充剂市场状况
2.1 韩国非手术注射美容市场
ISAPS统计资料显示:2014年韩国整形美容总量为98.03万例,其中手术整形44.06万例,较2010年增长77.36%。2014年韩国非手术整形数量为53.97万,较2010年增长90.71%,增长远高于美国市场(34.59%)。2014年韩国非手术整形美容总量中注射美容数量为45.49万例,其中神经毒素类肉毒素注射数量为27.57万例,占非手术总量半壁有余,较2010年增长183.50%,软组织填充类透明质酸注射数量为17.92万例,占非手术总量的11.09%,较2010年增长199.53%。
2.2 韩国KFDA批准软组织填充剂状况(1999-2015.4)
KSAPS资料显示:自1999年到2015年4月韩国KFDA共批准有112个品规的软组织填充剂。其中可吸收材料105个占93.80%,不可吸收材料7个占6.20%。可吸收材料中透明质酸类88个占83.81%,非透明质酸类17个占16.19%。112个品规中,进口品规75个占66.96%,韩国国产品规37个占33.04%。在整个软组织填充剂产品中透明质酸类产品占总比例的77.68%。在韩国KFDA批准的整个透明质酸类填充剂中进口产品有58个品规占65.91%,韩国国产30个品规占34.09%。
2.3 韩国KFDA批准上市的透明质酸类产品
1999-2008年十年间韩国KFDA批准有12个品规的软组织填充剂除两个不可吸收及一个类透明质酸类产品外,共有9个分别来自现美国艾尔建公司的乔雅登(Juvederm)系列,现法国高德梅瑞典Q-Med分公司的瑞蓝(Restylane)系列,德国默兹公司的Belotero系列等。
2009-2010年KFDA相继批准德国Adoderm公司Varioderm系列,瑞士Teoxane 公司Teosyal系列,美国Anika公司的Elevess,法国 Vivacy公司Stylage系列,法国高德美的Emervel Touch,法国Obvieline公司Perfectha系列,加拿大 Prollenium医疗技术公司的Revanesse系列等共25个品规,其中包括Radiesse(微晶瓷,羟基磷灰石)及Sculptra(L-聚乳酸)。2010年KFDA批准了第一个韩国LG生命科学的Yvoire classic,这对韩国的透明质酸类填充剂来说应该是具有标志性的发展节点。
2011-2014年是韩国透明质酸类填充剂发展最快的4年。共批准有26个品规的韩国透明质酸类产品品规及28个进口的透明质酸类产品品规。
2.4 韩国透明质酸类软组织填充剂市场分布及发展趋势
2013年韩国进口透明质酸类填充剂产品市场占有为 63.6%,而韩国国产透明质酸类填充剂产品市场占有为36.4%[1]。2013年韩国整个透明质酸类填充剂市场TOP5分别为:法国高德梅分公司Q-Med瑞蓝(Restylane)及法国高德梅公司的爱美薇(Emervel)系列,销售额188亿韩元占24%;韩国LG生命科学产品伊婉系列,销售额120亿韩元占15%;韩国Humedix公司的艾莉薇系列,销售额65亿韩元占8%;美国艾尔建公司的乔亚登系列及法国Obvieline公司的Perfectha系列分别占6%。
2009-2013年韩国透明质酸类填充剂发展趋势我们可以清晰的看到:韩国生产的透明质酸类填充剂年复合增长率达到了178.26%,韩国进口及出口透明质酸类填充剂产品的年复合增长率分别为26.33%和119.14%。于此同时透明质酸类填充剂的出口也得到了快速的发展,韩国的透明质酸类填充剂主要出口到了中国。而韩国产品在我国批准上市的第一个产品是在2013年7月。2012年是韩国透明质酸类填充剂发展最快的一年:韩国生产及出口透明质酸类填充剂12VS11分别爆发性增长了244.69%及269.25%,2013年韩国生产及出口透明质酸类填充剂仍保持着强劲快速的发展(2013年同比2012年分别增长为68.75%及57.89%)[2,3]。(见图1,2)
预计2013年到2020年全球面部微整市场仍将以每年11.63%的复合增长率速度发展,其中面部填充剂产品将从12亿美元增加到27亿美元,年复合增长率12.28%[4]。韩国透明质酸类填充剂市场的发展同样可期。
3.韩国透明质酸类软组织填充剂及相关产品介绍
在我国韩国透明质酸类填充剂产品系统介绍很少[5],我们将较系统简单介绍韩国的透明质酸类软组织填充剂,以此来帮助我们的医师及患者对自己所使用或被使用的产品有一个较清晰的认知。
3.1 韩国透明质酸类软组织填充剂
3.1.1 韩国LG生命科学(LGLife Sciences,Ltd)公司Yvoire系列
韩国LG生命科学成立于2002年,是LG集团为培育生命科学以及实现股东价值最大化而实行多元化战略所成立的专门从事生命科学的企业。LG生命科学的研发能力与技术主要专注于医药、兽药、精细化学品等领域。LG生命科学的透明质酸类产品有用于骨关节炎的Hyruan和HyruanPlus,用于眼科手术的Hyal 2000和Hyal Plus及用于外科防粘连的Protescal。透明质酸类皮肤填充剂开发有HESH专利技术,BDDE交联。Yvoir系列中的Yvoire Classic于2010年7月首获KFDA批准上市。产品规格:Yvoire Hydro(1×1ml,20 mg/ml,30G BD,非交联,2009上市),Yvoire Classic(1×1ml,22 mg/ml,27G & 30G,颗粒450μm,疗效12-18个月,2010上市),Yvoire Volume(1×1ml,22 mg/ml,27G,颗粒900μm,疗效12-18个月,2011上市),Yvoire Classic S(1×1ml,22 mg/ml,27G & 30G,颗粒450μm,疗效12-18个月,2011上市),Yvoire Volume S(1×1ml,22 mg/ml,27G,颗粒900μm,疗效12-18个月,2012上市),Yvoire Volume Plus(1×1ml,22 mg/ml,27G,颗粒900μm,疗效12-18个月,2013上市),Yvoire Classic Plus(1×1ml,22 mg/ml,30G&27G,颗粒450μm,疗效 12-18个月,2013上市),Yvoire Contour(1×2ml,22 mg/ml,21G,颗粒1400μm,疗效12-18个月,2013上市),Yvoire Contour Plu(1×1ml,22 mg/ml, 21G,颗粒1400μm,疗效12-18个月,2013上市)。
3.1.2 韩国BNC(BNCKOREA,Int.)公司酷婕(Cutegel)系列
韩国BNC公司成立于2007年。2008年公司经韩国KFDA验收通过GMP认证。2009年公司成立皮肤填充剂研究开发中心,2010年公司研发的透明质酸类皮肤填充产品酷婕(Cutegel)获韩国KFDA批准在韩国高丽大学医学院及峨山医疗中心开始临床研究。2011年10月完成临床研究,同年12月获得KFDA批准上市。酷婕(Cutegel)采用发酵高品质透明质酸原料经BDDE交联而成,产品浓度都为20mg/ml,产品规格:Cutegel Aqua S(1×0.9ml,31G,疗效至少3个月),Cutegel S(1×0.7ml,30G,疗效6-12个月),Cutegel(1×1ml,27G,疗效6-12个月),Cutegel Max(1×1.1ml,23G,疗效至少12个月),Cutegel Ultra(1×2ml,23G,疗效至少12个月),Cutegel Strong(1×3ml,23G,疗效至少12个月)。Cutegel系列已经出口全球,在国外商品名分别为Juveni,Aespira,Arvie。
3.1.3 韩国JW-Shinyak Inc集团茱丽菲(Juvenafill)系列
韩国JW Shinyak集团成立于2011年,前身为Jeongmo Pharmaceutical Inc公司(1990年被JW Pharmaceutical公司收购),集团总部位于首尔。集团产品主要专注于皮肤科,泌尿科及耳鼻喉科。集团名下拥有JW Pharmaceutical、JW Holdings、JW Life Science、JW Medical、JW Industrial等数十家子公司。JW Pharmaceutical拥有透明质酸类填充剂产品Juvenafill系列,2011年获KFDA批准上市。系列产品采用BDDE交联剂,产品规格:Juvenafill N(1×1ml),Juvenafill Max(1×1.1ml),Juvenafill Max 1400(1×1.1ml)。
3.1.4 韩国凯健(CaregenCo.,Ltd)公司Revofil系列
韩国凯健(CaregenCo.,Ltd)公司成立于2001年,是一家仿生肽和生长因子研究开发、生产和营销的企业,公司通过ISO9001:2000和14001体系认证。凯健公司是世界上第一个在PCPC注册生长因子的企业,在世界范围申请拥有很多开发的仿生肽专利,能提供客户定制加工所需求的仿生肽产品,并为跨国公司和药妆生产企业提供原料。公司同时生产专业皮肤护理产品及日常肌肤护理产品。公司新开发有透明质酸类皮肤填充剂Revofil系列,2011年KFDA批准上市。凯健公司皮肤护理产品系列Dermaheal,Renokin及刚上市(2012年通过CE认证)的皮肤填充剂Revofil系列在世界100多国家销售。Revofil系列采用长效多肽复合技术,交联剂:BDDE。产品规格:Revofil Fine(23mg/ ml,1×1ml,30G,疗效10个月),Revofil Plus(23mg/ml,1×1ml,27G,疗效12个月),Revofil Ultra(23mg/ml,1×1ml,27G,疗效12个月),RevofilAquashine(15mg/ml,1×2ml,32G 1/2,疗效4周,非交联)。
3.1.5 韩国Haifeel KoreaCo.,Ltd公司Haifeel系列
韩国Haifeel公司的法定代表人是韩国微整形专家林钟学博士,该公司的主要产品透明质酸填充剂Haifeel系列的专利号为PCT/KR2011/006443,BDDE交联。产品于2011年获KFDA批准上市。其中Haifeel Aqua是用于水光注射(配合水光针仪器Jetaplus使用),其余型号用于注射填充。产品规格:Haifeel Aqua(20mg/ml,1×1ml,31G,疗效3-6个月),Haifeel S(20mg/ml,1×1ml,30G,疗效6个月),Haifeel(20mg/ml,1×1ml,27G,疗效6个月),Haifeel Max(20mg/ml,1×1ml,23G,疗效6个月)。
3.1.6 韩国Humedix公司Elravie(艾莉薇)系列
Humedix公司为韩国制药企业Huons集团的子公司,成立于2003年6月,是韩国第一家研发透明质酸的企业。Huons为韩国最大透明质酸原料生产企业,旗下有多家子公司,年销售额4亿美元,出口额达3500万美元,透明质酸原料出口至欧美等多个国家。艾莉薇是韩国Humedix生产的注射用交联透明质酸钠凝胶,采用HDRM技术,BDDE交联。2012年艾莉薇系列获KFDA批准在韩国上市,2014年5月8日艾莉薇系列获韩国最高科技大奖之一的“蒋英实科学文化奖”。2015年Elravie deep在中国获CFDA许可上市。产品规格:Elravie light(20mg/ml,1×1ml,30G,疗效6个月),Elravie deep line(23mg/ml,1×1ml,27G,疗效6-9个月),Elravie deep line-L(23mg/ml,2×1ml,27G,疗效6-9个月),Elravie ultra volume(23mg/ ml,1×1ml,23G,疗效12-18个月),Elravie ultra volume-L(23mg/ml,2×1ml,23G,疗效12-18个月)。
3.1.7 韩国东国制药(DongkookCo., Ltd.)公司Bellast系列
韩国东国制药公司(DongkookCo., Ltd)成立于1968年,已有47年的历史,位于首都首尔。主要从事医药保健美容产业。公司最初从事于研发生产日化线护肤品,后逐渐发展为世界十大化妆品集团之一。东国制药同时是韩国第一家生产功能性保健品的公司。东国制药集团一直坚持自然美理念,致力实现每个人追求美丽的梦想。2012年公司的透明质酸类填充剂Bellast系列获KFDA批准上市。产品采用HCXL技术,交联剂BDDE。产品规格:Bellast(20mg/ml,1×1ml或1×0.6ml,27G 1/2,疗效6个月,2012上市),Bellast L24(24mg/ml,1×1ml或1×0.6ml,27G 1/2,疗效6个月,2014上市),Bellast Soft(18mg/ml,1×1ml或1×0.6ml,30G 1/2,疗效6个月,2014上市)。
3.1.8 韩国艾克洛斯(AcrossCo., Ltd.)公司Revolax(维诺斯)系列
韩国艾克洛斯成立于2009年,是一家具有从事药品和医疗器械生产经验的企业,公司拥有专业成熟的生产工艺技术及专有特殊的生产技术。公司自成立以来,不断投资于药妆,医疗器械,药品和保健食品的研制。该公司透明质酸填充剂Revolax系列2013年获KFDA批准上市。已在全球市场上市,在欧洲其商品名为Dermarn,由BCOSMEDI公司分销。产品采用BDDE交联剂,产品规格:Revolax(20mg/ml,1×1ml,30G,疗效8-12个月),Revolax Fine(20mg/ml,1×1ml,30G,疗效8-12个月),Revolax Deep(24mg/ml,1×1ml,27G,疗效12-18个月),Revolax Sub-Q(24mg/ ml,1×1ml,27G,疗效12-18个月),Revolax Fine利多卡因(20mg/ml,1.1×1ml,30G,疗效8-12个月),Rveolax Deep 利多卡因(24mg/ml,1.1×1ml,27G,疗效12-18个月),Revolax Sub-Q利多卡因(24mg/ ml,1.1×1ml,27G,疗效12-18个月)。
3.1.9 韩国麦迪奥斯(Medytox Inc.)公司 Neuramis系列
韩国麦迪奥斯是一家成立于2000年的生物医药研发生产企业,公司主要研究开发、生产A型肉毒杆菌毒素复合产品及注射美容皮肤填充剂类产品。由于该公司具有出色的研发能力、最先进的生产设施,正在全球医药市场建立起自己形象品牌。2006年肉毒素产品Meditoxin(100U)通过KFDA批准上市。2009年公司在KOSDAQS上市。目前正在开发新一代的肉毒杆菌毒素产品。公司产品销往世界各地约40多个国家。
2008年公司研究开发出注射美容皮肤填充剂产品Neuramis系列,产品采用SHAPE技术,交联剂BDDE。2011年Neuramis通过CE 认证进入欧洲市场。并获KFDA批准在韩国进入临床研究。Neuramis系列产品于2013年陆续上市。产品规格:Neuramis Deep(20mg/ ml,1×1ml,27G,疗效12个月,2013上市),Neuramis Light Lidocaine(20mg/ml,1×1ml,30G,维持时间8-10个月,2014上市),Neuramis Lidocaine(20mg/ml,1×1ml,30G,疗效8-10个月,2014上市),Neuramis Deep Lidocaine(20mg/ml,1×1ml,27G,疗效12个月,2014上市),Neuramis Volume Lidocaine(20mg/ml,1×1ml,27G,疗效12-18个月,2014上市)。
3.1.10 韩国AesturaCo.,Ltd公司Cleviel系列
韩国Aestura公司前身为爱茉莉太平洋集团旗下主要子公司太平洋制药公司,2015年更名为Aestura公司。公司主要基于医院渠道通过专家提供的拥有创新技术的美容解决方案,围绕“医疗美容医院”事业和“医院专业皮肤护理”事业,开展着抗皱、药妆、肥胖、美发、皮肤护理等5个领域的核心事业。旗下代表品牌包括:医疗美容专业化妆品“AESTURA”、高密HA填充剂“Cleviel”和手术用医疗仪器“Innojector”等。透明质酸类填充剂Cleviel采用4L技术,BDDE交联剂,产品规格:Cleviel Volume(50 mg/ml,2×1ml,27G 1/2,25G,疗效12-15个月,2014上市),Cleviel Contour(50 mg/ml,1×1ml,28G,疗效18个月,2014上市),Cleviel Prime(33mg/ ml,2×1ml,疗效12-15个月,2015上市)。
3.1.11 韩国查生物迪奥斯技术(Cha Bio & Diostech Co., Ltd.)公司HyaFilia系列
韩国查生物迪奥斯技术公司(Cha Bio & Diostech)成立于2000年位于首都首尔,主要从事光学镜和生物医药产业。公司前生为迪奥斯技术公司(Diostech Co.,Ltd),2009年变更为查生物迪奥斯技术公司业务涉足生物医药领域。HyaFilia系列为公司的注射美容皮肤填充剂产品,2014年获KFDA批准上市。产品采用BDDE交联剂,维持时间在6-12个月,产品规格:HyaFilia Petit(20mg/ml,1×1ml/2ml/3ml,27G, 29G,颗粒200μm),HyaFilia(20mg/ml,1×1ml/2ml/3ml,27G, 29G,颗粒500μm),HyaFilia Grand(20mg/ml,1×1ml/2ml/3ml,27G, 29G,颗粒1100μm)。
3.1.12 韩国新基因(NeoGenesis Co., Ltd)公司Regenovue系列
新基因(NeoGenesis Co., Ltd)公司成立于2012年,总部位于韩国首尔,主要涉足医疗器械与细胞治疗领域。该公司的透明质酸类填充剂Regenovue系列于2014年获得KFDA批准上市,产品采用了特殊专有交联技术。交联剂:BDDE,产品规格:Regenovue Fine/Fine Plus(20mg/ml,1×1.1ml,30G,维持时间8-12个月),Regenovue Deep/Deep Plus(24mg/ml,1×1.1ml,27G,维持时间12-18个月),Regenovue Sub-Q/ Sub-Q Plus(24mg/ml,1×1.1ml,27G,维持时间12-18个月)。
3.1.13 韩国吉诺斯(Genoss Co., Ltd )公司蒙娜丽莎(Monalisa)系列
韩国吉诺斯公司(Genoss Co., Ltd )成立于2004年,总部位于水原市,该公司主要涉足于心脏科,整形外科和牙科设备领域,致力于成为全球领先的医疗器械公司。该公司透明质酸填类充剂蒙娜丽莎(Monalisa)系列于2014年5月获批。产品采用交联剂:BDDE,产品规格:Monalisa HAF10S(20mg/ml,1×1ml,颗粒200 μm),Monalisa HAF10M(20mg/ ml,1×1ml,颗粒400μm),Monalisa HAF10H(20mg/ ml,1×1ml,颗粒600μm)。
3.1.14 韩国生物佳(BioPlusCo.,Ltd)公司SkinPlus-HYAL系列
韩国生物佳公司(BioPlusCo.,Ltd)成立于2009年,位于首都首尔,主要从事医药保健美容行业。SkinPlus-HYAL产品突破了现有透明质酸交联技术的限界,在透明质酸中不掺任何添加物的基础上以多级交联的方式提高了交联度,效果可维持5年。该产品的特殊交联技术MCL已获得了专利。SkinPlus-HYAL于2009年3月在首尔大学医院完成了临床实验,2014年7月获得了CE认证,2014年11月获KFDA批准上市,已在日本的几家医院具备5年多的临床经验。产品采用的交联剂:BDDE,产品规格:Skin Plus-Hyal Hard(20mg/ml,2×1ml,23G,疗效60个月),Skin Plus-HyalSemiHard(20mg/ml,2×1ml,26G,疗效60个月),Skin Plus-Hyal soft(20mg/ml,2×1ml,29G,疗效60个月),Hyal Dew 200(20mg/ ml,2×1ml,31G,疗效60个月),Deneb 200(20mg/ ml,2×2ml,31G,疗效60个月)。
3.1.15 韩国雨果(Hugel Pharma)公司Chaeum系列
韩国Hugel Pharma制药公司是一家集研发生产销售一体的微整形医疗器械公司,专注于抗衰老领域产品研究,致力于开发出世界上最佳的抗衰老产品。该公司主要产品是韩国销售第二,日本销售第一的肉毒毒素Botulax。公司开发生产的透明质酸类填充剂Chaeum系列于2014年获KFDA批准上市。产品采用BiHEXA专利技术,交联剂:BDDE,产品规格:Chaeum NO.1(24mg/ml,2×1ml,30G 1/2),Chaeum NO.2(20mg/ml,2×1ml,27G 1/2),Chaeum NO.3(20mg/ml,2×1ml,25G 1/2),Chaeum NO.4(20mg/ml,2×1ml,22G 1/2),Chaeum Mid 20A(20mg/ml,2×1ml,30G),Chaeum Deep 20A(20mg/ ml,2×1ml,27G),Chaeum Sub-Q 20A(20mg/ ml,2×1ml,25G),ChaeumVolus 20A(20mg/ml,2×1ml,23~21G)。Chaeum系列产品出口欧洲国家的商品名为HyalSense和Dermalax。公司还有生产有面膜(B'BIND),美容医疗器械(LED面具),蛋白线(BLUE ROSE),睡眠面膜和PP Cream(WELLAGE)。
3.1.16 韩国大熊制药( CGBioCo.,Ltd)公司Danae系列
大熊制药股份有限公司创建于1945年,总部位于韩国首尔,在韩国处方药市场长期居于首位。该公司拥有注射美容产品肉毒毒素Nabota(俗称绿毒)。透明质酸填充剂产品Danae系列于2014年底通过了KFDA认证上市。产品采用R-Square技术,交联剂:BDDE,产品规格:Danae Original(20mg/ml,1×1ml,1×30G 1/2 ,1×27G 1/2,疗效6-9个月),Danae Line(20mg/ml,1×1ml,2×27G 1/2,疗效9-12个月),Danae Contour(20mg/ml ,1×1ml,1×22G,1×27G 1/2 ,疗效12-15个月)。
3.1.17 韩国大韩新药业( Daehan New Pharm Co.,Ltd )有限公司拉菲尔(La-fillere)系列
大韩新药业有限公司成立于1984年,总部设在首尔,该公司提供两大类产品:人用药品和动物医药产品。该公司专注于骨科、泌尿科、消化科、精神神经科等的药物研发。公司的透明质酸类填充剂拉菲尔(La-fillere)系列于2014年3月获KFDA批准上市,成为该公司的主要产品。产品采用BDDE交联,产品规格:La-fillere(20mg/ml,1×1ml,颗粒400μm,27G),La-fillere Max(20mg/ml,1×1.1ml,颗粒800 μm,23G)。
3.1.18 韩国SCL Co., Ltd公司威雅士(Viearchee)系列
韩国Sung Comnet公司是一家以采购为主的公司,成立于1992年,总部位于韩国首尔。该公司透明质酸类皮肤填充剂Viearchee系列分别于2014年2015年获KFDA批准上市。产品采用BDDE交联,产品规格:Viearchee Volume S(24mg/ml,1×1ml,27G,疗效6-12个月,上市2014),Viearchee N Classic(24mg/ ml,1×1ml,30G,疗效6-12个月,上市2014),Viearchee A Retouch(24mg/ml,1×1ml,30G,疗效6-12个月,上市2014),Archeede(24mg/ml,1×3ml/5ml/10ml,23-25G,疗效6-12个月,上市2014),Boaderm N(24mg/ml,1×1ml,27G,疗效6-12个月,上市2015),Boaderm SubQ(24mg/ml,1×1ml,30G,疗效6-12个月,上市2015)。
3.1.19 韩国PRONEXX. Inc公司优妮薇洛(Univelo)和睿穆德(Remodeler)系列
韩国PRONEXX公司总部位于首尔,成立于1999年。2014年与VELTISTON集团合并为现在的PRONEXX公司, 开始专注于医学美容事业领域。2014年推出了透明质酸填充剂优妮薇洛(Univelo)和睿穆德勒(Remodeler)系列。产品采用SPLENDOR技术生产,交联剂:BDDE,产品规格:Univelo Sub-Q Plus(24mg/ml, 1×1.1ml,27G,疗效12-18个月,上市2014),Univelo Deep(24mg/ml,1×1.1ml ,27G,疗效12-18个月,上市2015),Univelo Fine(24mg/ ml,1×1.1ml,27G,疗效12-18个月,上市2015)。
3.1.20 韩国L&C BIO公司Megafill HA系列
韩国L&C生物公司成立于2011年。2012年推出了MegaDerm,MegaFill等系列,其中MegaDerm是通过捐赠的人体皮肤组织用AlloClean™技术加工的产品,主要应用于乳房重建、烧伤治疗、鼻整形、腹壁重建,防止粘连。MegaFill是粉碎MegaDerm而制成的产品,主要成分是胶原蛋白,弹性蛋白,蛋白质,蛋白聚糖等,可以用于增加脸部,胸部和臀部立体感,声带注射术等。MegaFill HA则是该公司的透明质酸类皮肤填充剂,2014年获KFDA批准上市。产品使用交联剂:BDDE,规格:1×2ml/3ml/4ml(20mg/ml),维持时间6个月。
3.1.21 韩国桑曼(SHAMMAHCo.,Ltd)集团海伦(Helene)系列
韩国桑曼公司成立于2011年11月,主要从事医用耗材的出口贸易,总部位于首尔。该公司推出的透明质酸类填充剂海伦系列于2015年获KFDA批准上市。产品采用微粒交联技术,交联剂:BDDE,产品规格:Helene All(20mg/ml,1×1ml,27 1/2G或23G,疗效24-36个月),Helene Smooth(20mg/ml,1×1ml,30G½,疗效24-36个月),Helene Shine(20mg/ ml,1×2ml,31G/32G,疗效24-36个月)。
3.1.22 韩国欧仁生命科学(Oreon Life Science - AezianCo.,Ltd)公司阿嘉可思(Ajax)/丽珍(Rejeunesse)系列
韩国Oreon生命科学是一个具有特色抗衰老及医学美容产品的企业,成立于2000年。该司拥有完整的产品组合,包括彩虹主题,KMC-EGF活肤精华,壳聚糖面膜,皮肤软组织填充剂和护肤用品。2008年成立子公司艾森公司(Aezian Co.,Ltd),从事新产品的销售与引进国外产品。
2015年4月欧仁生命科学推出了透明质酸填充剂阿嘉可思(Ajax)系列,该产品特点是富含维生素A的透明质酸类填充剂,产品规格:Ajax Vivid(20mg/ ml,1×1.1ml,27G,疗效12-18个月),Ajax Subline(20mg/ml,1×1.1ml,27G,疗效12-18个月),Ajax Cozy(20mg/ml,1×1.1ml,27G,疗效12-18个月)。同年8月该公司另一个透明质酸填充剂丽珍(Rejeunesse)通过了KFDA的认证。丽珍(Rejeunesse)系列由新梅迪奇(New Medic Co.,Ltd)公司负责海外的出口。产品采用3L-Cross技术,交联剂:BDDE,产品规格:Rejeunesse Sparkle(18mg/ml,1×1.1ml,30G,疗效1-3个月),Rejeunesse Fine(1×1.1ml,24mg/ml,30G,疗效8-12个月),Rejeunesse Deep(24mg/ ml,1×1.1ml,27G,疗效12-18个月),Rejeunesse Shape(24mg/ml,1×1.1ml,27G,疗效12-18个月)。
3.1.23 韩国完美创新( BR Beautiful Revolution Co., Ltd.)公司Revitrane/Hyalécht系列
韩国完美创新公司总部位于韩国首尔。该公司不断研究及临床试验结果显示:皮肤疾病是由于皮肤结构异常引起的,而人类的皮肤有着自我恢复和重建的惊人自愈能力。 根据这一发现,韩国完美创新公司研究和开发了许多产品,PDRN类注射美容针剂Rejuran(婴儿针)就是其中产品之一。
公司具有10多年各种新型皮肤组织修复材料(抗皱填充剂)的研究经验,其中开发的透明质酸皮肤填充剂Revitrane系列于2015年通过了KFDA的认证,该系列产品采用了BDDE交联技术,产品中添加了利多卡因。产品规格:Revitrane HA 1.0 (classic)(1×1ml),Revitrane HA 1.0(volume)(1×1ml),Revitrane HA20 (3×2ml)。Revitrane系列通过韩国达吉医疗公司( Daejin MedicineCo.,Ltd)重新包装,定名为韩雅丽(Hyalécht)系列透明质酸填充剂出口。2015年达吉医疗公司与中国DZL公司签订了韩雅丽(Hyalécht)系列(Hyalécht Classic及Hyalécht Volume,规格:1×1ml ,交联剂:BDDE,2015年KFDA获批)的独家销售合同,目前正在进行CFDA与CE认证。Hyalécht(规格:3×2ml)是水光针专用产品。
3.1.24 韩国迪美(D.medCo., Ltd)公司Vinci Filler系列
韩国迪美(D.medCo., Ltd)公司成立于1980年9月10日,总部在韩国首尔,其使命是向世界各地提供高品质且具有价格竞争力的医疗设备,使医疗服务更容易获得和负担得起。目前,该公司在脊柱重建设备,防粘性凝胶,椎体压缩性骨折植入物,压力性尿失禁的植入物,阴道植入五个产品领域提供超过180种产品,在纽约和加利福尼亚州均设立了办事处。透明质酸类填充剂Vinci系列于2015年获KFDA批准上市。产品交联剂:BDDE,规格:Mono(20mg/ml,1×1ml),Vinci Line(20mg/ml,1×1ml,颗粒200-300μm),Vinci Bold(20mg/ml,1×1ml,颗粒400-500μm),Vinci Plus(20mg/ml,1×1ml,颗粒700-800μm),Vinci Grande(20mg/ml,1×1ml,颗粒1000-1200μm)。
3.2 韩国非透明质酸类软组织填充剂产品
目前韩国生产的非透明质酸类软组织填充剂主要有:胶原蛋白(Collagen)类,Therafill(2010上市),Cartifill(2014上市),Novofill;己内酮(PCL)类,Ellanse系列(进口,2012上市),GanaFill;聚乳酸(PDLA)类,Sculptra(进口,2010上市),Aesthefill (2014上市);羟基磷灰石(CaHA)类:Radiesse(进口,2010上市),HY100P24/1(Hyaline,进口,2014上市),Facetem;多聚脱氧核苷酸(PDRN)类:Rejuran(리쥬란,2014上市);聚甲基丙烯酸甲酯(PMMA)类:Artesense(进口,1999上市),Artefill(进口,2013年上市),Aquamid(进口,2012上市),Licol P和Lipen P(2012上市);葡聚糖(Dextran)类,Licol D和Lipen D(2012上市)。其他:Perform(进口,4%交联聚烷基酰亚胺聚合物,2007上市),Bioinblue(进口,聚乙烯醇,2010上市),Aquafilling Faceline(进口,2%的共聚多酰胺,2013上市)。
3.2 韩国非透明质酸类软组织填充剂产品
目前韩国生产的非透明质酸类软组织填充剂主要有:胶原蛋白(Collagen)类,Therafill(2010上市),Cartifill(2014上市),Novofill;己内酮(PCL)类,Ellanse系列(进口,2012上市),GanaFill;聚乳酸(PDLA)类,Sculptra(进口,2010上市),Aesthefill (2014上市);羟基磷灰石(CaHA)类:Radiesse(进口,2010上市),HY100P24/1(Hyaline,进口,2014上市),Facetem;多聚脱氧核苷酸(PDRN)类:Rejuran(리쥬란,2014上市);聚甲基丙烯酸甲酯(PMMA)类:Artesense(进口,1999上市),Artefill(进口,2013年上市),Aquamid(进口,2012上市),Licol P和Lipen P(2012上市);葡聚糖(Dextran)类,Licol D和Lipen D(2012上市)。其他:Perform(进口,4%交联聚烷基酰亚胺聚合物,2007上市),Bioinblue(进口,聚乙烯醇,2010上市),Aquafilling Faceline(进口,2%的共聚多酰胺,2013上市)。
4.韩国KFDA批准上市及未批准上市产品在我国市场上的状况
4.1 韩国KFDA批准上市产品获CFDA批准在我国市场上的状况
目前我们CFDA批准有两家韩国公司透明质酸类软组织填充剂:韩国LG生命科学的Yvoire(伊婉)系列中的2个品规,国内代理为华东医药宁波有限公司,韩国Humedix公司的Elravie(艾莉薇)系列中的1个品规,国内注册代理为北京林特医药科技有限公司。共2个品牌3个规格。
2013年7月CFDA批准了韩国LG Life Sciences, Ltd.的注射用修饰透明质酸钠凝胶,商品名:伊婉(规格型号:Yvoire classic s,1ml,22mg/mL)(国食药监械(进)字2013第3462573号(更))。2014年4月CFDA批准了韩国LG Life Sciences, Ltd.的注射用修饰透明质酸钠凝胶,商品名:伊婉(规格型号:Yvoire volume s,1ml,22mg/mL)(国食药监械(进)字2014第3461856号)。2015年1月CFDA批准了韩国HumedixCo.,Ltd.的注射用交联透明质酸钠凝胶,商品名:艾莉薇(规格型号:Elravie Deep Line Plus,1ml,23mg/ml)(国械注进20153460263)。
4.2 韩国注射美容软组织填充剂产品在我国市场上的现状及思考
近年来随着我国CFDA批准的透明质酸类软组织填充剂越来越多,使得整个医疗注射美容市场得到了快速发展,与此同时未经过我国CFDA批准的国外透明质酸类填充剂产品在国内市场也不少,包括韩国KFDA批准及未批准的软组织填充剂产品。
4.2.1 韩国透明质酸类软组织填充剂产品在我国市场
韩国KFDA批准上市的产品(包括韩国进口韩国本国研发生产的)不下百余品规,还有韩国KFDA未批准的(或已获CE认证的)产品。
目前在我国市场可见的未经CFDA批准的韩国产品有不下20个系列(不包括已经批准在我国上市的产品)如:Bellast系列,Neuramis 系列,Cutegel系列 ,Haifeel系列,Rejeunesse系列,Revolax系列,Dermaren系列,MegaFill系列,ArVie系列,Wrinkless系列,HyaFilia系列,HyalDew系列,Regenovue系列,MisFill系列,SkinPlsu-Hyal系列,Monalisa系列,DolceVita系列,Revitrane系列,Hyalecht系列,Aquashine系列,Hydroxell系列,Remodeler系列,Univelo系列等,合计共约23个品牌系列。
4.2.2 非透明质酸类的填充剂
在我国能见到的韩国非透明质酸类填充剂产品有:TheraFill(主要成分:胶原蛋白),主要用于面部填充;Wink Feel(主要成分:葡萄聚糖+PMMA13%),主要用于女性;ButyRis(主要成分:羟磷灰石钙),主要用于面部填充剂;Licol P(主要成分:交联葡聚糖和聚甲基丙烯酸甲酯带利多卡因),主要用于面部填充剂;Aquafilling(主要成分:2%的共聚多酰胺(Copolyamide)主要用于面部及乳房填充(捷克产品韩国渠道进入我国)。
4.3 韩国透明质酸类软组织填充剂产品对我国市场的影响及思考
我国CFDA批准的韩国透明质酸类填充剂产品共2个品牌3个规格,这和市场上见到的韩国众多品规极不相符。上述23个系列韩国产品约70多个品规(按平均每个系列3个规格计),尽管有些品规是韩国KFDA批准的合规产品,但是这些未经CFDA批准的产品进入我国市场根据我国的相关法规都归属不合规的产品。然而市场的渴望及需求是巨大的,如何使这些产品尽快在我国合规流通,这是我国各方监管部门面临的问题及挑战。
从1999-2015年韩国批准的透明质酸类填充剂、2013年韩国透明质酸类填充剂生产、进口及出口的状况,我们可以看出韩国企业对市场顺应的敏感快速及韩国KFDA监管部门对产品市场准入的把控。同时我们注意到韩国KFDA在2011年及2014年批准的产品中有分别来自我国台湾的Hya-Dermis Facial Dermal Implant产品及杭州的HAfiller产品。我国在透明质酸类填充产品生产研发领域有着非常好的公司,希望我国有更多企业的产品进入韩国市场或国际市场,这是我国相关企业面临发展的思考及挑战。
5.结语
非手术注射美容已成为整形美容行业发展的主流趋势,而透明质酸类软组织填充剂产品已成为非手术注射美容发展的主流产品之一,韩国的透明质酸类软组织填充剂及皮肤年轻化设备在亚洲发展的较快,有可借鉴学习之处。深刻了解掌握注射美容软组织填充剂产品的市场及发展动态对推动整个微创整形产业链的健康发展尤为重要。
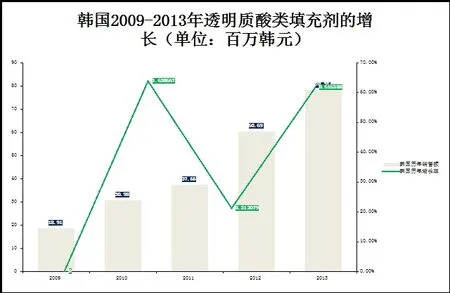
图1 :韩国2009-2013年透明质酸填充剂的增长(单位:百万韩元)
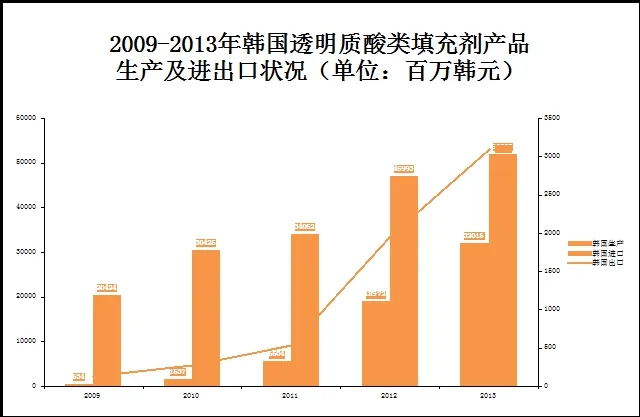
图2 :韩国2009-2013年透明质酸类填充剂产品生产及进出口状况(单位:百万韩元)
[1]보건산업브리프의료기기·IT헬스VOL.32 http:// medicaldevice.khidi.or.kr/
[2] 2015 ISAPS International Survey on Aesthetic/ Cosmetic.
[3] 의료기기 생산·수출·수입 실적 보고자료(2009~2013), 식품의약품안전처.
[4] Facial Aesthetics Market to 2020,GBI Research, 2014.
[5] 张建民 叶君梅 国外透明质酸类皮肤填充剂市场产品介绍(续)[J].中国医疗美容,2012,2(3);70-75.

