3xTg-拟AD小鼠脑内七种时钟基因启动子区甲基化分析
包训杰 蔡彦宁 祝艳秋 杨翠翠 李 林 张 兰*
(1.首都医科大学宣武医院药物研究室,北京100053;2.首都医科大学宣武医院神经生物学研究室,北京100053;3.神经变性病教育部重点实验室,北京100053)
阿尔茨海默症(Alzheimer’s disease,AD)是一种最常见的痴呆类型和精神障碍。据估计我国有600~700万阿尔茨海默症患者,60岁及以上人口的痴呆患病率平均为3.5%。全球大约有4 000万人患有该病,并且患病人数在未来十年里将呈爆炸式增长[1-2]。AD患者中常出现生理节律紊乱,据研究[3-4]报道,在65岁以上的AD患者中超过80%出现过睡眠障碍、体温波动、激素分泌异常以及糖代谢的异常。这些异常,常常出现在疾病的早期,甚至可以成为AD疾病的预测工具或者是AD病理进展的诊断靶标。因此,研究这种生理紊乱意义重大。
哺乳动物的生理节律中枢位于下丘脑视上交叉核,拥有10 000~15 000个神经元[5-6],而在一些外周器官,如肝脏、肾脏和心脏等也存在时钟节律调控点,他们共同控制机体的节律表现[7-8]。其除受一些外界影响如光照外,在分子水平主要由一些时钟基因调控,例如 per1、per2、cry1、cry2、bmal1、bmal2、clock 和 npas2等[9]。这些基因在转录、翻译以及翻译后修饰水平相互作用形成了一个反馈回路,共同影响机体的整体昼夜节律[10]。由于基因转录和蛋白转运入核需要一定时间,生物分子震荡周期正好维持24 h左右。因此,整个生理节律过程可在不同水平、不同时间点受到影响,而一旦某个点发生改变,可能会引起整个网络的改变,最终使患者发生各种各样的生理紊乱现象。
DNA启动子区甲基化是一种重要的表观遗传学修饰手段[11],其可影响基因的表达水平,通常在多种癌症的发病机制中扮演重要角色[12]。有研究[13]表明CpG岛的高度甲基化可影响时钟基因的转录。那么,AD疾病所引起的生理紊乱就有可能是DNA启动子甲基化所引起的。
在本实验中,笔者采用了3xTg小鼠,通过将APPSwe和tauP301L同时显微注射进PS1M146V基因敲入小鼠的单细胞胚胎中,得到的携带APPSwe、tauP301L、PS1M146V基因的三重转基因小鼠[14]。3xTg-AD小鼠的神经病理学发生的区域-时程模式十分近似地模拟了AD,而且出现AD的主要病理学变化——Aβ沉积和神经纤维缠结,同时伴随突触丢失、神经元死亡等,并且出现昼夜体温变化和活动规律异常。
1 材料和方法
1.1 材料
TIANamp Genomic DNA Kit,50 bp DNA Maker(天根生化科技有限公司);Wizard DNA purification resin(Promega,Madison,WI公司,美国);HS Taq 酶(Takara公司,日本);GelGreen(Biotium,CA公司,美国);SssI CpG甲基转移酶(New England Biolab公司,美国)。
1.2 动物
3xTg小鼠从美国Jackson实验室引进,并自行进行繁育,每只小鼠均经过基因型鉴定,饲养于中国医学科学院医学实验动物研究所SPF级环境。动物依据体质量进行完全随机分组。分组方法为:用Excel软件给每只小鼠随机编号,编号与每只动物体质量相对应。对编号为1的小鼠产生随机号,并用填充柄拖曳,使所有动物均编上不同的随机号,通过复制和选择性粘贴对数值加以固定。对产生的随机号进行递增排序,按照随机号从小到大的顺序,把动物分成实验所需的组数。实验动物分为2组,模型组采用3xTg小鼠15只(雄性8只,雌性7只),14月龄,体质量30~40 g。对照组采用3xTg转基因阴性背景小鼠15只(雄性8只,雌性7只),14月龄,体质量30~40 g。饲养条件:每日光照12 h,黑暗12 h,室温23℃,任意摄取水食。相同时间全部处死后,取小鼠新鲜脑组织-80℃冻存待用。实验全过程对动物的饲养与取材均遵守实验动物管理与保护的相关政策和规定。
1.3 基因组DNA提取与亚硫酸氢盐处理
基因组DNA的提取按照TIANamp Genomic DNA Kit说明书进行。取小鼠下丘脑组织,加入600 μL裂解液匀浆10 000 r/min离心1 min。本实验洗脱液TE的量为50 μL,-80℃保存。使用偏重亚硫酸氢钠和对苯二酚对基因组DNA进行处理。通过该处理,未甲基化的胞嘧啶转化为尿嘧啶,而甲基化的胞嘧啶保持不变。之后用设计好的两对引物分别扩增甲基化与非甲基化的片段。处理过程如下,1 μg基因组DNA使用0.3 mol/L的NaOH进行变性。而后使用新鲜配置的偏重亚硫酸氢钠(终浓度3.0 mmol/L,pH 5.0)与对苯二酚的混合溶液(终浓度0.5 mmol/L,pH 5.0)与基因组DNA混合,石蜡油覆盖,避光50℃孵育16 h。之后使用Wizard DNA purification resin纯化回收盐处理过的DNA。
1.4 启动子分析及引物设计
时钟基因启动子分析应用在线软件(http:∥www.mspprimer.org/cgi-mspprimer/design.cgi)。分析per1、per2、cry2、clock、npas2、bmal1、bmal2 共 7 个时钟基因启动子区转录起始位点上下游各600 bp长度序列。并用该软件设计时钟基因启动子区MSP引物。由于MSP只能检测引物3区大约3~4个CpG位点,位于引物以外和引物之间的序列不能检测到,因此可能出现假阴性结果。为避免此问题,每个基因设计了2对引物,用于扩增同一启动子区不同的位点。MSP引物见表 1,2。
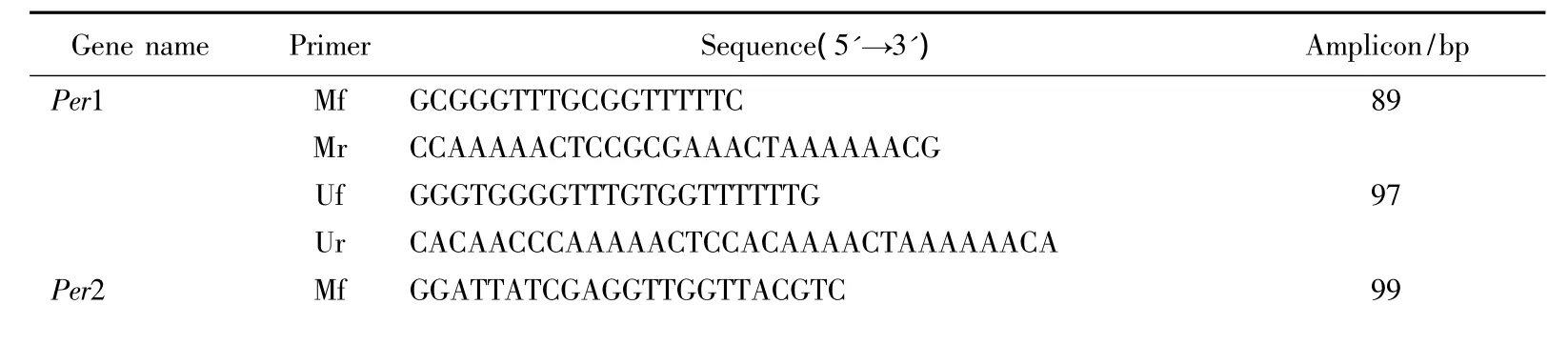
表1 时钟基因启动子甲基化分析第一套引物Tab.1 The first set of primers used for methylation analysis in the promoter of seven clock genes

Mr CGCGAAAAAATAATACTTAACCGCTACG Uf TTGGTTTTTTGGATTATTGAGGTTGGTTATGTTG 115 Ur CTACAACACAAAAAAATAATACTTAACCACTACA Cry2 Mf TTTTCGGTGTATTGGTTTCGTAAAGGATTAC 113 Mr AACCACGAATCGAAAATATAAACGCAACG Uf TGTTTTTGGTGTATTGGTTTTGTAAAGGATTATG 120 Ur CCACAAACCACAAATCAAAAATATAAACACAACA Clock Mf CGTCGGGAGGTAGCGTAATTAC 121 Mr GCACTCACCGAAAACGCG Uf TATGATGTATGTGTTGGGAGGTAGTGTAATTATG 143 Ur CCCAATAAAACACACTCACCAAAAACACA Npas2 Mf CGGAGTTTCGAGATTTCGGC 90 Mr ACCGAAACGACAAACGAACTCG Uf GGTTGTGGAGTTTTGAGATTTTGGTG 105 Ur ACCACAAAAAACCAAAACAACAAACAAACTCA Bmal1 Mf TTTTCGGGCGGGCGTATC 86 Mr CCTTTAAAACCGACAACGAACACG Uf GTGAGTTTTTGGGTGGGTGTATTG 98 Ur CACAAACCCTTTAAAACCAACAACAAACACA Bmal2 Mf TTTTGTTGAGGTTTCGTTCGTGC 163 Mr CCCGACACAATTTCGAAATCTCG Uf GGTTTTGTTGAGGTTTTGTTTGTGTG 176 Ur TATTAAAAACACCCAACACAATTTCAAAATCTCA

表2 时钟基因启动子甲基化分析第二套引物Tab.2 The second set of primers used for methylation analysis in the promoter of seven clock genes
1.5 甲基化特异性聚合酶链反应(methylation-specific polymerase chain reaction,MSP)
偏重亚硫酸氢盐处理的基因组DNA用HS Taq进行扩增。M引物的扩增子是发生甲基化改变的序列,U引物的扩增子是未发生甲基化改变的序列。PCR(polymerase chain reaction)产物用2%琼脂糖凝胶电泳,核酸染料使用GelGreen。为了确定MSP处理的特异性,SssI甲基转移酶处理的基因组DNA作为阳性对照,未经偏重亚硫酸氢盐处理的基因组DNA作为阴性对照。
1.6 统计学方法
采用SPSS 13.0进行数据分析。计数资料采用频数和百分数表示,组间比较采用Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 3xTg-拟AD小鼠脑内时钟基因启动子区甲基化特异条带的扩增
为提高实验的灵敏度和可靠性,笔者应用两套引物分别检测7个主要时钟基因(per1、per2、cry2、clock、npas2、bmal1和bmal2)启动子区甲基化。正常小鼠脑内,7个主要时钟基因启动子区呈非甲基化状态,3xTg拟AD小鼠脑内时钟基因启动子区出现部分甲基化改变。
以clock基因PCR产物电泳结果为例进行说明。如图1所示:M代表甲基化引物扩增子,即clock基因CpG岛发生甲基化的片段;U代表非甲基化引物扩增子,即clock基因CpG岛未发生甲基化的片段。甲基转移酶(SssI)处理的基因组DNA作为阳性对照,其甲基化扩增产物(M)出现在121bp位置,非甲基化扩增产物出现在143bp位置,符合预期。未经盐处理的基因组DNA作为阴性对照,两对引物均未扩增出目的条带。小鼠脑样本若出现和甲基化扩增产物一致的条带,则说明存在甲基化改变;若未出现M扩增产物仅扩增出U条带,说明未发生甲基化改变(图1)。
2.2 3xTg-拟AD小鼠脑内时钟基因启动子区甲基化的改变
检测7个时钟基因启动子区甲基化发现:cry2基因启动子区在转基因阴性小鼠脑内未出现甲基化,而在3xTg-拟AD小鼠脑内甲基化发生率增高至20%(图2,表3)。

图1 Clock基因PCR产物电泳图Fig.1 Methylation analysis of clock promoters
Clock和bmal2基因启动子区甲基化在模型小鼠脑内发生率为6.67%,转基因阴性组未出现甲基化(图2,表 3)。
Per1、per2、npas2和bmal1基因启动子区在3xTg-拟AD小鼠和转基因阴性小鼠脑内均未出现甲基化改变(表3)。
3 讨论
甲基化特异性PCR(MSP)是一种简单快速和经济的检查CpG岛甲基化状态的方法。由于每对引物只能检测3~4个甲基化位点,因此容易出现假阴性结果。为此,除了per1之外,笔者为每个基因设计了2对引物,其中一对针对甲基化的DNA(M)另一对针对非甲基化的DNA(U),用于扩增同一启动子区不同的位点。实验关键步骤——盐处理过程会使DNA降解达90%以上,故初始DNA处理量在1 μg为宜,而小鼠脑组织DNA丰度较低,为实验带来一定困难。
现今,AD治疗手段匮乏,所有针对AD的药物临床实验都以失败告终,而生理节律的异常不仅可以为AD早期诊断提供线索,而且已有研究[15-17]表明,AD引起的生理节律紊乱可反过来加重AD的病情,而重置生理时钟可以改善患者心理及代谢情况,延长患者生命,这成为治疗AD的一个新的靶点[18]。因此,研究时钟网络异常的分子机制就显得十分重要。Cedernaes等[19]研究发现正是bmal1、cry1、per1基因启动子区甲基化修饰引起转录改变是导致患者急性睡眠障碍的原因。Song等[20]报道了时钟基因翻译后水平的调控,他们发现AD的重要病理Aβ沉积可导致时钟网络核心蛋白bmal1和cbp的降解。还有一些大样本量研究[21]中也证实,同样存在生理节律紊乱的帕金森病患者当中,npas2基因的甲基化水平明显低于正常人。

图2 时钟基因PCR产物电泳图Fig.2 Methylation analysis of clock genes using set I primers
在整个时钟基因网络中,clock和bmal1(在有的组织是bmal2)起到核心作用,其转录蛋白clock和baml1可以通过PAS结构域形成异二聚体,结合到per和cry基因启动子E-boxes[CACGTG]上从而调节基因表达。而当per和cry蛋白产生过多又会进入细胞核形成聚集体抑制clock-bmal1调节转录因子形成负反馈环路[22]。同时clock-bmal1异二聚体也激活孤儿受体rev-erbα基因转录,其表达蛋白 rev-erbα可与bmal1启动子结合,阻抑bmal1的转录,如图3。clockbmal1异二聚体还可调控下游的钟控基因[23-24]如 nampt、alas1等。正因为clock与bmal基因的重要性,其表达异常甚至能导致时钟节律地缺失[25]。近年来的研究[26]还显示,cryptochrome(包括 cry1和cry2)的异常或缺失,还可能在机体的学习认知障碍产生中起到作用。

表3 模型小鼠和正常对照小鼠时钟基因启动子区甲基化数量和频率Tab.3 Amount and frequency of methylation in the promoters of clock genes in model group and control group

图3 时钟基因网络示意图Fig.3 The network structure of clock genes
本实验结果显示,在15例AD模型小鼠中发现3例cry2基因,1例clock基因和1例bmal2基因启动子CpG区发生甲基化,而在15例对照小鼠中未发现1例甲基化样本。虽然模型组与对照组并未显示出差异有统计学意义,但模型组甲基化频率高于对照组,且对照组甲基化频率为0。这启示我们,时钟基因启动子区甲基化引起时钟蛋白在转录水平发生变化,进而导致时钟网络异常可能是AD疾病伴随的生理节律紊乱的潜在机制,但需要更大样本量研究证实,这为以后的同类研究提供了一些思路。
[1] 陈传锋,何承林,陈红霞,等.我国老年痴呆研究概况[J].宁波大学学报,2012,34(2):45-49.
[2] Thome J,Coogan A N,Woods A G,et al.CLOCK genes and circadian rhythmicity in Alzheimer disease[J].J Aging Res,2011,2011:383091.
[3] Blazer D G,Hays J C,Foley D J.Sleep complaints in older adults:a racial comparison[J].J Gerontol A Biol Sci Med Sci,1995,50(5):M280-284.
[4] Van Someren E J.Circadian and sleep disturbances in the elderly[J].Exp Gerontol,2000,35(9-10):1229-1237.
[5] Slat E,Freeman G M Jr,Herzog E D.The clock in the brain:neurons,glia,and networks in daily rhythms[J].Handb Exp Pharmacol,2013,217:105-123.
[6] Farajnia S,Deboer T,Rohling J H,et al.Aging of the suprachiasmatic clock[J].Neuroscientist,2014,20(1):44-55.
[7] Schibler U,Sassone-Corsi P.A web of circadian pacemakers[J].Cell,2002,111(7):919-922.
[8] Hastings M H,Reddy A B,Maywood E S,et al.A clockwork web:circadian timing in brain and periphery,in health and disease[J].Nat Rev Neurosci,2003,4(8):649-661.
[9] Brown S A,Kowalska E,Dallmann R.(Re)inventing the circadian feedback loop[J].Dev Cell,2012,22(3):477-487.
[10] Aton S J,Herzog E D.Come together,right...now:synchronization of rhythms in a mammalian circadian clock[J].Neuron,2005,48(4):531-534.
[11] Holliday R,Grigg G W.DNA methylation and mutation[J].Mutat Res,1993,285(1):61-67.
[12] Hsu M C,Huang C C,Choo K B,et al.Uncoupling of promoter methylation and expression of Period1 in cervical cancer cells[J].Biochem.Biophys.Res Commun,2007,360(1):257-262.
[13]Satou R,Sugihara N,Ishizuka Y,et al.DNA methylation of the BMAL1 promoter[J].Bio-phys Res Commun,2013,440(3):449-453.
[14] Oddo S,Caccamo A,Shepherd J D,et al.Triple-transgenic model of Alzheimer's disease with plaques and tangles:intracellular Abeta and synaptic dysfunction[J].Neuron,2003,39(3):409-421.
[15] Musiek E S.Circadian clock disruption in neurodegenerative diseases:cause and effect[J].Front Pharmacol,2015,6:29.
[16]张静爽,王蓉.阿尔茨海默病发生机制的研究进展[J].首都医科大学学报,2014,35(6):721-724.
[17]田宝国,王子平.阿尔茨海默病突触功能障碍与Aβ的关系[J].中国煤炭工业医学杂志,2012,15(7):1129-1131.
[18] Froy O.Circadian rhythms,aging,and life span in mammals[J].Physiology(Bethesda),2011,26(4):225-235.
[19] Cedernaes J,Osler M E,Voisin S,et al.Acute sleep loss induces tissue-specific epigenetic and transcriptional alterations to circadian clock genes in men[J].J Clin Endocrinol Metab,2015,100(9):E1255-1261.
[20]Song H,Moon M,Choe H K,et al.Aβ-induced degradation of BMAL1 and CBP leads to circadian rhythm disruption in Alzheimer's disease[J].Mol Neurodegener,2015,10:13.
[21]Lin Q,Ding H,Zheng Z,et al.Promoter methylation analysis of seven clock genes in Parkinson's disease[J].Neurosci Lett,2012,507(2):147-150.
[22] Duong H A,Robles M S,Knutti D,et al.A molecular mechanism for circadian clock negative feedback[J].Science,2011,332(6036):1436-1439.
[23] Sahar S,Sassone-Corsi P.The epigenetic language of circadian clocks[J].Handb Exp Pharmacol,2013(217):29-44.
[24]Gibson E M,Williams W R 3rd,Kriegsfeld L J.Aging in the circadian system:considerat-ions for health,disease prevention and longevity[J].Exp Gerontol,2009,44(1-2):51-56.
[25]Khapre R V,Kondratova A A,Patel S,et al.BMAL1-dependent regulation of the mTOR signaling pathway delays aging[J].Aging(Albany NY),2014,6(1):48-57.
[26] Van der Zee,E A,et al.Circadian time-place learning in mice depends on Cry genes[J].Curr Biol,2008,18(11):844-848.

