腹腔内注射脂多糖对大鼠黑质ROS含量及NADPH酶的影响
白丽娟 姜 新 陈晓虹 任 艳 罗晓光
(1.辽宁省人民医院神经内科,沈阳110016;2.中国医科大学附属第一医院神经内科,沈阳110001)
小胶质细胞被激活后能够产生大量的活性氧(reactive oxygen species,ROS),产生细胞毒性作用,称为氧化应激反应。大量研究[1-3]表明,氧化应激在帕金森病的发病机制中起重要作用,而抗炎物质能够抑制氧化应激反应,具有神经保护作用。烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide-adenine dinucleotide phosphate,NADPH)酶广泛表达于中胚层来源的细胞中,如小胶质细胞、粒细胞和血管细胞。在外界刺激下,NADPH氧化酶激活,将电子从 NADPH传递给氧分子,从而产生ROS。本研究以SD大鼠为研究对象,观察了经腹腔注射脂多糖(lipopolysaccharide,LPS)后,大鼠黑质NADPH氧化酶的表达及ROS的产生情况。旨在探讨小胶质细胞被激活后的氧化应激机制。
1 材料和方法
1.1 实验动物与分组
取健康SD雄性大鼠,共200只,中国医科大学动物实验部门提供,实验动物许可证号:SCXK(辽)2013-0001。分别将大鼠分为实验青年组、老年组,对照青年组、老年组4组,各组大鼠均为50只;其中,青年组为雄性两月龄大鼠(体质量250~350 g),老年组为雄性12月龄(体质量450~600 g)。
各组又根据不同时间点随机分为5个亚组,每个亚组分别为10只SD大鼠,分别于给药后6 h、12 h、24 h、48 h及1周时处死。各组中有25只检测ROS产生情况,另外25只检测NADPH酶在胞质蛋白和膜蛋白的表达情况。
1.2 方法
实验组均给予腹腔注射LPS 1 mg/kg,对照组均给予腹腔注射0.9%(质量分数)氯化钠注射液1 mg/kg,各组大鼠分别于给药后 6 h、12 h、24 h、48 h 及 1周时快速断头取脑黑质。DCFH-DA探针检测各组大鼠ROS产生情况。采用Western blotting法检测各组大鼠NADPH酶情况。
1.3 统计学方法
SPSS 20.0软件对数据进行析因方差分析,计量数据用均数±标准差(±s)表示,以P<0.05为差异有统计学意义。
2 实验结果
2.1 各组大鼠活性氧(ROS)产生情况
老年组与青年组相比,各时间点老年组ROS含量相对较高,但差异无统计学意义(P>0.05);对照老年组各个时间点与对照老年组6 h相比,差异无统计学意义(P>0.05);对照青年组各个时间点与对照青年组6 h相比,差异无统计学意义(P>0.05)。但实验老年组、实验青年组各个时间点与各自实验老年组、实验青年组6 h相比,差异均有统计学意义,ROS在12 h达到最高,之后并逐渐下降;实验组均高于对照组,差异有统计学意义(表1,图1)。

表1 各组大鼠ROS的量Tab.1 ROS content of the rats in each group n=5
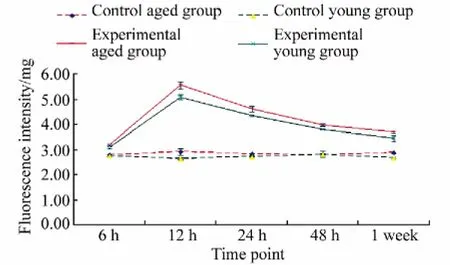
图1 各组ROS的量Fig.1 ROS content in each group
2.2 检测各组大鼠NADPH酶表达情况
2.2.1 各组大鼠胞质中NADPH酶表达情况
实验老年组及实验青年组在腹腔注射LPS 12 h均可见胞质中NADPH酶表达增多,达高峰,之后随时间延长而减少;而对照组胞质中NADPH酶表达量随时间延长无明显变化(图2)。
2.2.2 各组大鼠胞膜上NADPH酶表达情况
实验老年组及实验青年组在腹腔注射LPS 12 h均可见胞膜上有NADPH少量表达,而对照组未见胞膜上有NADPH酶的表达(图3)。

图2 各组胞质中NADPH酶表达情况Fig.2 Expression of NADPH oxidase in cytoplesm
3 讨论
机体内产生活性氧的途径很多,其中包括线粒体呼吸链和促氧化酶类。已知激活的小胶质细胞能生成大量的活性自由基(包括活性氧、活性氮),参与氧化应激反应[4]。NADPH氧化酶是小胶质细胞产生ROS的主要介质,其活性变化对局部组织器官乃至全身活性氧水平的高低具有重要影响。已有研究发现在LPS刺激小胶质细胞活化后,它通过激活NADPH氧化酶产生大量ROS。
NADPH酶广泛表达于中胚层来源的细胞系中,如小胶质细胞、粒细胞和血管细胞。它由多个亚基组成,包括位于胞膜的b558(gp91phox和p22phox)和胞质亚单位 p47phox、p67phox、p40phox和 GTPase。在外界的刺激下,其胞质中的亚基(主要是p47phox)转运到细胞膜上,与位于膜上的亚单位 b558结合,NADPH氧化酶激活,催化电子从NADPH传递到氧分子,同时产生 ROS[5]。
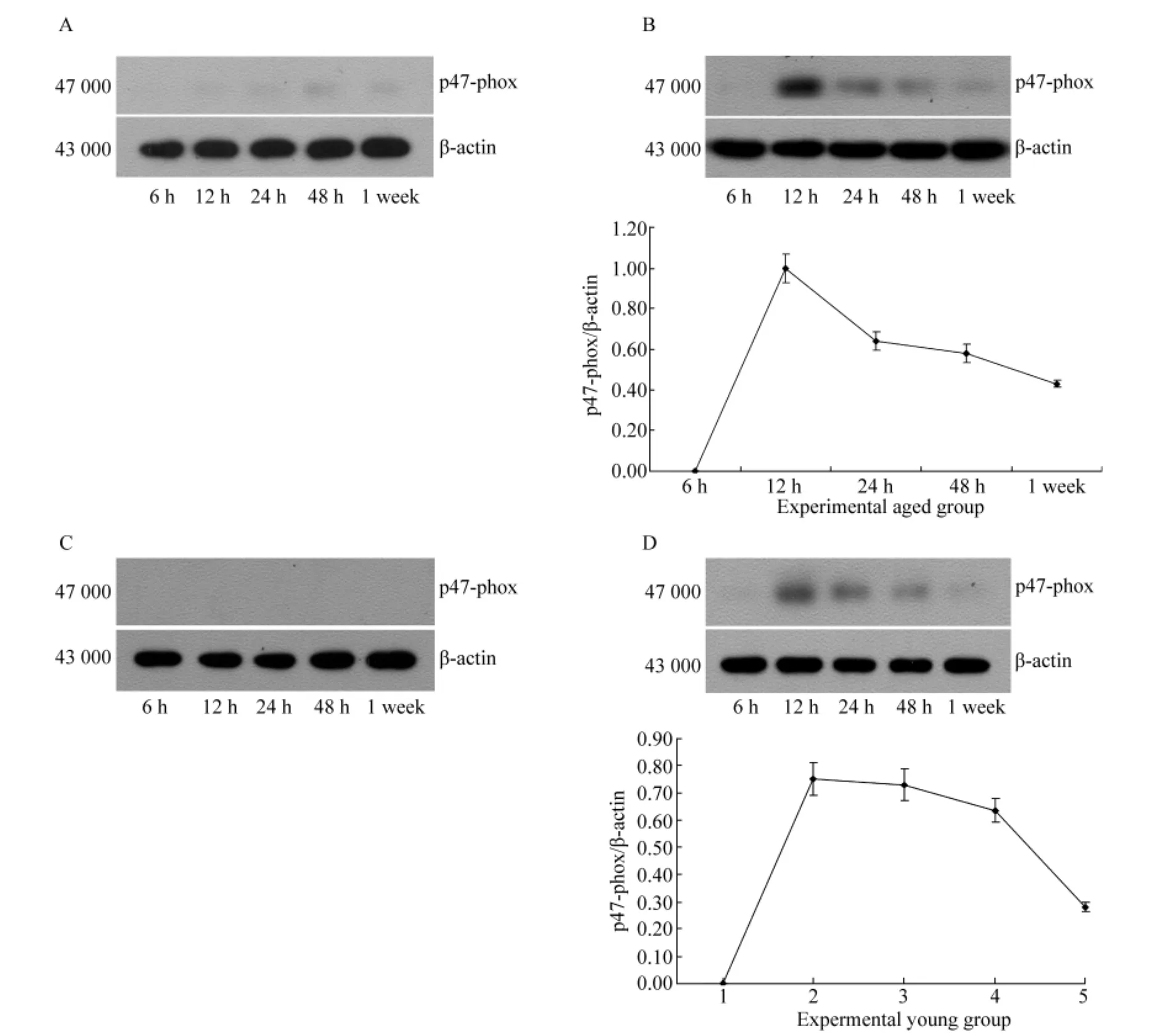
图3 各组胞膜上NADPH酶表达情况Fig.3 Expression of NADPH oxidase in membrane
中脑黑质是脑内小胶质细胞密度最高的区域,同时在DA合成过程中会产生大量的对神经元有毒性的易受氧化的DA代谢物,加之多巴胺能神经元的抗氧化能力低,因此,黑质的多巴胺能神经元对氧化应激尤为敏感[6]。研究[7]发现,激活的小胶质细胞中NADPH酶产生的氧化自由基可能是导致DA能神经元变性坏死的“重犯”。已有研究[8]提出PHOX-ROS通路参与了LPS诱导的神经毒性。胞质亚单位p47phox是NADPH氧化酶最重要的调节亚基,它在NADPH酶释放过氧化物粒子中起关键作用[9-12],p47phox在胞膜上的表达水平是提示PHOX活性的重要指征[13-14]。
本实验中,腹腔注射LPS 12 h,大鼠黑质内ROS活性达到高峰,但老年组与青年组差异无统计学意义(P>0.05),提示LPS刺激后(12 h)无论在老年组与青年组均有小胶质细胞活化,即发生了氧化应激反应。并且,腹腔注射LPS 12 h,老年组及青年组NADPH酶表达均增加,达到高峰,此后逐渐下降,但两组之间差异无统计学意义(P>0.05),而在12 h之后亦可见老年组及青年组NADPH酶由胞质向细胞膜移位,这提示LPS刺激后(12 h),无论在老年组与青年组氧化应激反应均可能是通过激活NADPH氧化酶途径而发生的。
[1] Liu Y,Qin L,Li G,et al.Dextromethorphan protects dopaminergic neurons against inflammation-mediated degeneration through inhibition of microglial activation[J].J Phamacol Exp Ther,2003,305(1):212-218.
[2] Qian L,Block M L,Wei S J,et al.Interleukin-10 protects lipopolysaccharide-induced neurotoxicity in primary midbrain cultures by inhibiting the function of NADPH oxidase[J].J Pharmacol Exp Ther,2006,319(1):44-52.
[3] Qian L,Block M L,Wei S J,et al.Microglia-mediated neurotoxicity is inhibited by morphine through an opioid receptor-independent reduction of NADPH oxidase activity[J].J Immunol,2007,179(2):1198-1209.
[4] Ma Q L,Zhang G G,Peng J.Vascular peroxidase 1:a novel enzyme in promoting oxidative stress in cardiovascular system[J].Trends Cardiovasc Med,2013,23(5):179-183.
[5] Gao H M,Hong J S,Zhang W,et al.Distinct role for microglia in rotenone-induced degeneration of dopaminergic neurons[J].J Neurosci,2002,22(3):782-790.
[6] Greenamyre J T,Mackenzie G M,Peng T I,et al.Mitochondrial dysfunction in Parkinson’s disease[J].J Biochem Soc Symp,1999,66:85-97.
[7] Gao H M,Jiang J W,Wilson B,et al.Microglial activation-mediated delayed and progressive degeneration of rat nigral dopaminergic neurons:relevance to Parkinsion’s disease[J].J Neurochem,2002,81(6):1285-1297.
[8] Qin L,Liu Y,Wang T,et al.NADPH oxidase mediated lipopolysaccharide-induced neurotoxicity and proinflammatory gene expression in activated microglia[J].J Biol Chem,2004,279(2):1415-1421.
[9] Li J M,Mullen A M,Yun S,et al.Essential role of the NADPH oxidase subunit p47(phox)in endothelial cell superoxide production in response to phorbol ester and tumor necrosis factor-alpha[J].Circ Res,2002,90(2):143-150.
[10]安子薇,李建民,吴庆文,等.帕金森病康复治疗研究新进展[J].中国煤炭工业医学杂志,2013,16(5):851-853.
[11]蒙萍,马慧萍,景临林,等.线粒体靶向抗氧化剂MitoQ的研究进展[J].解放军医药杂志,2014,26(12):108-111.
[12]王金保,张在旺,汤龙信,等.不同浓度CD46预先给药对鼠原代培养小胶质细胞补体蛋白表达的影响[J].解放军医药杂志,2013,25(7):28-30.
[13]孙广萍,于李汀,边晓慧,等.NADPH氧化酶参与机械牵张大鼠血管平滑肌细胞MCP-1 mRNA的生成[J].中国医科大学学报,2012,41(11):1014-1017.
[14]刘慧丰,杨巍巍,高华,等.自噬参与DJ-1保护大鼠黑质多巴胺能神经元抵抗鱼藤酮损伤[J].首都医科大学学报,2013,34(3):385-390.

