小干扰RNA沉默脂肪酸合酶基因对人肝细胞株HepG2脂代谢的影响
张秀云,冯艳萍,熊东,叶文静,朱粒仁,范阿强,陈建业,宋永砚
小干扰RNA沉默脂肪酸合酶基因对人肝细胞株HepG2脂代谢的影响
张秀云,冯艳萍,熊东,叶文静,朱粒仁,范阿强,陈建业,宋永砚
目的:研究基因干扰技术沉默脂肪酸合酶(FAS)基因后对人肝细胞株HepG2细胞内外脂质含量及脂代谢相关基因表达的影响。
方法:合成3对针对FAS mRNA不同位点序列的小干扰RNA(siRNA),分别转染至人肝细胞株HepG2,实时荧光定量聚合酶链反应(PCR)检测空白对照组(HepG2细胞不经过任何处理)、阴性对照组(转染没有任何基因干扰作用的阴性siRNA)、FAS-siRNA-1转染组、FAS-siRNA-2转染组和FAS-siRNA-3转染组的FAS mRNA的表达。蛋白免疫印迹(Western blot)法检测蛋白质的表达水平,筛选出沉默效果最佳的一对siRNA。将最有效siRNA转染至HepG2细胞,48 h后测定细胞内外甘油三酯及总胆固醇含量以及脂代谢相关基因的mRNA表达水平。
结果:25 nmol/L siRNA和3 μl/孔(24孔板)转染试剂的转染效率最高。FAS-siRNA-3对HepG2的FAS基因的沉默效果最好,FAS-siRNA-3转染组的FAS在mRNA水平和蛋白水平分别降低为空白对照组的(52.33±3.07)%和(51.57±3.14)%。FAS-siRNA-3沉默FAS基因后HepG2的细胞内和细胞外培养液中甘油三酯含量显著低于空白对照组,细胞外总胆固醇含量显著低于空白对照组。与空白对照组比较,FAS-siRNA-3转染组HepG2的肝脂酶基因mRNA表达水平显著升高(P<0.0001),微粒体甘油三酯转运蛋白基因mRNA表达水平显著降低(P<0.05),差异均有统计学意义。
结论:FAS基因沉默可显著降低HepG2细胞内甘油三酯、细胞外培养液甘油三酯和总胆固醇的含量,需进一步的体内外实验加以验证。
小干扰RNA ; 脂肪酸合酶 ;人肝细胞株HepG2
Methods: A total of 3 pairs of small interfering RNA (siRNA) targeting different sequences of FAS mRNA were synthesized as FAS-siRNA-1, FAS-siRNA-2 and FAS-siRNA-3, meanwhile, 2 controls were established as Blank control group, in which HepG2 cells were not treated, and Negative control group, in which HepG2 cells were transfected by noneffective siRNA. The mRNA, and protein expression levels of FAS in HepG2 cells were examined by real-time fluorescence quantitative RCR and Western blot analysis to screen the most effective pair of siRNA for FAS gene silencing; and that specific siRNA was transtected to HepG2 cells for 48 hours to detect the intra-/extra-cellular TG, TC levels and the mRNA expression related to lipid metabolism in HepG2 cells.
Results: The screening experiment indicated that FAS-siRNA-3 was most effective for FAS gene silencing. Compared with Blank control group, the mRNA and protein expressions in FAS-siRNA-3 transfected HepG2 cells (Transfected group)
decreased to (52.33 ± 3.07) % and (51.57 ± 3.14) % respectively. Compared with Blank control group, Transfected group had the reduced intra-/extra-cellular TG levels and reduced extracellular TC level; while increased mRNA expression of hepatic lipase, P<0.0001 and decreased mRNA expression of TG transfer protein in HepG2 microsome, P<0.05.
Conclusion: FAS gene silencing could significantly decrease the intra-/extra- cellular TG level and extracellular TC level in HepG2 cells, those findings need to be confirmed by further in vivo and in vitro studies.
(Chinese Circulation Journal, 2015,30:670.)
高甘油三酯血症(HTG)是动脉粥样硬化的独立危险因子,与心血管病(CVD)直接相关[1-6]。血浆甘油三酯主要来源于肝脏的从头合成(de novo synthesis)。在肝甘油三酯从头合成过程中,脂肪酸合酶(FAS)是起关键作用的多功能酶,其表达水平及活性决定了甘油三酯的合成速率以及血浆甘油三酯的水平[7]。重酒石酸烟碱诱导使大鼠肝FAS表达增强后,肝脏及血浆中甘油三酯水平显著升高[8]。FAS抑制剂可以有效降低大鼠血浆甘油三酯水平以及逆转非酒精性脂肪肝病[9,10]。本研究运用RNA干扰技术,特异性沉默HepG2细胞FAS表达,在细胞及分子水平上观察FAS沉默后肝细胞内外脂质含量以及脂代谢相关基因表达的改变,为相关体内研究的开展提供实验基础。
1 材料与方法
主要实验材料:试验时间:2014-07至2014-10,本研究涉及主要仪器和试剂包括:人肝细胞株HepG2从武汉博士德购买;细胞培养箱(美国Thermo);实时荧光定量聚合酶链反应(PCR)仪(美国ABI 7900HT);转染试剂TransIT-siQUEST(美国Mirus);细胞总RNA提取试剂盒(北京天根);荧光定量试剂盒(日本TaKaRa);细胞总蛋白提取及定量试剂盒(上海碧云天);FAS兔抗人一抗(美国GeneTex);蛋白免疫印迹(Western blot)试剂盒(上海碧云天);无血清培养液Opti-MEM(美国Gibco);细胞内甘油三酯/总胆固醇测定试剂盒(北京普利莱);血清甘油三酯/总胆固醇测定试剂盒(浙江东瓯)。小干扰RNA(siRNA)由上海吉码制药技术有限公司设计合成,3对siRNA及阴性对照序列分别为:FAS-siRNA-1:(280)GGACCUGUCUAGGUUUGAUTT; FAS-siRNA-2:(3072)CCCAGGCUGAAGUUUACAATT; FAS-siRNA-3:(7377)GGUCCUUCUACUACAAGCUTT; 5’-UUCUCCGAACGUGUCACGUTT-3’。
细胞培养:HepG2细胞采用Iscove's改良的Eagle培养基(IMEM)培养,含10%胎牛血清、2 000 μmol/L L-谷氨酰胺及双抗(100 U/ml青霉素、100 μg/ml链霉素)。细胞置37℃,5% CO2培养箱中培养,生长至对数生长期的细胞用于实验。
转染条件的优化:HepG2细胞接种于24孔板培养,细胞融合度长至50%~70%时进行转染。将转染试剂(1.5 μl/孔或3 μl/孔)和荧光标记的阴性对照组siRNA(25、50或75 nmol/L)与无血清培养液(Opti-MEM)混合、静置形成转染复合物。转染复合物的配制过程为:吸取50μl Opti-MEM培养液,加入转染试剂并轻轻混匀。然后加入阴性对照组储存液,移液枪反复轻轻吹打混匀。室温下静置20 min形成转染复合物。将转染复合物“十”字形滴加到细胞培养孔中,轻轻晃动培养板使之混合均匀,放回培养箱继续培养,6 h后荧光显微镜拍照计数。根据荧光细胞数占总细胞数的比例确定最佳转染条件。
最有效siRNA的筛选:以转染条件优化中得出的最佳转染条件将阴性对照组及3对siRNA分别转染进入HepG2细胞。转染后48 h,实时荧光定量PCR分别检测空白对照组(HepG2细胞不经过任何处理)、阴性对照组(转染没有任何基因干扰作用的阴性siRNA)、FAS-siRNA-1转染组、FAS-siRNA-2转染组和FAS-siRNA-3转染组的FAS mRNA的表达。FAS上游引物为5’-AAGGGCCTAGAGGAGCGTGT-3’,下游引物为5’-TGGTACTTGGCCTTGGGTGT’,产物大小为149bp;内参照GAPDH上游引物为5’-CTTTGGTATCGTGGAAGGACTC-3’,下游引物为5’- GTAGAGGCAGGGATGATGTTCT-3’,产物大小为132bp。定量反应体系:上、下游引物各0.5 μl,cDNA 1.0 μl,SYBR Premix Ex Taq 10 μl,dH2O 8.0 μl,总体积20 μl。反应条件:95℃预变性15s,95℃ 5s,60℃ 30s,45次循环。溶解曲线95℃ 5s,55℃ 60s,55℃~95℃30s。根据2-ΔΔCt法计算样本的mRNA含量。
Western blot法检测细胞中FAS的表达量:严格按照试剂盒说明书提取细胞总蛋白并进行定量,蛋白变性后行十二烷基磺酸钠(SDS)—聚丙烯酰胺凝胶电泳,转膜、封闭后,各组先后与兔抗人FAS一抗以及辣根过氧化物酶HRP标记的二抗孵育,洗膜后化学发光法成像。采用Image lab 3.0分析软件对条带灰度值进行测定并分析。
FAS-siRNA-3处理对HepG2细胞内外脂质含量的影响:以最佳转染条件和最有效siRNA(FAS-siRNA-3)转染HepG2细胞。转染后48 h,同时收集细胞和上清液。细胞内甘油三酯和总胆固醇含量测定参照北京普利莱基因技术有限公司测定试剂盒说明书进行:细胞加入裂解液充分吹打裂解,12 000×g、4℃离心10 min。取上清,分成两份,一份真空冷冻抽干后采用细胞甘油三酯和总胆固醇测定试剂盒测定甘油三酯和总胆固醇含量;另一份采用二喹啉甲酸(BCA)法测定蛋白质浓度(参照上海碧云天生物技术有限公司的蛋白质浓度测定试剂盒说明书进行),结果以每g蛋白质对应的细胞内甘油三酯或总胆固醇含量(mmol/g)表示。细胞培养上清液甘油三酯和总胆固醇含量测定:取1 ml上清液真空冷冻抽干,采用血清甘油三酯和总胆固醇测定试剂盒测定490 nm处的吸光度,根据标准液的吸光度值求出样品溶液的甘油三酯及总胆固醇含量。每个处理重复3次,均值用于统计分析。
FAS-siRNA-3处理对HepG2细胞脂代谢相关基因表达的影响:以最佳转染条件和最有效siRNA(FAS-siRNA-3)转染HepG2细胞。转染后48 h,裂解细胞提取总RNA,实时荧光定量PCR检测肝脂酶基因(HL)、3-羟基-3-甲基戊二酸单酰辅酶A还原酶基因(HMGR)、固醇调节元件结合蛋白-1基因(SREBP1)、微粒体甘油三酯转运蛋白基因(MTP)、载脂蛋白B100基因(APOB100)的mRNA表达水平。每个处理重复3次,均值用于统计分析。
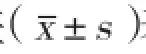
2 结果
转染条件的优化(图1):转染后6 h,根据荧光细胞数占总细胞数的比例计算,1.5 μl/孔(24孔板)转染试剂×25 nmol/L siRNA、1.5 μl/孔转染试剂×50 nmol/L siRNA、1.5μl /孔转染试剂×75 nmol/L siRNA、3 μl/孔转染试剂×25nmol/L siRNA、3 μl/孔转染试剂×50 nmol/L siRNA和3 μl/孔转染试剂×75 nmol/L siRNA的转染率分别为43.0%、35.5%、49.0%、65.0%、32.5.0%和50.0%,因此确定3 μl/孔转染试剂×25 nmol/L siRNA的转染效率最高。

图1 25 nmol/L荧光标记的小干扰RNA转染HepG2细胞6 h后的荧光照片(×200)
最有效siRNA的筛选:实时荧光定量PCR检测发现FAS-siRNA-1和FAS-siRNA-3对FAS基因的沉默效果较好。与空白对照组(100±7.89)%比较,阴性对照组的FAS mRNA水平为(96.79±20.26)%。FAS-siRNA-1转染组、FAS-siRNA-2转染组和FAS-siRNA-3转染组的mRNA水平分别降低为空白对照组的(52.57±2.36)%、(61.42±5.23)%和(52.33±3.07)%,与空白对照组和阴性对照组比较差异均有统计学意义(P<0.0001)。通过Western blot法检测细胞内FAS的表达量,与空白对照组比较,FAS-siRNA-1转染组、FAS-siRNA-2转染组和FAS-siRNA-3转染组的FAS含量分别降低为空白对照组的(64.34±7.85)%、(69.74±11.61)%和(51.57±3.14)%,差异均有统计学意义(P<0.05)(图2)。根据实时荧光定量PCR和Western blot检测结果确定FAS-siRNA-3对FAS基因沉默效果最好,为最佳干扰siRNA,用于后续实验。

图2 蛋白免疫印迹法检测不同处理下脂肪酸合酶的蛋白质表达水平
FAS-siRNA-3处理对HepG2 48 h后细胞内外脂质含量的影响(表1): FAS-siRNA-3转染组细胞内甘油三酯含量显著低于空白及阴性对照组(P<0.05),细胞外培养液中甘油三酯和总胆固醇含量显著低于空白及阴性对照组(P<0.05),差异均有统计学意义。细胞内总胆固醇含量在各组之间差异无统计学意义。
表1 FAS-siRNA-3处理HepG2细胞48h后细胞内外甘油三酯和总胆固醇的相对百分含量
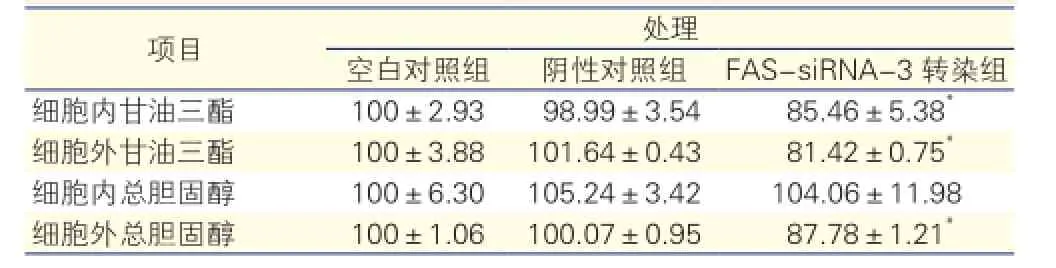
表1 FAS-siRNA-3处理HepG2细胞48h后细胞内外甘油三酯和总胆固醇的相对百分含量
注:FAS:脂肪酸合酶;siRNA:小干扰RNA。与空白对照组和阴性对照组相比*P<0.05
?
FAS-siRNA-3处理对HepG2细胞脂代谢相关基因表达的影响(表2):与空白及阴性对照组比较,FAS-siRNA-3转染组HL基因表达显著增强(P<0.0001),MTP基因表达水平显著降低(P<0.05),差异均有统计学意义。HMGR、SREBP1和APOB1000的表达水平在各组之间差异无统计学意义。
表2 FAS-siRNA-3处理HepG2细胞48 h后脂代谢相关基因mRNA的相对百分含量
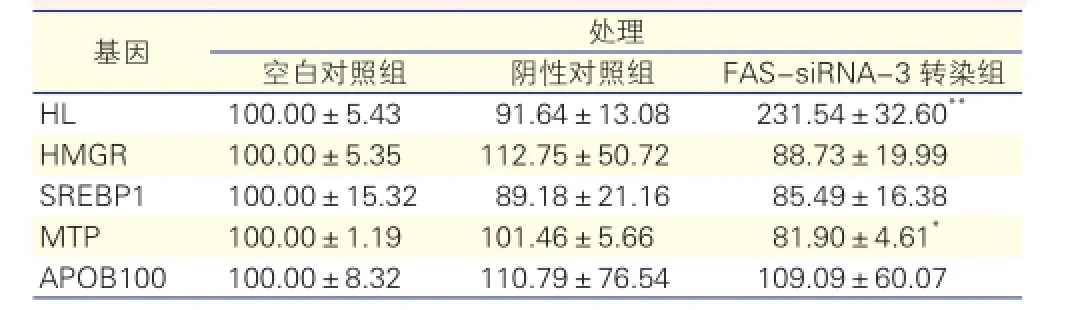
表2 FAS-siRNA-3处理HepG2细胞48 h后脂代谢相关基因mRNA的相对百分含量
注:HL:肝脂酶基因;HMGR:3-羟基-3-甲基戊二酸单酰辅酶A还原酶基因;SREBP1:固醇调节元件结合蛋白-1基因;MTP:微粒体甘油三酯转运蛋白基因;APOB100:载脂蛋白B100基因;与空白对照组和阴性对照组相比*P<0.05**P<0.0001。余注见表1
?
3 讨论
FAS是催化脂肪酸合成的关键酶, 已成为治疗高脂血症、肥胖、肿瘤等疾病的重要靶标[11,12]。在人类细胞中,FAS是含有两个相同亚基的同源二聚体,两亚基首尾相接,构成一个环状的多酶复合体。FAS每个亚基大小约为270 kD,含有乙酰转移酶等7种酶活性,依次以乙酰辅酶A和丙二酸单酰辅酶A为原料合成16碳的软脂酸,软脂酸进一步延长和酯化成甘油三酯。人FAS定位于染色体17q25,含有42个内含子和43个外显子,长约22 kb。FAS普遍表达于全身各组织中,在肝脏的表达量最高,其脂肪酸合成能力是脂肪组织的8~9倍[13]。
血液甘油三酯主要来源于肝脏的从头合成。肝细胞合成的甘油三酯以极低密度脂蛋白(VLDL)的形式释放入血。FAS在肝脏中的表达水平及活性与血浆甘油三酯水平显著相关。Ma等[8]给雌性Wistar大鼠注射重酒石酸烟碱[1mg/(kg·d)]2周后,肝脏FAS表达显著增强,同时肝脏及血浆中的甘油三酯水平显著增高。与之对应,大豆异黄酮干预非酒精性脂肪肝模型大鼠12周后,肝FAS表达水平显著降低,同时肝脏及血清中的甘油三酯显著降低[14]。
基于FAS在高甘油三酯血症发病中的重要作用,FAS很可能成为临床治疗高甘油三酯血症的一个重要靶点,抑制FAS基因表达也很可能成为治疗高甘油三酯血症的重要手段。
RNA干扰技术根据靶基因mRNA序列设计互补的siRNA,体外合成后导入细胞或体内,在细胞内siRNA与一些酶(包括内切酶、外切酶、解旋酶等)结合形成RNA诱导的沉默复合物(RISC)。RISC识别和结合靶基因mRNA的同源区域,并在结合区内切割mRNA,导致靶基因功能缺失,从而达到疾病治疗的目的。RNA干扰技术已广泛应用于高脂血症相关基因的沉默[15-19]。本研究首次运用siRNA技术沉默FAS基因。研究结果显示,siRNA有效抑制FAS基因表达后,细胞内及细胞外培养液中甘油三酯含量较对照组显著降低,提示通过siRNA沉默FAS基因可能是一条潜在的降低血浆甘油三酯水平的有效途径。
肝细胞从头合成甘油三酯后,通过合成和分泌VLDL将其转出肝脏。MTP存在于肝细胞内质网腔内,是VLDL组装必需的异源二聚体酯转运蛋白。MTP的主要功能是将新合成的甘油三酯转运至载脂蛋白B,逐渐形成成熟的VLDL颗粒。VLDL颗粒不仅转运内源性甘油三酯,肝合成的胆固醇也通过其转出。当VLDL-甘油三酯被脂蛋白酯酶(LPL)水解后,VLDL残粒可转变成低密度脂蛋白(LDL)。因此,MTP不仅在肝甘油三酯输出中发挥作用,而且与肝胆固醇的分泌有关。研究显示,MTP抑制剂可显著降低血浆总胆固醇水平[20,21]。在本研究中,FAS基因siRNA沉默后,MTP基因表达显著下调,同时细胞外总胆固醇含量显著降低,这可能是因为FAS基因表达被抑制后,HepG2细胞分泌VLDL颗粒减少,从而导致胆固醇分泌也减少,培养液中总胆固醇降低。FAS基因沉默可能对MTP基因的表达形成正反馈,使MTP基因表达显著降低。肝细胞内甘油三酯
和胆固醇的合成是协调一致的,当肝甘油三酯合成受到抑制时,胆固醇的合成也会相应降低[22],因此,尽管在本研究中HepG2细胞分泌的胆固醇减少,细胞内胆固醇含量也没有显著增加。
HL存在于肝血窦内皮细胞,其功能是水解VLDL残粒中的甘油三酯,促进VLDL残骸的清除。在本研究中,FAS基因沉默后HL基因表达显著增高,这提示FAS基因沉默后不仅可以减少肝脏VLDL的合成与输出,还可促进肝脏对外周脂蛋白残骸的吸收和清除。本研究没有发现siRNA沉默FAS基因后SREBP1基因表达发生显著性变化,提示FAS基因沉默后MTP基因和HL基因表达的改变可能是通过其它信号通路实现的。
本研究在细胞水平上揭示了FAS基因siRNA沉默可降低肝细胞内及细胞外培养液中的甘油三酯水平,也可降低细胞外培养液中的总胆固醇水平,需进一步的体内外实验加以验证。
[1] Sarwar N, Danesh J, Eiriksdottir G, et al. Triglycerides and the risk of coronary heart disease: 10, 158 incident cases among 262, 525 participants in 29 Western prospective studies. Circulation, 2007, 115: 450-458.
[2] 杨伟宪, 杨铮, 窦克非, 等. 217例青年冠心病患者临床特点分析.中国循环杂志, 2014, 29: 339-342.
[3] Stauffer ME, Weisenfluh L, Morrison A. Association between triglycerides and cardiovascular events in primary populations: a meta-regression analysis and synthesis of evidence. Vasc Health Risk Manag, 2013, 9: 671-680.
[4] Staniak HL, Salgado Filho W, Miname MH, et al. Association between postprandial triglycerides and coronary artery disease detected by coronary computed tomography angiography. Atherosclerosis, 2014, 233: 381-386.
[5] Miller M, Cannon CP, Murphy SA, et al. Impact of triglyceride levels beyond low-density lipoprotein cholesterol after acute coronary syndrome in the PROVE IT-TIMI 22 trial. J Am Coll Cardiol, 2008, 51: 724-730.
[6] 刘玲, 赵水平, 王钟林. 甘油三酯与冠心病关系及其机制研究. 中国循环杂志, 1998, 13: 251-252.
[7] Fukuda N, Ito T, Ohwada K, et al. Upregulation of fatty acid synthesis and the suppression of hepatic triglyceride lipase as a direct cause of hereditary postprandial hypertriglyceridemia in rabbits. J Clin Biochem Nutr, 2013, 53: 114-121.
[8] Ma N, Nicholson CJ, Wong M, et al. Fetal and neonatal exposure to nicotine leads to augmented hepatic and circulating triglycerides in adult male offspring due to increased expression of fatty acid synthase. Toxicol Appl Pharmacol, 2014, 275: 1-11.
[9] Burdeos GC, Nakagawa K, Kimura F, et al. Tocotrienol attenuates triglyceride accumulation in HepG2 cells and F344 rats. Lipids, 2012, 47: 471-481.
[10] Duncan RE, Archer MC. Farnesol decreases serum triglycerides in rats: identification of mechanisms including up-regulation of PPARalpha and down-regulation of fatty acid synthase in hepatocytes. Lipids, 2008, 43: 619-627.
[11] Loftus TM, Jaworsky DE, Frehywot GL, et al. Reduced food intake and body weight in mice treated with fatty acid synthase inhibitors. Science, 2000, 288: 2379-2381.
[12] Hopperton KE, Duncan RE, Bazinet RP, et al. Fatty acid synthase plays a role in cancer metabolism beyond providing fatty acids for phospholipid synthesis or sustaining elevations in glycolytic activity. Exp Cell Res, 2014, 320: 302-310.
[13] 赵励彦, 王莉莉, 李松. 脂肪酸合成酶抑制剂减肥作用机制的研究进展. 中国药理学通报, 2006, 22: 780-784.
[14] 冷亮, 蒋卓勤, 纪桂元. 大豆异黄酮对非酒精性脂肪肝大鼠肝脏脂代谢的影响. 中华预防医学杂志, 2011, 45: 335-339.
[15] Soutschek J, Akinc A, Bramlage B, et al. Therapeutic silencing of an endogenous gene by systemic administration of modified siRNAs. Nature, 2004, 432: 173-178.
[16] Tadin-Strapps M, Peterson LB, Cumiskey AM, et al. siRNA-induced liver ApoB knockdown lowers serum LDL-cholesterol in a mouse model with human-like serum lipids. J Lipid Res, 2011, 52: 1084-1097.
[17] Koornneef A, Maczuga P, van Logtenstein R, et al. Apolipoprotein B knockdown by AAV-delivered shRNA lowers plasma cholesterol in mice. Mol Ther, 2011, 19: 731-740.
[18] Frank-Kamenetsky M, Grefhorst A, Anderson NN, et al. Therapeutic RNAi targeting PCSK9 acutely lowers plasma cholesterol in rodents and LDL cholesterol in nonhuman primates. Proc Natl Acad Sci USA, 2008, 105: 11915-11920.
[19] Frank-Kamenetsky M, Grefhorst A, Anderson NN, et al. Effect of an RNA interference drug on the synthesis of proprotein convertase subtilisin/kexin type9 (PCSK9) and the concentration of serum LDL cholesterol in healthy volunteers: a randomised, single-blind, placebocontrolled, phase 1 trial. Lancet, 2013, 6736: 61914-61915.
[20] Cuchel M, Meagher EA, du Toit Theron H, et al. Efficacy and safety of a microsomal triglyceride transfer protein inhibitor in patients with homozygous familial hypercholesterolaemia: a single-arm, open-label, phase 3 study. Lancet, 2013, 381: 40-46.
[21] Cuchel M, Bloedon LT, Szapary PO, et al. Inhibition of microsomal triglyceride transfer protein in familial hypercholesterolemia. N Engl J Med, 2007, 356: 148-156.
[22] Oliva J, French SW, Li J, et al. Proteasome inhibitor treatment reduced fatty acid, triacylglycerol and cholesterol synthesis. Exp Mol Pathol, 2012, 93: 26-34.
Effect of Small Interfering RNA Silencing the Fatty Acid Synthase Gene on Lipid Metabolism in Human Hepatic Cell Line HepG2
ZHANG Xiu-yun, FENG Yan-ping, XIONG Dong, YE Wen-jing, ZHU Li-ren, FAN A-qiang, CHEN Jian-ye, SONG Yong-yan.
Department of Biochemistry, School of Preclinical Medicine, North Sichuan Medical College, Nanchong (637000), Sichuan, China
Objective: To investigate the effect of the gene interfering technology on fatty acid synthase (FAS) gene silencing for lipid contents in human hepatic cell line HepG2 and to study the lipid metabolism related gene expression in HepG2 cells.
Small Interfering RNA; Fatty acid synthase; Human hepatic cell line HepG2
2014-11-24)
(编辑:汪碧蓉)
四川省应用基础研究计划(2013JY0072);四川省教育厅重点项目(12ZA232)
637000 四川省南充市,川北医学院基础医学院生物化学教研室(张秀云、陈建业、宋永砚);川北医学院临床医学系(冯艳萍、熊东、叶文静、朱粒仁、范阿强)
张秀云 讲师 硕士 主要从事脂代谢紊乱与动脉粥样硬化研究 Email: 396530604@qq.com 通讯作者:宋永砚 Email: songyongyan2014@hotmail.com
R54
A
1000-3614( 2015 )07-0670-05
10.3969/ j. issn. 1000-3614. 2015.07.014

