金雀异黄素对尼罗罗非鱼(Oreochromis niloticus)生长及生长轴相关基因表达的影响
■陈 栋 金秋燕
(青岛理工大学环境与市政工程学院,山东青岛 266033)
鱼粉是鱼饲料中的主要蛋白源,过度捕捞和不良气候致使世界鱼粉的总产量逐步下降,而需求量又不断加大,这种供需矛盾导致鱼粉价格急剧上升[1]。而具有消化吸收率高、氨基酸组成好、价格低廉和资源丰富的大豆蛋白逐步成为首选替代品[2]。但大豆蛋白中富含大豆异黄酮,金雀异黄素、黄豆苷元和黄豆黄素是大豆异黄酮中含量最丰富的三种物质,它们在不同大豆源中的浓度大约为619.1~2 367.9、539.5~1 737.7、291.5~600.8 μg/g[3]。在实际生产中,金雀异黄素和黄豆苷元在大豆浓缩蛋白中检出量最高可达到5 900和1 990 μg/g[4],当饲料中的50%鱼粉完全被大豆浓缩蛋白替代时,饲料中的金雀异黄素和黄豆苷元将分别接近3 000和1 000 μg/g。大豆异黄酮对鱼类[5]、畜禽[6]和人类[7]均具有潜在的生物学作用。在畜禽中,黄豆苷元通常作为提高生殖性能、促进生长和增强机体免疫力的绿色添加剂广泛应用于畜禽饲料中[8];在鱼类中,大豆异黄酮影响研究大多集中在用豆粉替代水产饲料中的鱼粉后对鱼类生长产生的间接影响上,而对鱼类生长直接影响的研究报道比较少,研究结果之间的差异也比较大[9-12]。
与高等脊椎动物相似,鱼类生长的内分泌调控模式也主要受到下丘脑-垂体-肝脏所组成的生长轴线的调控,即受到生长激素/胰岛素样生长因子轴(GH/IGF-I)的调控[13]。下丘脑分泌产生多种神经内分泌因子,调控脑垂体生长激素细胞合成并分泌GH,通过血液循环,GH与肝细胞表面的GHR结合,刺激肝细胞释放IGF-I,进而促进细胞的增殖和生长[14]。因此,GH、GHR和IGF-I是反映鱼类生长性能的重要指标。
金雀异黄素是大豆异黄酮中含量最丰富、生物活性最强的一种物质。因此,本文以含不同浓度金雀异黄素的饵料饲喂尼罗罗非鱼(Oreochromis niloticus)幼鱼,研究金雀异黄素对罗非鱼生长性能的影响,并利用real-time PCR方法检测其对GH/IGF-I生长轴中垂体GH、肝脏GHRs和肝脏IGF-I基因表达的影响,初步探讨金雀异黄素对罗非鱼生长的影响效应,为推广以豆粉为蛋白源的新型鱼饲料提供理论依据。
1 材料与方法
1.1 饲料原料与配方
以鱼粉为主要蛋白源,鱼油为脂肪源,小麦粉为糖源,制备4种等氮、等能的实验饲料(见表1),分别向基础饲料中添加0、30、300 μg/g和3 000 μg/g的金雀异黄素(购自深圳市美荷生物技术有限公司)。配制饲料前,各种饲料原料经粉碎机预先粉碎后过80目筛。按表1所示均匀混合,再与水和鱼油充分混匀,然后用双螺杆挤条机(华南理工大学,F-26(Ⅱ)型)加工成型,45℃烘干至水分含量在10%左右。饲料破碎过筛,制备成1.5 mm×3.0 mm大小的颗粒,颗粒饲料密封保存,-20℃备用。
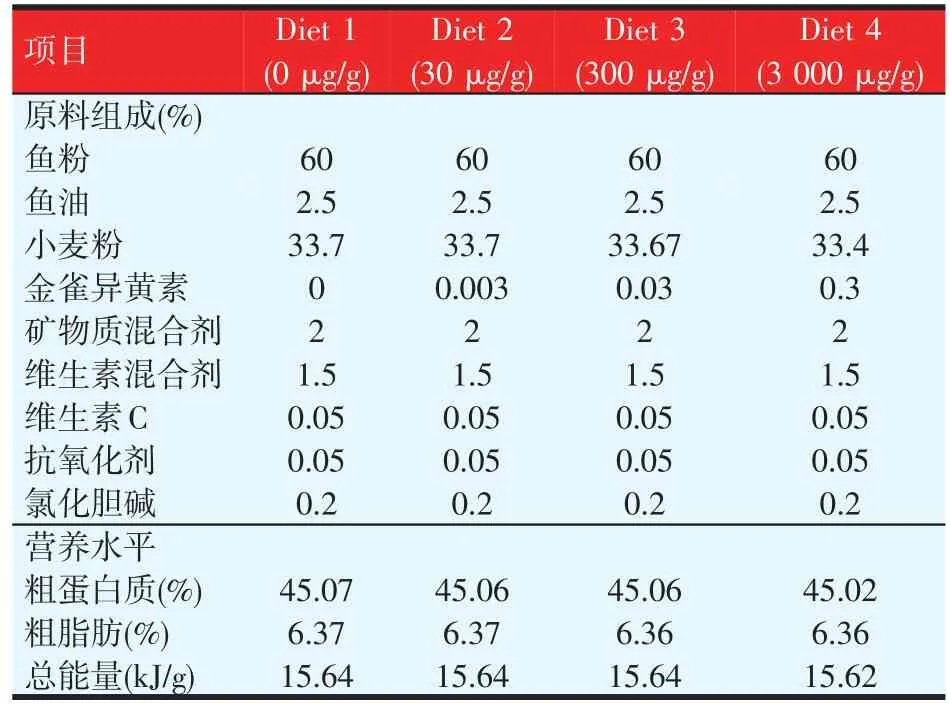
表1 饲料组成及营养水平(干重)
1.2 实验动物及饲养管理
实验选用两月龄的“新吉富”品系尼罗罗非鱼(Oreochromis niloticus)幼鱼,该鱼购自国家级青岛罗非鱼良种场。实验前,将该鱼用基础饲料(Diet 1)喂食2周以适应实验室内养殖环境,驯养结束后,罗非鱼禁食24 h。挑选体格健壮、规格一致的罗非鱼[(10.47±1.24)g]随机分配于12个玻璃水族箱(50 L,4个实验处理组,每组3个重复),每箱15尾鱼。每天上午9:00,下午4:00分2次投喂饲料,投饵量约为平均生物量的5%。投喂结束后1 h,清除残饵及粪便。养殖实验共进行8周,水温26~30 ℃,溶解氧为6.9~7.1 mg/l,pH值7.4~7.8,14 h/10 h光暗比。
1.3 样品收集与分析
养殖实验结束后,禁食24 h,将罗非鱼用75 mg/l MS-222(Sigma,St.Louis,MO,USA)麻醉,用吸水纸轻轻地擦净鱼体上的水分,用直尺测量罗非鱼的体长(cm),精确至0.01 cm;用分析天平测量体重(g),精确至0.01 g。而后,选取每组15尾鱼中的8尾,用剪刀从泄殖孔开始沿腹腔解剖,取出下丘脑、垂体和肝脏等组织,用生理盐水清洗后,液氮速冻,-80℃保存,用以提取RNA。
1.4 生长轴mRNA表达分析
将冻存的组织取出匀浆后,按照Trizol(Invitrogen,Carlsbad,CA,USA)试剂盒说明提取总RNA,根据OD260值计算RNA样品浓度,以OD260/280比值判断RNA的纯度。在反转录前用DNase I(Promega,Madison,WI,USA)去除痕量的DNA。用反转录试剂盒(Toyobo,Osaka)将总量为1 μg的RNA在20 μl的反应体系中反转录成cDNA,而后向所得cDNA加入80 μl dH2O,稀释5倍后保存于-20℃冰箱中备用。
根据Genebank中已经发表的基因序列,使用Primer premier 5.0软件设计尼罗罗非鱼GH、GHR1、GHR2、IGF-I以及内参基因β-actin和18S rRNA等基因的引物(见表2),用于real-time PCR扩增。扩增在Eppendorf Mastercycler®ep realplex2(Eppendorf,Germany)real-time PCR仪中进行,所使用的荧光剂为SYBR green mix kit(TaKaRa,Dalian,China)。20 μl的Real-time PCR反应体系为10 μl SYBR®Premix Ex TaqTM II,0.4 μl ROX 参考染料,各0.4 μl的上下游引物(10 μmol/l),4 μl cDNA 样品和 4.8 μl dH2O。反应条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。采用内参基因的△Ct法计算目的基因的相对表达量,Ct值表示每个反应管内基因的荧光信号达到设定阈值时的所经历的循环数。为了对反应体系中的基因扩增进行均一化处理,使用β-actin和18S rRNA作为内参基因,以两个内参基因Ct值的几何平均数作为修正内参基因的Ct值,目的基因表达值=log2(2Ct(修正内参基因)-Ct(目的基因)+1)。

表2 荧光实时定量PCR引物序列
1.5 计算及数据分析
罗非鱼的特定生长率、存活率、摄食率和饲料系数参照以下公式计算。
特定生长率(SGR,%/d)=100×(ln Wt-ln W0)/t;
存活率(%)=100×Nt/N0;
摄食率(FI,%BW/d)=100×Df/[(Wt+W0)/2×t)];
饲料系数(FER)=(Wt-W0)/Df。
式中:Wt——终体重(g);
W0——初始体重(g);
Nt——试验末鱼尾数;
N0——试验初鱼尾数;
Df——总投饲量(g);
t——养殖实验时间(d)。
将所有数据表示为“平均值±标准差(Mean±SD)”,采用Spss16.0统计软件对数据进行方差分析,采用Tukey's方法分析处理组和对照组数据之间的显著性差异,其中P<0.05为差异显著;P<0.01为差异极显著。
2 结果
2.1 金雀异黄素对罗非鱼生长性能的影响(见表3)

表3 金雀异黄素对罗非鱼生长性能的影响
由表3可见,8周后,对照组罗非鱼平均体重为(43.75±1.64)g,当向饲料中添加30、300 μg/g金雀异黄素时,罗非鱼平均体重与对照组相比没有显著变化,而添加3 000 μg/g时,比对照组显著降低,为(36.83±1.80)g(P<0.05)。对照组罗非鱼特定生长率为(2.52±0.07)%/d,30、300 μg/g饲料组罗非鱼特定生长率与对照组相比无显著变化,而3 000 μg/g饲料组显著降低至(2.21±0.09)%/d(P<0.05)。各处理组罗非鱼的存活率、摄食率和饲料系数与对照组相比没有显著差异(P>0.05)。
2.2 金雀异黄素对罗非鱼垂体GH mRNA表达的影响(见图1)
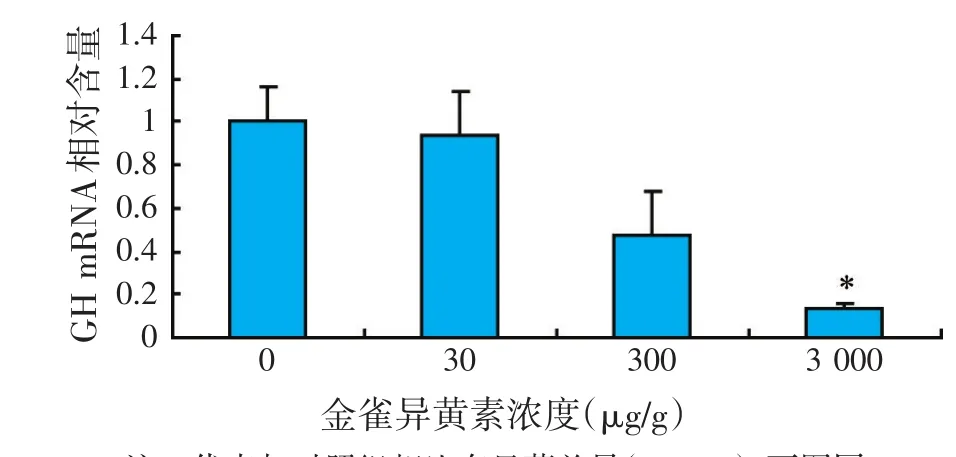
图1 金雀异黄素对垂体GH基因表达水平的影响
如图1所示,随着金雀异黄素含量增加,罗非鱼垂体GH mRNA水平逐步降低,3 000 μg/g组比对照组显著降低(P<0.05),而30、300 μg/g组与对照组没有显著差异(P>0.05)。
2.3 金雀异黄素对罗非鱼肝脏GHR1、GHR2 mRNA表达的影响(见图2~图3)
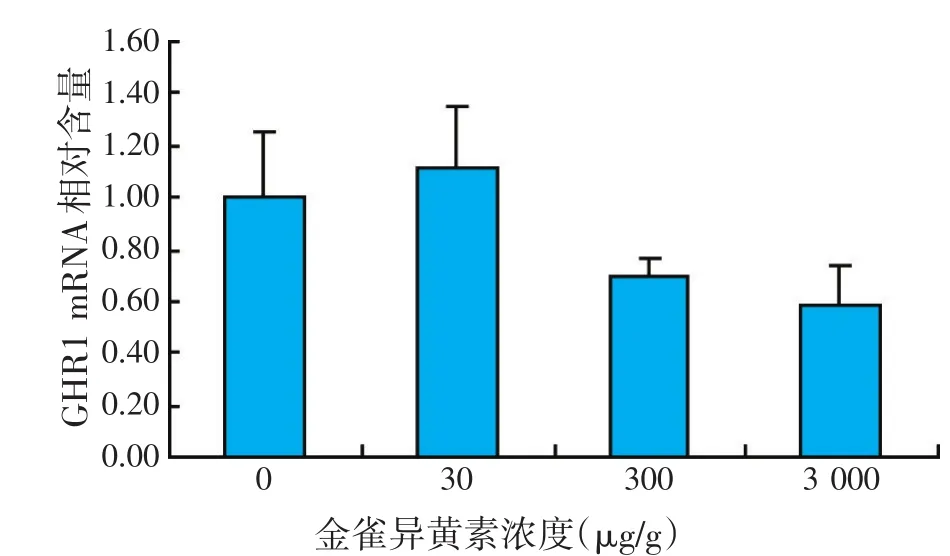
图2 金雀异黄素对肝脏GHR1基因表达水平的影响
如图2、图3所示,各处理组罗非鱼肝脏GHR1 mRNA表达水平与对照组相比,没有显著差异(P>0.05),而随着饲料中金雀异黄素添加量的增加,罗非鱼肝脏GHR2 mRNA表达水平逐步降低,当添加量为3 000 μg/g时,GHR2 mRNA表达水平比对照组显著降低(P<0.05),而30、300 μg/g组GHR2 mRNA表达水平与对照组没有显著差异(P>0.05)。
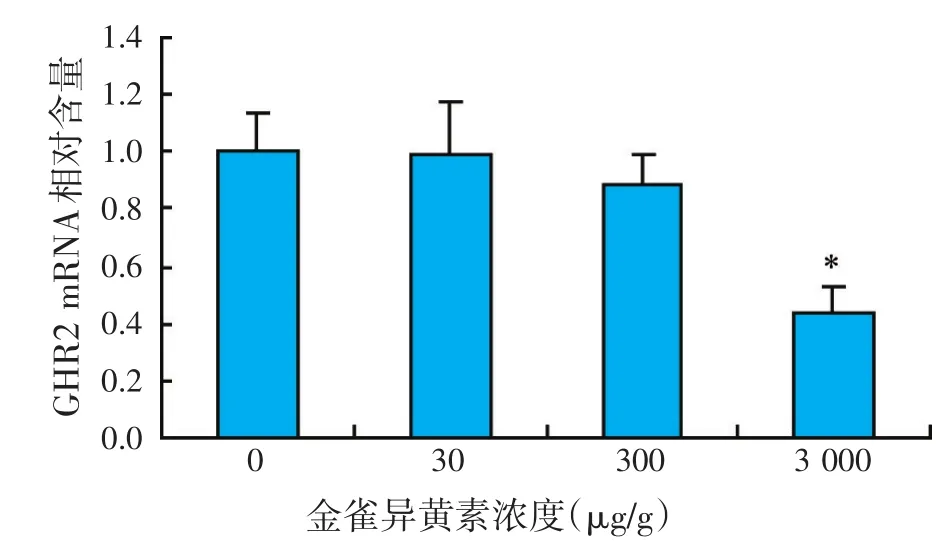
图3 金雀异黄素对肝脏GHR2基因表达水平的影响
2.4 金雀异黄素对罗非鱼肝脏IGF-I mRNA表达的影响(见图4)

图4 金雀异黄素对肝脏IGF-I基因表达水平的影响
如图4所示,随着饲料中金雀异黄素添加量的增加,罗非鱼肝脏IGF-I mRNA表达水平呈现下降的趋势,且当添加量为3 000 μg/g时,IGF-I mRNA表达水平比对照组显著降低(P<0.05),而30、300 μg/g组IGFI mRNA表达水平与对照组没有显著差异(P>0.05)。
3 讨论
本研究中配制的四组饲料蛋白质含量均达到了45%,能够满足罗非鱼对蛋白质的营养需求[15]。目前,豆类产品中金雀异黄素最大含量大约为5 900 μg/g[4],因此,当用豆粉完全替代鱼粉时,饲料中金雀异黄素的最高含量大约3 000 μg/g,所以本实验中金雀异黄素的最大添加量为3 000 μg/g。一些研究表明,豆粉中存在皂苷、寡糖、凝集素和蛋白酶抑制因子等诸多抗营养因子[16],这些因子会通过影响饲料的适口性而降低鱼类的食欲,减少鱼类的摄食量,进而抑制鱼类的生长[17],所以本研究选择直接向基础饲料中添加不同浓度的金雀异黄素,进而排除其它抗营养因子的影响。实验结果也表明,与对照组相比,各处理组罗非鱼的摄食率和饲料系数均没有显著变化,罗非鱼生长性能的差异主要是由不同浓度金雀异黄素的影响而产生的。
本研究表明,向饲料中添加较低浓度的金雀异黄素(0~300 μg/g),罗非鱼的生长没有显著变化,这一结果与许多研究结果基本一致,Rodriguez[18]和Catherine等[19]分别发现,500 μg/g的金雀异黄素对尼罗罗非鱼(Oreochromis niloticus)和虹鳟鱼(Oncorhynchus mykiss)的生长均没有显著影响,而Kinarm等[20]也观察到750 μg/g的金雀异黄素对黄金鲈鱼(Perca flavescens)的生长没有显著影响。而当添加3 000 μg/g的金雀异黄素时,则显著抑制了罗非鱼幼鱼的生长,其最终平均体重和特定生长率分别降低了15.82%和12.30%。与此类似,蔡英华[21]也发现,含金雀异黄素3 100 μg/g的饲料显著抑制了牙鲆(Paralichthys olivaceus)的生长。张伟[5]观察到,用金雀异黄素含量为7 200 μg/g的饲料饲喂异育银鲫(Carassius auratus gibelio×Cyprinus carpio)时,其最终平均体重与对照组相比显著降低了10.4%。但Pollack等[22]的研究却表明,8 000 μg/g的金雀异黄素对条纹鲈鱼(Morone chrysops)的生长没有显著影响。以上研究结果的较大差异可能与实验鱼的种类、发育阶段和鱼的性别等因素相关。尽管金雀异黄素对鱼类生长的抑制浓度在不同的研究中差别较大,但根据已有的研究结果可以看出,当金雀异黄素的含量在mg/g水平时或许才对鱼类的生长有潜在的抑制作用。
鱼类的生长主要受到GH/IGF-I生长轴线的调控[23],GH和IGF-I是该轴线中的核心因子。在正常的环境条件下,鱼类的生长状况与体内GH水平成正相关,处于快速生长期的罗非鱼血浆中的GH含量显著升高[24]。但在某些胁迫条件下,鱼体的生长状况与体内的GH水平也可能成负相关。Fox等[25]将莫桑比克罗非鱼禁食4周后,发现其最终平均体重和特定生长率均显著降低,但血浆GH含量及垂体GH mRNA表达量却显著升高;尼罗罗非鱼在含有久效磷农药的水中暴露3周后,其生长受到了显著的抑制,但其GH水平却显著升高[26]。本研究发现,罗非鱼垂体GH mRNA的表达水平与罗非鱼体生长状况趋势一致,均随着金雀异黄素含量的增加而逐步降低,3 000 μg/g的金雀异黄素显著抑制了垂体GH mRNA的表达,进而抑制了鱼体的生长。
IGF-I通过调控细胞代谢,促进细胞的有丝分裂、分化而介导GH的促生长作用,与GH相比,鱼体的生长状况与IGF-I水平有更高的相关性。在不同的温度条件下,尼罗罗非鱼的最终平均体重与肝脏IGF-I mRNA表达量呈显著正相关[27]。莫桑比克罗非鱼禁食2周后,其最终平均体重和特定生长率均显著下降,与此同时,其血浆IGF-I含量及肝脏IGF-I mRNA表达量也显著降低[28]。而且,鱼类垂体GH可以促进肝脏IGF-I基因的表达,并能提高血浆IGF-I浓度[29]。本研究中,3 000 μg/g金雀异黄素显著抑制了垂体GH mRNA的表达,这与肝脏IGF-I mRNA表达量和鱼体生长状况的变化趋势一致,均是随着金雀异黄素含量的增加而逐步降低,且3 000 μg/g饲料组比对照组显著降低。因此,金雀异黄素可通过抑制垂体GH而抑制肝脏IGF-I的合成,进而抑制罗非鱼的生长。
GH与肝脏表面的GHR结合后,刺激肝细胞合成并分泌IGF-I,因此GHR对IGF-I有重要的调控作用,其表达水平在某种程度上能够反映动物的生长状况。郑艳研究表明,GHR2是介导GH促生长作用的主要因子,其对GH的亲和力远高于GHR1[26]。本研究也发现,3 000 μg/g金雀异黄素显著抑制了GHR2 mRNA的表达,而对GHR1 mRNA的表达没有显著影响。由此可见,由于GHR2表达量的下降引起了IGFI表达水平的降低,进而抑制了罗非鱼的生长。
具有雌激素活性物质能够影响鱼类GHRs的表达。Lori(2009)研究表明,E2能够显著抑制雄性罗非鱼GHR1和GHR2的表达;o,p’-DDE能够显著抑制GHR2的表达,而对GHR1表达没有影响;七氯同样能够显著抑制GHR2的表达,但对GHR1表达有显著的促进作用[30]。关于这些雌激素活性物质调控GHRs表达的机理是通过与ERs结合还是通过影响甲状腺激素或神经系统发挥作用目前还不清楚,有待进一步研究。
4 结论
①30、300 μg/g金雀异黄素对罗非鱼终末均重和特定生长率均未产生显著影响,3 000 μg/g金雀异黄素显著降低了罗非鱼的生长,各处理组对罗非鱼的摄食率和饲料系数均未产生显著影响。
②随着金雀异黄素含量的增加,罗非鱼垂体GH和肝脏IGF-I mRNA表达量逐步降低,3 000 μg/g饲料组显著降低。各处理组对罗非鱼肝脏GHR1 mRNA表达量没有显著影响,3 000 μg/g饲料组显著降低了GHR2 mRNA表达量。
③高浓度金雀异黄素可通过抑制尼罗罗非鱼生长轴相关基因的表达,进而抑制鱼类的生长。

