元素综合推断题的解题策略分析
江苏 马秋英
元素综合推断题的解题策略分析
江苏 马秋英
在元素周期表中存在着纵横两种递变规律,与之相关的考题类型较多,其中最重要的是与元素位置、结构和性质相关的综合推断题。复习时要以解答这类题目来巩固知识,提升能力。下面具体举例,探析这类试题的解题策略。
一、元素推断的基本思路
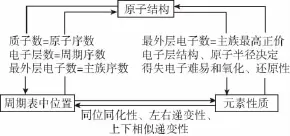
根据原子结构、元素周期表的知识及已知条件,可推算原子序数,判断元素在周期表中的位置等,基本思路如下:

二、元素推断的常见方法
1.根据原子结构推断
根据原子结构推断主族元素的基本依据是三个等式:核内质子数=原子序数,电子层数=周期数,最外层电子数=主族序数。复习时要在掌握核外电子排布规律的基础上,灵活运用以下规律:
(1)最外层电子数规律

最外层电子数(N)3≤N<8N=1或2N>次外层电子数元素在周期表中的位置主族ⅠA族、ⅡA族、Ⅷ族、副族、0族元素氦第二周期(Li、Be除外)
(2)“阴三阳四”规律
某元素阴离子最外层电子数与次外层相同,该元素位于第三周期。若为阳离子,则位于第四周期。
(3)“阴上阳下”规律
电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期——“阴上阳下”规律。
【例1】(2015全国Ⅱ)原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
【解析】a-的电子层结构与氦相同,则a是H;b、c的最外层分别有6、7个电子,次外层有8个电子,则b是S,c是Cl;c-和d+的电子层结构相同,则d是K。元素的非金属性次序为Cl>S>H,A正确;K只能形成离子化合物,不能形成共价化合物,B错误;K和其他3种元素均能形成离子化合物:KH、K2S和KCl,C正确;H、S、Cl元素各自最高正价和最低负价分别为+1和-1、+6和-2、+7和-1,各自最高和最低化合价的代数和分别为0、4、6,D正确。
【答案】B
2.由元素及其化合物的性质推断
元素及其化合物的一些特征性质可以成为推断的突破口,需要归纳记忆,熟练掌握。
(1)形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最高的元素:C。
(2)空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
(3)地壳中含量最多的元素、氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素:O。
(4)等物质的量的单质最轻的元素:H;最轻的金属单质:Li。
(5)单质在常温下呈液态的,非金属元素:Br;金属元素:Hg。
(6)最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Al。
(7)元素的气态氢化物和它的最高价氧化物对应的水化物能起化合反应的元素:N;能起氧化还原反应的元素:S。
(8)元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
(9)单质是重要的半导体材料、氧化物可用作光导纤维:Si。
(10)短周期中金属性最强的元素:Na;非金属性最强的元素:F。
【例2】(2015江苏)短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是( )
A.原子最外层电子数由多到少的顺序:Y、X、W、Z
B.原子半径由大到小的顺序:W、Z、Y、X
C.元素非金属性由强到弱的顺序:Z、W、X
D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
【解析】短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,则X为O;Y是至今发现的非金属性最强的元素,则Y为F;Z元素位于第3周期,其周期序数等于族序数,则Z为Al;W的单质广泛用作半导体材料,则W为Si。依据原子结构特点和元素周期律知识判断,原子最外层电子数:F>O>Si>Al,A正确;原子半径:Al>Si>O>F,B错误;非金属性:F>O>Si>Al,C错误;简单气态氢化物的稳定性:HF>H2O>SiH4,D错误。
【答案】A
3.由元素在周期表中的相对位置推断
给出一小部分元素周期表推断元素是一种常见题型,需要根据题目明确给出的信息或周期表结构中“隐藏”的信息进行推断。如第一周期只有两端有元素,如果某元素上方有相邻元素,则必为第三周期元素或Li或Ne。解题时,应先根据题示信息推出某种元素,然后顺藤摸瓜,由元素的位置关系确定其他元素。
(1)元素周期表的一些结构特点:①短周期元素只包括前三周期;②主族中只有ⅡA族元素全部是金属元素;③ⅠA族中的H元素不是碱金属元素;④元素周期表的第18列是0族,不是ⅧA族;⑤第8、9、10列是Ⅷ族,不是ⅧB族。
(2)主族元素在周期表中的特殊位置:①族序数等于周期数的元素:H、Be、Al;②族序数等于周期数2倍的元素:C、S;③族序数等于周期数3倍的元素:O;④周期数是族序数2倍的元素:Li、Ca;⑤周期数是族序数3倍的元素:Na、Ba;⑥最高正价与最低负价代数和为零的短周期元素:H、C、Si;⑦最高正价是最低负价绝对值3倍的短周期元素:S;⑧除H外,原子半径最小的元素:F;⑨最高正价不等于族序数的短周期元素:O(F无正价)。
【例3】(2015福建)短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
【解析】根据元素周期表的结构特点可知,W是第三周期元素。设W原子的最外层电子数为n,则2+8+n=3n,n=5,则W为15号元素磷;根据元素在周期表中的位置关系,可推出X为氮元素,Y为氧元素,Z为硅元素。根据同周期、同主族元素性质的递变规律,可确定原子半径:Si>P>N>O,A错误;最高价氧化物对应水化物的酸性:HNO3>H3PO4>H2SiO3,B正确;气态氢化物的热稳定性:H2O>NH3>PH3>SiH4,C正确;元素的最高化合价一般等于该元素原子的最外层电子数,D正确。
【答案】A
4.综合利用“位、构、性”关系推断
元素周期律是元素周期表的高度概括,元素周期表是元素周期律的具体体现。在元素周期表中,表的结构存在纵横关系,性质规律表现在周期性、相似性和递变性三个方面。元素在周期表中的位置、原子结构和元素性质三位一体,相辅相成,综合利用“位、构、性”关系推断元素是这部分的最重要题型。
【例4】(2015广东,双选)甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )

A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物可用于制造光导纤维
【解析】己的最高价氧化物对应水化物有强脱水性,则己为S;甲和丁与S在同一周期(第三周期),甲原子最外层与最内层具有相同电子数,则甲为Mg;根据图中各元素的相对位置,可推断出乙为Ca、丙为B、丁为Si、戊为As、庚为F。B与As的原子序数相差28,A正确;元素非金属性强弱顺序是F>S>As,故气态氢化物的稳定性应为庚>己>戊,B错误;常温下镁与水只能缓慢反应,C错误;SiO2可以用于制造光导纤维,D正确。
【答案】AD
(作者单位:江苏省常州市横山桥高级中学)

