钙处理管线钢中Al2O3夹杂物的动力学模型
李 阳,陈时雨,夏 玲,曹瀛丹,赵金鑫,杨 倩
(东北大学冶金学院,沈阳110819 )
钙处理管线钢中Al2O3夹杂物的动力学模型
李 阳,陈时雨,夏 玲,曹瀛丹,赵金鑫,杨 倩
(东北大学冶金学院,沈阳110819 )
在热力学计算的基础上,基于未反应核模型,建立了管线钢中Al2O3夹杂物变性的动力学模型.计算结果表明,Al2O3夹杂物变性过程最难阶段在中段,因此Al2O3夹杂物变性的中段应创造良好的夹杂物变性的动力学条件;Al2O3夹杂物的尺寸是影响夹杂物变性的重要因素,随着Al2O3夹杂物粒径的增加,变性难度急剧增加;本模型计算条件下,只有当钢液中Ca质量分数达到0.0014%时,夹杂物才可能变性为液态钙铝酸盐,钙处理用量不同,Al2O3夹杂物变性的产物也不同,应根据Al2O3夹杂物变性的目标产物决定用钙量,避免夹杂物变性过度.工业试验较好地验证了本模型的计算结果.
夹杂物;动力学;钙处理;管线钢
管线钢主要应用于制造石油天然气的输送管道,尤其是高级别、大口径管线钢,对其强韧性、加工、疲劳及焊接要求极为严格,工艺较为复杂.其冶炼过程中一般采用铝脱氧方式,但会带来一系列问题,如脱氧产物造成水口结瘤、残留在钢材中的Al2O3夹杂物在加工过程中易造成应力集中,从而成为裂纹源而导致断裂.因而,目前较流行的做法是不改变铝脱氧方式,而增加钙处理工艺.但钙处理技术并非十分成熟.比如钙处理过程中,钙的加入量及处理时间都对钙处理效果的优劣有着至关重要的影响.
已有许多学者对钙处理进行了研究.Lu等[1]建立了氧硫化物变性的动力学模型,认为尺寸大的夹杂物变性比尺寸小的夹杂物变性要困难得多.Park等[2]认为Al2O3夹杂物在变性开始时如同一个未反应的核,提出Al2O3与钢液间存在一层固态渣壳,在钢液、渣壳、Al2O3夹杂之间进行着渣金反应,变性过程的限制环节在于Al3+在渣壳中的扩散,但其只提出了模型存在一定的合理性,未建立完整的动力学模型.郭靖等[3]提出了铝镇静钢钙处理后氧化铝夹杂物变性的动力学模型,并用未反应核模型较详细地描述其变性过程,并认为Al2O3夹杂变性的控制环节存在于Al3+在液态钙铝酸盐层中的扩散.但其忽略了固态钙铝酸盐层内边界进行的变性反应产生的Al3+向外扩散比液态钙铝酸盐层内边界反应产生的Al3+向外扩散时间更长这一事实,且夹杂物边缘产生的Ca2+应参加各钙铝酸盐层的反应,不应只在一层反应.
本文在对X80冶炼过程中各工位取样并在相关检测的基础上,基于未反应核模型,建立了钙处理条件下Al2O3夹杂物变性的动力学模型,以期更好地揭示Al2O3夹杂物变性的过程及机理.
1 模型建立
按照逐级转变原则及CaO-Al2O3相图,Al2O3夹杂物在钙处理过程中应逐渐转变为如下化合物:Al2O3→ CaO·6Al2O3(S)(简记为CA6,下同) → CaO·2Al2O3(S)(CA2) → CaO·Al2O3(S)(CA) → 12CaO·7Al2O3(L)(C12A7) → 3CaO·Al2O3(L)(C3A).其中,C12A7和C3A在一般炼钢温度下(1 600 ℃)为液态.根据未反应核理论,可以将Al2O3视为未反应核,钢液中Ca通过扩散到达Al2O3表面后,逐层向内扩散反应,最终将其变性成为C3A和C12A7.本文以Al2O3夹杂变性成为C3A为例进行说明.
(1)Ca扩散到C3A层/钢液面,发生如下反应.
[Ca]-2e-=(Ca2+)
(1)
(2)Ca2+逐层向内扩散到未反应核Al2O3表面
(3)在Al2O3表面,Ca2+与Al2O3发生反应
3(Ca2+)+(Al2O3)=3(CaO)inCA6+2(Al3+)
(2)
(4)产生的Al3+向夹杂物外扩散
(5)在C3A层/钢液界面发生如下反应,之后产生的[Al]直接进入钢液.
(Al3+)+3e-=[Al]
(3)
上述反应进行同时有如下多个反应同时进行.
(1)Ca扩散到C3A层/钢液面,发生如下反应.
[Ca]-2e-=(Ca2+)
(4)
(2)Ca2+扩散到达CxAy层表面(CxAy可代表CA6、CA2、CA、C12A7)
(3)在CxAy层表面,Ca2+与Cx+1Ay+1层中Al2O3发生反应
3(Ca2+)+(Al2O3)inCxAy=3(CaO)inCx+1Ay+1+
2(Al3+)
(5)
式中:Cx+1Ay+1为CxAy外侧钙铝酸盐层.
(4)生成Al3+夹杂物内向外扩散
(5)在C3A层/钢液界面发生如下反应,之后产生的[Al]直接进入钢液.
(Al3+)+3e-=[Al]
(6)
图1为Al2O3夹杂物变性过程.由于高温、吹氩等因素,[Al]、[Ca]在钢液中非常容易扩散,所以整个变性过程反应速率的控制环节应为Al3+、Ca2+在钙铝酸盐中的扩散[2,4].高温下Al3+、Ca2+在钙铝酸盐中的扩散系数分别为DAl3+=4×10-11m2·s-1、DCa2+=1.2×10-10m2·s-1[5].

图1 Al2O3夹杂物变性过程
因为Ca2+扩散系数大于Al3+扩散系数,所以上述每个反应过程的控速环节都应为Al3+在钙铝酸盐内的扩散.除C3A层外,钙铝酸盐层内边界反应产生的Al3+向外扩散过程总是比其外边界反应产生的Al3+向外扩散过程中多经过一个钙铝酸盐层,而且此钙铝酸盐层比外侧相邻钙铝酸盐层更加难以穿越,如此内边界向内反应推进速率应比外边界要慢.各钙铝酸盐层外边界向内扩散反应的速率总是受到内边界扩散反应速率的制约.假定每当外边界与内边界无限接近时,便因受内边界向内推进速率较慢这一因素制约而停止,内边界继续向内推进,内外边界拉开一定距离时外边界将继续追赶,以如此方式循环进行.在这种变性方式下,除C3A层外,其余各个钙铝酸盐层将很薄,为建模计算方便,假定它们无限薄,其厚度可视为零.
归根结底,整个变性过程的控速环节应为CA6层/未反应核Al2O3界面变性反应产生的Al3+向外扩散过程,即Al3+在最厚钙铝酸盐层C3A中的扩散过程.由于除C3A层外,其余各个钙铝酸盐层内外边界无限接近,向内推进速率基本相同,所以可认为内边界反应产生的CxAy很快便被变性成为Cx+1Ay+1(Cx+1Ay+1为CxAy外侧钙铝酸盐层).因此可认为新产生的CA6在很短时间内便转变成为C3A.假设按反应(2)只产生了3 mol CaO.CaO和Al2O3进行以下反应
x(CaO)+y(Al2O3)=x(CaO)·yAl2O3
(7)
则3 mol CaO将产生3 mol CA6,若要将其变性成为C3A,则CaO与Al2O3摩尔比应为3/1,其中按反应(5)和反应(7),列方程如下:
(8)
式中:x为3个CA6中被还原的Al2O3个数.整个变性反应由无数个这样的反应组成.按计算结果,得出图1中界面b0处的Ca2+只有2/19参与CA6层/未反应核Al2O3界面的反应,其余则参与其他钙铝酸盐层的变性反应.
Al3+在C3A内扩散速率可表示为
(9)
式中:n为物质的量,mol;DAl为Al3+的扩散系数;c为浓度,mol·m-3;t表示时间,s.
C3A层中扩散速率可看成一个常数,重新调整式(9)中变量后,得:
(10)
积分可得
(11)
整理得
(12)
由式(2)可知,变性反应消耗的Al2O3速率
(13)
式中,mAl2O3为Al2O3的质量,MAl2O3为Al2O3的摩尔质量.根据式(10)和式(11),可以得到
(14)
上式中,ρAl2O3表示Al2O3密度.进一步得到夹杂物未反应核Al2O3半径与变性时间关系为
(15)
r=0时,所需时间为
(16)
若忽略边界b2、b0之间钙铝酸盐厚度,则tf即为变性完成最短时间.
由于ρAl2O3和MAl2O3均是常数,DAl已知,所以Al2O3夹杂物变性的时间由其粒径、边界b1、b2之间Al3+浓度差决定.
2 模型参数的确定
目前,很难确定各种复杂钙铝酸盐中Al3+的活度,因此,可以采用式(17)中Al的活度替代.由于Al3+在C3A中扩散是夹杂物变性速率控制性环节,可认为界面b0处Al3+迅速反应生成Al,可用钢液中Al的活度替代界面b0处Al3+的活度.也因为Al3+在C3A中扩散是夹杂物变性速率控制性环节,同理认为b0处Ca2+活度与钢液中Ca的活度相等.
由于b0边界处反应产生的Ca2+仅有2/19到达最内侧界面b2反应,Ca2+扩散非变性过程的控速环节,粗略认为钙铝酸盐中Ca2+活度系数相等,计算中简单以界面b2处Ca2+活度为2/19倍的b0边界处活度处理.
界面b2
3[Ca]+(Al2O3)=3(CaO)inCA6+2[Al]
(17)
反应的标准吉布斯自由能变量为

(18)
(19)
界面b0和b2上的活度
aAl,b0=fAlw[Al]%
(20)
(21)

表1 现场X80管线钢 RH喂钙结束成分(质量分数)

jCSiMnPSOAlCaejCa-0 34-0 097-0 0156-0 097-336*-0 072-0 002ejAl0 0910 005600 0330 03-6 600 045-0 047

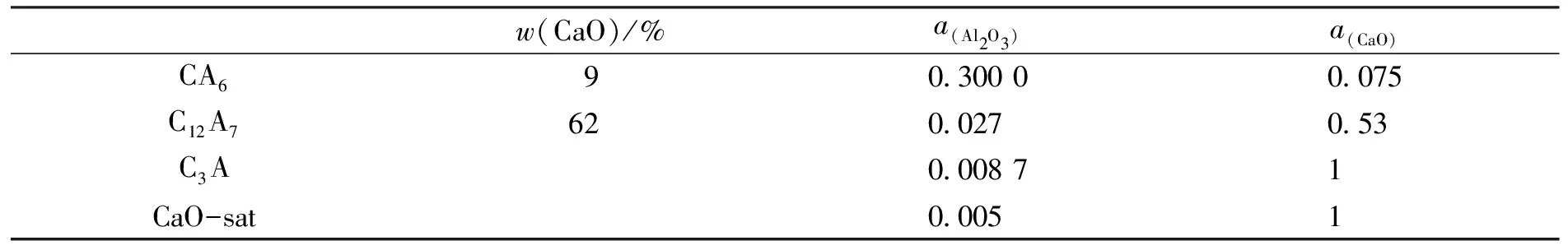
表3 不同钙铝酸盐中Al2O3和CaO的活度(1 873 K)
式(21)中,w[Ca]%为钢液中Ca的质量分数,%.fCa为钢液中Ca的活度系数,按表1中X80管线钢成分和 1 873 K 的相互作用系数(见表2),得fCa=4.6×10-4.类似地,fAl采用与fCa相同的计算方法,其 1 873 K 的相互作用系数如表2所示,计算得fAl=1.01.不同钙铝酸盐中CaO和Al2O3的活度[3 ,6]见表3.因为Al2O3中Al2O3基本达到饱和,可将aAl2O3视为1.
3 模型结果的分析与讨论
由图2,以15 μm曲线为例,可知随已完成变性的液态钙铝酸盐层C3A层厚度的不断增加,Al2O3夹杂物变性速率先减小后增大.Al2O3夹杂物变性开始时速率逐渐减小,变性接近完成时速率变大.对比图2三条曲线可知,相同变性量所需时间随Al2O3夹杂半径的增加而急剧增加.
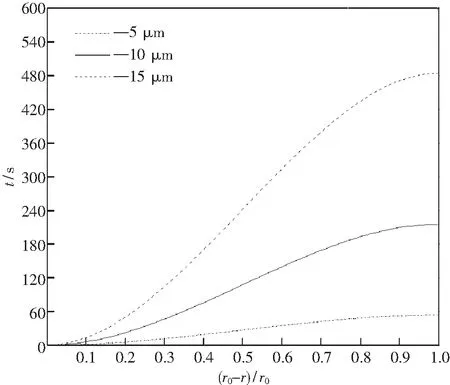
图2 变性时间与Al2O3尺寸的关系(w[Ca] =0.0034%)
如图3所示,完全变性时间随Al2O3夹杂物半径的增长而快速增加.由图3还可以看出,钢液中Ca质量分数越大,同一尺寸Al2O3夹杂物的完全变性时间越短.但钙处理过重会导致CaO和CaS的产生.所以应根据Al2O3夹杂物尺寸,合理选择钙处理用钙量.

图3 夹杂物尺寸对Al2O3夹杂物完全变性时间的影响
图4所示,当Ca含量的增加时,Al2O3夹杂物完全变性时间急剧减小,夹杂物变性速率增快.即,钙含量增加对加快夹杂物变性速率具有促进作用,但是这种促进作用会随着钙含量的增加而逐渐减弱.
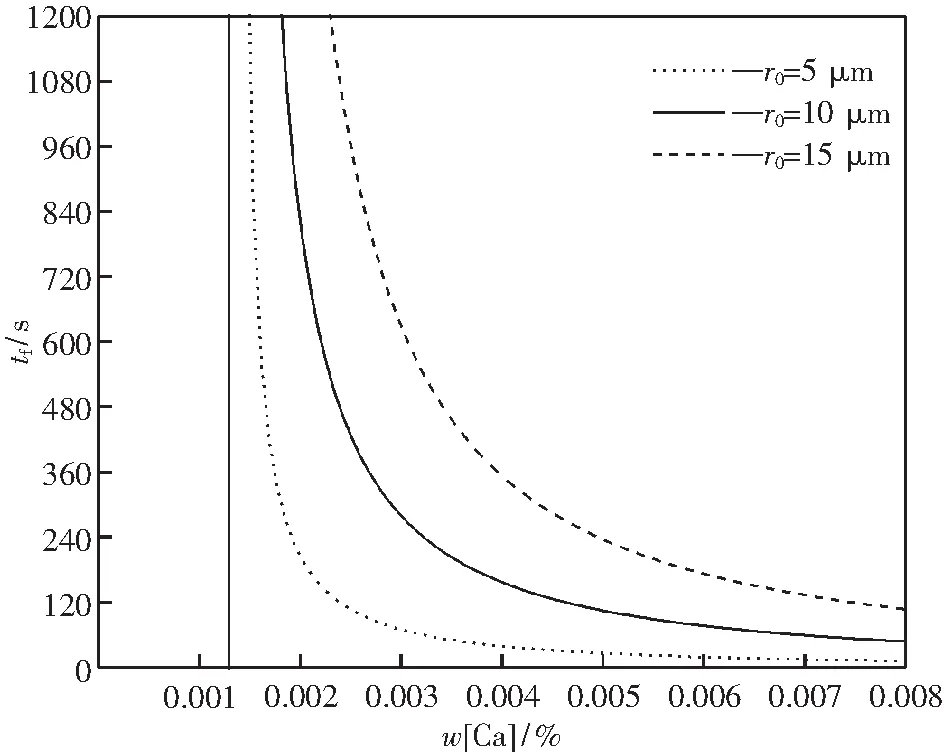
图4 钢液中w[Ca]对不同尺寸的Al2O3夹杂物完全变性为C3A时间的影响
图4曲线是从w[Ca]约0.0014%开始的,这说明只有当w[Ca]大于0.0014%时,才能使Al2O3夹杂物具有变性至C3A的能力,但是变性能否彻底完成,还要看在动力学条件下的Al2O3夹杂物尺寸和钙处理后的静吹时间能否满足.
以15 μm Al2O3夹杂物,静吹时间10 min为例,若要使夹杂物完成变性,w[Ca]应有0.0031%,若低于0.0031%,基于逐层变性理论,在此认为C12A7变性成为C3A的反应层将自动消失,Al2O3夹杂物将寻求变性成为C12A7.若w[Ca]高于0.0031%,则可能使夹杂物变性过度.
同理,如果Al2O3夹杂物变性成为C12A7,如图5所示,w[Ca]大于0.0011%时,才能使Al2O3夹杂物具有变性至C12A7的能力.同样,以15μm Al2O3夹杂物,静吹时间10 min为例,若要使夹杂物完成变性,w[Ca]应有0.0027%,若低于0.0027%,则CA变性至C12A7反应层将消失,Al2O3夹杂物将转而变性至CA,若钙含量更低,则变性至合适种类的钙铝酸盐或无法对Al2O3夹杂物变性.若w[Ca]高于0.0027%低于0.0031%,我们认为Al2O3夹杂物变性为介于C12A7和C3A之间的钙铝酸盐,w[Ca]为0.0031%时,夹杂物变性为C3A,高于0.0031%,则可能使夹杂物变性过度.夹杂物的尺寸是不同的,如果钙处理所用钙量可以在10 min时刚好完成对15 μm Al2O3夹杂物的变性,那么尺寸小于15 μm的Al2O3夹杂物则早已完成变性.

图5 钢液中Ca含量对不同尺寸的Al2O3夹杂物完全变性为C12A7的影响
因此为了不让尺寸小于15 μm的Al2O3夹杂物变性过度,应当加强静吹过程的搅拌强度,保持小气泡大流量吹气,及时将已变性完成的Al2O3夹杂物上浮去除,以防止Al2O3夹杂物变性过度,导致CaO、CaS的析出.值得一提的是钢液中钙含量在钙处理过程中是一个变化的过程,而本模型建立在钙含量不变基础之上,应用时应综合该处理前后钙含量考量.
4 工业验证
为了验证本模型的结果,通过国内某钢厂现场取样,使用扫描电镜,直读光谱,透射电镜等方法分析,找到了本模型合理的证明.该钢厂X80管线钢采用BOF-LF-RH-CC工艺流程生产,RH结束后喂SiCa线,然后静吹10 min,使Al2O3夹杂物变性上浮.将喂线结束后10 min提桶样进行电子探针分析,得到典型夹杂物面扫描图.
如图6所示,该夹杂物尺寸约为30 μm,w[Ca] =0.0034%,底吹10 min条件下,夹杂物不能完成变性.钙从夹杂物的外表面向内扩散的过程中,钙含量逐渐降低,从而证明了本模型具有一定合理性.
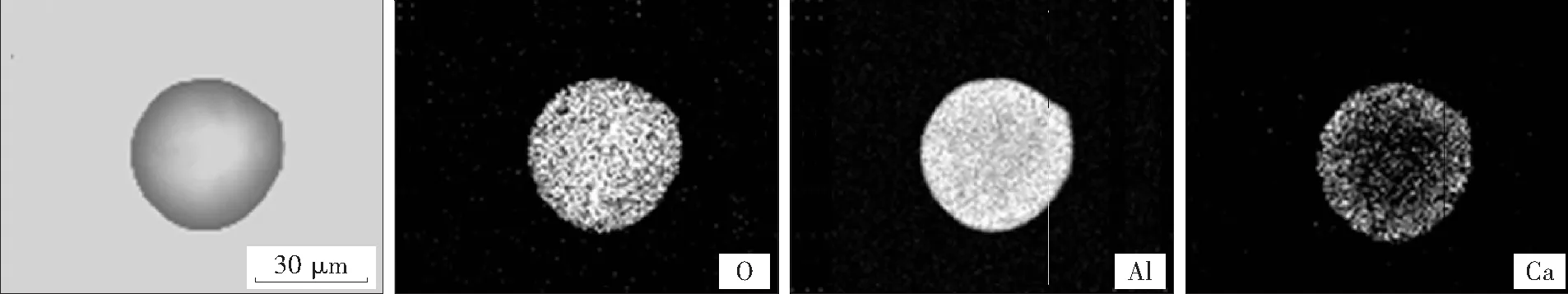
图6 钙处理10 min典型夹杂物电子探针照片
5 结 论
以未反应核模型为基础,结合热力学计算构建了管线钢中Al2O3夹杂物变性的动力学模型,得出以下结论:
(1)Al2O3夹杂物变性过程最难阶段在中段而不是末端,因此Al2O3夹杂物变性的中段应加强促进夹杂物变性动力学条件,如加强搅拌、提高炉温、加大底吹流量等.
(2)脱氧生成的Al2O3夹杂物的尺寸是影响夹杂物变性的重要因素,随着Al2O3夹杂物粒径的增加,变性难度急剧增加.
(3)本模型计算条件下,只当钢液w[Ca]达到0.0014%时,夹杂物才可能变性为液态钙铝酸盐.钙含量增加对加快夹杂物变性速率具有促进作用,但是这种促进作用会随着钙含量的增加而逐渐减弱.
(4)实际操作过程中,钙处理用量不同,Al2O3夹杂物变性的产物也不同,应根据Al2O3夹杂物变性的目标产物决定用钙量.应加强静吹过程的搅拌强度,及时将已完成变性的夹杂物排出,避免夹杂物变性过度.
[1]Lu D Z, Irons G A, Lu W K. Kinetics and mechanisms of calcium dissolution and modification of oxide and sulphide inclusions in steel[J]. Iron Making and Steelmaking, 1994, 21(5) : 362-371.
[2]Park J H, Kim D S, Lee S B. Inclusion control of ferritic stainless steel by aluminum deoxidation and calcium treatment[J]. Metall Mater Trans B, 2005, 36(1): 67-73.
[3]郭靖, 程树森, 程子建, 等. 铝镇静钢钙处理后氧化铝夹杂物变性的动力学模型[J]. 北京科技大学学报, 2014, 36(4):424-431. (Guo Jing, Cheng Shusen, Cheng Zijian,etal. Kinetic modeling of alumina inclusion modification in Al-killed steel after Ca treatment[J]. Journal of University of Science and Technology Beijing, 2014, 36(4): 424-431.)
[4]Guozhu Y E. Thermodynamics and kinetics of the modification of Al2O3inclutions[J]. ISIJ International, 1996, 36(Suppl): 105-108.
[5]张国华, 薛庆国, 李丽芬, 等. CaO-Al2O3-SiO2熔体的电导率扩散系数研究[J]. 北京科技大学学报, 2012, 34(11): 1250-1255. (Zhang Guohua, Xue Qingguo, Li Lifen,etal. Studies on the electrical conductivities and diffusion coefficients of ions in CaO-Al2O3-SiO2melt [J]. Journal of University of Science and Technology Beijing, 2012, 34(11): 1250-1255.)
[6]Choudhary S K, Ghosh A. Thermodynamic evaluation of formation of oxide-sulfide duplex inclusions in steel[J]. ISIJ International, 2008, 48(11) : 1552-1559.
[7]The Japan Society for the Promotion of Science. Steelmaking data sourcebook[M]. New York: Gordon and Breach Science Publishers, 1988.
[8]Elliott J F, Gleiser M, Ramakrishna V. Thermochemistry for steelmaking[M]. London: Addison-Wesley, 1963.
[9]唐海燕. EAF-LF-VD-CC流程生产的N80套管钢中非金属夹杂物控制研究[D]. 北京:北京科技大学, 2007. (Tang Haiyan. Study on inclusion control for N80 casing steel produced by EAF-LF-VD-CC process[D]. Beijing: University of Science and Technology Beijing, 2007.)
A kinetics model of Al2O3inclusions in the treated pipeline steel by calcium
Li Yang, Chen Shiyu, Xia Ling, Cao Yingdan, Zhao Jinxin, Yang Qian
( School of Metallurgy , Northeastern University, Shenyang 110819)
A kinetics model of Al2O3inclusions modification in pipeline steel was established according to the thermodynamic calculation and based on the unreacted core model. The results showed that, the most difficult step in Al2O3inclusions modification process is in the middle stage. Therefore, a favorable kinetics condition should be created in the middle stage for Al2O3inclusions to modificy ,size of the Al2O3inclusions is an important factor for the inclusion modification, and the difficulty index dramatically increases with increase of the Al2O3inclusions size. Under the calculated conditions of the model, only when the Ca content(mass fraction) in the molten steel reached 0.0014%, the inclusions can be modified to liquid calcium-aluminate and modification product of the Al2O3inclusions is different with the calcium amount. So calcium content in the treatment process should be depended on the target product of Al2O3inclusions modification. The industrial test verified the results of the authors model well.
inclusion; kinetics; calcium treatment; pipeline steel
10.14186/j.cnki.1671-6620.2016.03.005
TF 769.2
A
1671-6620(2016)03-0181-06

