程序性死亡受体1、程序性死亡配体1和神经生长因子在肝癌组织中的表达及意义
杨 硕,张云辉,孙艳玲,周志平,施 明
程序性死亡受体1、程序性死亡配体1和神经生长因子在肝癌组织中的表达及意义
杨 硕,张云辉,孙艳玲,周志平,施 明
[摘要]目的 检测肝细胞癌组织中程序性死亡受体1(programmed death 1, PD-1)及其主要配体程序性死亡配体1 (programmed death ligand-1, PD-L1)、神经生长因子(nerve growth factor, NGF)的表达与不同病理分级、肝癌临床分期、肝功能及AFP的关系。方法 采用免疫组织化学法检测63例肝癌石蜡包埋组织标本中PD-1、PD-L1和NGF的表达量,16例正常供体肝脏石蜡包埋组织标本作为正常对照组。比较不同病理分级、不同肝癌临床分期、不同肝功能及不同AFP水平情况下肝癌组织中PD-1、PD-L1和NGF的表达差异。结果 肝癌组织中PD-1、PD-L1和NGF阳性表达率高于正常对照组(P<0.05),不同病理分级肝癌组织中PD-1、PD-L1及NGF的阳性表达率不同,以中分化肝癌最高(P<0.05)。PD-1、PD-L1及NGF阳性表达率以肝癌巴塞罗那分期C期升高最为显著(P<0.05)。不同肝功能Child分级患者肝癌组织中PD-1、PD-L1和NGF阳性表达率差异无统计学意义。肝癌组织PD-1、PD-L1、NGF阳性表达率在血清AFP水平≥400 μg/L与<400 μg/L患者中差异有统计学意义,前者高于后者,而在年龄≥50岁与<50岁患者中差异无统计学意义。结论 肝癌患者肝癌组织PD-1、PD-L1和NGF阳性表达率明显升高。PD-1、PD-L1和NGF在肝癌组织中的表达可能在肝癌发生、发展及转移过程中可能发挥一定作用。
[关键词]癌,肝细胞;淋巴细胞活化;淋巴细胞;评价研究
[作者单位] 100850 北京,军事医学科学院2012级研究生队(杨硕),基础医学研究所(杨硕、施明);100039 北京,解放军第三〇二医院医学信息中心(张云辉),肝胆外科二中心(孙艳玲),感染性疾病诊疗与研究中心(周志平)
肝癌的发病机制十分复杂,其发生、发展和转移与多种基因突变、细胞信号传导通路异常及多种免疫逃避等有关。在肿瘤免疫应答中,肿瘤抗原特异性T淋巴细胞的诱导凋亡是肿瘤免疫逃避的主要机制。已知T淋巴细胞的活化需要抗原提供的第一信号和协同刺激分子提供的第二信号。程序性死亡受体1(programmed death 1, PD-1)及其主要配体程序性死亡配体1(programmed death ligand-1, PD-L1)作为免疫球蛋白超家族协同刺激分子的重要成员,为负性免疫调节信号,近年来被证实与T淋巴细胞免疫功能缺陷相关,是导致肿瘤免疫逃逸的重要机制[1-2]。神经生长因子(nerve growth factor, NGF)是神经营养蛋白家族的一种,是一种与神经细胞的分化、生长、修复、再生有关的细胞因子。研究显示,NGF还与肿瘤的发生、侵袭、转移有关[3-4]。本研究检测肝癌组织中PD-1、PD-L1及NGF的表达,分析与患者不同肝癌病理分级、肝癌临床分期、肝功能及AFP的关系,讨论其在肝癌发生、发展中的作用。
1 对象与方法
1.1对象 选取 2011年6月—2015年1月在解放军第三〇二医院住院行手术治疗的HBV相关肝癌患者63例,其中男57例,女6例,年龄30~70(51.23±5.50)岁。63例均接受核苷(酸)类似物抗病毒治疗,入院后检测HBV DNA均为阴性,HBsAg均为阳性,肝癌标本术后病理检查结果均为肝细胞癌。
采用免疫组织化学(免疫组化)法检测63例肝癌石蜡包埋组织标本中PD-1、PD-L1和NGF的分布和表达情况,根据病理检查结果将63例分为3组:高分化组20例,中分化组25例,低分化组18例。对照组来自同院肝胆外科二中心提供的16例正常供体肝脏石蜡包埋组织标本,16例供者均为男性,年龄30~42岁。所有标本均经10%福尔马林液固定,石蜡包埋切片。
1.2免疫组化检测 石蜡切片在65 ℃烤箱干烤30 min,在二甲苯中浸泡15 min,然后在无水乙醇、95%乙醇、80%乙醇、70%乙醇中分别浸泡各5 min,双蒸水浸泡5 min。将切片浸入枸橼酸修复液(0.01 mol/L,pH值6.0)中进行抗原修复。室温下用磷酸盐缓冲液洗涤3次,0.3%双氧水室温孵育15 min,以消除内源性过氧化物酶的活性,室温下磷酸盐缓冲液洗涤3次。滴加正常羊血清封闭液,37 ℃孵育30 min。滴加适当1∶200稀释的第一抗体,4 ℃ 孵育过夜。磷酸盐吐温缓冲液冲洗3次,滴加辣根过氧化物酶标记山羊抗兔IgG,37 ℃ 孵育30 min,磷酸盐吐温缓冲液冲洗3次,二甲氨基偶氮苯显色苏木素复染,4 min后流水冲洗。分别在70%乙醇、80%乙醇、95%乙醇和无水乙醇中脱水各3 min。中性树脂封片,OLYMPUS显微镜观察切片并拍照。
1.3结果判断标准 免疫组化切片均由2名资深病理科医师双盲独立观察评估,以细胞质或细胞膜出现黄至棕褐色颗粒为阳性显色。先在低倍镜下观察切片整个视野,分别在肿瘤细胞及肿瘤间质随机选择5个高倍视野(×400),染色强度分级如下:无着色为0分,淡黄色为1 分,棕黄色为2分,棕褐色为3分;阳性细胞密度分级为:阳性细胞数≤10%为1分,10%~50%为2分,>50%为3分。2项得分相乘结果≥3分为阳性表达。肿瘤细胞及肿瘤间质内任一项阳性均为阳性表达[5-6]。
1.4统计学处理 用CHISS 2004软件进行统计分析计量资料呈正态分布或近似正态分布,用±s表示。2组计量资料差异性比较用成组t检验(组间方差齐);多组间计量资料差异性比较用单因素方差分析(组间方差齐),多重比较用q检验。P<0.05表示差异有统计学意义。
2 结果
2.1PD-1、PD-L1、NGF在肝癌组织中的分布及表达
2.1.1分布 肝癌组织免疫组化染色可见PD-1、PD-L1和NGF分布,而正常肝组织染色较少见到(图1)。

图1 肝组织免疫组化染色结果(×400)Figure 1 Immunohistochemical staining of liver tissue(×400)
2.1.2 PD-1阳性表达率 PD-1在高分化组、中分化组、低分化组和对照组的阳性表达率见表1,4组差异有统计学意义。PD-1阳性表达率在高、中、低分化肝癌组织中明显高于正常组织(P均<0.05),其中以中分化肝癌组织阳性率最高(P均<0.05),但高分化组与低分化组差异无统计学意义。
2.1.3PD-L1阳性表达率 PD-L1在高分化组、中分化组、低分化组和对照组的阳性表达率见表1,4组差异有统计学意义。PD-L1阳性表达率在高、中、低分化肝癌组织中明显高于正常组织(P均<0.05),其中以中分化肝癌组织阳性率最高,其次为高分化组和低分化组(P均<0.05)。
2.1.4NGF阳性表达率 NGF在高分化组、中分化组、低分化组和对照组的阳性表达率见表1,4组差异有统计学意义。NGF阳性表达率在高、中、低分化肝癌组织中明显高于正常组织(P均<0.05),其中以中分化肝癌组织阳性率最高,其次为高分化组和低分化组(P均<0.05)。
表1 不同病理分化肝癌组织PD-1、PD-L1和NGF阳性表达率(±s,%)Table 1 Positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens with different pathological differentiation (±s,%)

表1 不同病理分化肝癌组织PD-1、PD-L1和NGF阳性表达率(±s,%)Table 1 Positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens with different pathological differentiation (±s,%)
注:多重比较用q检验,a. 与高分化组比较,P<0.05;b. 与中分化组比较,P<0.05;c. 与低分化组比较,P<0.05
病理分级 n PD-1 PD-L1 NGF高分化组 20 3.33±0.47 5.70±1.31 3.00±0.78中分化组 25 32.97±2.87a21.77±1.81a17.77±1.46a低分化组 18 3.46±0.84b2.57±1.71ab8.67±1.07ab对照组 16 1.57±0.19abc1.19±0.32abc2.06±0.26abcF值 1 918.400 863.296 1 030.144 P值 0.000 0.000 0.000
2.2不同年龄患者肝癌组织PD-1、PD-L1、NGF阳性表达率 年龄≥50岁和<50岁患者肝癌组织PD-1、PD-L1、NGF阳性表达率差异无统计学意义(表2)。
表2 不同年龄患者肝癌组织PD-1、PD-L1和NGF阳性表达率(±s,%)Table 2 Positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens of patients at different ages (±s,%)

表2 不同年龄患者肝癌组织PD-1、PD-L1和NGF阳性表达率(±s,%)Table 2 Positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens of patients at different ages (±s,%)
年龄(岁)n PD-1 PD-L1 NGF ≥50 39 14.65±8.24 9.24±5.32 10.52±3.21 <50 24 12.92±6.28 7.91±6.65 8.55±4.76 t值 0.882 0.875 1.963 P值 0.381 0.385 0.054
2.3不同肝功能Child分级患者肝癌组织PD-1、PD-L1和NGF阳性表达率 PD-1、PD-L1和NGF在不同肝功能Child分级患者肝癌组织表达差异无统计学意义(表3)。
表3 不同肝功能Child分级患者肝癌组织PD-1、PD-L1 和NGF阳性表达率(±s,%)Table 3 Positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens of patients with different Child-Pugh grades(±s,%)
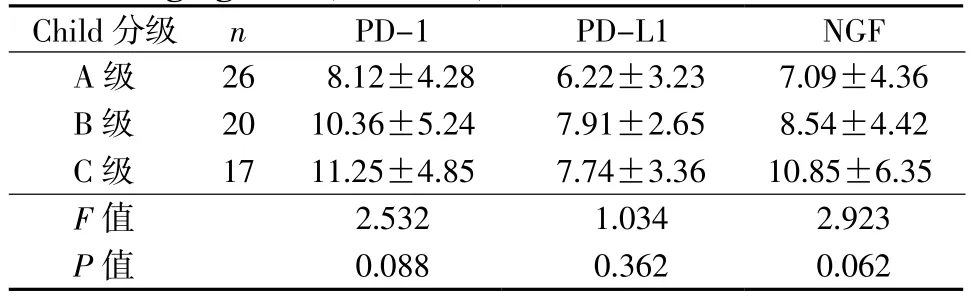
表3 不同肝功能Child分级患者肝癌组织PD-1、PD-L1 和NGF阳性表达率(±s,%)Table 3 Positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens of patients with different Child-Pugh grades(±s,%)
Child分级 n PD-1 PD-L1 NGF A级 26 8.12±4.28 6.22±3.23 7.09±4.36 B级 20 10.36±5.24 7.91±2.65 8.54±4.42 C级 17 11.25±4.85 7.74±3.36 10.85±6.35 F值 2.532 1.034 2.923 P值 0.088 0.362 0.062
2.4不同巴塞罗那分期患者肝癌组织PD-1、PD-L1和NGF阳性表达率 巴塞罗那分期C期患者PD-1、PD-L1和NGF阳性表达率最高(P均<0.05),而A、B、D期患者之间差异无统计学意义(表4)。
表4 不同巴塞罗那分期患者肝癌组织PD-1、PD-L1和NGF阳性表达率(±s,%)Table 4 Positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens of patients at different Barcelona clinic liver cancer stages (±s,%)

表4 不同巴塞罗那分期患者肝癌组织PD-1、PD-L1和NGF阳性表达率(±s,%)Table 4 Positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens of patients at different Barcelona clinic liver cancer stages (±s,%)
注:多重比较用q检验,a. 与A期比较,P<0.05;b. 与B期比较,P<0.05;c. 与C期比较,P<0.05
巴塞罗那分期 n PD-1 PD-L1 NGF A期 16 5.01±5.62 5.65±4.43 4.56±5.98 B 期 21 7.25±3.42 6.35±4.25 6.76±3.58 C期 15 11.65±6.58ab10.88±7.69ab 9.87±3.23abD期 11 8.27±5.89 6.97±5.38 7.35±3.28 F值 4.203 2.837 4.320 P值 0.009 0.046 0.008
2.5不同血清AFP水平患者PD-1、PD-L1和NGF阳性表达率 血清AFP水平≥400 μg/L患者肝癌组织PD-1、PD-L1和NGF阳性表达率明显高于<400 μg/L岁患者(P均<0.05)。见表5。
表5 不同AFP水平患者肝癌组织PD-1、PD-L1和NGF阳性表达率(±s,μg/L)Table 5 Positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens of patients with different AFP levels (±s,μg/L)

表5 不同AFP水平患者肝癌组织PD-1、PD-L1和NGF阳性表达率(±s,μg/L)Table 5 Positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens of patients with different AFP levels (±s,μg/L)
AFP(μg/L) n PD-1 PD-L1 NGF ≥400 48 13.25±7.12 9.96±7.49 11.05±5.28 <400 15 6.58±5.34 5.35±4.76 7.69±4.87 t值 3.339 2.240 2.189 P值 0.001 0.029 0.032
3 讨论
细胞免疫是机体抗肿瘤免疫的主要免疫机制,在细胞免疫应答过程中,T淋巴细胞充当了主要角色。T淋巴细胞在静息状态下低表达PD-1,而T淋巴细胞的激活引起PD-1表达上调。PD-1 作为一种抑制共受体,与PD-L1相互作用后能抑制T淋巴细胞活性,使细胞阻滞在G0/G1期,从而抑制T淋巴细胞的增殖,阻碍其分化为浆细胞,并诱导T淋巴细胞凋亡。在肿瘤免疫应答中,肿瘤抗原特异性T淋巴细胞的诱导凋亡是肿瘤免疫逃避的主要机制。机体免疫细胞的激活或抑制是通过正性信号和负性信号来调节,PD-1/PD-L1是负性免疫调节信号,抑制了肿瘤特异性T淋巴细胞的免疫活性,介导了免疫逃逸[7-10]。
目前有研究资料证实,肝癌细胞能使自身表面抗原修饰和周围微环境改变,肝癌组织中PD-1阳性的T淋巴细胞浸润也明显增强。在肝癌组织中,PD-L1可与PD-1结合,参与肝脏T淋巴细胞介导的免疫耐受,抑制肝脏组织中细胞毒性T淋巴细胞的功能,逃避机体免疫识别,诱导肝癌细胞的免疫逃避,从而导致肿瘤转移以及复发等。目前PD-1/PD-L1信号通路成为肿瘤免疫研究的热点之一[9-12]。
近年研究发现PD-1/PD-L1信号通路的异常与肿瘤、自身免疫性疾病以及HIV、HBV和HCV等慢性感染有关,癌组织高表达PD-1和PD-L1,造成肿瘤细胞的免疫逃逸,导致肿瘤的发生和发展。在原发性肝癌、黑色素瘤、乳腺癌、胶质瘤、淋巴瘤、白血病及各种泌尿系肿瘤、消化道肿瘤、生殖系肿瘤等肿瘤组织中已观察到PD-1和PD-L1的过量表达[11,13]。但PD-1/PD-L1在肝癌组织中的表达相关文献较少。
NGF在肿瘤中所发挥的作用及其机制尚不完全明确。有研究认为,NGF与肿瘤血管生成关系密切,NGF可能具有提高血管内皮生长因子表达的功能。NGF通过提高血管内皮生长因子的表达,间接促进血管内皮细胞的增殖和迁移,从而促进肿瘤血管生成和肿瘤生长。此外,国外研究发现NGF具有增加肿瘤细胞肝素酶分泌的作用[12,14]。肝素酶能够降解硫酸肝素多糖,从而降解基膜,促使细胞通过基膜,利于肿瘤侵袭和转移 。因此,NGF可能通过增加肿瘤细胞肝素酶的分泌而促进肿瘤细胞侵袭转移[13,15]。
本研究结果显示,肝癌组织PD-1、PD-L1和NGF阳性表达率显著高于健康人肝脏组织;PD-1 和PD-L1阳性率在高、中和低分化肝癌组织中以中分化肝癌组织阳性率最为明显,提示肝癌组织中PD-1和PD-L1高表达可能与PD-1/PD-L1信号通路激活有关;巴塞罗那分期C期患者PD-1、PD-L1和NGF阳性表达率最高(P均<0.05),而A、B和D期患者之间差异无统计学意义;血清AFP水平≥400 μg/L患者肝癌组织PD-1、PD-L1和NGF阳性表达率明显高于<400 μg/L岁患者(P<0.05)。另外,PD-1、PD-L1和NGF阳性表达率与肝细胞癌患者的年龄(以50岁为界值)、肝功能Child分级无关(P均>0.05)。
本研究提示PD-1和PD-L1在肝癌组织中高表达,与近年研究结果一致[10,14-15]。PD-1/PD-L1与肝癌的免疫逃逸有关,可能与肝癌组织微环境中PD-1/PD-L1信号通路激活,抑制T淋巴细胞的增殖,阻碍其分化为浆细胞,并诱导T淋巴细胞的凋亡,利于肝癌细胞发生细胞免疫逃逸。PD-1/ PD-L1阳性率在高、中和低分化肝癌组织中以中分化肝癌组织阳性率最为明显,机制尚不清楚,但提示中分化肝癌患者是PD-1/PD-L1抗体治疗的合适人群[15]。
巴塞罗那分期是一种肝癌临床分期系统,是目前被认为最好的分期系统并在大量的临床研究中得到证实。本研究提示NGF在肝癌组织中高表达,NGF阳性率在高、中和低分化肝癌组织中以中分化肝癌组织阳性率最为明显。NGF与巴塞罗那分期有关,随着巴塞罗那分期升高,NGF阳性表达率也逐级升高,提示NGF与肝癌生长及转移有关。
综上,肝癌患者肝癌组织PD-1、PD-L1和NGF阳性表达率明显升高,PD-1、PD-L1和NGF在肝癌组织中的表达可能在肝癌发生、发展及转移过程中发挥一定作用。这些结论是否可以用于肝癌的诊断、治疗和患者疾病进展的判断,有待于大样本量研究的进一步探索。
【参考文献】
[1] Blake SJ, Ching AL, Kenna TJ, et al. Blockade of PD-1/PDL1 promotes adoptive T-cell immunotherapy in a tolerogenic environment[J]. PLoS One, 2015, 10(3):e0119483.
[2] Taube JM, Klein A, Brahmer JR, et al. Association of PD-1, PD-1 ligands, and other features of the tumor immune microenvironment with response to anti-PD-1 therapy[J]. Clin Cancer Res, 2014, 20(19):5064-5074.
[3] 何学元,张有成.神经生长因子及其受体与肿瘤相关性研究进展[J].国际消化病杂志,2010,30(4):234-236.
[4] 冼成恩,刘胜. 神经生长因子在颅脑外伤中的应用进展[J].中国现代医生,2013,51(11):29-31.
[5] 中华人民共和国卫生部. 原发性肝癌诊疗规范( 2 0 1 1 年版)[J]. 临床肝胆病杂志,2011,27(11):1141-1159.
[6] Bosman FT, Carneiro F, Hruban RH, et al. 消化系统肿瘤WHO分类[M]. 崔全才,孟宇宏,王鲁平,译. 4版. 北京:诊断病理学杂志社,2012:434.
[7] Dolan DE, Gupta S. PD-1 pathway inhibitors: changing the landscape of cancer immunotherapy[J]. Cancer Control, 2014, 21(3):231-237.
[8] Chang DY, Song SH, You S, et al. Programmed death-1 (PD-1)-dependent functional impairment of CD4+T cells in recurrent genital papilloma[J]. Clin Exp Med, 2014, 14(3):305-313.
[9] Mamalis A, Garcha M, Jagdeo J. Targeting the PD-1 pathway: a promising future for the treatment of melanoma[J]. Arch Dermatol Res, 2014, 306(6):511-519.
[10] 曾珍,石峰,张敏娜,等. 肝细胞癌患者CD8+T淋巴细胞上PD-1高表达的意义研究[J]. 传染病信息,2009,22(2):83-85.
[11] Madore J, Vilain RE, Menzies AM,et al. PD-L1 expression in melanoma shows marked heterogeneity within and between patients: implications for anti-PD-1/PD-L1 clinical trials[J]. Pigment Cell Melanoma Res, 2015, 28(3):245-253.
[12] Lussier DM, O’Neill L, Nieves LM, et al. Enhanced T-cell immunity to osteosarcoma through antibody blockade of PD-1/PDL1 interactions[J]. J Immunother, 2015, 38(3):96-106.
[13] 原琳,李智伟. PD-1/PD-L通路对乙型肝炎病毒感染结局的影响[J]. 世界华人消化杂志,2011,19(10):1051-1056.
[14] 谢冬英,陈凤娟,林炳亮,等. PD-1和PD-L1表达与慢性HBV感染者肝脏病变程度的相关性[J/CD]. 中华实验和临床感染病杂志(电子版),2010,4(3):287-293.
[15] 黎培员,柯小丽,朱倩,等.神经生长因子在原发性肝癌中的表达及其临床意义[J].中华肝脏病杂志,2013,21(2):121-124.
(2015-12-27 收稿 2016-02-27 修回)
(责任编委 张玲霞 本文编辑 陈玉琪)
Expressions of programmed death 1, programmed death ligand-1 and nerve growth factor in liver cancer tissues and their significance
YANG Shuo, ZHANG Yun-hui*, SUN Yan-ling, ZHOU Zhi-ping, SHI Ming*
2012 Graduate Squad of Academy of Military Medical Sciences, Beijing 100850, China
*Corresponding author, SHI Ming, E-mail: shiming_amms@sina.cn; ZHANG Yun-hui,E-mail: zh_302@163.com
[Abstract]Objective To detect the protein expressions of programmed death 1 (PD-1), programmed death ligand-1 (PD-L1) and nerve growth factor (NGF) in hepatocellular carcinoma (HCC) tissue and investigate their relationships with different pathological classification, clinical liver cancer stages, liver function and AFP level. Methods Immunohistochemistry (IHC) was used to detect the protein expressions of PD-1, PD-L1 and NGF in the paraffin-embedded tissue specimens of 63 HCC patients. Paraffin-embedded liver tissue specimens from 16 healthy donors were used as the controls. The expressions of PD-1, PD-L1 and NGF in HCC tissues of different pathological classification, clinical liver cancer stages, liver function and AFP level were compared. Results The positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens were significantly higher than that in the controls (P<0.05). The positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens with different pathological classification varied, being the highest in moderately differentiated HCC tissues (P<0.05). The positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens with Barcelona clinical liver cancer stage C increased (P<0.05). The differences in the positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens with different Child-Pugh grades were not significant. The differences in the positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens were significant between patients with AFP level ≥400 μg/L and those with AFP level <400 μg/L, and the rates in the former were significantly higher than those in the latter. There was no significant difference in the positive expression rates of PD-1, PD-L1 and NGF in HCC tissue specimens between patients aged over and equal to 50 and those aged less than 50. Conclusions The positive expression rates of PD-1, PD-L1 and NGF in HCC tissues increase significantly. The expressions of PD-1, PD-L1 and NGF in HCC tissues may play a role in the occurrence, development and metastasis of HCC.
[Key words]carcinoma, hepatocellular; lymphocyte activation; lymphocytes; evaluation studies
[通讯作者]施明,E-mail:shiming_amms@sina.cn;张云辉,E-mail:zh_302@163.com
DOI:10.3969/j.issn.1007-8134.2016.02.008
[文献标志码][中国图书资料分类号] R512.62 A
[文章编号]1007-8134(2016)02-0092-05

