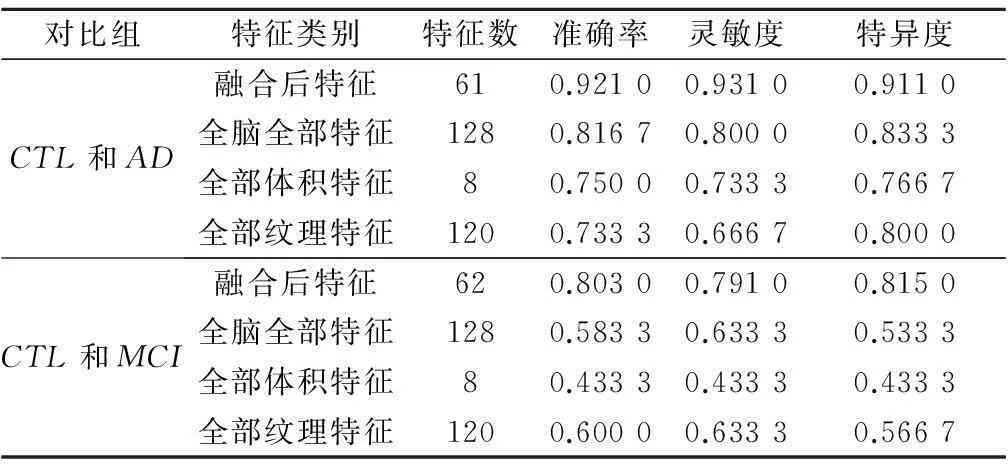
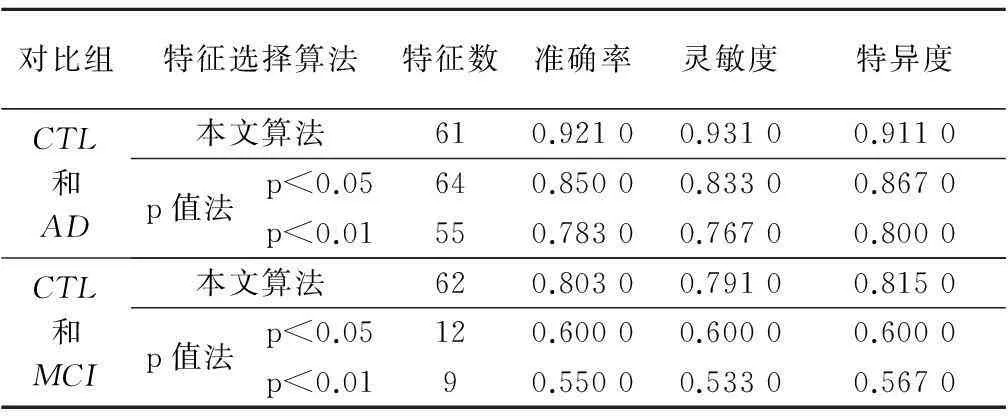
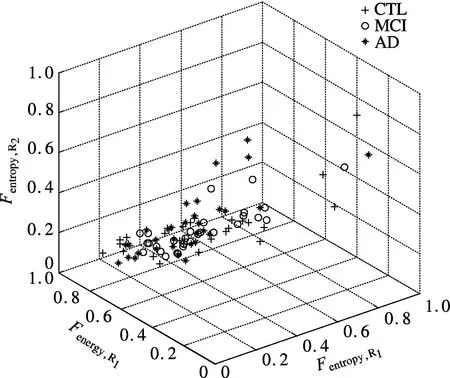
基于磁共振影像特征集成融合的AD诊断
李勇明 吕 洋 李 帆 王 品 邱明国 刘书君 闫 瑾
(1重庆大学通信工程学院,重庆400044)(2第三军医大学生物医学工程学院,重庆400038)
基于磁共振影像特征集成融合的AD诊断
李勇明1,2吕洋1李帆1王品1邱明国2刘书君1闫瑾1
(1重庆大学通信工程学院,重庆400044)(2第三军医大学生物医学工程学院,重庆400038)
摘要:为了得到更高更稳定的阿尔茨海默病(AD)诊断准确率,对脑磁共振影像纹理特征进行了集成融合,并用于AD分类诊断.首先,基于病理知识提取脑磁共振影像中左右脑相关解剖结构的体积、纹理特征;然后,采用链式智能体遗传算法与支持向量机相结合的封装式特征选择分类集成模型,对提取的特征集进行特征选择,从而实现融合;最后,利用融合后的特征进行分类诊断,并将融合后的分类结果与融合前以及采用p值法特征选择的分类结果进行对比.实验结果表明,相比融合前的特征以及采用p值法进行选择的特征,利用所提算法融合后的特征具有更高且更稳定的分类准确率、灵敏度和特异度.
关键词:磁共振影像;阿尔茨海默病;影像特征融合;特征选择分类集成模型;链式智能体遗传算法;支持向量机
阿尔茨海默病(Alzheimer’sdisease,AD)是一种常见的神经性退行性疾病,其防治的关键是早期无创诊断.磁共振成像(MRI)能定量地反映脑中不同组织在结构和功能上的变化,表征代谢物浓度,在AD早期诊断中取得了较好的应用效果[1].研究发现,AD的早期病变过程和一些与认知相关的解剖结构关系紧密,早期病变过程中这些解剖结构发生了体积和纹理的变化,如海马体出现萎缩[2].学者们研究了灰质、灰质中海马体、白质、脑脊髓液等的体积纹理变化[2-4],并提取了游程矩阵、灰度共生矩阵、灰度梯度共生矩阵、熵等磁共振影像纹理特征进行定量分析[5-7],用于AD早期诊断.根据信息熵理论,影像特征越丰富,其信息表达能力越强.但是,目前绝大多数研究仅限于单个或少量几个解剖结构的部分影像特征与AD的相关关系,这些特征较为片面.Kim等[8]将结构像和功能像中某些解剖结构影像特征相结合,明显改进了MCI分类诊断效果.然而,特征的简单合并无法消除特征间的冗余相关性,且当特征数量较多时复杂度较高,分类速度较低,分类准确率较低,因而普适性较差.
特征选择是消除特征冗余从而有效降低特征数目的一种有效方式.本文将CAGA和SVM相结合,建立了封装式特征集成融合模型.利用该模型对提取的多种类型磁共振影像特征进行深度选择,并将选择后的特征用于AD分类诊断.最后,通过比较实验来验证本文算法的有效性.
1基于CAGA和SVM的封装式特征集成融合算法
图1为基于磁共振影像特征融合算法的AD诊断基本流程图,包括脑MR图像样本预处理、磁共振影像特征提取、特征融合及分类诊断4个部分.
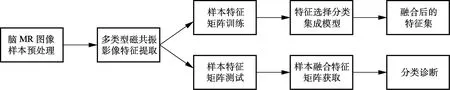
图1 基于磁共振影像特征融合算法的AD诊断基本流程图
1.1脑MR图像样本预处理
1.1.1图像配准
各个脑MR图像样本存在空间差异性,为了消除这种差异性对后续处理的影响,需要进行配准.配准步骤如下:① 选择一个标准的脑图像样本作为基准图像;② 对其他图像样本进行非线性仿射变换;③ 根据变换参数进行图像对准操作.本文基于Matlab中的SPM8软件包,利用Talairach-Tournoux脑图谱空间作为配准的模板[9].
1.1.2图像分割
本文采集的原始脑图像包括头皮、灰质、颅骨、白质、神经胶质、皮下脂肪、脑脊液、肌肉、结缔组织等.为了去除与AD病变不相关的组织(如头骨、小脑等),需要进行头骨剥离和组织分割.解剖结构分割的主要步骤为:① 利用MIPAV软件中的ExtractBrainSurface功能进行头骨剥离,实现对外围头骨的去除以及非相关组织(如眼睛等)的过滤[10];② 使用模糊C均值聚类(FCM)算法从脑组织中分割出灰质、白质、脑脊髓液以及海马体4个部分[11].分割结果见图2.
1.2多类型磁共振影像特征提取
研究表明,AD病变时解剖结构会发生体积和纹理变化.此外,在AD早期病变过程中,脑的不对称性也在逐渐发生变化[12-13].为了研究特征的不对称性,分别提取了脑的4个解剖结构左右部分的体积特征和纹理特征.这8个体积特征为左脑灰质体积、右脑灰质体积、左脑白质体积、右脑白质体积、左脑脊液体积、右脑脊液体积、左脑海马体体积、右脑海马体体积.纹理特征包括以下15种.
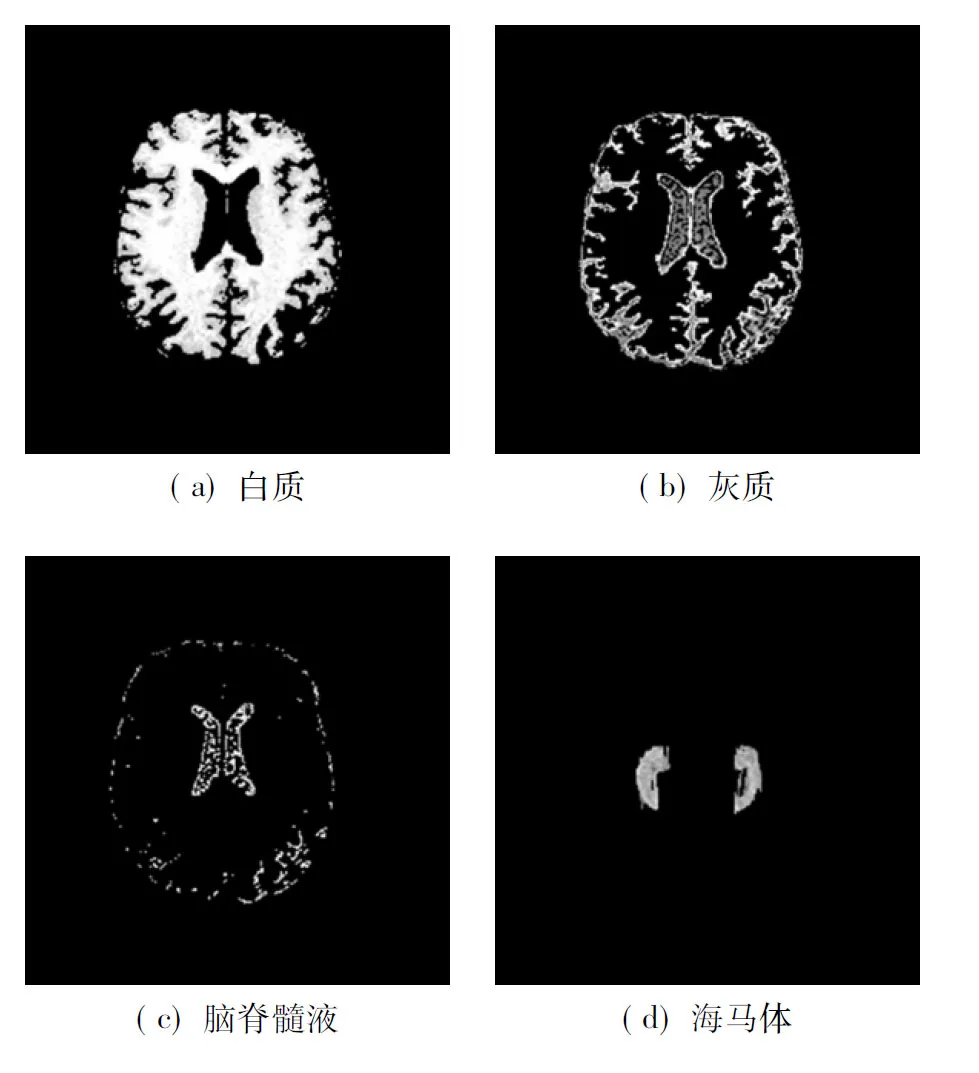
图2 解剖结构分割效果图
1) 能量

(1)
2) 对比度
(2)
3) 逆差分矩
(3)
4) 熵
(4)
5) 灰度相关系数
(5)
6) 长游程低灰度级加重
(6)
7) 长游程高灰度级加重
(7)
8) 短游程低灰度级加重
(8)
9) 短游程高灰度级加重
(9)
10) 灰度级非均匀性
(10)
11) 游程长度非均匀性
(11)
12) 长游程加重
(12)
13) 短游程加重
(13)
14) 低灰度级游程加重
(14)
15) 高灰度级游程加重
(15)

综上所述,特征集包括8个左右脑体积特征,120个左右脑的纹理特征,共计128个特征.
1.3基于CAGA和SVM的封装式特征集成融合模型
封装式特征集成融合本质上即为封装式特征选择.本文采用封装式特征选择分类集成模型对提取的特征进行融合.其中,优化算法采用链式智能体遗传算法(CAGA)[14],该算法相对于普通遗传算法而言,准确率更高,稳定性更好.分类器选用支持向量机(SVM),按照下式进行训练:
(16)
式中,c为惩罚参数;αq为第q个样本的学习率;sq为第q个样本的标签;x为样本数据;b为偏移量;k()为核函数,这里采用RBF(径向基)函数作为核函数类型,其表达式如下:
k(z,zc)=exp(-γ‖z-zc‖2)
(17)
式中,z为空间中任一点;zc为核函数中心;γ为核函数的径向作用长度.
该特征集成融合算法包括数据预处理和特征集成融合2部分,数据预处理步骤为:① 对原始样本Fea()进行样本处理,得到样本特征矩阵F={f1,f2,…,fp},其中p为特征数;② 将样本矩阵随机划分为训练样本矩阵和测试样本矩阵;③ 根据初始的第i个智能体,对训练样本矩阵和测试样本矩阵分别进行裁剪,生成该智能体所对应的训练特征样本矩阵T和测试特征样本矩阵E.特征集成融合算法的伪代码流程见算法1.
算法1特征集成融合算法
输入:训练特征样本矩阵和测试特征样本矩阵.
输出:最优智能体po(t),对应的最优特征子集和对应的分类诊断准确率Ac.
Initializep(t);//初始化种群
[po(t),Ac]=CAGA_SVM(T,E)
WHILE(t≤N)//N为迭代次数
Evaluation(p(t));//将T送入SVM模型进行训练,然后基于训练后的SVM模型和E输出测试诊断准确率,作为该智能体的初始适应度值
ps(t)=Selection(p(t));//领域竞争选择
pc(t)=Crossover(ps(t));//自适应交叉
pm(t)=Mutation(pc(t));//自适应变异
Evaluation(pm(t));//计算自适应变异后的适应度值
IFEvaluation(p(t))>Evaluation(pm(t))
po(t)=p(t)
Ac=Evaluation(p(t))
ELSEIFEvaluation(p(t)) po(t)=pm(t) Ac=Evaluation(pm(t)) ENDIF t=t+1 ENDWHILE Outputpo(t)和Ac; 1.4基于SVM模型的分类 根据1.3节中的特征集成融合模型获得最优特征子集,结合SVM模型对脑MR图像样本进行分类,实现诊断.采用leave-one-out交叉校验法来验证本文算法的有效性.重复上述实验多次,统计分类准确率的平均值,从而评估特征融合的性能优劣. 2实验结果与分析 2.1实验条件 实验所用数据来自重庆大坪医院,数据真实可靠,并经过医学专家认可.数据信息简述如下:该数据包含了结构T1MR图像,样本共计246个.图像采集装置为1.5TSigna扫描仪.采集的时间段为1999~2004年.采集方法为破坏性梯度回返采集(SPGR)法,采用体积式T1加权脉冲序列.回波时间为5ms,重复时间为 25ms,反转角为40°,脉冲重复激发次数为1, 单层厚度为1.5mm.图像采集对象由大坪医院神经内科和影像科的专家确定,且采集对象没有其他神经性方面的疾病,并具有相似的教育程度,平均年龄为66岁,年龄标准差为7.5年. 近年来,部分相关文章的图像样本来自ADNI数据集.本文没有选取该数据集的原因如下:① 本文处理的是sMRI图像,但该数据集里的MRI图像缺乏sMRI图像[15];② 本文的主旨是验证所提算法的集成融合性能,即基于同样的图像比较融合前后的效果,因此无需采用公共数据集;③ 本文处理的图像样本经过大坪医院神经内科和影像科的专家确认,来自相似背景,处理结果更能验证所提算法的集成融合性能. AD样本数较少,且部分残缺,为了均衡各类样本数目,本文选择了3类样本,每类30个,共计90个样本.这3类分别为阿尔兹海默病患者(AD)、轻度认知障碍患者(MCI)和正常对照组(CTL).对每个样本划分左右脑,并提取8个解剖结构,再分别对每个解剖结构提取1个体积特征和15个纹理特征,共计128个特征. SVM模型的核函数为RBF核函数,初始核参数 γ=0.3,惩罚因子C=4.参数选择时首先根据经验,给定γ和C的待搜索范围,设置搜索步长,然后分别取这2个参数的所有可能组合来训练SVM模型,并对模型的推广能力进行检验;最后,选择出推广能力最好的SVM模型所对应的γ和C. 针对CAGA,为了较好地平衡时间代价和优化精度,通过多次实验统计,确定初始种群规模为200,初始交叉概率为0.8,初始变异概率为0.05.每次迭代结束时,根据适应度值大小保留前25个最优个体,最大迭代次数设置为50,可以较快搜寻到全局最优,选出最优特征子集. 2.2特征集成融合前后的分类性能对比 本组实验的目的是通过对集成融合后特征的分类准确率与融合前特征的分类准确率进行对比,验证特征集成融合算法的有效性.实验结果见表1.表中,融合后特征指本文算法得到的最优特征;全脑全部特征指未经融合的所有特征;全部体积特征指未经融合的所有体积特征;全部纹理特征指未经融合的所有纹理特征.分别针对对比组CTL和AD以及对比组CTL和MCI进行实验,采用leave-one-out交叉校验法,统计分类准确率,重复30次,得到平均结果. 表1 融合特征前后的分类性能对比 由表1可见,经本文算法集成融合后,特征数明显减少,有利于降低分类复杂度,减小时间代价,分类准确率明显提高.另外,对于对比组CTL和AD以及对比组CTL和MCI,融合后的特征数目不一样,这说明针对不同类别,需要进行具体的融合操作.单独使用体积特征或纹理特征时准确率不如采用全部特征的结果,说明将体积特征和纹理特征结合在一起有助于提高分类准确率. 根据本文算法所选的特征在不同解剖结构中的个数见表2.由表可见,基于对比组CTL和AD,集成融合后选中的纹理特征分布于4个解剖结构中,而体积特征仅分布于脑脊髓液和灰质中.被选特征具有明显的不对称性,即同一个解剖结构的被选特征数目在左右脑分布不一致.例如,白质的被选特征中左脑纹理特征数目低于右脑,灰质的被选特征中左脑纹理特征数目高于右脑.基于对比组CTL和AD以及对比组CTL和MCI,被选特征数目在不同解剖结构中的分布也是不一样的.这说明不同特征对于不同类别分类的作用各不相同. 表2 集成融合后特征在各解剖结构中的个数 2.3集成融合与假设检验特征选择的分类性能对比 p值法是分析特征与类别相关性的常用方法,也是目前医学领域(包括疾病辅助诊断)中常用的方法,能起到筛选特征的作用.从特征选择的角度看,这一方法没有考虑特征间的冗余性,提高分类准确率的作用有限.表3为p值法与本文算法的对比结果.由表可见,利用本文算法集成融合后的特征所获得的准确率、灵敏度和特异度更高.此外,当p值法中所取阈值较小时,被选特征数目较少,分类准确率也明显下降,可能原因为阈值较小时特征选择条件严苛,使得一些分类能力强的特征被筛掉. 表3 集成融合与p值法特征选择的分类性能对比 2.4融合后特征分类能力实验 本组实验的目的是验证集成融合后的特征中单个特征对3类样本的分类能力,以验证所提特征集成融合算法的性能.在融合后的特征中,选择了4个特征.针对每个特征,计算每类样本的均值和标准差,结果见表4.由表可知,针对每个特征,3类样本的均值呈现出单调性变化,这说明利用本文算法融合的特征的分类能力较好,并且还具有跟踪监测病变过程的能力.这一结果再次证明了本文算法的高效性. 表4 最优特征子集中部分特征 注:FLRLGE,L为左脑灰质长游程低灰度级加重;FLGRE,L为左脑灰质低灰度级游程加重;FSRE,L,FSRE,R分别为左脑灰质和右脑灰质的短游程加重. 2.5基于少量特征的分类实验 本组实验的目的是验证本文算法融合后的特征具有良好的分类能力.从被选特征中任选的3个特征的样本散点图见图3(a),这些特征为左脑灰质长游程高灰度级加重FLRHGE,L、左脑灰质短游程低灰度级加重FSRLGE,L和右脑灰质短游程加重FSRE,R.由图可知,这3类样本区分良好,AD样本总体分布于下方,CTL样本总体分布于上方,MCI样本总体分布于中间.从未被选择的特征中任选的3个特征的散点图见图3(b),这些特征为右脑脑脊液的能量Fenergy, R1、右脑海马体的熵Fentropy, R1和右脑脑脊液的熵Fentropy, R2.由图可知,大部分样本集聚在一起,说明可分性较差.综上可知,采用所提算法所选的特征具有良好的可分性. 3结语 本文提取了左右脑多个解剖结构的体积和纹理特征,采用特征集成融合模型进行了深度特征选择,从而获得融合后的最优特征子集.根据该特征子集进行AD分类诊断,分类准确率显著提高.实验结果表明,针对对比组CTL和AD以及对比组CTL和MCI,利用本文算法融合后的特征具有更高的分类准确率.在融合后的特征中,单个特征大多具有显著单调性,分类能力较好. (a) 被选特征 (b) 未被选中特征 [1]TondelliM,WilcockGK,NichelliP,etal.StructuralMRIchangesdetectableuptotenyearsbeforeclinicalAlzheimer’sdisease[J]. Neurobiol Aging, 2012, 33(4): 825.e25-825.e36.DOI:10.1016/j.neurobiolaging.2011.05.018. [2]LötjönenJ,WolzR,KoikkalainenJ,etal.FastandrobustextractionofhippocampusfromMRimagesfordiagnosticsofAlzheimer’sdisease[J]. Neuroimage, 2011, 56(1): 185-196.DOI:10.1016/j.neuroimage.2011.01.062. [3]SchoonenboomNSM,vanderFlierWM,BlankensteinMA,etal.CSFandMRImarkersindependentlycontributetothediagnosisofAlzheimer’sdisease[J]. Neurobiol Aging, 2008, 29(5): 669-675.DOI:10.1016/j.neurobiolaging.2006.11.018. [4]SalatDH.Imagingsmallvessel-associatedwhitematterchangesinaging[J]. Neuroscience, 2014, 276: 174-186.DOI:10.1016/j.neuroscience.2013.11.041. [5]李昕, 童隆正, 周晓霞, 等. 基于MR图像三维纹理特征的阿尔茨海默病和轻度认知障碍的分类[J]. 中国医学影像技术, 2011, 27(5):1047-1051. LiXin,TongLongzheng,ZhouXiaoxia,etal.Classificationof3dtexturefeaturesbasedonMRimageindiscriminationofAlzheimerdiseaseandmildcognitiveimpairmentfromnormalcontrols[J]. Chinese Journal of Medical Imaging Technology, 2011, 27(5):1047-1051.(inChinese) [6]ChincariniA,BoscoP,CalviniP,etal.LocalMRIanalysisapproachinthediagnosisofearlyandprodromalAlzheimer’sdisease[J]. Neuroimage, 2011, 58(2): 469-480.DOI:10.1016/j.neuroimage.2011.05.083. [7]夏宇. 基于不对称脑图像特征的阿尔兹海默病自动识别方法研究[D]. 重庆: 重庆大学通信工程学院, 2013. [8]KimJ,LeeJH.Integrationofstructuralandfunctionalmagneticresonanceimagingimprovesmildcognitiveimpairmentdetection[J]. Magn Reson Imaging, 2013, 31(5): 718-732.DOI:10.1016/j.mri.2012.11.009. [9]ChenYW,LinCL,MimoriA.Multimodalmedicalimageregistrationusingparticleswarmoptimization[C]//2008 IEEE International Conference on Intelligent Systems Design and Applications.Kaohsiung,China, 2008:127-131. [10]BaillardC,HellierP,BarillotC.Segmentationofbrain3DMRimagesusinglevelsetsanddenseregistration[J]. Medical Image Analysis, 2001, 5(3):185-194. [11]GuptaL,SortrakulT.AGaussian-mixture-basedimagesegmentationalgorithm[J]. Pattern Recognition, 1998, 31(3):315-325. [12]TsaiKJ,YangCH,LeePC,etal.AsymmetricexpressionpatternsofbraintransthyretininnormalmiceandatransgenicmousemodelofAlzheimer’sdisease[J]. Neuroscience, 2009, 159(2):638-646.DOI:10.1016/j.neuroscience.2008.12.045. [13]TogaAW,ThompsonPM.Mappingbrainasymmetry[J]. Nature Reviews Neuroscience, 2003, 4(1):37-48.DOI:10.1038/nrn1009. [14]LiYongming,ZengXiaoping,HanLiang,etal.Twocodingbasedadaptiveparallelco-geneticalgorithmwithdoubleagentsstructure[J]. Engineering Applications of Artificial Intelligence, 2010, 23(4): 526-542.DOI:10.1016/j.engappai.2009.04.004. [15]PetersenRC,AisenPS,BeckettLA,etal.Alzheimer’sdiseaseneuroimaginginitiative(ADNI):clinicalcharacterization[J]. Neurology, 2010, 74(3): 201-209.DOI:10.1212/WNL.0b013e3181cb3e25. ADdiagnosisbasedonintegratedfusionofMRimagefeatures LiYongming1,2LüYang1LiFan1WangPin1QiuMingguo2LiuShujun1YanJin1 (1CollegeofCommunicationEngineering,ChongqingUniversity,Chongqing400044,China)(2CollegeofBiomedicalEngineering,TheThirdMilitaryMedicalUniversity,Chongqing400038,China) Abstract:In order to obtain higher and more stable diagnostic accuracy of Alzheimer’s disease (AD), the texture features of magnetic resonance(MR) images were integrated and fused for AD diagnosis. First, the volume and texture features of the left and right parts of multiple anatomical structures were extracted based on pathological knowledge. Secondly, by combining the chain-like agent genetic algorithm (CAGA) and support vector machine (SVM), a feature selection classification ensemble model was designed to conduct deep feature selection and realize feature fusion. Finally, the fused features were used for classification and diagnosis of AD and the classification results are compared with those before fusion and those obtained by the p-value method. The experimental results show that the features fused by this proposed algorithm have higher and more stable classification accuracy, sensitivity and specificity than the features before fusion and the features selected by the p-value method. Key words:magnetic resonance(MR) image; Alzheimer’s disease (AD); image feature fusion; feature selection classification ensemble model; chain-like agent genetic algorithm(CAGA); support vector machine(SVM) doi:10.3969/j.issn.1001-0505.2016.02.008 收稿日期:2015-06-08. 作者简介:李勇明(1976—),男,博士,副教授;邱明国(联系人),男,博士,教授,qiumg_2002@sina.com. 基金项目:国家自然科学基金资助项目 (61108086,91438104,11304382)、 中国博士后科学基金资助项目(2013M532153)、中央高校基本科研业务费专项资金资助项目(CDJZR12160011,CDJZR13160008,CDJZR155507)、重庆市博士后科研项目特别资助项目. 中图分类号:R445.2;R741 文献标志码:A 文章编号:1001-0505(2016)02-0271-06 引用本文: 李勇明,吕洋,李帆,等.基于磁共振影像特征集成融合的AD诊断[J].东南大学学报(自然科学版),2016,46(2):271-276.DOI:10.3969/j.issn.1001-0505.2016.02.008.