自噬相关蛋白Atg5和LC3在婴幼儿血管瘤中的表达
米 萱,孙 峰,仇利红,石 定,余 州,杨 力
血管瘤及脉管畸形
自噬相关蛋白Atg5和LC3在婴幼儿血管瘤中的表达
米 萱,孙 峰,仇利红,石 定,余 州,杨 力
目的 研究自噬相关蛋白在婴幼儿血管瘤中的表达,初探自噬在婴幼儿血管瘤发生发展中的作用。方法 根据患儿临床表现判断其瘤体处于增殖期还是消退期;将石蜡包埋的婴幼儿血管瘤(IH)标本经HE染色后,于光学显微镜下观察不同时期IH内血管内皮细胞的增生程度、形态;切片经TUNEL 法染色后,根据标记凋亡细胞计数比较不同时期IH凋亡率差异;免疫组化染色观察不同时期IH中Atg5的表达水平差异;免疫荧光标记法分析不同时期IH中LC3-Ⅱ的表达水平变化。结果 Tunel凋亡检测显示,消退期IH细胞凋亡率明显高于增殖期IH(P<0.01);免疫组化结果显示,增殖期IH中Atg5的表达水平高于消退期IH(P<0.01);免疫荧光显示增殖期IH中的LC3-Ⅱ阳性细胞多于消退期IH。结论 消退期IH凋亡细胞比增殖期明显增多;增殖期自噬活性较强,消退期自噬下调;自噬的下调有可能促进增殖期IH向消退期转化。
婴幼儿血管瘤; 凋亡; 自噬; 增殖期; 消退期; Atg5; LC3-Ⅱ; 自噬相关蛋白
婴幼儿血管瘤(infantile hemangioma,IH)是主要由血管内皮细胞构成的良性肿瘤,目前对于IH与自噬相关关系的研究仍较少。本研究进行血管瘤组织标本的相关检测和分析,探讨不同时期血管瘤的自噬情况,推测自噬在血管瘤发展进程中的相关作用及意义。
1 对象与方法
1.1 标本组织来源
收集自2014年 1 月至2015 年8月于西京医院全军整形外科研究所行手术切除并经病理确诊的7例血管瘤患者组织。男性3例,女性4例;年龄6个月至1.5岁。本研究符合第四军医大学医学伦理会标准并获得患儿父母的知情同意。
1.2 血管瘤分期标准
根据患儿临床表现判定其瘤体处于增殖期还是消退期。增殖期血管瘤特征:血管瘤开始出现并伴瘤体增大、色泽较深;消退期血管瘤特征:瘤体缩小或瘤体大小不变,但出现退色或张力降低。并结合HE染色结果综合判断。本组7例标本中,增殖期4例,消退期3例。
1.3 主要试剂
抗人多克隆抗体Atg5(SANTA CRUZ公司,美国);LC3-Ⅱ抗体(CST公司,美国);免疫组化试剂盒(上海明睿生物技术有限公司);生物素化山羊抗兔IgG、辣根过氧化物酶标记驴抗山羊IgG、辣根酶标记链酶亲合素、Cy3标记山羊抗兔IgG、DAPI(碧云天公司,美国)。
1.4 主要仪器
正置显微镜、荧光显微镜BX53、显微镜DP73(OLYMPUS公司,日本);石蜡包埋机EG-1160、切片机、烘片机(LEICA公司,德国)。
1.5 方法
1.5.1 HE染色 将石蜡包埋的新鲜血管瘤标本切片,厚度为5 mm,HE染色,常规脱蜡、经HE染后的切片依次浸入75%、85%、95%的乙醇中,每级停留2 min,脱水、透明,滴加半滴中性树胶,盖上盖玻片封片,室温晾干。光学显微镜下观察不同时期血管瘤内血管内皮细胞的增生程度、形态及管腔大小、血管数量、间质纤维细胞的增生程度等。
1.5.2 TUNEL检测 标本蜡块切成5 μm的薄片,切片脱蜡至水,透化,滴加3%H2O250 μl封闭,滴加TUNEL反应液(Enzyme solution及Label Solution按1∶9配制;即用即配,冰上操作)50 μl,保湿、避光、37℃孵育60 min。滴加Converter-POD 50 μl。保湿、37℃孵育30 min。加DAB底物50 μl,待颜色刚刚变深时迅速置于水中终止反应。苏木素复染,浸入1%盐酸乙醇中分化3 s,立即浸入自来水中,流水反蓝20 min。 脱水、透明、封片,反蓝后的切片依次浸入75 %、85 %、95 %的乙醇中,每个停留2 min,沥干残液,浸入无水乙醇Ⅰ、Ⅱ,二甲苯Ⅰ、Ⅱ中,分别浸泡10 min,取出切片,擦干周围液体,胶头滴管滴加半滴中性树胶,盖上盖玻片。低倍显微镜下观察染色情况,选取阳性细胞丰富的视野,高倍镜下拍照。
1.5.3 免疫组化(Atg5) 切片脱蜡、至水,抗原修复,过氧化氢孵育,滴加正常山羊(与二抗同一种属)血清封闭,室温孵育15 min,弃去血清,一抗孵育,将Atg5用PBS按1∶50稀释,滴加至完全覆盖组织,湿盒内4℃过夜。浸泡在PBS中5 min,重复3次。二抗孵育,二抗用PBS稀释200倍,湿盒内37℃孵育30 min,浸泡在PBS中5 min,重复3次。辣根酶标记,37℃孵育30 min。取出切片,摆放在切片架上,浸泡在PBS中5 min,重复3次。DAB显色,苏木素复染,常规脱水、透明、封片。显微镜下观察染色效果。应用Image-Pro Plus 6.0图像分析系统进行光密度分析,统计不同时期IH平均光密度(平均IOD值)。
1.5.4 免疫荧光(LC3-Ⅱ) 切片脱蜡、至水步骤同前。将切片置于煮沸的抗原修复液中,低火修复10 min。将切片置于PBS中5 min,3次。用免疫组化笔画圈,滴加山羊血清,完全覆盖组织,室温、湿盒内放置30 min。PBS中停留5 min,重复3次。滴加一抗(1∶200)孵育,滴加至完全覆盖细胞,湿盒内4℃过夜。浸泡在PBS中5 min,3次。滴加荧光二抗,用PBS稀释200倍(以下操作避光),室温孵育1.5 h。将装好切片的切片架浸泡于PBS中5 min,3次。滴DAPI复染核,将装好切片的切片架浸泡于PBS中5 min,3次。滴加抗荧光淬灭剂,盖玻片封片。荧光显微镜下观察染色效果。应用Image-Pro Plus 6.0图像分析系统进行分析,比较不同时期IH阳性细胞百分比情况。
1.6 统计学处理
2 结果
2.1 HE染色
增殖期血管瘤组织标本:血管内皮细胞增生成团,间隔组织少,形成大小不等的变形管腔样结构或血窦,大部分管径微小,只有内皮细胞包裹 (图1a)。消退期血管瘤组织标本:内皮细胞疏松,血管内皮细胞呈单层或复层,基底膜增厚。间质纤维结缔组织增多,脂肪组织增多。内皮细胞团与纤维脂肪组织无明显边界(图1b)。
2.2 TUNEL凋亡检测
经DAB显色后,凋亡细胞即染色阳性的细胞,胞核呈棕色至棕褐色(图2);统计分析结果显示,增殖期血管瘤凋亡指数为(4.97±0.89)%,消退期血管瘤凋亡指数为(15.56±1.78)%,组间差异具有统计学意义(P<0.01)。
2.3 免疫组化
Atg5在细胞膜及细胞浆中均有表达(图3);光密度分析结果显示,增殖期血管瘤样本中Atg5的IOD值为0.0214±0.0016,消退期血管瘤样本中Atg5的IOD值 为0.0150±0.0020,差异具有统计学意义(P<0.01)。
2.4 免疫荧光
从图4可见,LC3-Ⅱ用Cy3标记,呈明亮的红色荧光,细胞核用DAPI衬染为蓝色。LC3在胞浆中可见较为明显的表达;在增殖期血管瘤中,LC3-Ⅱ表达阳性的细胞多于消退期血管瘤。
3 讨论
1982年,JB Mulliken和J Glowack依据血管内皮细胞的生物学特性,将先天性血管病变分为血管瘤和血管畸形。婴幼儿血管瘤与其他脉管畸形的显著区别是:前者具有以内皮细胞增生为特征的增殖期,后者是胚胎血管发生过程中的结构异常。Kleiman等将血管瘤按病程分为3期:即增殖期(0~1岁)、消退期(1~5岁)和消退完成期(5~10岁),在临床上可表现出3个序贯发生的阶段[1]。至于消退期IH发生的原因以及IH如何从增殖期转变到消退期,有研究者推测可能与凋亡相关。因为通过凋亡蛋白检测发现,消退期血管瘤的细胞凋亡水平是增殖期血管瘤的5倍[2],且免疫组织化学染色提示凋亡的细胞为内皮细胞。
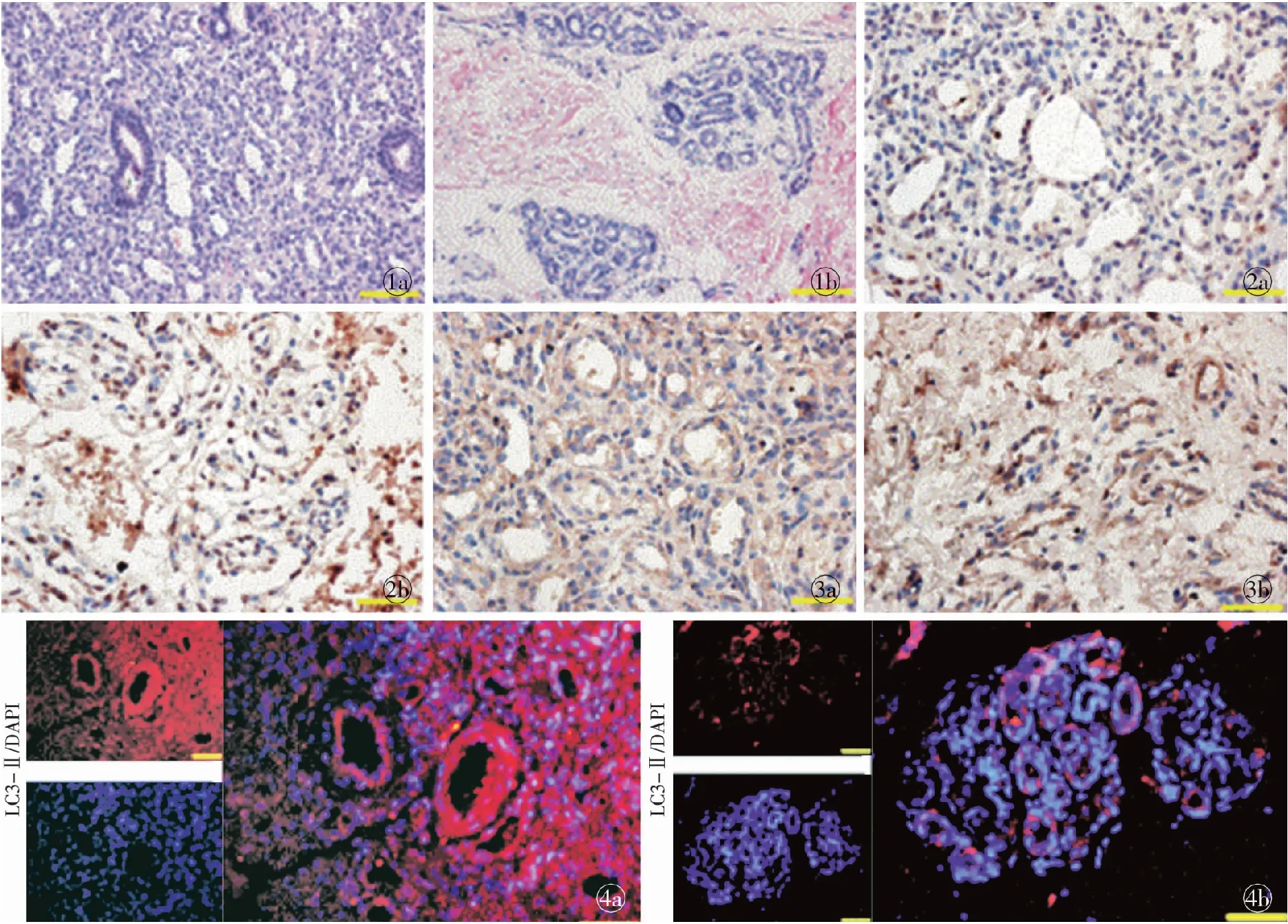
图1 HE染色(×200) a.增殖期 b.消退期 图2 TUNEL染色(×400) a.增殖期 b.消退期 图3 Atg5免疫组化染色(×400) a.增殖期 b.消退期 图4 LC3-Ⅱ免疫荧光染色(×400) a.增殖期 b.消退期
Fig 1 HE staining (×200). a.proliferative phase. b.regression phase. Fig 2 TUNEL staining (×400). a.proliferative phase. b.regression phase. Fig 3 Immunohistochemistry stain of Atg5 (×400). a.proliferative phase. b.regression phase. Fig 4 Immunofluorescent staining of LC3-Ⅱ (×400). a.proliferative phase. b.regression phase.
通常自噬的发生包含4个阶段:自噬体的诱导、延伸、闭合成熟及降解。 首先,在各种复杂的分子调控作用下诱导启动自噬;接着内质网来源的单层膜凹陷成杯状双层膜结构,包裹细胞内受损的细胞器和其他废物,进而由 LC3-Ⅱ和Atg12-Atg5-Atg16L复合体共同作用,延伸并闭合形成自噬体;接着与溶酶体融合降解其中的废物,分解的氨基酸、脂肪酸及其他有用物质可回收再利用,为细胞的重建、再生和修复提供必需的原料。因此,自噬不仅可清除体内的受损蛋白和细胞器,还可回收利用其中的废物,从而为应激状态下的细胞提供能量,是一种防止细胞死亡的保护性反应[3]。
众多研究发现,自噬与肿瘤、衰老、心血管疾病、神经退行性疾病和代谢疾病等密切相关。且在不同肿瘤或同一肿瘤的不同阶段起着不同的作用。自噬对细胞的作用具有两面性,既可以促进细胞生存,又可以诱导细胞死亡,主要取决于疾病进展的不同时期、细胞的微环境变化[4]。尽管大部分肿瘤细胞的自噬活性是降低的,但仍有一些肿瘤自噬活性较高,如大肠癌细胞、肺癌细胞及宫颈癌Hela细胞等。研究显示,在缺乏血清的条件下培养Hela细胞3 h,自噬活性明显上调。推测高水平的自噬对肿瘤细胞在恶劣环境下的生存起到保护性作用[5]。
最近武汉大学口腔医学院的研究团队发现,在IH 标本中有自噬相关蛋白Beclin1 和Atg5 的表达,即IH内存在自噬活化,且增殖期血管瘤中自噬相关分子Beclin1与survivin共表达,体外实验也发现短时间的缺氧培养可以诱导内皮细胞发生自噬,自噬加快了细胞的生长增殖,推测在增殖期IH中,自噬促进了内皮细胞的存活[6]。
Atg5作为关键性基因参与自噬过程,参与两个泛素样连接系统及自噬小体的产生[7]。LC3 (在酵母中即ATG8),作为公认的自噬特异性标志物,其定位于前自噬泡或者自噬泡表面,与自噬体的形成密不可分。在自噬过程中,细胞质可溶型LC3-Ⅰ经加工修饰,与自噬体膜上PE相聚合,产生LC3- Ⅱ[8],其数量多寡与自噬体含量呈正线性相关关系。通过特异荧光抗体方式,与LC3相联结聚合,自噬体荧光显微镜下为高亮荧光颗粒样或者泡样结构,可间接评估自噬情况。
本研究显示,Atg5在增殖期血管瘤中的表达呈现强阳性,而在消退期血管瘤中的表达较弱,平均光密度值比较差异具有统计学意义。另外,免疫荧光检测结果显示,LC3-Ⅱ阳性细胞在消退期血管瘤标本中明显少于增殖期血管瘤标本,这间接表明消退期血管瘤自噬体的形成减少。
本研究得出结论,消退期IH中凋亡细胞多于增殖期IH,增殖期IH细胞自噬活性高于消退期,推测自噬可能参与增殖期IH的内皮细胞保护作用。其原因可能是由于增殖期血管瘤中内皮细胞密度较大,生长速度快,细胞暴露于由高增殖率和供血不足所导致的缺氧环境,正如文献所述,缺氧环境和雌激素为IH的发生、发展提供适宜的细胞外环境,导致婴幼儿血管瘤的增殖[9],自噬可以为在代谢性应激状态中的细胞提供氨基酸、核苷酸等营养物质,加强细胞的存活能力;而自噬的下调有可能促进内皮细胞启动凋亡程序,引发IH由增殖期向消退期转化。至于自噬活化及下调所涉及的具体分子机制及通路仍需下一步探索研究。由于我们的前期实验标本较少,且仅静态检测了自噬相关蛋白的表达,关于目前开始倍受关注的自噬流检测尚需收集更多标本加以完善和分析。
[1] Kleiman A,Keats EC,Chan NG,et al.Evolution of hemangioma endothelium[J].Exp Mol Pathol,2012,93(2):264-272.
[2] Razon MJ,Kraling BM,Mulliken JB,et al.Increased apoptosis coincides with onset of involution in infantile hemangioma[J].Microcirculation,1998,5(2-3):189-195.
[3] Mizushima N.Autophagy:process and function[J].Genes Dev,2007,21(22):2861-2873.
[4] Ogier-Denis E,Codogno P.Autophagy:a barrier or an adaptive response to cancer[J].Biochim Biophys Acta,2003,1603(2):113-128.
[5] Cuervo AM.Autophagy:in sickness and in health[J].Trends Cell Biol,2004,14(2):70-77.
[6] Chen G,Zhang W,Li YP,et al.Hypoxia-induced autophagy in endothelial cells:a double-edged sword in the progression of infantile haemangioma?[J].Cardiovasc Res,2013,98(3):437-448.
[7] Mizushima N,Kuma A,Kobayashi Y,et al.Mouse Apg16L,a novel WD-repeat protein,targets to the autophagic isolation membrane with the Apg12-Apg5 conjugate[J].J Cell Sci,2003,116(Pt 9):1679-1688.
[8] Chen Y,Azad MB,Gibson SB.Methods for detecting autophagy and determining autophagy-induced cell death[J].Can J Physiol Pharmacol,2010,88(3):285-295.
[9] Chang EI,Chang EI,Thangarajah H,et al.Hypoxia,hormones,and endothelial progenitor cells in hemangioma[J].Lymphat Res Biol,2007,5(4):237-243.
Expression of autophagy-related proteins(Atg5 and LC3)in infantile hemangioma
MIXuan,SUNFeng,QIULi-hong,SHIDing,YUZhou,YANGLi.
(InstituteofPlasticSurgery,XijingHospital,TheFourthMilitaryMedicalUniversity,Xi′an710032,China)
Objective To study the expression of autophagy-related proteins in infantile hemangioma (IH) and explore the role of autophagy in the occurrence and development of IH.Methods According to the clinical manifestations of children,tumors in the proliferative phase or regression phase were identified.Specimens were embedded in paraffin and then were observed under a light microscope after HE staining.The degree of hyperplasia and morphology of vascular endothelial cells were observed at different periods in IH.After TUNEL staining,slices labeled according to apoptotic cell counts were compared between the IH at different periods to determine differences in apoptotic rate.The difference in ATG5 expression and the changes in LC3-Ⅱ expression between the IH at different periods were observed by IHC and immunofluorescence analysis,respectively.Results Measurement by TUNEL method demonstrated that the IH apoptosis rate in the regression phase was significantly higher than that in the proliferative phase (P<0.01).Immunohistochemistry showed that the expression level of ATG5 in the proliferative phase was higher than that in the regression phase (P<0.01).Immunofluorescence demonstrated that the positive expression of LC3-Ⅱ in the IH of the proliferative phase was higher than that in the regression phase in the proliferating IH group.Conclusion Apoptotic cells increased significantly in the regression phase over those of the proliferative phase.Autophagic activity of IH in the proliferative phase is higher than that in the regression phase IH.Down-regulating autophagy may promote the transformation of proliferating IH to regression phase.
Infantile hemangioma; Apoptosis; Autophagy; Proliferative period; Regression phase; Atg5; LC3-Ⅱ; Autophagy-related proteins
陕西省社会发展攻关计划项目(2014K11-03-09-11)
710032 陕西 西安,第四军医大学西京医院 全军整形外科研究所
米 萱(1988-),女,陕西西安人,医师,硕士研究生.
杨 力,710032,第四军医大学西京医院 全军整形外科研究所,电子信箱:yangli@fmmu.edu.cn
10.3969/j.issn.1673-7040.2016.06.007
R732.2
A
1673-7040(2016)06-0343-04
2016-04-17)

