酶联免疫吸附分析检测鳍藻毒素DTX1和DTX2
刘 丽, 刘 磊, 赵 芮, 韦 宁, 杨 琳,刘仁沿, 梁玉波*, 孙 茜
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.国家海洋环境监测中心,辽宁大连116023)
大田软海绵酸(Okadaic Acid,OA)及其天然衍生物鳍藻毒素(Dinophysistoxins,DTXs)是腹泻性贝毒(Diarrhetic Shellfish Poisoning,DSP)的致腹泻性成分。这些毒素是以OA为骨架结构的天然同系物[1],其化学结构见图1。此类毒素可以通过食物链的传递,在贝类体内累积。食用者误食了染毒贝类后,会出现腹泻、呕吐等中毒症状。此类毒素还能促进细胞凋亡和肿瘤的形成[2,3]。OA和DTXS是分布范围最广、发病率最高的海洋生物毒素之一,众多的沿海国家或地区都已发现和检出了这类毒素[4]。欧盟规定双壳贝类中OA及其等价物毒素的安全剂量为160 μg/kg贝肉[5]。
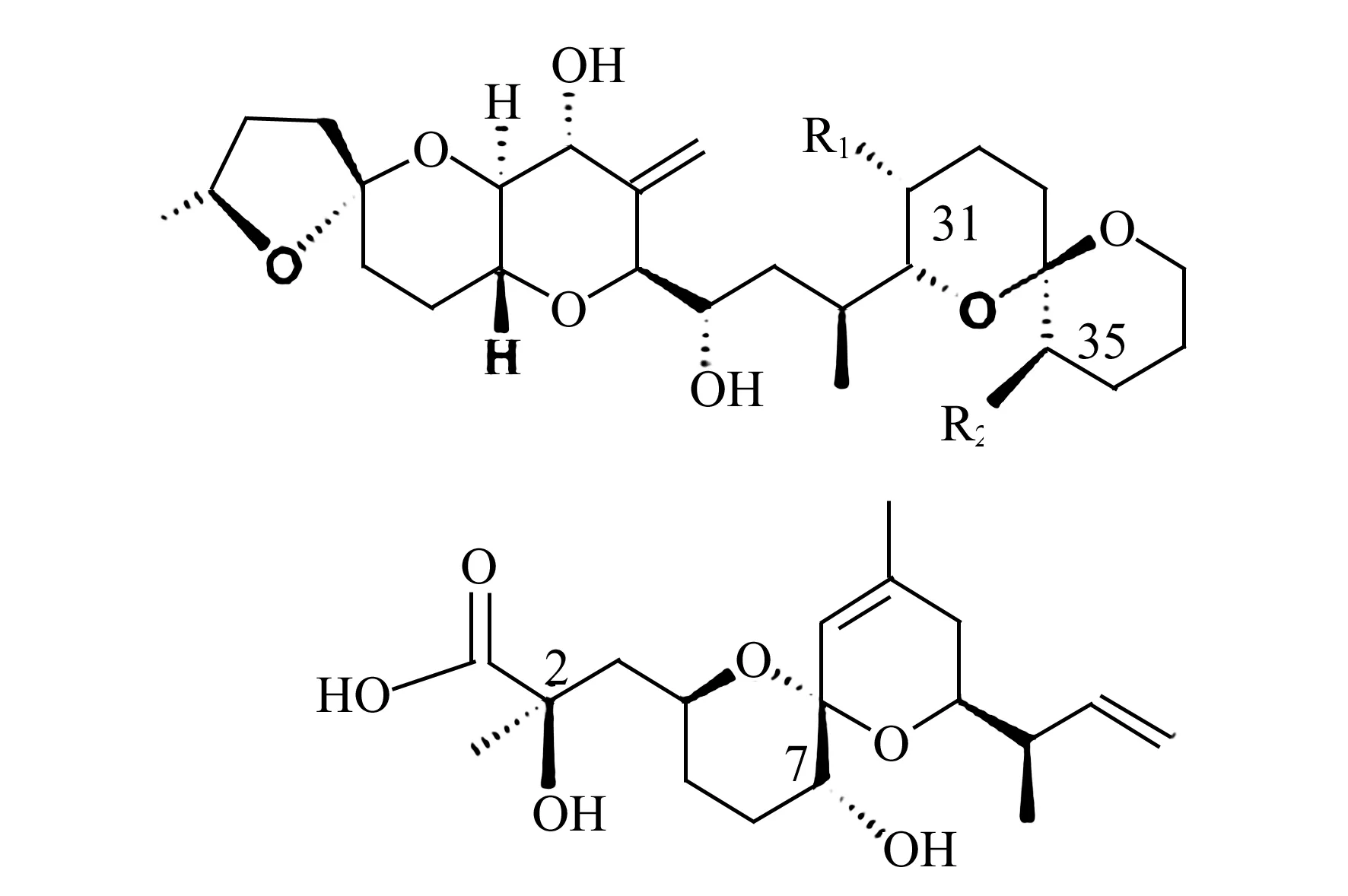
图1 OA和DTXs 毒素的化学结构Fig.1 Structures of okadaic acid and dinophysistoxins OA:R1=CH3,R2=H;DTX1:R1=CH3,R2=CH3;DTX2:R1=H,R2=CH3.
目前,针对DSP的检测方法主要有小鼠生物法[6]、液-质联用(LC-MS/MS)法[7]、磷酸酶活性抑制检测法[8]和酶联免疫吸附分析法(Enzyme Linked Immunosorbent Assay,ELISA)[9]等。ELISA法是利用抗体抗原的特异性结合,通过加入酶标记或荧光标记的二抗,经底物显色,用酶标仪测定的免疫化学方法,操作简单方便,不需要复杂的仪器设备,检测时间短,分析速度快,适于大量样本的快速筛查。目前,国外已有可用于藻类和贝类样品中OA和DTX1检测的酶联免疫分析商品化试剂盒,国内对此类毒素试剂盒的开发也有研究报道,但只是针对OA的检测[10 - 12],而对DTXs检测尚未见研究报道。本课题组曾制备了抗OA的单克隆抗体[13],并建立了相应的ELISA检测方法。本文利用抗OA的单克隆重抗体,研究测试了该抗体对标准品OA、DTX1和DTX2的竞争抑制反应,并尝试利用该抗体建立检测DTX1和DTX2的酶联免疫实验方法,以期为我国DTX1和DTX2的快速检测奠定技术基础。
1 实验部分
1.1 仪器与设备
Model 680型酶标仪(美国,BIO-RAD公司);Wellwash AC型洗板机(美国,Thermo Fisher);L535-1型离心机(湖南湘仪实验室仪器开发有限公司);IKA MS2 Minishaher型涡旋混合器(广州仪科实验室技术有限公司);WZ-2A型微量振荡器(北京海淀电子医疗仪器厂);DNP-9272型电热恒温培养箱(上海精宏实验设备有限公司);Starter2100型酸度计(OHRUS)。
1.2 试剂与材料
OA、DTX1和DTX2标准品,均购自加拿大海洋生物研究所:OA-OVA(Okadaic Acid-ovalbumin,OA-OVA)偶联抗原和单克隆抗体均为本课题组自行研制[12];辣根过氧化物酶(HRP)标记羊抗鼠IgG(H+L) 购自Thermo公司;二甲基亚砜(DMSO)、聚乙烯醇(PVA),均购自Sigma 公司;碳酸盐缓冲液(pH=9.6)、洗液PBS -T (pH=7.4)、显色液均为本实验室自行配制。
生物样品于2014年春季采自东海上海附近海域,包括虾夷扇贝(Patinopectenyessoensis)、扁玉螺(Neveritadidyma)和螠蛏(Sinonovaculaconstricta)。虾夷扇贝去壳去消化腺匀浆,扁玉螺和螠蛏去壳匀浆。称取2 g组织匀浆,加入9 mL甲醇,涡旋3 min混匀,超声提取10 min,3 500 r/min离心10 min,倾倒出上清液,重新提取一次,合并两次提取液,用甲醇定容至20 mL。然后用磷酸盐缓冲溶液(PBS,pH=7.4)将样品稀释30倍,待用。
1.3 实验方法
采用间接竞争ELISA法。用OA-OVA 偶联物作为包被抗原,用碳酸盐缓冲液(pH=9.6)稀释2 000倍后,加到96孔酶标板中,每孔100 μL,4 ℃过夜;弃去残液,洗涤96 孔酶标板,洗液为PBS -1%吐温-20洗涤3次;用 1%的 PVA-PBS溶液每孔300 μL封闭,37 ℃孵育3 h(可保存数周)。测定时弃去封闭液,洗板3次,每孔加OA、DTX1和DTX2标准溶液或样品各50 μL,及适当稀释的单抗50 μL,振荡90 s,37 ℃孵育1 h;洗涤3次,加入适当稀释的酶标羊抗鼠,每孔100 μL,37 ℃孵育40 min;洗板,每孔加TMB底物溶液100 μL,37 ℃避光显色12 min后中止反应,用酶标仪在450 nm波长处测定吸光度值。
2 结果与讨论
2.1 OA、DTX1和DTX2的标准曲线
以加入不同浓度的OA、DTX1和DTX2标准品的吸光度值与空白对照孔吸光度值的比(抑制率,B/B0)为纵坐标,相应的OA、DTX1、DTX2标准品浓度对数为横坐标,绘制标准曲线,计算出各标准物抑制率为50%时所需的质量浓度即Ic50。结果表明:OA在0.13~10.00 μg/L范围内,B/B0值(y)与其浓度的对数值(x)呈线性关系,回归方程为:y=-0.4475x+0.6616,r=0.9862,Ic50=2.30 μg/L。DTX1在0.32~10.00 μg/L范围内,B/B0值(y)与其浓度的对数值(x)呈线性关系,回归方程为:y=-0.5037x+0.821,r=0.9796,Ic50=4.34 μg/L。DTX2在0.32~10.00 μg/L范围内,B/B0值(y)与其浓度的对数值(x)呈线性关系,回归方程为:y=-0.5697x+0.7636,r=0.9824,Ic50=2.90 μg/L。
以PBS(pH=7.4)做10个空白对照,使用酶标仪检测出 10个空白对照孔OD值的平均值为0.988,10个OD值的标准偏差为0.014。以空白样品标准偏差的3倍计算检出限,所建立ELISA法分析OA的检出限为0.22 μg/L,相当于65 μg/kg贝肉;DTX1的检出限为0.53 μg/L,相当于159 μg/kg贝肉;DTX2的检出限为0.45 μg/L,相当于135 μg/kg贝肉,完全能够满足规定的160 μg/kg的安全阈值要求。
2.2 OA、DTX1和DTX2的交叉抑制反应曲线

图2 OA、DTX1和DTX2的交叉抑制反应曲线Fig.2 Cross inhibition curve of OA,DTX1 and DTX2
用间接竞争ELISA方法检测标准孔中的OA、DTX1和DTX2对包被抗原的竞争抑制反应,以OA、DTX1和DTX2标准物质浓度为横坐标,抑制率为纵坐标,绘制交叉抑制反应曲线(图2)。从图中可以看出,该抗体对OA反应特异性最强,其次是DTX2,同样浓度的抗原DTX1对抗体的反应率稍低于DTX2和OA。DTX1、DTX2和OA三种抗原的Ic50分别为4.34 μg/L、2.90 μg/L和2.30 μg/L。Ic50是反应抗体结合反应性质的一个指标,OA的Ic50最小,则表现为该抗体对OA反应特异性最强。
2.3 精确度测定
进行批内精确度试验时,测定4次标准样品浓度抑制率的平均值,并求标准差,按变异系数公式求出批内变异系数。OA(0.25、2、8 μg/L),DTX1和DTX2(0.625、2.5、10 μg/L)低、中、高浓度组的批内平均变异系数为6.21%、6.18%、5.11%。进行批间精确度试验时,求标准样品浓度在不同批次测定的抑制率的平均值,并求标准差,按变异系数公式求出批间变异系数,OA、DTX1和DTX2低、中、高浓度组的批间平均变异系数为6.40%、7.28%、5.79%。结果见表1。

表1 ELISA标准品的批内和批间误差
2.4 准确度的测定
在阴性样品中加入一定量的OA、DTX1和DTX2标准溶液,制备成低浓度组样品,OA的最终浓度均为1 ng/mL,DTX1和DTX2最终浓度均为2.5 ng/mL。高浓度组样品OA、DTX1和DTX2的最终浓度均为8 ng/mL。用上述ELISA 法检测样品的吸光度值,测定后计算抑制率,代入各自的标准曲线回归方程计算出毒素的质量浓度值,计算回收率,结果见表2。

表2 样品回收率结果
此方法OA、DTX1和DTX2的低、高浓度组的平均回收率为84.3%、76.4%、79.9%。说明该方法准确度良好。
3 结论
本文利用研制的抗OA的单克隆抗体,建立了灵敏的竞争酶联免疫检测OA、DTX1和DTX2的方法,可以快速筛选出阳性样品,能广泛应用于OA、DTX1和DTX2同时快速检测分析,为大规模开展实施我国赤潮微藻毒素监测计划,保障水产养殖业的可持续发展,以及人们的健康奠定了技术基础,且具有广阔的应用前景。

