血管支架对颅内动脉瘤血液动力学的数值模拟*
胡成龙,木合塔尔·克力木,张光武,刘鹏,刘小月,王丽君
(新疆大学 机械工程学院,乌鲁木齐830047)
1 引 言
动脉瘤一旦破裂,会导致蛛网膜下腔出血,致死率和致残率非常高[1]。目前治疗颅内动脉瘤的方法主要是颅内动脉瘤夹闭术和弹簧圈栓塞术。随着高分辨率的二维、三维血管影像的出现,神经外科显微技术和血管内介入技术的完善和普及,以及应用材料的不断改进,血管内介入治疗方法已广泛应用于颅内动脉瘤的治疗中,成为颅内动脉瘤治疗的重要方法[2]。但是由于弹簧圈跑圈及移位等现象,使得常规的弹簧圈栓塞介入治疗方法对于某些特殊形状的动脉瘤如梭形动脉瘤、宽颈以及巨大动脉瘤的治疗有很大困难。如果采用常规的弹簧圈栓塞介入治疗方法进行治疗,需要对动脉瘤进行致密填塞,需要的弹簧圈数量大,费用高,易形成移位效应,且动脉瘤易复发,风险高。而支架的使用明显提高了治疗效果[3]。Mase等[4]首次将支架应用于治疗颅内宽颈动脉瘤中,血管支架成为治疗颅内动脉瘤的新方法,且使用越来越普遍。Metcalfe等[5]研究发现,载瘤动脉置入支架后,瘤内的血流速度及壁面剪切力明显减少,涡流运动减弱甚至消失,并随着支架网眼密度的增加而更加减弱,而对血管中的流场影响不大。Ohta等[6]的数值模拟结果发现,置入支架后,动脉瘤内尤其是瘤颈处血液动态黏度明显增加,易于形成血栓。但我们也应该看到,血管支架技术仍然是一个正在发展中的技术,还存在诸多待解决的问题,例如:支架植入后的血栓堵塞问题依然是影响后期通畅率的关键。植入支架后的患者需要在很长一段时间内服用抗血栓药物,以抑制支架与血液成分的不良反应[7]。因此,支架的设计与选材就显得尤为重要。
2 支架结构的设计
2.1 矩形截面网格状支架的设计
自主设计的网格支架每一排梯形环状支撑体为一个单元组,网格支架单元组之间由S型连接体连接,连接体沿支架周向均匀分布,使支架在不损失径向支撑力情况下,能够提供优良的轴向顺应性;支架尺寸:网格状矩形截面支架长0.12 mm,宽 0.09 mm,通透率 77%[8],见图 1。

图1 矩形截面网格状支架Fig 1 Rectangular grid shaped stent
2.2 网丝编织成的圆形截面螺旋形支架的设计
圆形截面螺旋形支架也是在UG8.5中进行绘制的,是由4根金属丝顺时针旋绕,另4根金属丝逆时针旋绕,8根金属丝相互交织形成。螺旋状圆形截面支架直径 d取值为0.12 mm[9],通透率取为78%左右。绘制出圆形截面螺旋形支架见图2。该支架在前期临床上已经使用,术后血管易再狭窄。

图2 圆形截面螺旋形支架Fig 2 Spiral shaped stent with circular
3 结构静力学分析比较两种支架的弯曲变形能力与扭转变形能力
3.1 血管支架的弯曲变形能力
3.1.1 支架材料属性的选取 支架材料大多使用不锈钢或者钛合金等,其中钛合金的密度一般在4 500 kg/m3,仅为不锈钢的60%左右,而且纯金属钛的密度已经与普通不锈钢的密度差不多,一些高强度的钛合金甚至超过了许多不锈钢的强度极限。因此,钛合金的强度远大于了其他金属材料的强度,而且钛合金的生物相容性比较好,可用于制造强度高、刚性良好、质量轻柔的部件。这些均符合血管支架的设计理念,所以,我们在本研究中采用钛合金作为血管支架的材料,其杨氏模量取为110 GPa,泊松比为 0.45[10],密度取 4 500 kg/m3。
3.1.2 结构静力学分析 将设计好的圆形横截面积螺旋状血管支架模型和矩形截面网格状支架分别导入ANSYS结构静力学模块的Geometry中,在Engineering Data中设定支架的参数,采用自由划分网格进行网格划分。然后在Setup模块中施加标准地球力,施加一端固定约束,再施加力载荷设为0.1N,最后受力分析求解。在Result中观察支架弯曲总变形云图,见图3。

图3 支架弯曲总变形云图Fig 3 Total deformation of stent bending
根据以上两个支架总变形云图可以很直观的发现这两种支架弯曲变形能力有较大的差异,且网格状支架的弯曲变形能力远远大于螺旋形支架。
3.2 血管支架的扭转变形能力
因为我们研究的是扭转变形能力,所以,此处采用悬臂梁一端固定后,另一端施加一个固定力偶矩的方法对血管支架扭转能力进行分析研究。支架的材料属性与上部分分析弯曲变形时采用相同的材料属性。
3.2.1 结构静力学分析 将设计好的螺旋状血管支架模型和网格状支架模型导入结构静力学模块的Geometry中,在Engineering Data中设定支架的各项参数,采用自由划分网格进行网格划分。然后在Setup模块中施加标准地球力,施加一端固定约束,再施加力偶矩设为0.00004 N.m,最后受力分析求解。在结果中观察两种支架扭转总变形云图,见图4。

图4 支架扭转总变形云图Fig 4 Total deformation of stent reverse
根据以上两种支架的扭转变形的比较,与弯曲变形相类似,很容易看出网格状支架的扭转变形能力也远高于螺旋形支架,故网格支架有更强的顺应变形能力。以下研究中选取网格支架植入真实脑动脉瘤分析其对动脉瘤血液动力学影响。
4 支架植入后对动脉瘤血液动力学影响分析
4.1 动脉瘤三维重建
依托于新疆医科大学附属医院,针对此医院收治的50例年龄在35~65岁之间的脑动脉瘤患者,进行脑部CT影像资料的采集。综合50例动脉瘤的病发形态及位置因素,从中选取了一例形状较为理想且有代表性的49岁女性患者的动脉瘤模型进行提取。对动脉瘤CT影像进行 calculate 3D frommask操作,生成三维图并进行修建及光滑处理。使用Geomagic Studio 11.0逆向工程软件对动脉瘤流场表面网格和动脉瘤壁表面网格进行优化处理,然后将STL与NURBS格式进行转换,另存为STP格式输出,分析结果对此类动脉瘤模型均实用,具有普遍实用性,见图5。

图5 动脉瘤模型Fig 5 The model of aneurysm
4.2 脑动脉瘤流固耦合边界条件设定
研究中将血液看作是不可压缩的牛顿流体[11],密度为1 050 kg/m3,血液粘度设置为0.004 Pa.s。据相关文献可以设定入口边界为速度入口边界,出口边界为压力出口边界,其余为流-固耦合边界。根据文献[12]假设血流速度按正弦规律变化,其最大值取人体管径动脉血流速度的平均值v=0.8 m/s-1。出口压力设定为恒压 0 pa[13]。为了简化计算,可以假设动脉壁与瘤壁为线性、各向同性的弹性材料,计算时,设置血管壁的杨氏模量为1×108Pa[14],泊松比为 0.45[15],血管壁面设置无滑移条件(即壁面速度为0 m/s-1)。
4.3 仿真结果分析
如图6所示,置入后对颅内动脉瘤血液流速并无太大的影响,因为置入前动脉瘤顶部的血液流动非常缓慢,而在支架置入后,该地方的血流速度几乎完全停滞,所以无需另行计算血管支架置入后瘤顶部的速度值,但是瘤体内部还有漩涡出现,只是较置入血管支架前略大。
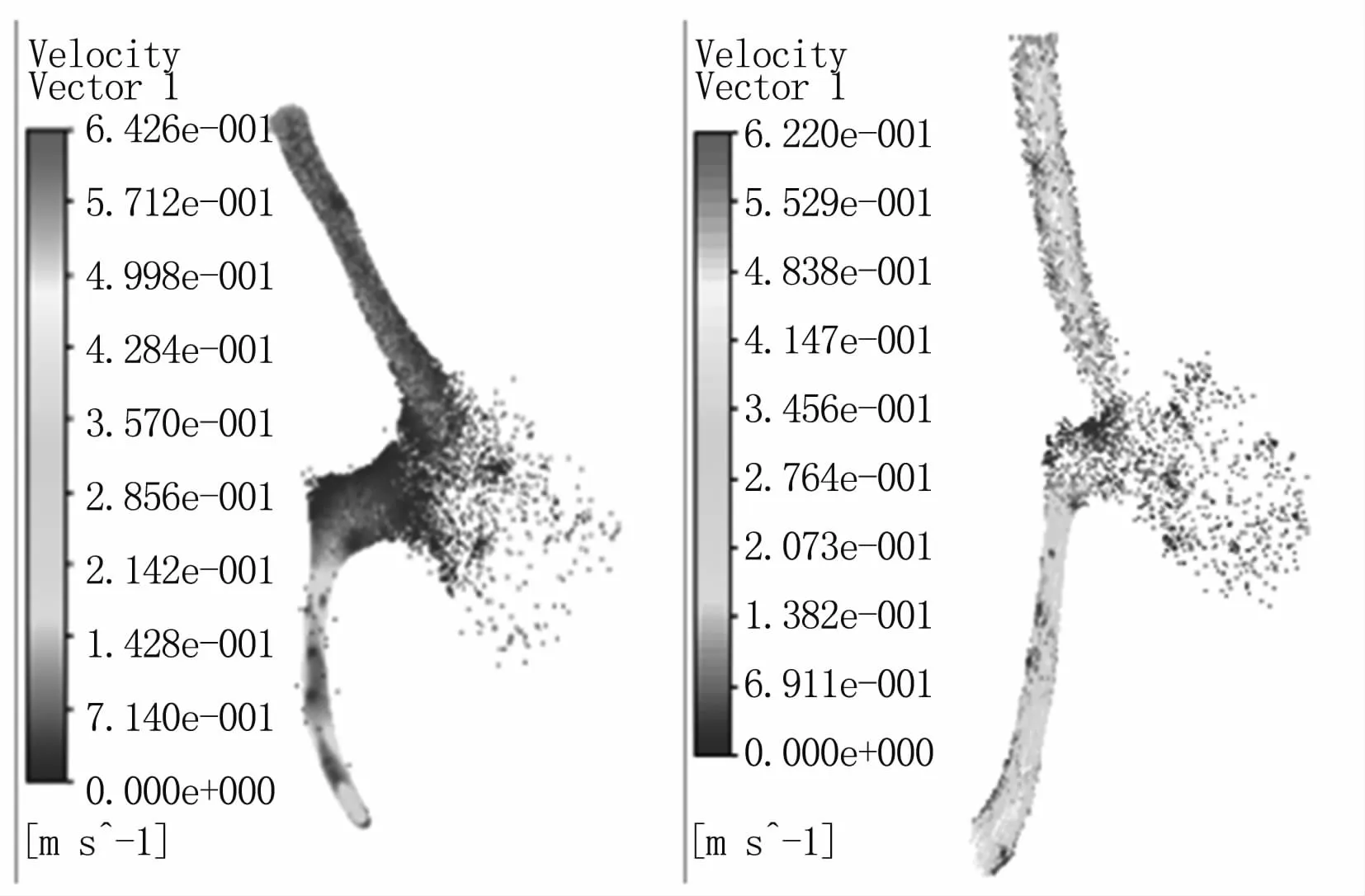
图6 为支架置入前、后速度矢量图Fig 6 Velocity vector before and after stenting
如图7所示,未置入血管支架时脑动脉瘤瘤颈部位的壁面剪切力偏高,且最大壁面剪切力发生在动脉瘤颈口附近血液流入一侧;置入血管支架后瘤颈远侧壁高剪切力区域(血流直接冲击的部位)范围明显减小,动脉瘤顶部血液流动速度非常缓慢,壁面剪切力也随之降低接近于零,且下降幅度极大。

图7 支架置入前、后壁面剪切力Fig 7 The wall shear stress before and after stenting

图8 支架置入前、后壁面压力分布图Fig 8 Pressure distribution before and after Stenting
图8为血管支架置入前,由于载瘤动脉受到血液流动冲击,所以入口处壁面压力较大,瘤体表面压力也随之增大,血液流经瘤体后壁面压力开始逐渐减小;置入血管支架后瘤体壁面压力也无明显变化,但是收缩峰期出现于瘤颈远侧壁的压力梯度在血管支架植入后基本上消失。
5 结论
本研究对支架进行了结构静力学分析,结果发现网格状支架的变形能力(弯曲变形和扭转变形)均高于螺旋状支架,说明网格状支架具有更好的顺应性。如果置入复杂的动脉瘤中的话,网格状支架要更具临床意义。支架植入前由于二次流的存在,在血液直接冲击到的瘤体下游附近弯曲部位或者形状不规则的部位,壁面压力和剪切力比其他部位要大一些,支架植入后瘤内血液流动速度、壁面剪切力及壁面压力均相应减小,促进动脉瘤内部血栓的形成,降低动脉瘤破裂和血管再狭窄的风险。为临床治疗动脉瘤提供可靠的理论依据。

