无机陶瓷固体电解质基固态锂空气电池的研究进展及挑战
孙继杨,崔忠慧,郭向欣
(1.中国科学院上海硅酸盐研究所,上海 200050)
无机陶瓷固体电解质基固态锂空气电池的研究进展及挑战
孙继杨,崔忠慧,郭向欣
(1.中国科学院上海硅酸盐研究所,上海 200050)
锂空气电池具有远高于锂离子电池的理论能量密度,是新一代高比能储能体系研发的热点。其中,以有机液体电解液为基础的非水系锂空气电池具有优异的可充电性能,最受人们关注。但研究发现常用的有机电解液在工作时易自身发生分解形成碳酸盐,严重损害电池的可逆性。同时,有机电解液的易燃性、易挥发性以及难以阻挡空气中H2O、CO2等非氧组分对锂负极的侵蚀等不足,更不利于高性能非水系锂空气电池的开发。使用无机陶瓷固体电解质构筑全固态锂空气电池有望从根本上解决上述问题,推动锂氧电池向锂空气电池发展。本文从电池结构、电极和电解质材料及反应机制等方面概述陶瓷电解质基固态锂空气电池近来的研究进展及其面临的挑战。
固态锂空气电池;无机陶瓷固体电解质;电池结构;反应机制
1 背景与意义
随着环境污染及能源问题的日益凸显,交通工具电气化越来越受到社会各界的认可,被认为是直接有效的应对手段之一;而且近年来以电动汽车为代表的绿色交通工具开始走进人们的日常生活。锂离子电池具有高的能量密度、优异的循环效率及低的自放电等优势,成为电动交通工具能量供给单元的首选[1,2]。虽然锂离子电池具有以上诸多方面优势,但目前它的技术水平(特别是能量密度、安全性)和经济指标还难以完全满足纯电驱动电动汽车技术发展的要求[3]。如目前LG、SDI和CATL等主要电池厂商量产的锂离子动力电池单体能量密度约为165-180 Wh/kg。当单体电池组成系统时,其它一些非活性材料如外包装、控制系统等加入会使能量密度进一步降低,导致电动汽车的续航里程难以满足消费者的预期,制约了电动汽车的技术发展和市场的受欢迎程度。提高动力电池的能量密度已成为推动电动汽车产业快速发展的首要任务。
通信联系人:郭向欣(1973-),男,博士,研究员。
由基于插层反应机制的正负极材料和液体电解液组成的锂离子电池已经发展了近三十年,技术已趋于成熟。通过新型高容量的负极如硅基材料和正极如锰基固溶体的开发应用,锂离子电池能量密度虽可以进一步提高,但也正在接近它的极限值[4,5]。从长远来看,要想实现电动汽车单次充电续航500 km或是更高的目标,还需要开发能量密度更高的新型电池体系。在众多新型储能体系中(图1[6]),锂空气电池具有最高的理论能量密度,达3582 Wh·kg-1,受到了人们的广泛关注。按目前锂离子电池技术~1/3的能量实现效率估算,它的实际能量密度有望达到1000 Wh·kg-1。若作为动力电池,将有望实现电动汽车单次充电续航里程超过500 km[7]。
Correspondent author:GUO Xiangxin(1973-), male, Ph.D., Professor.
E-mail:xxguo@mail.sic.ac.cn
与现有锂离子电池类似,锂空气电池主要由负极、电解液和多孔空气正极三部分构成。依据它所采用的电解质种类,锂空气电池的基本构型可分成四类[8],如图2所示。其中有三种电池构型采用的是液体电解液,分别为水系电解液体系、有机电解液体系和混合电解液体系(图2a-c)。最后一种电池构型是采用固态电解质的全固态锂空气电池(图2d)。其中,非水系(有机)锂空气电池更易实现较好的可充电性,是近来研究者关注的焦点。随着研究的不断深入,人们发现非水系锂空气电池虽具有优异的可充电性,但电池的可逆性却非常差。有机电解液在电池循环过程中的自身分解导致大量副产物形成是造成电池可逆性差的重要原因[9,10]。此外,与商业化的锂离子电池不同,锂空气电池是一个开放体系,它在工作过程中难免会发生与工作环境间的物质交换。此时,有机电解液的易挥发性以及难以阻挡空气中非氧组分如水蒸气、CO2等的侵入对锂负极和反应产物造成侵蚀,都会导致电池性能快速衰减[11]。同时液态有机电解液的易燃性还可能会导致锂离子电池发生严重的安全性问题。由于越来越多的科学技术难题的暴露,研究者开始将更多的目光转移到全固态锂空气电池上,如图2d所示。采用由无机材料构成的固体电解质构筑全固态锂空气电池,可从根本上解决非水系锂空气电池所面临的有机电解液易挥发、难以抵挡外界非氧组分侵入对电池性能的影响和有机电解液易燃导致的安全性问题,同时还有望抑制电池循环中锂枝晶问题。
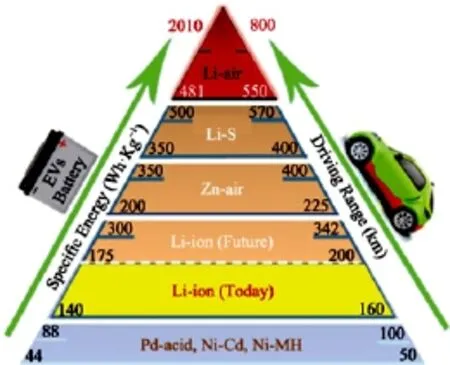
图1 各电池体系比能量密度(Wh/kg)及其作为电动汽车动力电池时可能实现的续航里程[6]Fig.1 Gravimetric energy densities (Wh/kg) for various battery systems and their potentials for driving range[6]

图2 四种类型锂空气电池的结构示意图[8]Fig.2 Schematic cell configurations for the four types of Li-air batteries[8]
2 研究现状与存在的问题
全固态锂空气(氧气)电池首先是由Kumar等人[12]在2010年报道的,最初的电池设计如图3所示。负极采用的是金属锂,电解质采用的是玻璃陶瓷18.5Li2O∶6.07Al2O3∶37.05GeO2∶37.05P2O5(LA GP),正极则是由该电解质粉体与碳复合构成。为了改善电极-电解质界面,他们在与电解质接触的正负极两侧分别添加了一层由聚环氧乙烷(polyethylene oxide, PEO)、锂盐和无机物(Li2O或BN)构成的聚合物电解质层。随后的研究中研究者还发展了基于有机固体电解质(聚合物基锂离子导体)的固态锂空气电池。有机聚合物固体电解质通常是基于PEO和LiX (X为阴离子,如TFSI-)锂盐开发的,但这种PEO基聚合物用于锂空气电池时易被锂氧反应产物氧化而发生自身分解,造成电池失效[13],制约了有机固体电解质基固态锂空气电池的开发。相比之下,无机固体电解质材料具有优异的化学和电化学稳定性、以及宽的电化学窗口(>5 V),使基于无机陶瓷基固态电解质构筑的全固态锂空气电池具有更稳定的电池性能[14],是近来固态锂空气电池研究的热点。此外,无机陶瓷基固体电解质的致密度更高,可以完全阻止空气中非氧组分如H2O、CO2等的侵入,有望实现电池在大气环境下循环工作,构筑真正的锂空气电池;并且,它优异的机械强度还可以抑制锂枝晶的形成,提高电池的安全性。

图3 固态Li-O2电池结构示意图[12]Fig.3 A schematic of the solid-state Li-O2cell[12]
本文从负极、多孔空气正极、固体电解质和电池反应机制等方面对陶瓷基固态锂空气电池目前的研究进展进行分类阐述。
2.1 金属锂负极
表1总结了现有报道中无机陶瓷基固态锂空气电池所采用的正负极材料及固体电解质,可以看出这些研究都是基于锂金属负极开展的。使用金属锂作为负极,主要是因为它具有可逆电位低(-3.04 V vs SHE)、密度小(0.534 g/cm3)和比容量大(3860 mAh/g)的优势[15]。金属锂负极是锂离子电池高容量负极开发的最终目标。它的成功开发,不仅利于提高电池的输出电压和减少负极的使用量及降低电池体系的总质量获得更高的能量密度,而且对锂空气电池和锂硫电池等新型体系的发展具有决定意义。但一直以来,不可控的枝晶生长和锂沉积/析出过程中低的库仑效率制约了锂金属负极走向商业化[16]。相比液体电解液,研究者认为由于固体电解质具有更高的机械强度和锂离子迁移数接近1的优势[14],可有效地抑制锂枝晶问题的发生,这为基于金属锂负极开发固态锂电池奠定了基础。虽然目前固态锂空气电池都是基于锂金属负极开展的(表1),但现有的研究还主要集中在正极设计和电池性能优化方面,对金属锂负极在电池循环过程中的自身演变和对电池性能的影响及相关机制关注的还很少。此外,循环过程中锂负极的体积变化对金属锂-固体电解质界面的影响也是急需开展的重要课题。
2.2 多孔空气正极
与锂离子电池不同,空气正极自身并不是锂空气电池正极反应的活性物质,它只是锂氧反应发生和反应产物存储/分解的场所。这一特殊属性就要求空气正极既要具备良好的电子和离子输运性能,能够快速的将电子和锂离子输运到锂氧反应界面;又要具有丰富的孔结构,能够利于氧气的传输、提供更多的锂氧反应界面和容纳更多的反应产物。另外,考虑到氧还原/氧析出(ORR/OER)反应的反应动力学都比较差,空气正极还需要具有较高的反应活性能够促进氧还原/氧析出反应的发生。
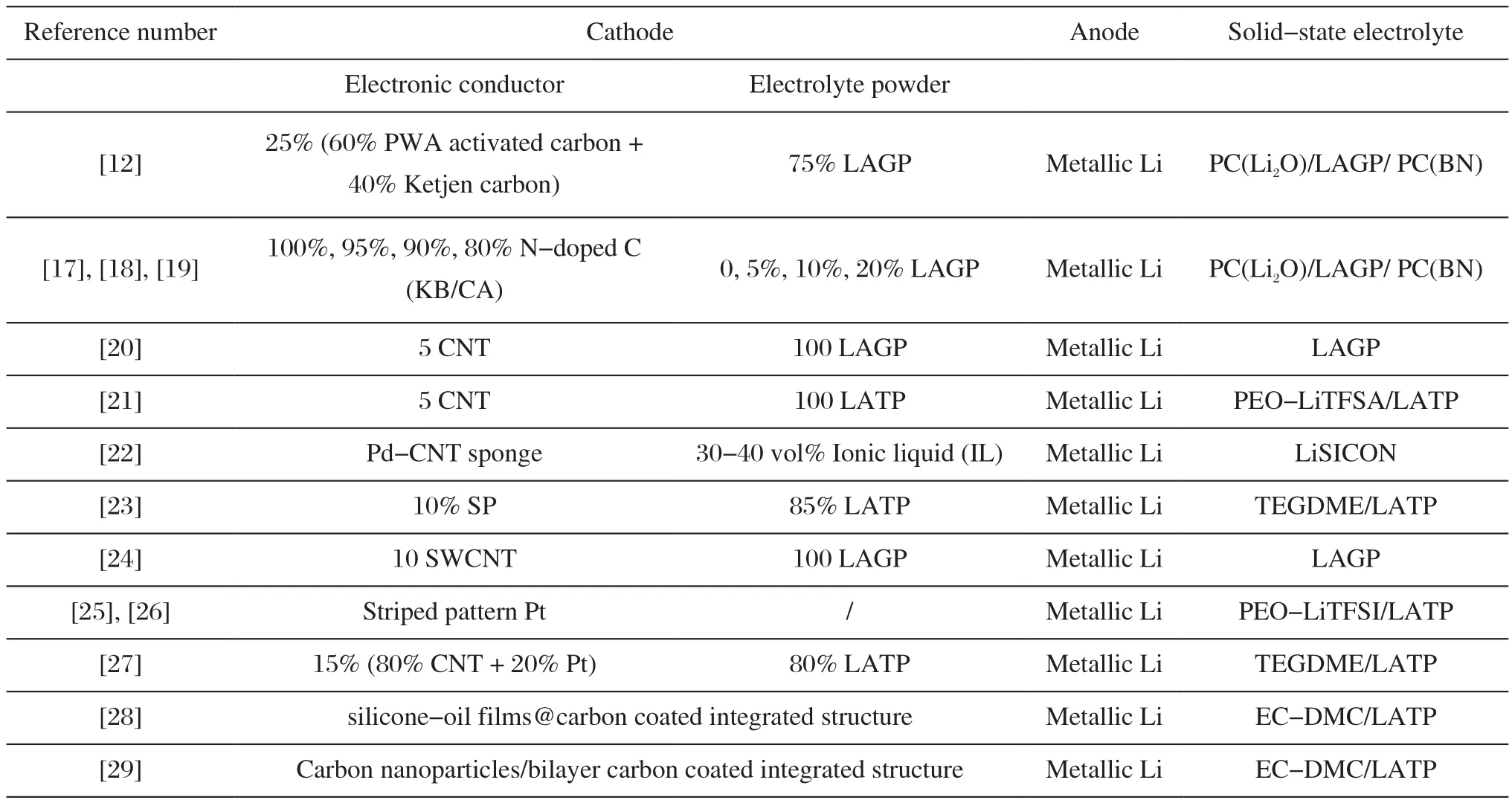
表1 部分已报道陶瓷基固态锂空气电池所用材料Tab.1 Components of electrodes and electrolytes of the solid-state Li-air batteries based on ceramic electrolytes which have been reported
固态电池中,由于固体电解质无法像液体电解液一样通过浸润作用在正极中形成贯通的离子通路,因此如何在空气正极内部同时构筑优良的离子和电子传输通路是高性能空气正极构筑面临的首要难题。目前的设计思路是将无机陶瓷电解质粉体与导电的碳基材料如科琴碳(Ketjen carbon)、Super P或碳纳米管(CNT)等混合经高温烧结形成空气正极。其中,无机陶瓷电解质颗粒在高温下相互连接形成正极骨架,提供贯通的离子传输通道,复合的碳材料则同时作为导电剂形成电子传输通道和氧还原/氧析出反应的催化剂促进锂氧反应的发生。如Kumar等人[12]首次报道的全固态锂空气电池(电池结构如图3所示),它的空气正极就是采用两种碳材料(Activated carbon与Ketjen carbon混合物)与LAGP电解质粉体混合经240 ℃烧结获得的。虽然基于该复合正极构筑的固态锂空气电池展现出了优异的耐高温特性,可以在30-105 ℃下循环工作,但充放电反应的极化还比较大,而且充放电的可逆容量还有待进一步大幅提高。此外,Zhou研究小组[21]采用碳纳米管与LAGP复合报道了相类似的空气正极,但采用了更高的烧结温度。高温烧结可以有效降低无机陶瓷电解质粉体颗粒间的界面阻抗,提高空气正极的离子电导率。另一种空气正极构筑的方法是将无机陶瓷电解质粉体、碳材料和粘结剂混合后直接负载在泡沫镍等多孔骨架上形成空气正极。值得注意的是,这几种方法所构筑的空气正极都含有大量的无机陶瓷电解质粉体(如文献[21]中LATP与CNT质量比为100 ∶ 5)。高含量的电解质粉体一方面由于它自身大的密度,严重损害了电池的能量密度;另一方面不利于在复合正极中创建大量的锂氧反应界面,制约了电池的可逆容量和能量效率。因此,如何在保证空气正极内部锂离子传输通道完整的同时,通过结构设计降低电解质粉体在空气正极中的使用量是构筑高性能固态锂空气电池亟待解决的技术难题。

图4 SEM照片:(a)(b)多孔空气正极、电解质整体结构;(c)未包覆碳前多孔正极孔洞形貌;(d)包覆碳后多孔正极孔洞形貌,插入图展现了LATP表面碳包覆层的厚度[29]Fig.4 The SEM images for (a), (b) integrated structure, (c) one pore in porous cathode support before carbon loading, and (d) one pore in porous cathode support after carbon coating. The insert shows the thickness of carbon layer on LATP scaffold prepared by an impregnation and pyrolysis process[29]
近来,Zhao等人[28,29]报道了一种采用模板法制备多孔空气正极的方法,所构筑的空气正极具有较大的孔隙率和完善的3D孔结构(图4)。实验中,他们首先将LATP陶瓷粉体与淀粉模板剂以一定比例混合后压制成片后在850 ℃热处理15 h提高陶瓷片机械强度并去除模板剂。再将获得的多孔LATP片与通过旋涂LATP陶瓷浆料的方法与制备的LATP致密陶瓷片粘附在一起。最后在1000 ℃下烧结5 h使二者形成整体,消除多孔层与致密层之间的界面以形成贯通的Li+输运通路。最终获得的多孔正极如图4所示,它的孔隙率可达78%。与早期的研究报道相比,该研究小组报道的空气正极不仅孔隙率高(大幅降低了无机陶瓷电解质粉体的使用量),而且多孔层厚度可调。如图4中,多孔层的厚度可以是致密层的十几倍,达519 μm,提供了更多的锂氧反应界面,获得了更高的放电容量和优异的循环特性。
以上概述了空气正极中离子通路构建方面的研究进展。高性能的空气正极设计时除需关注离子通路外,还需要关注电子通路和氧还原/氧析出反应活性体的构筑。关于电子导体,碳是最常用的材料。一方面由于它具有优异的导电性,另一方它易于通过预先添加或原位生成的方法与空气正极复合。如Zhao等人[28,29]便是通过蔗糖原位碳化的方法设计了电子通路。另外还得益于碳材料它自身还具有一定的氧还原/氧析出活性,如大量的非水系锂空气电池的研究结果已经证明它可以促进Li2O2的生成与分解[30]。但在锂空气电池中,要想将碳基材料用作电子导体和锂氧反应的催化剂,还需要考虑它的稳定性问题[31]。除碳材料对锂氧反应有催化作用,Kumar等人[32]认为LAGP电解质对正极反应也具有一定的催化作用。吸附于LAGP结构表面的氧气分子,会与LAGP通过反应形成2LAGP-Li+∶O。形成的 2LAGP-Li+∶O具有适当的键强使得O可以在放电时脱附直接与Li+形成Li2O2。此外,Chen小组[27]还报道了碳纳米管负载Pd纳米颗粒对全固态锂氧电池的促进作用,发现Pd纳米颗粒的引入不仅降低了锂氧反应的过电势,而且增强了电池的循环寿命。总的来讲,虽然现有的研究结果中构筑的空气正极都具有一定的可循环性,但都还面临着稳定性问题,高性能的空气正极设计以及稳定可用的材料还需要更多的工作去开发。
2.3 陶瓷基固体电解质
图5概述了常见锂离子导体如Li0.5La0.5TiO3、LAGP、Li3.25Ge0.25P0.75S4、Li7P3S11和Li7La3Zr2O12等离子电导率与温度的关系[33]。在这些无机固体电解质中,被用于构筑固态锂空气电池的无机固体电解质只有NASICON结构的LAGP或LATP。一方面是由于它们具有不错的室温离子电导率(LAGP∶5.08×10-3S/cm[34];LATP∶ 7×10-4S/cm[29]),另一方面是它们可以在较低的烧结温度下形成较致密的电解质陶瓷。但这两种无机固态电解质最大的缺点是无法直接与锂金属接触使用,直接接触时Ge4+和 Ti4+会被锂还原[35]。所以,使用以上这两种固态电解质构筑全固态锂空气电池时,必须在固态电解质与金属锂负极之间添加过渡层,减缓两者间的反应。常用的过渡层有基于PEO-LiX(X-为阴离子)的聚合物电解质。添加聚合物过渡层虽缓解了LAGP或LATP与锂间的反应,但会带来两方面的影响:(1)聚合物电解质层增加了电池的内阻[20],损害了电池体系的能量效率;(2)PEO耐氧化性和耐高温性较差,会限制电池的使用范围[13]。
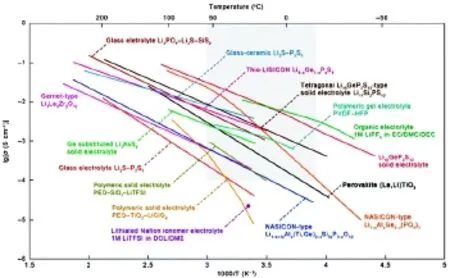
图5 常见锂离子导体离子电导率与温度的关系[33]Fig.5 Thermal evolution of ionic conductivity (σ) of the solid electrolytes and polymeric solid electrolytes[33]
除了上述LAGP或LATP这种NASICON结构的无机固体电解质,LLZO固体电解质是另一种有潜力的固体电解质。它由Wappner等人[36]在2007年首次报道,具有优异的化学和电化学稳定性(> 5 V vs. Li+/Li),这确保了它可以直接与金属锂负极接触使用。而且LLZO具有较高的室温离子电导率,可达10-3 S/cm。近来,本课题组经过元素掺杂和热压烧结[37-40],制备了离子电导率达1.6×10-3S/cm,致密度达99.5%的Li6.4La3Zr1.4Ta0.6O12(LLZTO)陶瓷电解质。并基于该固体电解质构筑了全固态锂空气。电池可以在200 ℃下可逆工作,具有优异的循环性能和倍率性能(图6)。
硫化物电解质是近来新发现的一类离子电导可以与液体电解液相媲美的固体电解质体系(图5),目前报道的离子电导率可达12 mS/cm[41]。但这类材料对空气非常的敏感,能否被用于空气电池还有待相关的工作去验证。无论是氧化物体系、硫化物体系还是其它新型电解质体系,可用于锂空气电池的固体电解质必须具有优异的抗氧化性(能抵御氧自由基和LiOx等的氧化)和耐空气中非氧组分如水气、CO2等侵蚀的特性。
2.4 正极反应机制
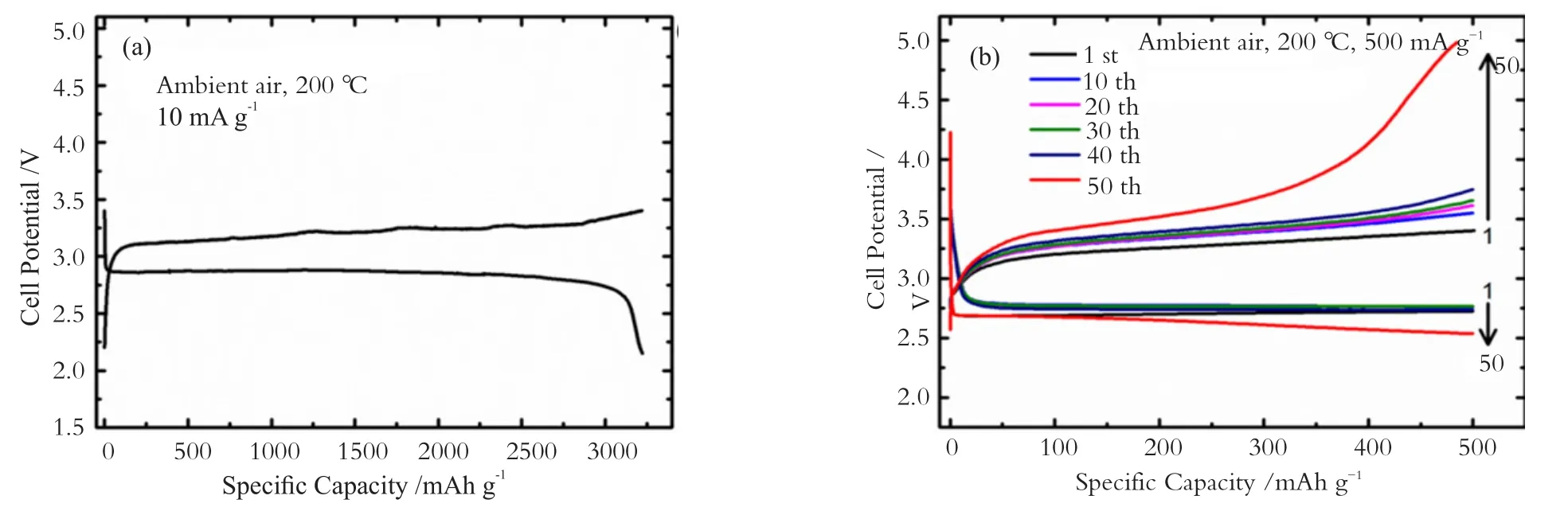
图6 基于LLZTO陶瓷电解质的固态锂空气电池在200 ℃时的充放电曲线:(a) 10 mA·g-1电流密度下首次循环; (b) 500 mA·g-1电流密度下限容500 mAh·g-1循环Fig.6 Discharge-charge curves of solid-state Li-air batteries based on LLZTO ceramic electrolytes at 200 ℃: (a) first cycle at a current density of 10 mA·g-1; (b) cycle performance at a current density of 500 mA·g-1and a cut-off capacity of 500 mAh·g-1
追踪分析实际固态锂空气电池正极反应的反应产物种类、状态及演变过程,对分析固态锂空气电池的反应机制有着重要意义。基于前文所述的复合正极设计,Zhou等人通过XRD和Raman光谱却无法检测到充放电过程中反应产物的信号,他们认为这主要是由于反应产物的生成量太少导致的[20]。为了能够清楚地观察到放电产物在正极表面的生成过程,Suzuki[25]等人通过溅射方法在LATP陶瓷电解质表面生长条纹状Pt空气正极构筑了简易固体电池,研究了该电池在纯O2下反应时产物的生成过程(图7)。Raman光谱和XPS分析表明放电过程生成的产物是Li2O2,并发现在Pt和LATP表面都有Li2O2产物生成。该现象的发生被认为是由于放电生成的Li2O2自身具有一定的电子和离子导电性,使得放电过程中产物生长沿着Li2O2表面持续进行。基于相同的方法,他们研究了潮湿的O2气氛下电池的放电产物[26]。结果表明放电产物主要由O、H和Li元素构成,但无法确定其具体的化学结构。
以上Suzuki等人分析了非碳电极表面Li2O2的生长过程。Zhou等人[42]研究了碳电极(CNT)表面产物的生长和分解(图8)。通过TEM对充放电不同阶段电极形貌的观察,发现放电产物是在CNT表面与LAGP-CNT界面上形成,并在随后的放电过程中与H2O和CO2等通过化学反应转变形成Li2CO3,包覆在Li2O2表面。Li2O2的剩余量与放电时间密切相关。充电时,Li2O2首先分解形成第一个充电平台,Li2CO3随后分解形成第二个平台。充电至5 V时,仍可观察到有薄层状产物残留在电极表面。而且,距离LAGP-CNT界面越远的放电产物越难分解。此外,他们还观察到了CNT会发生断裂,可能是由CNT通过副反应生成的Li2CO3在充电时被分解导致的。Zheng等人[43]通过环境扫描电镜(ESEM)原位观察了Li2O2的生长、分解过程,同样发现放电时Li2O2是优先在碳纳米管-固态电解质-氧气三相界面上成核,再逐渐长大。

图7 不同放电状态下Pt正极表面形貌[25]Fig.7 SEM images of the patterned platinum oxygen electrode from the Li/PEO18LiTFSI/LTAP/Pt, O2cell after discharge at 1 μA for 300 h at 60 °C[25]

图8 (a-h)空气正极在充放电过程充放电过程中的TEM照片;(i)提出的反应机制[42]Fig.8 TEM images of the air electrode powders (a), (b) before discharge, (c), (d) after discharge, (e), (f) after charge to 4.0 V, and (g), (h) after charge to 5.0 V. (i) Proposed mechanism of the all-solid-state Li-air batteries[42]

图9 陶瓷基固态锂空气电池发展所面临的科学技术难题Fig.9 Key challenges for the development of all-solid-state Li-air batteries based on inorganic ceramic electrolytes
从上述讨论可知,无论是在氧气环境下还是空气环境下,固态锂空气电池放电时会优先生成Li2O2,而且会优先在电子-离子-氧气(即碳材料-固态电解质-氧气)三相界面处生长。说明空气正极中构建大量的三相界面是改善锂空气电池性能的关键。当电池在空气环境下工作时,Li2O2不可避免的都会被空气中非氧组分侵蚀生成Li2CO3,导致充电过电势增大。一旦有碳酸盐副产物形成,即使充电至5 V,电极表面依然有少量产物无法完全分解。由此可见,未来要想实现真正的锂空气电池,不仅要寻找能够促进Li2O2高效可逆分解的正极材料,而且要有能促进Li2CO3分解的正极催化剂。
3 展 望
相较于有机电解质体系锂空气电池,无机陶瓷基全固态锂空气电池具有诸多优势,特别是在安全性和电解质的稳定性方面,但全固态锂空气电池相关的研究自2010年Kumar等人首次报道以来才刚刚开始。它的发展还面临许多科学技术难题(图9),这些难题的解决还需要更多深入细致的研究工作。
(1)电池可逆工作的反应化学:放电产物的种类及其生长、演变和分解机制。液态电解质构成的锂空气电池中,正极反应的活性位为气-固-液三相界,而在固态锂空气电池中,正极上只有气-固两相界。目前的研究中对于固固界面上锂氧反应的反应产物生长、演变及分解机制关注的还不够,还没有建立起电池可逆工作的反应化学。此外,空气中非氧组分H2O、CO2等对反应产物具有侵蚀作用,如何促进副产物的分解还没有建立有效的手段。
(2)高效空气正极构筑问题。如何在正极中构筑电子-离子-氧气高效通路目前还没有形成有效的方法。固体电解质材料通常都具有较大的密度,如何降低正极材料中的使用量、改善电池的能量密度,同样需要在后续工作中持续关注。
(3)电解质/电极界面的界面阻抗问题。界面电阻是固态锂空气电池内阻的主要来源,降低界面电阻能有效降低电池的充放电过电势,提高电池的能量效率。通常,固体电解质具有优异的耐温特性,虽然升高温度可以改善电池的界面电阻,但在常温环境下如何改善界面电阻目前还没有有效的手段。
(4)高性能的电解质材料。目前报道的固态锂空气电池都是基于NISICON结构的LATP或LAGP构筑的,但这类电解质无法直接与金属锂负极接触使用。探索新型的高性能固体电解质对构筑全固态锂空气电池具有重要意义。从目前的研究来看,适用于固态电池的电解质要具有优异的离子电导率、机械性能和优异的可加工性。同时对于锂空气电池来讲,还需要能够耐氧化和耐空气中非氧组分侵蚀。
(5)金属锂负极。现有的固态锂空气电池虽都是基于锂金属负极构筑的,但对金属锂负极在电池循环过程中的自身演变和对电池性能的影响及相关机制关注的还很少。同时,循环过程中锂负极的体积变化对金属锂-固体电解质界面的影响也是急需开展的重要课题。
[1] SCROSATI B, HASSOUN J, SUN Y K. Lithium-ion batteries. A Look into the future [J]. Energy & Environmental Science, 2011, 9(4)∶ 3287.
[2] LARCHER D, TARASCON J M. Towards greener and more sustainable batteries for electrical energy storage [J]. Nature Chemistry, 2014, 1(7)∶ 19-29.
[3] LU L, HAN X, LI J, et al. A review on the key issues for lithium-ion battery management in electric vehicles [J]. Journal of Power Sources, 2013, 226∶ 272-288.
[4] CHOI J W, AURBACH D. Promise and reality of post-lithiumion batteries with high energy densities [J]. Nature Reviews Materials, 2016, 4(1)∶ 16013.
[5] ETACHERI V, MAROM R, ELAZARI R, et al. Challenges in the development of advanced li-ion batteries∶ A review [J]. Energy & Environmental Science, 2011, 9(4)∶ 3243.
[6] 郭向欣, 黄诗婷, 赵宁, 等. 二次锂空气电池研究的快速发展及其急需解决的关键科学问题[J]. 无机材料学报, 2014, 2(29)∶113-123.
GUO X X, HUANG S T, ZHAO N, et al. Journal of Inorganic Materials, 2014, 2(29)∶ 113-123.
[7] BRUCE P G, FREUNBERGER S A, HARDWICK L J, et al. Li-O2and Li-S batteries with high energy storage [J]. Nature Materials, 2011, 1(11)∶ 19-29.
[8] LU J, LI L, PARK J B, et al. Aprotic and aqueous Li-O2batteries [J]. Chemical Reviews. 2014, 11(114)∶ 5611-5640.
[9] FREUNBERGER S A, CHEN Y, DREWETT N E, et al. The lithium-oxygen battery with ether-based electrolytes [J]. Angewandte Chemie International Edition, 2011, 37(50)∶ 8609-8613.
[10] SHARON D, HIRSHBERG D, AFRI M, et al. Lithium-oxygen electrochemistry in non-aqueous solutions [J]. Israel Journal of Chemistry, 2015, 5(55)∶ 508-520.
[11] HUANG S, CUI Z, ZHAO N, et al. Influence of ambient air on cell reactions of li-air batteries [J]. Electrochimica Acta, 2016, 191∶ 473-478.
[12] KUMAR B, KUMAR J, LEESE R, et al. A solid-state, rechargeable, long cycle life lithium-air battery [J]. Journal of the Electrochemical Society, 2010, 1(157)∶ A50.
[13] HARDING J R, AMANCHUKWU C V, HAMMOND P T, et al. Instability of poly(ethylene oxide) upon oxidation in lithium-air batteries [J]. The Journal of Physical Chemistry C, 2015, 13(119)∶ 6947-6955.
[14] BACHMAN J C, MUY S, GRIMAUD A, et al. Inorganic solid-state electrolytes for lithium batteries∶ Mechanisms and properties governing ion conduction [J]. Chemical Reviews, 2016, 1(116)∶ 140-162.
[15] XU W, WANG J, DING F, et al. Lithium metal anodes for rechargeable batteries [J]. Energy Environ. Sci., 2014, 2(7)∶513-537.
[16] AURBACH D, ZINIGRAD E, COHEN Y, et al. A short review of failure mechanisms of lithium metal and lithiated graphite anodes in liquid electrolyte solutions [J]. Solid State Ionics, 2002, 3(148)∶ 405-416.
[17] KICHAMBARE P, KUMAR J, RODRIGUES S, et al. Electrochemical performance of highly mesoporous nitrogen doped carbon cathode in lithium-oxygen batteries [J]. Journal of Power Sources, 2011, 6(196)∶ 3310-3316.
[18] KICHAMBARE P, RODRIGUES S, KUMAR J. Mesoporous nitrogen-doped carbon-glass ceramic cathodes for solidstate lithium-oxygen batteries [J]. ACS Applied Materials &Interfaces. 2012, 1(4)∶ 49-52.
[19] KICHAMBARE P, RODRIGUES S. Mesoporous nitrogendoped carbon-LiSICON glass ceramics as high performance cathodes in solid-state lithium-oxygen batteries [J]. Energy Technology, 2013, 4(1)∶ 209-211.
[20] KITAURA H, ZHOU H. Electrochemical performance and reaction mechanism of all-solid-state lithium-air batteries composed of lithium, Li1+xAlyGe2-y(PO4)3solid electrolyte and carbon nanotube air electrode [J]. Energy & Environmental Science, 2012, 10(5)∶ 9077.
[21] KITAURA H, ZHOU H. Electrochemical performance of solid-state lithium-air batteries using carbon nanotube catalyst in the air electrode [J]. Advanced Energy Materials, 2012, 7(2)∶889-894.
[22] SHEN Y, SUN D, YU L, et al. A high-capacity lithiumair battery with Pd modified carbon nanotube sponge cathode working in regular air [J]. Carbon, 2013, 62∶ 288-295.
[23] WANG X, ZHU D, SONG M, et al. A Li-O2/air battery using an inorganic solid-state air cathode [J]. ACS Applied Materials & Interfaces, 2014, 14(6)∶ 11204-11210.
[24] LIU Y, LI B, KITAURA H, et al. Fabrication and performance of all-solid-state li-air battery with SWCNTs/LAGP cathode [J]. ACS Applied Materials & Interfaces, 2015, 31(7)∶ 17307-17310. [25] SUZUKI Y, KAMI K, WATANABE K, et al. Characteristics of discharge products in all-solid-state Li-air batteries [J]. Solid State Ionics, 2015, 278∶ 222-227.
[26] SUZUKI Y, WATANABE K, SAKUMA S, et al. Electrochemical performance of an all-solid-state lithiumoxygen battery under humidified oxygen [J]. Solid State Ionics, 2016, 289∶ 72-76.
[27] WANG X, CAI S, ZHU D, et al. Enhanced electrochemical performance of Li-O2battery based on modifying the solidstate air cathode with Pd catalyst [J]. RSC Adv., 2015, 107(5)∶88485-88491.
[28] ZHU X B, ZHAO T S, WEI Z H, et al. A high-rate and long cycle life solid-state lithium-air battery [J]. Energy & Environmental Science, 2015, 12(8)∶ 3745-3754.
[29] ZHU X B, ZHAO T S, WEI Z H, et al. A novel solid-state Li-O2battery with an integrated electrolyte and cathode structure [J]. Energy Environ. Sci., 2015, 9(8)∶ 2782-2790.
[30] ZHAI D, WANG H-H, YANG J, et al. Disproportionation in Li-O2 batteries based on a large surface area carbon cathode [J]. Journal of the American Chemical Society, 2013, 41(135)∶15364-15372.
[31] THOTIYL M M O, FREUNBERGER S A, PENG Z, et al. A stable cathode for the aprotic Li-O2battery [J]. Nature Materials, 2013, 11(12)∶ 1050-1056.
[32] KUMAR B, KUMAR J. Cathodes for solid-state lithiumoxygen cells∶ Roles of nasicon glass-ceramics [J]. Journal of the Electrochemical Society, 2010, 5(157)∶ A611.
[33] ZHAO Y, DING Y, LI Y, et al. A chemistry and material perspective on lithium redox flow batteries towards highdensity electrical energy storage [J]. Chemical Society Reviews, 2015, 22(44)∶ 7968-7996.
[34] THOKCHOM J S, GUPTA N, KUMAR B. Superionic conductivity in a lithium aluminum germanium phosphate glass-ceramic [J]. Journal of the Electrochemical Society, 2008, 12(155)∶ A915.
[35] HARTMANN P, LEICHTWEISS T, BUSCHE M R, et al. Degradation of NASICON-type materials in contact with lithium metal∶ Formation of mixed conducting interphases (MCI) on solid electrolytes [J]. The Journal of Physical Chemistry C, 2013, 41(117)∶ 21064-21074.
[36] MURUGAN R, THANGADURAI V, WEPPNER W. Fast lithium ion conduction in garnet-type Li7La3Zr2O12[J]. Angewandte Chemie International Edition, 2007, 41(46)∶7778-7781
[37] LI Y, CAO Y, GUO X. Influence of lithium oxide additives on densification and ionic conductivity of garnet-type Li6.75La3Zr1.75Ta0.25O12solid electrolytes [J]. Solid State Ionics, 2013, 253∶ 76-80.
[38] LI Y, WANG Z, CAO Y, et al. W-doped Li7La3Zr2O12ceramic electrolytes for solid state Li-ion batteries [J]. Electrochimica Acta, 2015, 180∶ 37-42.
[39] LI Y, WANG Z, LI C, et al. Densification and ionicconduction improvement of lithium garnet solid electrolytes by flowing oxygen sintering [J]. Journal of Power Sources, 2014, 248∶ 642-646.
[40] DU F, ZHAO N, LI Y, et al. All solid state lithium batteries based on lamellar garnet-type ceramic electrolytes [J]. Journal of Power Sources, 2015, 300∶ 24-28.
[41] SEINO Y, OTA T, TAKADA K, et al. A sulphide lithium super ion conductor is superior to liquid ion conductors for use in rechargeable batteries [J]. Energy Environ. Sci., 2014, 2(7)∶627-631.
[42] KITAURA H, ZHOU H. Reaction and degradation mechanism in all-solid-state lithium-air batteries [J]. Chem. Commun., 2015, 99(51)∶ 17560-17563.
[43] ZHENG H, XIAO D, LI X, et al. New insight in understanding oxygen reduction and evolution in solid-state lithium-oxygen batteries using an in situ environmental scanning Electron microscope [J]. Nano Letters, 2014, 8(14)∶ 4245-4249.
Progress and Challenges for Solid-State Li-Air Batteries Based on Inorganic Ceramic Solid Electrolytes
SUN Jiyang, CUI Zhonghui, GUO Xiangxin
(1. Shanghai Institute of Ceramics, Chinese Academy of Sciences, Shanghai 200050, China)
Aprotic Li-air batteries (LABs) have attracted intensive interest because of their highest theoretical energy density compared with other available battery systems. However, recent research results demonstrated that the organic electrolytes tend to decompose and form carbonates during charge/and discharge process, which severely impairs the reversibility of such batteries. Moreover, the problems related to the organic electrolytes like flammability, volatility as well as incapacity to block the penetration of non-oxygen components from air will hinder the development of high performance aprotic LABs. Replacing organic electrolytes with inorganic ceramic solid electrolytes is promising to completely solve these problems and promotes the development from lithium oxygen batteries to lithium air batteries. This paper summarizes the progress and challenges for solid-state Li-air batteries based on inorganic ceramic solid electrolytes from the aspects of battery architecture, materials (electrodes and electrolytes) and reaction mechanism.
solid state Li-air battery; inorganic ceramic solid electrolytes; battery architecture; reaction mechanism
date: 2016-03-14. Revised date: 2016-05-09.
10.13957/j.cnki.tcxb.2016.05.001
TQ174.75
A
1000-2278(2016)05-0451-09
2016-03-14。
2016-05-09。
--先进无机材料论坛例记(Ⅰ)

