响应面优化桑叶槲皮素提取物脱色工艺
王海燕, 许静雅, 李 睿, 熊定奎, 曾 秀, 谷山林, 王介平, 周 婵, 王小燕, 姚 洪
(重庆市畜牧科学院,重庆 402460)
研究与技术
响应面优化桑叶槲皮素提取物脱色工艺
王海燕, 许静雅, 李 睿, 熊定奎, 曾 秀, 谷山林, 王介平, 周 婵, 王小燕, 姚 洪
(重庆市畜牧科学院,重庆 402460)
为了减少色素等杂质对桑叶槲皮素提取物分离纯化的干扰,采用活性炭对其进行脱色处理,并对工艺进行优化。以桑叶槲皮素提取物脱色率为评价指标,通过响应面法对影响活性炭脱色效果的3个因素进行优化,分别为活性炭质量浓度、脱色时间和脱色温度。结果表明,桑叶槲皮素提取物活性炭最佳脱色工艺为:活性炭质量浓度5 g/L、脱色时间9 min、脱色温度79.04 ℃,桑叶槲皮素提取物的脱色率达94.65%±1.65%,与模型预测值94.30%基本相符。结果显示,试验所得脱色工艺简单易操作且脱色效果较好,对桑叶槲皮素提取物后续纯化具有一定意义。
桑叶;槲皮素;醇提物;响应面;活性炭;脱色
桑叶是药食两用植物[1],自古以来都有将桑叶作为中药或食物进行使用。研究表明,桑叶所具有的抗氧化、抗菌、降血糖、防治动脉硬化等生理作用,与其含有的黄酮、多糖、生物碱等物质息息相关[2-7]。为了提高桑叶经济价值,多元化开发利用是重要的途径。目前,桑叶作为药物提取原料的研究主要集中在桑叶粗提物及功能作用方面,对桑叶中单体的分析纯化研究报道较少。槲皮素是桑叶黄酮中一种重要的苷元物质,活性作用强,具有极大开发潜力[8-11]。根据文献报道,桑叶中槲皮素的提取法主要为乙醇提取,多采用超声波辅、微波、加热回流等进行辅助提取[12-20]。然而乙醇提取桑叶槲皮素的同时,大量色素等杂质也一并被提取,色素对桑叶槲皮素进一步分离纯化造成严重干扰。为了减少色素对桑叶槲皮素分离纯化的干扰,本试验拟采取较广泛应用的活性碳脱色方法进行处理,同时根据响应曲面法对活性炭脱色工艺进行优化,以期为桑叶槲皮素分离纯化提供技术参考。
1 材料与方法
1.1 材料与试剂
桑叶(重庆市畜牧科学院蚕业研究所);无水乙醇、活性炭(粉状),以及其他化学试剂均为国产分析纯(成都市科龙化工试剂厂)。
1.2 仪器与设备
FA2004 B电子天平(上海越平科学仪器有限公司);XMTD-4000电热数显恒温水槽(上海比朗仪器有限公司);THC-10B数控超声波提取机(济宁天华超声电子仪器有限公司);SHZ-D Ⅲ循环水式真空泵,旋转蒸发器RE-2000B(巩义市予华仪器有限责任公司);TU-1901双光束紫外可见分光光度计(普析通用仪器有限责任公司)。
1.3 方 法
1.3.1 桑叶槲皮素提取方法
称取干桑叶粉38 g,按照乙醇质量分数50%、料液比1︰26、温度70 ℃提取30 min,提取2次,3 000 r/min离心10 min,过滤,合并滤液,真空减压浓缩,回收乙醇,去离子水定容至100 mL,获得桑叶槲皮素提液原液备用[21]。吸取桑叶槲皮素提取物原液10 mL,去离子水定容至1 000 mL,作为桑叶醇槲皮素提取稀释液用于脱色处理。
1.3.2 脱色处理及计算方法
取250 mL烧杯,分别加入50 mL桑叶槲皮素提取稀释液及适量的活性炭,在设定的温度下搅拌脱色至相应的时间。用TU-1901双光束紫外可见分光光度计通过全波长扫描,确定最佳吸收波长,在该波长下测定吸光度,去离子水作空白试样。再按下式计算脱色率:
其中主要使用的定理为,已知集合U={u1,u2,…,un},V={u1,u2,…,um},能够发现其中对于确定的模糊影射f:U→F(V),u1→f(u1)=r=(ri1,ri2…rin)其中r∈F(V),m=1,2,···,n,能够发现,其中惟一确定模糊关系矩阵为
(1)
式中:Y为脱色率,A0为脱色前吸光度值,A1为脱色后吸光度值。
1.3.3 单因素试验
1)活性炭质量浓度对桑叶槲皮素提取液脱色效果的影响
在7个250 mL锥形瓶中分别量取桑叶槲皮素稀释液50 mL,再分别加入质量浓度为2、4、6、8、10、12、14 g/L的活性炭,在70 ℃温度下脱色10 min,脱色处理后过滤,在最佳吸收波长下测定吸光度。
2)脱色时间对桑叶槲皮素提取液脱色效果的影响
在7个250 mL锥形瓶中分别量取桑叶槲皮素稀释液50 mL,加入12 g/L活性炭,在70 ℃条件下分别脱色处理4、5、6、7、8、9、10 min,脱色处理后过滤,在最佳吸收波长下测定吸光度。
在7个250 mL锥形瓶中分别量取桑叶槲皮素稀释液50 mL,加入12 g/L活性炭,分别在55、60、65、70、75 ℃条件下脱色处理10 min,脱色处理后过滤,在最佳吸收波长下测定吸光度。
1.3.4 Box-Behnken试验设计
在单因素试验的基础上,选取活性炭质量浓度、脱色时间和脱色温度自变量,脱色率(Y)为响应值,根据Box-Behnken design(BBD)试验设计原理,进行3因素3水平的响应面分析试验,如表1所示。通过Design-Expert 7.1.6软件(STAT-EASE Inc., Minneapolis, USA)对试验数据进行回归分析,试验结果通过多元回归分析方法来拟合多元二次方程。
表2 试验因素与水平
Tab.2 Experimental factors and levels

水平编码活性炭质量浓度/(g·L-1)脱色时间/min脱色温度/℃-1 10.05.060012.57.570115.010.0 80
1.4 数据统计分析
采用SPSS 15数据处理软件,各组数据结果均以平均值±SD(n=3)表示,并进行方差分析,LSD法多重比较,p<0.05为差异具有显著性。
2 结果与分析
2.1 桑叶槲皮素提取物澄清度与色度测定波长的确定
图1为桑叶槲皮素提取物的波长与吸光度的关系曲线。

图1 桑叶槲皮素提取物的波长与吸光度的关系Fig.1 Relation curve between the wavelength and absorbance of quercetin extracted from mulberry leaves
由图1可知,在190~400 nm的波长范围内桑叶槲皮素提取物有两个明显的吸收峰330 nm和210 nm。脱色率是根据比色法评价,透光率越大,显示澄清效果越好。提取液在330 nm处测的透光率最小,背景吸收较小,相对误差小。为了更科学地反映桑叶槲皮素提取物在脱色前后在紫外区域的颜色变化,本试验选择330 nm波长处作为测定波长[22-24]。
2.2 单因素试验分析
图2为活性炭质量浓度、脱色时间和脱色温度对桑叶槲皮素提取物脱色率的影响。

图2 活性炭质量浓度、脱色时间和脱色温度对桑叶槲皮素提取物脱色率的影响Fig.2 Effects of mass concentration of activated carbon, decolorization time and decolorization temperature on decolorization rates of quercetin extracted from mulberry leaves
从图2(a)可以看出,活性炭质量浓度在2.00~14.00 g/L时,脱色率先随活性炭质量浓度增加而增加,在2.00 g/L时,脱色率最低,为4.69%。活性炭质量浓度在12.00 g/L之后,脱色率增加趋势变缓,稳定在98.69%~98.70%。结果表明,活性炭质量浓度的较佳水平为12.00 g/L。
从图2(b)可以看出,脱色时间在4.00~10.00 min,脱色率随着时间的增加而小幅增加,脱色率达到97.86%。当脱色时间为4.00 min时,脱色率为95.13%,之后逐渐趋于平缓并维持在98.50%左右。综合考虑为节约能耗,脱色时间为8.00 min时已能达到较好脱色效果。
从图2(c)可以看出,脱色温度在55.00~75.00 ℃时,脱色率随温度缓慢上升,温度在55.00 ℃时,脱色率为最低值77.45%。温度在70.00 ℃,脱色率为94.65%,75.00 ℃脱色率在96.80%。考虑节约能耗的问题,选择脱色温度为70.00 ℃。
2.3 响应面优化桑叶槲皮素提取物脱色率工艺参数
2.3.1 数学模型的建立与检验
本试验利用Design-Expert 7.1.6软件中的Box-Benhnken中心组合试验设计,可获得桑叶槲皮素提取物脱色率(Y)的三因素三水平试验设计及结果(表2),并获得二次回归方程:
表2 响应面分析方案及试验结果
Tab.2 Experimental designs and results of response surface analysis
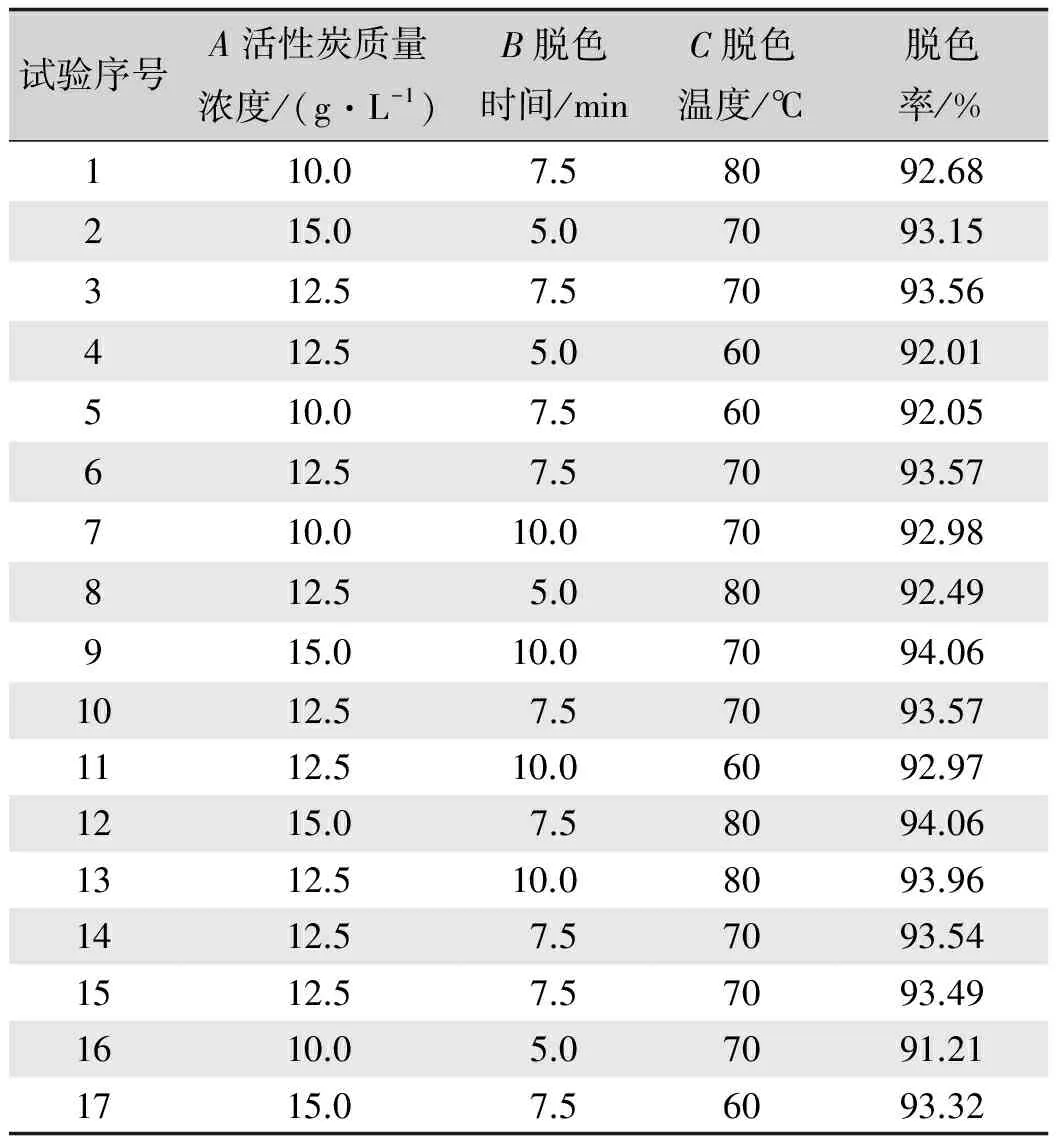
试验序号A活性炭质量浓度/(g·L-1)B脱色时间/minC脱色温度/℃脱色率/%110.07.58092.68215.05.07093.15312.57.57093.56412.55.06092.01510.07.56092.05612.57.57093.57710.010.0 7092.98812.55.08092.49915.010.0 7094.061012.57.57093.571112.510.0 6092.971215.07.58094.061312.510.0 8093.961412.57.57093.541512.57.57093.491610.05.07091.211715.07.56093.32
Y/%=(93.93+3.32A+0.83B-0.076C-2.04AB+0.68AC+0.38BC-1.80A2-0.53B2+0.44C2)×100
(2)
试验结果方差分析见表3。由表3可知,影响提取物脱色率的因素A,B,AB和A2均表现出了显著水平,二次回归方程整体模型极显著,该回归模型与实测值能较好地拟合。进一步对该回归模型进行显著性检验发现,提取物脱色率二次回归模的决定系数R2为96.78%,提取物脱色率二次回归模的校正决定系数RAdj2为92.65%,均≥90%,说明模型相关度很好,p<0.0001,回归模型极显著。
表3 桑叶槲皮素提取物脱色率回归方程的方差分析
Tab.3 Variance analysis of decolorization rate regression equation of quercetin extracted from mulberry leaves
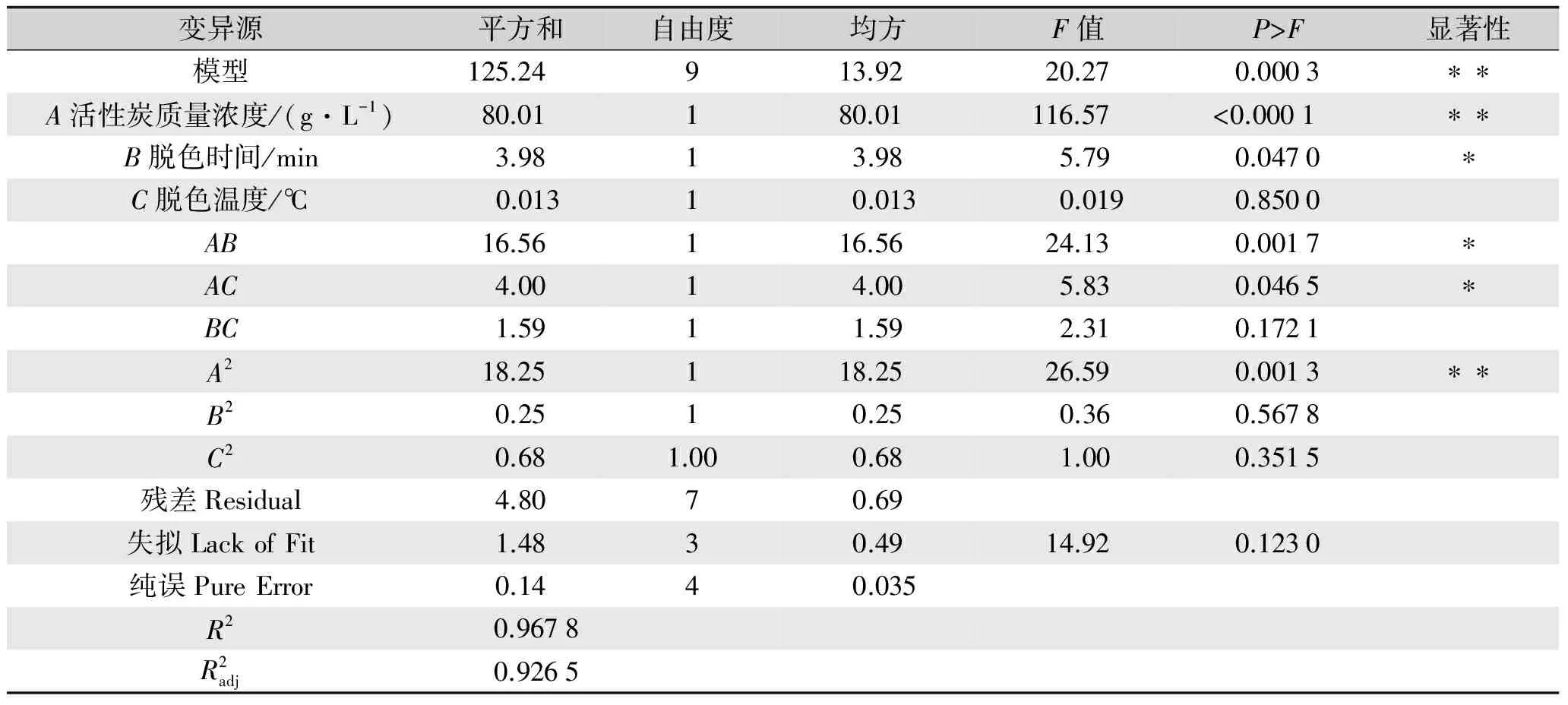
变异源平方和自由度均方F值P>F显著性模型125.24 913.92 20.270.0003∗∗A活性炭质量浓度/(g·L-1)80.01 180.01 116.57 <0.0001 ∗∗B脱色时间/min3.9813.98 5.790.0470∗C脱色温度/℃0.01310.013 0.0190.8500AB16.56 116.56 24.130.0017∗AC4.0014.00 5.830.0465∗BC1.5911.59 2.310.1721A218.25 118.25 26.590.0013∗∗B20.2510.25 0.360.5678C20.681.000.68 1.000.3515残差Residual4.8070.69失拟LackofFit1.4830.4914.920.1230纯误PureError0.1440.035R2 0.9678R2adj 0.9265
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
3.3.2 响应面分析和优化参数的优化与验证
为了考察活性炭质量浓度、脱色时间和脱色温度交互项对桑叶槲皮素提取物脱色率的影响,在其他因素条件固定为0水平时,考察交互项对桑叶槲皮素提取物脱色率的影响,对模型进行降维分析。经Design-Expert 7.1.6软件分析,所得的响应面图见图3。
由图3可知,活性炭质量浓度(A)与脱色时间(B)、活性炭质量浓度(A)与脱色温度(C)的响应曲面图坡度较陡,AB、AC交互较显著。脱色时间(B)与脱色温度(C)响应曲面图坡度较缓,显示BC交互作用不显著。响应曲面图与回归模型的方差分析结果相吻合。
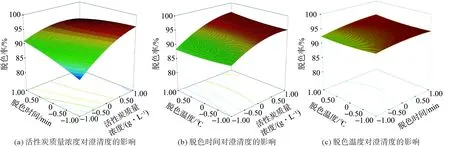
图3 活性炭质量浓度、脱色时间和脱色温度对澄清度的影响三维响应面Fig.3 Response surface for the effect of cross-interaction among mass concentration of activated carbon, decolorization time and decolorization temperature
2.4 桑叶醇提取脱色率工艺参数的优化和验证
为了进一步确定回归方程式(2)模拟的最佳试验点,对所得的回归方程取一阶偏导等于零并整理得:A=1.000,B=0.735,C=1.000。换算成实际试验条件:活性炭质量浓度15.00 g/L、脱色时间9.00 min、脱色温度79.04 ℃,桑叶醇提液脱色率为94.30%。
通过试验进一步检验方程的可靠性,采用上述优化条件进行澄清试验,测得桑叶醇提取脱色率为94.65%±1.65%(n=3),与方程模拟值基本接近,进一步验证了模型可靠性。
表4 桑叶槲皮素提取脱色率的优化结果
Tab.4 The optimal results of decolorization rate of quercetin extracted from mulberry leaves
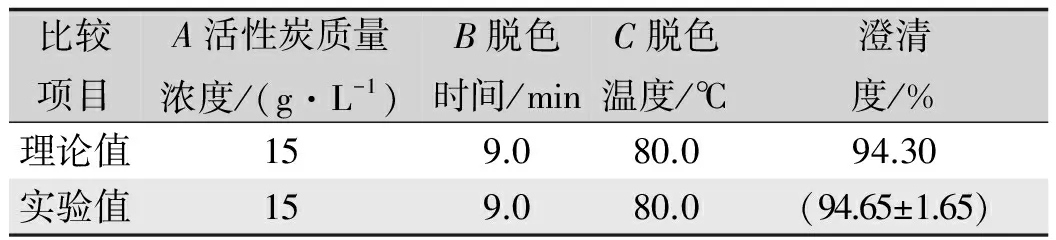
比较项目A活性炭质量浓度/(g·L-1)B脱色时间/minC脱色温度/℃澄清度/%理论值159.080.094.30实验值159.080.0(94.65±1.65)
3 结 论
通过桑叶乙醇提取、浓缩、单因素脱色、响应曲面优化、验证等步骤,对于由70.00%乙醇提取桑叶粉得出的桑叶槲皮素提取液的脱色工艺而言,经过响应曲面方法优化后,其脱色最佳工艺条件为:活性炭质量浓度15.00 g/L、脱色时间9.00 min、脱色温度80.00 ℃。按照最佳脱色工艺进行脱色的样液,脱色率达到94.65%±1.65%。因此,本次试验得出的脱色工艺简单易操作且脱色效果极好,对桑叶槲皮素后续分离纯化研究具有重要意义。
[1]黄自然,李树英.蚕业资源综合利用[M].北京:中国农业出版社,2013:46-47. HUANG Ziran, LI Shuying. Comprehensive Utilization of Sericulture Resources[M]. Beijing: China Agriculture Press,2013:46-47.
[2]王芳,励建荣.桑叶的化学成分、生理功能及应用研究进展[J].食品科学,2005,26(1):111-117. WANG Fang, LI Jianrong. Research progress on chemical constituents, physiological function and application of mulberry leaves[J]. Food Science,2005,26(1):111-117.
[3]夏满莉,高琴,夏强,等.桑叶乙酸乙酯提取物的血管作用及其机制[J].浙江大学学报(医学版),2007,36(1):50-52. XIA Manli, GAO Qin, XIA Qiang, et al. Vascular effect of extract from mulberry leaves and underlying mechanism[J]. Journal of Zhejiang University(Medical Sciences),2007,36(1):50-52.
[4]曹旭,赵明,尚磊.桑叶总生物碱中1-脱氧野尻霉素在大鼠体内的药物动力学研究[J].中药新药与临床药理,2012,23(4):451-452. CAO Xu, ZHAO Ming, SHANG Lei. Pharmacokinetics studies on 1-deoxynojirimycin from total alkaloids of folium mori in rats[J]. Traditional Chinese Drug Research and Clinical Pharmacology,2012,23(4):451-452.
[5]黄筱钧.桑叶乙醇提取物体外对呼吸道合胞病毒的抑制作用[J].中国实验方剂学杂志,2014,20(22):170-171. HUANG Xiaojun. Inhibiting effects of ethanol extract of mori folium on respiratory syncytial virus in vitro[J]. Chinese Journal of Experimental Traditional Medical Formulae,2014,20(22):170-171.
[6]王灿,左艇,王琳琳.桑叶黄酮抗皮肤衰老实验研究[J].中国医药导报,2011,8(3):30-31. WANG Can, ZUO Ting, WANG Linlin. Experimental research from flavonoids of mulberry leaves on the anti-aging effect[J]. China Medical Herald,2011,8(3):30-31.
[7]王洪侠.桑叶及桑白皮的抗衰老作用研究[D].北京:中国协和医科大学,2005:20-24. WANG Hongxia. Study of Folium Mori and Cortex Mori Oil Anti-aging Effect[D]. Beijing: Chinese Academy of Medical Sciences,2005:20-24.
[8]姚芳芳,张锐,傅瑞娟.槲皮素和芹菜素对高尿酸血症大鼠血尿酸及抗氧化能力的影响[J].食品科学,2011,32(5):287-289. YAO Fangfang, ZHANG Rui, FU Ruijuan. Effects of quercetin and apigenin on serum uric acid and antioxidant capacity in hyperuricemic rats[J]. Food Science,2011,32(5):287-289.
[9]FUKUDA I, ASHIDA H. Suppressive effects of flavonoids on activation of the arylhydrocarbon receptor induced by dioxins[C]// SHIBAMOTO T, SHAHIDI F, KANAZAWA K. Functional Foods and Health, ACS Symposium Series. Washington DC: American Chemical Society,2008:368-374.
[10]PSAHOULIA F H, DROSOPOULOS K G, DOUBRAVSKA L, et al. Quercetin enhances TRAIL-mediated apoptosis in colon cancer cells by inducing the accumulation of death receptors in lipid rafts[J]. Molecular Cancer Therapeutics,2007,6(9):2591-2599.
[11]CHEN Chen, ZHOU Jane, JI Chunyan. Quercetin: a potential drug to reverse multidrug resistance[J]. Life Sciences,2010,87(11-12):333-338.
[12]廖玉婷.桑叶的抑菌作用及其活性物质的提取分离研究[D].无锡:江南大学,2007:9-14. LIAO Yuting. The Antimicrobial Effect of Antibacterial Activity of Mulberry Leaves and Extract and Isolate for Its Antimicrobial Activies[D]. Wuxi: Jiangnan University,2007:9-14.
[13]梁薇,梁莹,应慧芳.桑叶水提物及醇提物抗菌作用的研究[J].时珍国医国药,2005,16(8):753. LIANG Wei, LIANG Ying, YING Huifang. Antibacteria effect of aqueous extract and ethanol extract of mulberry leaves[J]. Li Shizhen Medicine and Materia Medica Research,2005,16(8):753.
[14]王芳,励建荣,蒋跃明.桑叶黄酮的提取纯化及对油脂抗氧化活性的研究[J].中国粮油学报,2006,21(4):108-110. WANG Fang, LI Jianrong, JIANG Yueming. Extraction, purification and anti-oxidation evaluation of flavonoids from morus alba L. leaves[J]. Journal of the Chinese Cereals and Oils Association,2006,21(4):108-110.
[15]刘凡,黄勇,廖森泰.应用响应面法优化桑叶多糖、黄酮和生物碱联合提取工艺条件[J].蚕业科学,2013,39(3):568-575. LIU Fan, HUANG Yong, LIAO Sentai. Process optimization for combined extraction of polysaccharide, flavones and alkaloid from mulberry leaves by response surface methodology[J]. Science of Sericulture,2013,39(3):568-575.
[16]俞坚.桑叶黄酮类化合物提取、分离鉴定及其抗氧化活性的研究[D].杭州:浙江工商大学,2007:20-27. YU Jian. Studies on Extraction, Separation, Identification and Antioxidant Ablity of Mulberry (Morus Alba L.) Leaf Flavonoids[D]. Hangzhou: Zhejiang Gongshang University,2007:20-27.
[17]章华伟,陈星宇,凌春英.响应面优化醇法提取桑叶黄酮工艺研究[J].氨基酸和生物资源,2010,34(3):76-79. ZHANG Huawei, CHEN Xingyu, LING Chunying. Optimization of alcoholic extraction of flavonoids from mulberry leaves using response surface methodology[J]. Amino Acids & Biotic Resources,2010,34(3):76-79.
[18]王芳,乔璐,淡小艳,等.桑叶黄酮的提取及抗氧化研究[J].广东农业科学,2011(15):76-79. WANG Fang, QIAO Lu, DAN Xiaoyan, et al. Study on extraction and anti-oxidation of flavonoids from morus aLba L. leaves[J]. Guangdong Agricultural Sciences,2011(15):76-79.
[19]李飞鸣,张国平,邹湘月.桑叶黄酮类化合物研究进展[J].中国蚕业,2015,36(2):1-4. LI Feiming, ZHANG Guoping, ZHOU Xiangyue. The progress of mulberry flavonoids research[J]. China Sericulture,2015,36(2):1-4.
[20]杨青珍,王锋,王帅.龙桑叶黄酮类物质的提取工艺及抗氧化性研究[J].江苏农业科学,2010(2):305-307. YANG Qinzhen, WANG Feng, WANG Shuai. The research of extraction process and antioxidant activities of long mulberry flavonoids[J]. Jiangsu Agricultural Sciences,2010(2):305-307.
[21]王海燕,李睿,曾秀,等.响应面优化超声波提取桑叶槲皮素工艺[J].食品科学,2014,35(22):56-62. WANG Haiyan, LI Rui, ZENG Xiu, et al.. Optimization of ultrasound-assisted extraction of quercetin from mulberry leaves by response surface methodology[J]. Food Science,2014,35(22):56-62.
[22]吴红梅.多酚氧化酶酶源筛选及酶法制取茶色素研究[D].合肥:安徽农业大学,2004:6-10. WU Hongmei. Studies on Selection of Ppo Enzyme Source and Preparation of Tea Pigments by Enzymatic Method[D]. Hefei: Anhui Agricultural University,2004:6-10.
[23]王洪新,孙军涛,吕文平,等.茶黄素的制备、分析、分离功能活性研究进展[J].食品与生物技术学报,2011,30(1):12-18. WANG Hongxin, SUN Juntao, LÜ Wenping, et al. Research progress on preparation, analysis, separation and function of theaflavins[J]. Journal of Food Science and Biotechnology,2011,30(1):12-18.
[24]杨妍,彭春秀,盛军,等.普洱茶中茶褐素含量的紫外光谱法测定[J].光谱学与光谱分析,2013,33(7):1850-1856. YANG Yan, PENG Chunxiu, SHENG Jun, et al. Study on the UV-quantitative analysis of the abrownins in Pu-Erh tea[J]. Spectroscopy and Spectral Analysis,2013,33(7):1850-1856.
Optimization of decolorization process of quercetin extracted from mulberry leaves by response surface methodology
WANG Haiyan, XU Jingya, LI Rui, XIONG Dingkui, ZENG Xiu, GU Shanlin, WANG Jieping,ZHOU Chan, WANG Xiaoyan, YAO Hong
(Chongqing Academy of Animal Sciences, Chongqing 402460, China)
In order to reduce the effects of pigments on isolating and purifying of quercetin extracted mulberry leaves, activated carbon was used to decolor it and the process was optimized. By taking the decolorization rate as a comprehensive evaluation index, the 3 process parameters (mass concentration of activated carbon, decolorization time and decolorization temperature) were optimized by response surface methodology. The results show that the best decolorization process (of activated carbon of quercetin extracted from mulberry leaves) is as follows: mass concentration of activated carbon 5 g/L, decolorization time 9 min and decolorization temperature 79.04 ℃. The decolourization ratio of the extract was 94.65%±1.65%, which was basically consistent with the predicted value (94.30%). The results show that the obtained decolorization process was easy to operate and its effect was better. The results have certain significance for subsequent purification of the extract.
mulberry leaves; quercetin; ethanol extract; response surface methodology; activated carbon; decolorization process
10.3969/j.issn.1001-7003.2016.12.003
2016-05-31;
2016-11-04 基金项目: 重庆市科委应用开发计划项目(cstc2014 yykfA80014);重庆市2015年农发资金项目(15403) 作者简介: 王海燕(1986_),女,助理研究员,主要从事天然活性成分、蚕桑资源综合利用及食品安全与质量控制的研究。通信作者:曾秀,研究员,whydetian@163.com。
TS190.924
A
1001-7003(2016)12-0012-06 引用页码: 121102

