微生物促生剂发酵玉米皮生产饲料蛋白研究
季 彬,祁宏山,王治业*,杜军国,曾 杨,陈 娟,祝 英
(甘肃省科学院生物研究所,甘肃兰州730000)
微生物促生剂发酵玉米皮生产饲料蛋白研究
季 彬,祁宏山,王治业*,杜军国,曾 杨,陈 娟,祝 英
(甘肃省科学院生物研究所,甘肃兰州730000)
以玉米皮为基本碳源,通过单因素和正交试验,以产朊假丝酵母、啤酒酵母和白地霉联合固态发酵生产蛋白饲料进行了研究。以提高真蛋白含量为主要目的,优化得到最佳的发酵条件为菌液接种量7%,固态发酵培养基料水比1:1.8(g:mL),发酵温度31℃,发酵时间80 h。在此条件下,真蛋白含量可达15.6%,是发酵前的1.94倍。
玉米皮;固态发酵;饲料蛋白
我国优质饲料资源短缺,一直以来都制约着畜牧业的长效发展[1-3]。玉米皮是玉米籽粒的表皮部分,也称作玉米纤维或玉米渣,是玉米加工淀粉后的副产物,通常在湿法[4]加工淀粉的过程中被分离出来。玉米皮富含淀粉和纤维素[5],还有少量的植物蛋白,传统的使用方法是直接用来饲喂牛羊,但因其适口性差,牛羊等采食率低,饲喂效果不好。利用微生物发酵[6-7]的方法,可将玉米皮中的淀粉、纤维类物质直接转化为牛羊易采食的单细胞蛋白。目前,相关研究[8-9]多采用将不同饲料化菌株分别接入玉米皮,然后再利用固态混合发酵的方式生产单细胞蛋白饲料,但这种方法在工业化生产中一是由于不同菌株间可能存在的竞争、协同关系,菌株间的配比往往不能反映饲料化过程中各菌株间真实的相互关系,增蛋白效果有限;二是多次接种增加了工作量,也增加了杂菌污染的机会。针对于此,本试验采用将饲料化菌株经细胞固定化后接种至玉米皮糖化醪中反复培养,待其菌群结构稳定后再将菌液一次性接入玉米皮后固态发酵。由于菌液中各菌株的配比已经玉米皮水解液的反复优化,呈稳定的状态,在接入玉米皮后可在较短时间内迅速进入饲料化发酵,其最佳的菌株配比也更能高产单细胞蛋白。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
白地霉(GeotrichumcandidumLink)、产朊假丝酵母(Candida utilis)、啤酒酵母(Saccharomyces cerevisiaeHansen):中国工业微生物菌种保藏中心甘肃分中心提供。
1.1.2 材料
聚乙烯醇复合凝胶[10]:兰州凯奇生物工程有限责任公司提供。
玉米皮:甘肃张掖昆仑生化有限责任公司提供。将玉米皮粉碎后过40目筛,加入相当于干料总量1%的营养盐液(0.05%硫酸铵,0.027%磷酸二氢钾,硫酸镁0.02%,水1000mL),含水量控制在60%左右,于121℃灭菌处理25min。
1.1.3 培养基
白地霉培养基:马铃薯200g去皮,切成小块,加水煮沸20min后用纱布过滤,滤液加葡萄糖20g,定容至1000mL,pH值自然,冷却后待用。固体培养基加琼脂16 g。
酵母种子培养基:蛋白胨8 g,牛肉膏5 g,酵母粉3 g,葡萄糖10 g,七水硫酸镁0.5 g,水1 000 mL。
固定化细胞培养基[11]:白地霉菌液体培养基与玉米糖化醪1∶1混合,其中玉米糖化醪的制作方法:将玉米粉碎并过40目筛,与水以1:4.5的比例混合并加热,待温度为40℃,开始加入所需酶量一半的淀粉酶(淀粉酶按12 U/g玉米粉称取),保温30 min,后继续加热至90℃,加入剩余的淀粉酶,并加热至沸25 min,后开始冷却,待温度为62~64℃时加入糖化酶(糖化酶按200 U/g玉米粉称取),并保温40 min后降温至28~30℃。
1.2 仪器与设备
LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;SW-CJ-1F超净工作台:苏州净化设备有限公司;MJ-160型霉菌培养箱:上海恒跃医疗器械有限公司。
1.3 方法
1.3.1 工艺流程
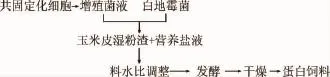
1.3.2 酵母菌共固定化方法
将待固定的酵母菌种分别经种子培养基增殖培养后,待菌悬液中酵母细胞数达到1.2×108CFU/mL以上时,将产朊假丝酵母、啤酒酵母菌悬液以1:1的体积比混合,然后以2:8的体积比与聚乙烯醇凝胶混合,搅拌均匀后置于低温冷冻箱中固化48 h,解冻后切成4 cm×4 cm×4 cm的切块备用。
1.3.3 共固定化细胞增殖培养[12]
将备用的固定化细胞切块加入固定化增殖培养基中,在28℃条件下增殖18 h,增殖罐搅拌转速为90 r/min。
将固定化酵母增殖液与白地霉菌培养液以1∶1的比例混合[13]后,接种在蒸煮好的玉米皮中,在一定培养条件下发酵。
1.3.4 玉米皮固态发酵试验[14-16]
①单因素试验
试验以玉米皮为基本碳源,添加营养盐液后控制料水比,经蒸煮灭菌处理后接种培养,初始培养条件为玉米皮200 g,料水比1∶2(g∶mL),接种量10%,30℃培养72 h,考察不同接种量(5.0%、7.5%、10.0%、12.5%、15.0%)、基质料水比(1∶1.0、1∶1.4、1∶1.8、1∶2.2、1∶2.6、1∶3.0(g∶mL))、发酵温度(25℃、28℃、31℃、34℃、37℃)和培养时间(48 h、64 h、72h、80h、90h)对玉米皮饲料化发酵产真蛋白量的影响。
②正交试验
在单因素试验基础上,选取接种量、培养基料水比、发酵温度和发酵时间4个因素,取3水平设计试验,发酵终了时测定真蛋白含量,并且利用软件对试验结果进行极差分析。正交试验因素与水平见表1。

表1 玉米皮发酵条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal tests for corn bran culture conditions optimization
1.3.5 真蛋白含量测定[17]
用电子天平精确称取发酵后产物0.5 g放置于100 mL烧杯中,加入30 mL蒸馏水用玻璃棒搅拌均匀,再煮沸依次加入10%硫酸铜水溶液20 mL和2.5%氢氧化钠溶液20 mL,边加边搅拌,加完后继续搅拌几分钟。放置2 h,沉淀物用滤纸过滤,并用70℃以上热蒸馏水反复洗涤沉淀,直至滤液无沉淀为止(用氯化钡试验检验)。最后将滤纸和沉淀物包好,65~70℃烘箱干燥。用凯氏定氮法测定样品中真蛋白含量,同时作空白对照。
2 结果与分析
2.1 单因素试验
2.1.1 料水比对玉米皮饲料化发酵产真蛋白的影响
固态发酵不同于液态发酵,固态发酵中合理控制发酵基质中水分的含量,有利于微生物进行细胞运动、生长、细胞内外营养物质交换。料水比对真蛋白含量的影响见图1。

图1 料水比对玉米皮产真蛋白含量的影响Fig.1 Effects of solid-liquid ratio on true protein content from corn bean
由图1可以看出,真蛋白含量随料水比的增加呈先增大后减小的趋势,当料水比为1∶1.8(g∶mL)时,饲料化发酵后玉米皮真蛋白含量达最大值,为14.3%。原因可能是低水分发酵时,底物中的营养物没有足够的自由水将其扩散到底物表面,菌株生长繁殖的营养物质供给不足,真蛋白增量不足;高水分发酵时,底物颗粒间没有足够的孔隙率,供氧不足,菌株生长受限,真蛋白增量有限。因此选择料水比为1∶1.8(g∶mL)进行后续试验。
2.1.2 接种量对玉米皮饲料化发酵产真蛋白的影响
接种量对真蛋白含量的影响见图2。由图2可知,真蛋白含量随接种量的增加呈先快速后缓慢增大的趋势,当接种量为7.5%时,饲料化发酵后玉米皮中真蛋白含量可达9.7%,之后随着接种量的增加,真蛋白含量增量较小,考虑到菌液生产成本,控制接种量在7.5%较为合适。接种量大可以缩短发酵过程中菌株细胞数达到峰值的时间,提早形成发酵终产物。这是因为种子液中含有胞外水解酶类,接种量大,酶量也多,有利于对固态基质中营养物质的分解和利用,同时菌体量多,占有绝对生长优势,可以相对减少杂菌污染和生长的机会。但接种量过大,也会造成菌体前期生长过速,后期由于基质中菌体代谢产物堆积和营养物质消耗殆尽,导致菌体早衰,从而影响产物的合成。因此,选择接种量为7.5%进行后续试验。

图2 接种量对玉米皮产真蛋白含量的影响Fig.2 Effects of inoculum on true protein content from corn bran
2.1.3 发酵温度对玉米皮饲料化发酵产真蛋白的影响
温度对发酵的影响及其调节控制是影响微生物生长繁殖最重要的因素之一,其主要表现在对细胞生长、产物合成和培养基质物理性质的改变等方面。据此,控制适当的发酵温度,使生产菌种处于产物合成最佳的温度下生长,才能得到优质高产的效果。发酵温度对真蛋白含量的影响见图3。

图3 发酵温度对玉米皮产真蛋白含量的影响Fig.3 Effects of the fermentation temperature on true protein content from corn bran
由图3可知,真蛋白含量随发酵温度的升高呈先增大后减小的趋势,当混合菌液在31℃发酵玉米皮时,发酵后得成熟物料中真蛋白含量最高为14.5%,之后,随着温度的上升,真蛋白含量有所下降。因此,选择发酵温度为31℃进行后续试验。
2.1.4 发酵时间对玉米皮饲料化发酵产真蛋白的影响
真蛋白含量是评价玉米皮饲料化发酵效果的重要指标,而微生物的生长要经过停滞期、对数生长期、稳定期和衰退期四个阶段,微生物发酵产物的总量随着微生物的生长阶段的改变而改变。发酵时间对真蛋白含量的影响见图4。
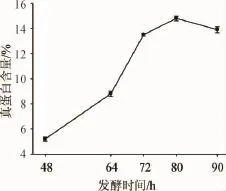
图4 发酵时间对玉米皮产真蛋白含量的影响Fig.4 Effects of the fermentation time on true protein content from corn bran
由图4可知,真蛋白含量随发酵时间的延长呈先增大后减小的趋势,玉米皮饲料化发酵80 h时,真蛋白含量可达峰值为14.8%,之后随着发酵时间的延长有所减低,分析认为是由于微生物自身分解代谢所致。因此,选择发酵时间为80 h进行后续试验。
2.2 正交试验结果
在单因素试验的基础上,选取接种量、培养基料水比、发酵温度、发酵时间4因素,分别设3个水平,用正交表L9(34)设计试验,研究各因素对玉米皮饲料化发酵的影响,试验结果与分析见表2。

表2 玉米皮发酵条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal tests for corn bran fermentation conditions optimization
由表2可知,直观分析得出最佳水平组合为A1B2C2D2,即菌种接种量7%,固态发酵培养基料水比1∶1.8(g∶mL),发酵温度31℃,发酵时间80 h。在此条件下,真蛋白含量为15.6%,是发酵前的1.94倍。4种因素对真蛋白产量影响依次为培养基料水比>发酵温度>接种量>发酵时间,即培养基含水量和发酵温度是影响玉米皮饲料化发酵的主要因素,其他影响较小。
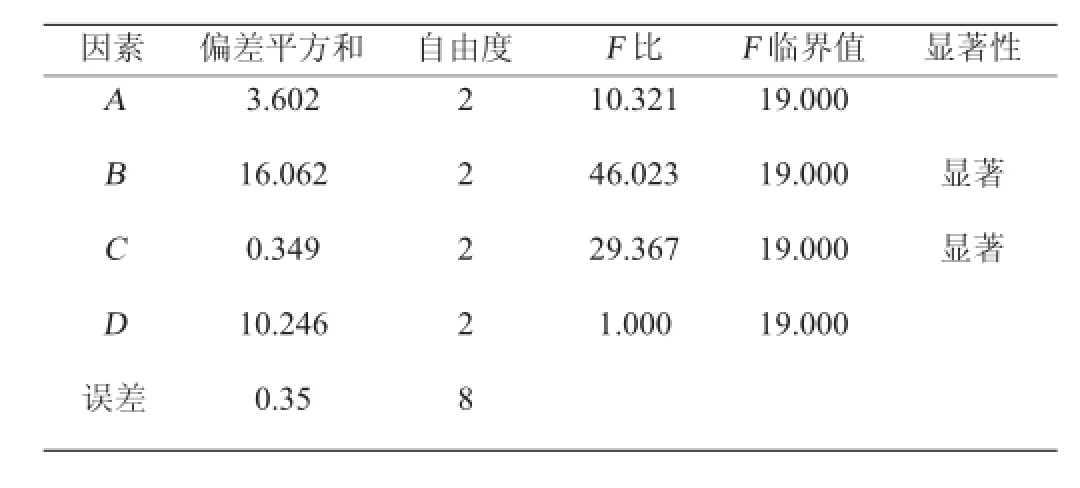
表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal test result
由方差分析(表3)可知,培养基料水比、发酵时间F比>F0.05(2,2),故其对玉米皮饲料化发酵产真蛋白十分显著(P<0.05);接种量、发酵温度F比<F0.05(2,2),故其对玉米皮饲料化发酵产真蛋白的影响不显著(P>0.05)。
3 结论
本试验中玉米皮经蒸煮灭菌处理后,接种经细胞固定化后制得的产朊假丝酵母、啤酒酵母、白地霉菌液优化菌液,固态发酵后制取单细胞蛋白饲料。试验结果表明,将菌液接种量控制在7%,固态发酵培养基料水比1∶1.8(g∶mL),发酵温度31℃,发酵80 h时,真蛋白含量可达15.6%,是发酵前的1.94倍。本研究由于优化了发酵菌液,发酵后玉米皮真蛋白含量要高于现有的研究水平,显示了其优越性,具有一定的工业应用潜力。
[1]刘靖,张石蕊.蛋白质饲料资源的合理利用及开发对策[J].饲料工业,2009(5):43-46.
[2]祝玉洪,马立周.发酵技术在饲料行业中的应用[J].饲料工业,2013(18):49-54.
[3]邹志恒,宋琼莉,韦启鹏,等.发酵饲料在养猪生产中的应用与研究进展[J].中国动物保健,2009(3):66-68.
[4]胡叶碧.改性玉米皮膳食纤维的酶法制备及其降血脂机理研究[D].无锡:江南大学,2008.
[5]武霞.用玉米皮制取饲料酵母[J].粮食与饲料工业,1997(7):20-21.
[6]农业部畜牧业司.中华人民共和国农业部公告第2045号[EB/OL].(2013-12-30).http://www.moa.gov.cn/zwllm/tzgg/gg/201401/t20140103_ 3730193.html.
[7]李勇凯,毛胜勇,朱伟云.益生菌发酵饲料研究及应用现状[J].畜牧与兽医,2009,41(3):90-93.
[8]孙付保,陈晓旭,陈晓萍,等.混合菌株固态发酵玉米皮生产饲料蛋白[J].食品与生物技术学报,2010,29(6):916-920.
[9]王伟伟,齐景伟,安晓萍,等.混菌固态发酵制备玉米皮菌体蛋白饲料的培养基优化[J].中国饲料,2013(10):16-19.
[10]周剑平,魏甲乾,龚伟中,等.聚乙烯醇复合凝胶及其合成方法,CN200410038808.5[P].2005-11-02.
[11]魏甲乾,杨宗贤.共固定化细胞在生物饲料发酵生产中的应用[J].饲料工业,2012,33(21):23-25.
[12]赵小峰,季彬,曾杨,等.固定化酵母在山西老陈醋全固态发酵工艺中的应用[J].中国酿造,2009,28(10):105-107.
[13]晨曦,赵建国.混株发酵混合酒糟生产含酶蛋白饲料的研究[J].中国酿造,2006,25(5):30-33.
[14]罗明朗.论固体发酵对物料蛋白质含量的提高[J].粮食与饲料工业,1996(11):26-28.
[15]张龙翔,张庭芳,李令援.生化实验方法和技术[M].北京:高等教育出版社,1997:163.
[16]赵萍,夏文旭,赵瑛,等.微生物与酶制剂在秸秆发酵饲料生产中的应用[J].中国酿造,2015,34(7):121-124.
[17]刘琳,郑波.电流法测定乳制品中真蛋白含量的方法探究[J].中国卫生检验杂志,2016(14):2013-2014.
Feed protein production from corn bran with microbial fermentation promoters
JI Bin,QI Hongshan,WANG Zhiye*,DU Junguo,ZENG yang,CHEN Juan,ZHU Yin(Institute of Biology,Gansu Provincial Academy of Sciences,Lanzhou 730000,China)
Usingcornbranasbasiccarbonsource,proteinfeedwasproducedwiththesolid-statefermentationofCandidautilis,Saccharomycescerevisiae andGeotrichum candidumby single-factor and orthogonal experiments.To improve pure protein content,the optimal fermentation conditions were as follows:solid-liquid ratio of solid-state fermentation medium 1:1.8(g:ml),inoculum 7%,fermentation temperature 31℃and time 80 h.Under the above conditions,the true protein content in the final product achieved 15.6%,which was 1.94 times of before fermentation.
corn bran;solid-state fermentation;feed protein
S816.6
0254-5071(2017)01-0107-04
10.11882/j.issn.0254-5071.2017.01.022
2016-05-04
甘肃省科学院青年基金(2013QN-07);国家科技支撑计划(2012BAD14B10-4);国家星火项目(2012GA860003)
季彬(1983-),男,助理研究员,本科,主要从事农业废弃物高值化利用研究工作。
*通讯作者:王治业(1976-),男,研究员,硕士,主要从事生物资源高值化及清洁生产方面的研究工作。

