羊肝蛋白酶解条件优化及酶解产物抗氧化活性研究
文 飞,母应春,李静雯,赵 旭,唐素婷,杨旭卉,苏 伟*
(贵州大学酿酒与食品工程学院,贵州贵阳550025)
羊肝蛋白酶解条件优化及酶解产物抗氧化活性研究
文 飞,母应春,李静雯,赵 旭,唐素婷,杨旭卉,苏 伟*
(贵州大学酿酒与食品工程学院,贵州贵阳550025)
为优化羊肝蛋白酶解工艺条件及探讨其体外抗氧化活性,以水解度为评价指标,采用碱性蛋白酶酶解羊肝,在单因素试验基础上,通过响应面法优化羊肝蛋白的酶解工艺条件。结果表明,羊肝蛋白最佳酶解条件为酶解温度51℃、pH 8.5、酶解时间4.1 h、加酶量0.40%。在此条件下,进行3次验证试验,测得羊肝酶解液实际水解度为(40.31±0.24)%。体外抗氧化试验结果表明,羊肝酶解产物具有一定的抗氧化活性,其清除羟自由基(·OH)、超氧阴离子自由基(O2-·)和DPPH自由基的IC50值分别为17.01 mg/mL、13.21 mg/mL和10.42 mg/mL,并具有一定的还原能力。
羊肝;蛋白;酶解;抗氧化活性
我国每年对羊肉的需求量达数百万吨,随着对羊肉需求量和羊肉加工企业的增多,羊肉加工过程不可避免产生大量的副产物,这些副产物常被加工成饲料或被丢弃,不仅产品附加值低,而且污染环境,资源未得到充分利用。羊肝为羊肉加工过程中的副产物之一,其营养丰富,除含蛋白质外,还含有铁、磷、钙、尼克酸及维生素A等营养元素,并具有明目和止血的作用[1-2]。因此,如何对羊肝进行深加工,提高其附加值是亟待解决的问题。
酶解法制备蛋白因其反应时间短、反应条件温和可控、水解效率高等优点,而广泛应用于多肽的制备。KECHAOU E S等[3-5]分别通过酶解内脏的方式获得了生物活性肽;刘旺旺等[6]利用微生物发酵法制备羊胎盘多肽的工艺及体外清除自由基能力的研究;韩志慧等[2]以羊肝为原料,研究了制作羊肝羹的工艺。而优化羊肝酶解条件及其酶解产物的抗氧化活性方面的报道鲜见。
随着人工合成抗氧化剂的使用,如2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)和丁基羟基茴香醚(butyl hydroxy anisd,BHA)对机体虽能起到一定的抗氧化作用,但研究表明,人工合成抗氧化剂存在不安全性,使用过量会对人体产生致癌作用,因此,利用酶解技术来制备安全、高效的天然抗氧化剂成为了研究热点。王艳梅等[7]利用碱性蛋白酶酶解黄缘盒龟肉,研究其体外抗氧化活性,得到的酶解产物具有良好地清除羟基自由基、超氧阴离子、DPPH自由基和过氧化氢能力,还具有一定的还原能力、亚油酸氧化抑制能力。尹利瑞等[8]采用蛋白酶酶解鲤鱼鱼鳞得到具有清除DPPH自由基、羟基自由基能力和一定还原能力的胶原蛋白肽。徐怀德等[9]分别利用木瓜蛋白酶、胰蛋白酶和枯草蛋白酶来酶解甲鱼蛋白,得到3种酶解产物都具有较强的清除DPPH自由基、羟基自由基能力和还原能力。
为提高羊肉加工过程中副产物资源利用率,本研究以羊肝为原料,以水解度为评价指标,在单因素试验结果的基础上,通过响应面法优化羊肝蛋白酶解工艺条件,并研究其酶解产物的体外抗氧化活性,以期为羊肝副产物的深加工及提高羊肝资源加工利用率提供理论依据。
1 材料与方法
1.1 材料与试剂
羊肝:贵州省晴隆县海权清真肉羊食品加工有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):美国Sigma公司;中性蛋白酶(酶活力40万U/g)、Alcalase 2.4 L碱性蛋白酶(Alcalase 2.4 L,酶活力40万U/g)、木瓜蛋白酶(酶活力80万U/g)、胰蛋白酶(酶活力4万U/g):广西南宁庞博生物工程有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
SpectraMax-190酶标仪:美国Molecular Devices公司;LGJ-10D冷冻干燥机:北京四环科学有限公司;SER148脂肪测定仪:意大利威尔普仪器有限公司;KDN系列消化炉、KDN-08系列凯氏定氮仪:浙江托普科学仪器有限公司;SX-4-10型箱式电阻炉:天津泰斯特仪器公司;T6新世纪紫外分光光度计:北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 羊肝酶解液的制备工艺流程

1.3.2 蛋白酶种类的筛选
选择中性蛋白酶、碱性蛋白酶、胰蛋白酶和木瓜蛋白酶对羊肝进行单酶酶解,并根据酶制剂使用说明,在各蛋白酶最适pH值和酶解温度条件下进行水解,分别考察中性蛋白酶、碱性蛋白酶、胰蛋白酶和木瓜蛋白酶对羊肝蛋白水解度的影响。4种酶最适酶解条件见表1。
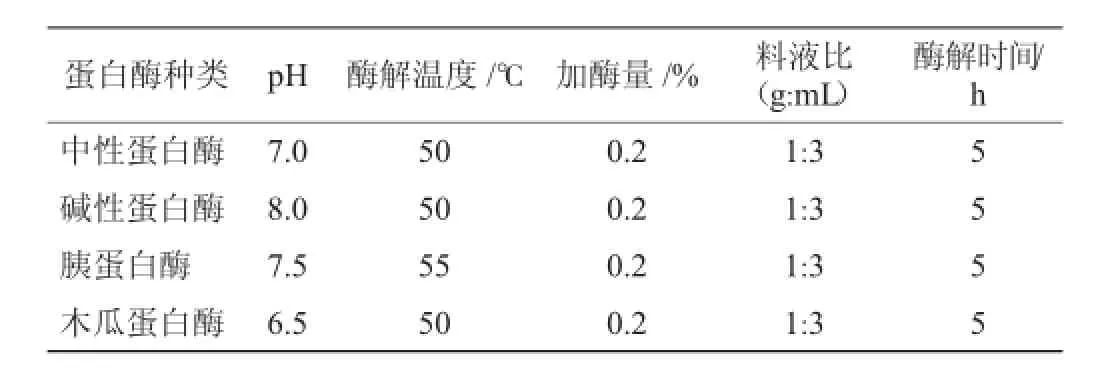
表1 羊肝蛋白酶解工艺参数Table 1 Enzymatic hydrolysis process parameters of sheep liver proteins
1.3.3 单因素试验
利用1.3.2节中筛选出来的碱性蛋白酶对羊肝进行酶解。在料液比1∶3(g∶mL)条件下,研究酶解时间(1h、2h、3h、4 h、5 h、6 h)、酶解温度(40℃、45℃、50℃、55℃、60℃)、pH(7.0、7.5、8.0、8.5、9.0、10.0)和加酶量(酶与底物质量比)(0.2%、0.3%、0.4%、0.5%、0.6%)对羊肝蛋白水解度的影响。
1.3.4 蛋白水解度测定
羊肝酶解液中氨基氮含量和羊肝样品中总氮含量分别采用甲醛电位滴定法[10]和凯氏定氮法测定,水解度(degree of hydrolysis,DH)计算公式如下:

1.3.5 分析检测方法
蛋白质的测定:参照GB 5009.5—2010《食品中蛋白质测定》中凯氏定氮法;脂肪的测定:参照GB/T 5009.6—2003《食品中脂肪的测定》中索氏抽提法;水分的测定:参照GB/T 5009.3—2010《食品中水分的测定》中直接干燥法;灰分的测定:参照GB/T 5009.4—2010《食品中灰分的测定》中灼烧法。
1.3.6 响应面分析
在单因素试验结果的基础上,以酶解温度(X1)、pH(X2)、酶解时间(X3)、加酶量(X4)为自变量,水解度(Y)为响应值,按照Box-Behnken中心组合设计原理,进行响应面试验,因素与水平见表2。

表2 酶解条件优化响应面试验因素与水平Table 2 Factors and levels of response surface experiments for enzymatic hydrolysis conditions optimization
1.3.6 羊肝酶解产物对DPPH自由基清除率的测定[10]
取一定量羊肝冻干粉于试管中用蒸馏水配制成不同质量浓度羊肝酶解液。准确称取7.92 mg DPPH,用体积分数95%乙醇溶解并定容至100 mL,配制成0.2 mmol/mL DPPH-乙醇溶液。取羊肝酶解液2.0 mL与2.0 mL DPPH乙醇溶液混合摇匀,常温下避光反应30 min后,在波长517 nm处测定吸光度值,计为Ai;再取羊肝酶解液2.0 mL与2.0 mL体积分数95%乙醇溶液混合摇匀,在波长517 nm处的测定吸光度值,读数计为Aj;取2 mL DPPH乙醇溶液加上2 mL蒸馏水混合摇匀测定波长517 nm处的吸光度值,读数计为Ac;空白为2mL体积分数95%的乙醇溶液加入2mL蒸馏水,调零。以维生素C(vitaminC,VC)为阳性对照。DPPH自由基清除率计算公式如下:
DPPH自由基清除率=[1-(Ai-Aj)/Ac]×100%
1.3.7 羊肝酶解产物对超氧阴离子自由基(O2-·)清除率的测定
参照赵强忠等[12]的方法略微修改,采用邻苯三酚自氧化法进行测定。准确称取37.8 mg邻苯三酚,用0.01 mol/L HCl溶解并定容至100 mL,配制成浓度为3 mmol/L的邻苯三酚溶液,并用超纯水配制一定质量浓度的羊肝酶解液,取0.1 mol/L Tris-HCl缓冲液(pH 8.2)4.5 mL于25℃水浴保温20 min,取出后立即加入羊肝酶解液2 mL、蒸馏水3 mL及邻苯三酚0.5 mL(试验前于25℃保温)后迅速摇匀,分别取200 μL于96孔板上,用酶标仪恒温下每隔30 s在波长325 nm测定其吸光度值(A325nm),反应4.0 min后结束。计算样品抑制邻苯三酚自氧化的速率V样(即每分钟光吸收的平均变化率)。空白管中以0.01 mol/L的HCl代替羊肝酶解液,反应启动后4.0 min内,计算邻苯三酚自氧化速率V自。以VC为阳性对照。O2-·的清除率计算公式如下:

1.3.8 羊肝酶解产物还原力的测定[13]
取先配制好的不同质量浓度的羊肝酶解液1 mL于试管中,加入2.0 mL质量分数为1%的铁氰化钾溶液和2.0 mL 0.2 mol/L的磷酸盐缓冲液(pH 6.6),混匀后在50℃水浴中保温30 min,然后加入2.0 mL质量分数为10%的三氯乙酸,混合后3 000 r/min离心10 min,取上清液2 mL,加入2 mL超纯水和0.5 mL质量分数为0.1%的FeCl3溶液,混匀后于50℃水浴中保温10 min,在波长700 nm处测定吸光度值。以超纯水代替羊肝酶解液作为空白对照。每个浓度做3个平行,吸光度值越大,表示还原能力越强。以VC为阳性对照。1.3.9羊肝酶解产物对羟自由基(·OH)清除率的测定[14]
取1 mL先配制好的不同质量浓度羊肝酶解液,依次加入1 mL 9 mmol/L FeSO4溶液、1 mL 9 mmol/L水杨酸-乙醇溶液、1 mL 8.8 mmol/L H2O2溶液,混合均匀后静置30 min,以超纯水为参比,于波长510 nm处测定吸光度值(A1)。取1 mL蒸馏水代替FeSO4溶液,测得吸光度值(A2)。取1 mL蒸馏水代替羊肝酶解液,于波长510 nm处测得吸光度值(A0)。以VC为阳性对照。·OH的清除率计算公式如下:

1.3.10 数据分析与处理
每个试验做3个平行,测定结果以平均数±标准偏差表示,并利用Origin 8.5和Design-Expert V 8.0.6软件对实验数据进行处理分析。
2 结果与分析
2.1 羊肝基本组分分析
由表3可知,羊肝的蛋白质含量为17.61%左右,因此,羊肝粗蛋白可用于酶解制备多肽的蛋白源。

表3 羊肝基本组分分析Table 3 Analysis of the basic components of sheep liver
2.2 蛋白酶的筛选
蛋白酶的种类不同,其作用位点及其所结合的底物特性也有所不同[15],4种蛋白酶对羊肝进行酶解,结果见图1。

图1 酶的种类对羊肝酶解产物水解度的影响Fig.1 Effect of enzyme types on hydrolysis degree of sheep liver enzymatic hydrolysates
由图1可知,各蛋白酶对羊肝的酶解能力不相同,依次为碱性蛋白酶>胰蛋白酶>木瓜蛋白酶>中性蛋白酶,即碱性蛋白酶酶解羊肝的水解度最高,达12.43%。因此,选用碱性蛋白酶作为最佳用酶,进行后续酶解工艺条件优化及抗氧化活性研究。
2.3 羊肝酶解工艺的单因素试验
2.3.1 酶解温度对羊肝酶解产物水解度的影响

图2 酶解温度对羊肝酶解产物水解度的影响Fig.2 Effect of hydrolysis temperature on hydrolysis degree of sheep liver enzymatic hydrolysates
由图2可知,在40~50℃温度范围内,水解度随着酶解温度的增加而增大,当温度为50℃时,水解度达到最大值,为34.40%;继续升高酶解温度,水解度呈下降趋势,这是因为在反应前期,酶与底物接触频繁,酶活力较高,水解度开始增加,而当温度超过了该蛋白酶的最适温度,酶的结构发生变性,从而酶活力降低,酶与底物作用位点的结合受到抑制[16],使得水解度开始下降。因此,选择酶解温度50℃为宜。
2.3.2 pH值对羊肝酶解产物水解度的影响
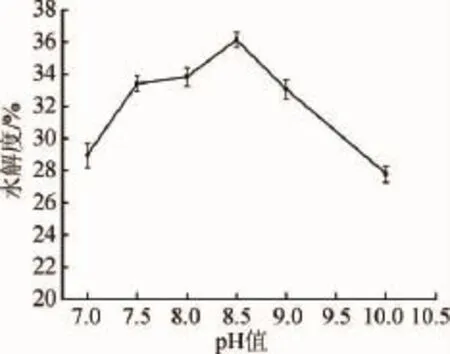
图3 pH值对羊肝酶解产物水解度的影响Fig.3 Effect of pH on hydrolysis degree of sheep liver enzymatic hydrolysates
由图3可知,当pH值在7.0~8.5时,羊肝酶解产物的水解度呈现缓慢上升趋势;当pH值为8.5时,水解度达到最大值,为36.13%;此后由于pH值增大不适合酶的最佳作用条件,使得蛋白质分子的某些基团解离受到限制[17-18],从而水解效果开始下降。因此,选择pH 8.5为宜。
2.3.3 酶解时间对羊肝酶解产物水解度的影响
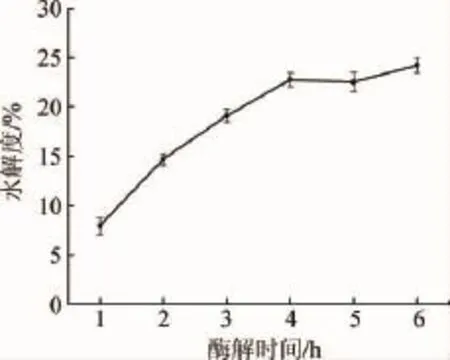
图4 酶解时间对羊肝酶解产物水解度的影响Fig.4 Effect of hydrolysis time on hydrolysis degree of sheep liver enzymatic hydrolysates
由图4可知,水解度随着酶解时间的增加呈现上升趋势,酶解时间在1~4 h范围内,水解度增大较快;当酶解时间达到4 h时,水解度为22.74%,此后进一步延长酶解时间,水解效果变化不大。因此,选择酶解时间4 h为宜。
2.3.4 加酶量对羊肝酶解产物水解度的影响
由图5可知,在0.2%~0.4%范围内,随着加酶量增加,水解度呈现出上升趋势。当加酶量为0.4%时,水解度达到最大值,为38.69%;此后随着酶添加量的增加,水解度开始下降,这是由于底物的蛋白结合位点被逐渐占据,中间复合物也达到饱和状态[19]。因此,选择加酶量0.4%为宜。

图5 加酶量对羊肝酶解产物水解度的影响Fig.5 Effect of enzyme addition on hydrolysis degree of sheep liver enzymatic hydrolysates
2.4 响应面优化结果分析
响应面试验设计及数据结果如表4所示,对试验数据进行方差分析,结果见表5。

表4 响应面试验设计及结果Table 4 Design and results of response surface experiments
使用Design-Expert V 8.0.6软件对表4试验数据进行多元回归拟合,得到自变量(X1、X2、X3、X4)与水解度(Y)之间的二次多项式回归模型方程为:
Y=39.08+0.45X1+0.17X2+0.35X3-0.033X4-0.45X1X2-0.15X1X3-0.047X1X4-0.26X2X3-0.30X2X4-0.48X3X4-1.10X12-1.84X22-1.03X32-1.02X42
由表5方差分析结果可知,水解度的模型确定系数R2=0.954 0,校正系数R2Adj=0.908 0,模型的P值<0.000 1,说明模型达极显著,失拟项P值为0.821 6>0.05,影响不显著,表明回归方程与实测值之间拟合较好;一次项X1、X3,二次项X12、X22、X32、X42对水解度的影响均极显著(P<0.01),而交互作用项X1X2、X3X4对结果影响显著(P<0.05)。由表5中各因素的P值可知,各因素对羊肝水解度的影响大小依次为酶解温度(X1)>酶解时间(X3)>pH(X2)>加酶量(X4)。
等高线圆形状表示两者交互作用不显著,椭圆形则表示交互作用显著[20-21]。图6中显示了各因素之间的交互作用对羊肝水解度三维响应面及等高线图的影响。由图6可知,酶解温度与pH、酶解时间与加酶量的等高线图形状呈椭圆形且排列紧密,说明酶解温度与pH、酶解时间与加酶量之间交互作用显著,这与表5方差分析结果一致。
根据表4中的响应值Y的结果,通过Design-Expert V 8.0.6软件对方程进行求解,得到酶解羊肝蛋白工艺的最佳条件为:酶解温度50.96℃、pH 8.51、酶解时间4.09 h、加酶量0.39%,在此工艺条件下理论上水解度为40.02%。为了验证最优酶解条件,考虑到试验设备和实际操作的可行性,将优化所得最佳酶解条件修正为:酶解温度51℃、pH 8.5、酶解时间4.1 h、加酶量0.40%。在上述确定的最优酶解条件下进行3次验证试验,得到羊肝酶解液的水解度为(40.31±0.24)%,与理论值相差不大,说明二次多项式模型拟合度较好。

表5 回归模型方差分析Table 5 Variance analysis of regression model

图6 酶解温度、pH、酶解时间和加酶量的交互作用对羊肝酶解产物水解度影响的响应面和等高线Fig.6 Response surface plots and contour line of effects of interaction between hydrolysis temperature,pH,hydrolysis time and enzyme addition on hydrolysis degree of sheep liver enzymatic hydrolysates
2.5 羊肝酶解产物的抗氧化活性研究
2.5.1 清除羟自由基(·OH)的能力
在自由基体系中,·OH是一种对生物体毒性最强、危害最大的活性氧自由基,能引起机体发生多种疾病[22]。在优化条件下酶解羊肝蛋白,测定酶解产物羟自由基清除率,结果见图7。

图7 羊肝酶解液与VC对·OH的清除作用Fig.7 Scavenging effect of sheep liver enzymatic hydrolysate and VC on·OH
由图7可知,羊肝酶解液清除·OH的能力随着质量浓度的增加而增强,当酶解液质量浓度为18 mg/mL时,羊肝酶解产物对·OH清除率为49.62%,与王运改等[23]酶解鮰鱼皮明胶制备抗氧化肽清除·OH的结果大体一致。对羊肝酶解液质量浓度(y1)和VC质量浓度(y2)分别进行·OH清除率(x)与质量浓度之间的拟合,得到两者的拟合方程分别为y1=2.224x+12.19(R2=0.9760),y2=19.103lnx+89.825(R2= 0.9831),通过方程可以得到羊肝酶解液和VC清除·OH的半抑制浓度(half maximal inhibitory concentration,IC50)值分别为17.01 mg/mL和0.74 mg/mL。与VC相比,羊肝酶解液的IC50值较高,约为VC的22.97倍,表明羊肝酶解液清除·OH的能力较VC弱(IC50值越低,表明抗氧化活性越强),但具有一定的抗氧化能力。
2.5.2 清除超氧阴离子自由基(O2-·)的能力
人体内存在一定数量的超氧阴离子,不发生化学变化时对人体无害,但与羟基自由基(·OH)结合后的产物易导致细胞脱氧核糖核酸(deoxyribonucleic acid,DNA)损伤,破坏人类机体功能[22]。在优化条件下酶解羊肝蛋白,测定酶解产物O2-·清除率,结果见图8。
由图8可知,羊肝酶解液与VC清除O2-·的能力随着质量浓度的增加而增强,表现出剂量效应关系。当羊肝酶解液质量浓度为20 mg/mL时,其对超氧阴离子自由基的清除率为64.78%。对羊肝酶解液质量浓度(y1)和VC质量浓度(y2)分别进行超氧阴离子自由基清除率(x)与质量浓度之间的拟合,得到两者拟合方程为y1=2.992 1x+10.474(R2=0.944 3),y2=22.638ln(x)+93.792(R2=0.945 2),通过方程得到两者的IC50值分别为13.21 mg/mL和1.52 mg/mL。与VC相比,羊肝酶解液清除超氧阴离子的能力较VC弱,其IC50值约为VC的8.71倍,表明在一定质量浓度下羊肝酶解产物具有清除超氧阴离子的能力。

图8 羊肝酶解液与VC对O2-·的清除作用Fig.8 Scavenging effect of sheep liver enzymatic hydrolysate and VC on O2-·
2.5.3 清除DPPH自由基的能力
在优化条件下酶解羊肝蛋白,测定酶解产物DPPH自由基清除率,结果见图9。

图9 羊肝酶解液与VC对DPPH自由基的清除作用Fig.9 Scavenging effect of sheep liver enzymatic hydrolysate and VC on DPPH free radical
由图9可知,在一定范围内,羊肝酶解液和VC清除DPPH自由基的能力随着质量浓度的增大而增强。当羊肝酶解液的质量浓度为20 mg/mL时,其对DPPH自由基的清除率为79.36%,而VC质量浓度在3 mg/mL时,对DPPH自由基的清除率达到94.75%。对羊肝酶解液质量浓度(y1)和VC质量浓度(y2)分别进行DPPH自由基清除率(x)与质量浓度之间的拟合,得到拟合方程分别为y1=3.209x+16.552(R2=0.984 1),y2=34.491x+22.892(R2=0.986 2),通过方程得到两者IC50值分别为10.42mg/mL和0.79mg/mL。与VC相比,羊肝酶解产物清除DPPH自由基的能力较弱,但羊肝酶解产物已表现出良好的抑制DPPH自由基的能力,说明羊肝酶解产物具有一定的抗氧化能力。
2.5.4 羊肝酶解产物的还原能力
还原力在波长700 nm处的吸光度值大小可以反映出样品的抗氧化活性强弱。吸光度值越大,表明还原能力越强,其抗氧化活性就越强[24-25]。在优化条件下酶解羊肝蛋白,测定其还原能力,结果见图10。

图10 羊肝酶解液与VC的还原能力Fig.10 Reduction capacity of sheep liver enzymatic hydrolysate and VC
由图10可知,羊肝酶解液和VC在波长700 nm处的吸光度值都随着质量浓度的增大而增强,VC质量浓度为1.2 mg/mL时,其吸光度值为0.743;而羊肝酶解液质量浓度为15 mg/mL时,其吸光度值为0.445,约为VC吸光值的一半左右,表明羊肝酶解液要达到低质量浓度下VC的还原能力,需要12.5倍质量浓度的羊肝酶解产物。与VC相比,羊肝酶解液的还原力一般,但也表明了羊肝酶解产物具有一定的还原能力。
3 结论
本研究选用碱性蛋白酶、中性蛋白酶、胰蛋白酶、木瓜蛋白酶等4种酶对羊肝蛋白进行酶解,以水解度为评价指标,结果表明,碱性蛋白酶酶解产物的水解度最高,确定酶解用酶为碱性蛋白酶。并且在单因素试验基础上,运用响应面分析法,获得羊肝蛋白的最佳酶解条件为酶解温度51℃、pH 8.5、酶解时间4.1 h、加酶量0.40%,在该条件下,羊肝酶解液的水解度为(40.31±0.24)%。体外抗氧化试验结果表明,羊肝酶解产物在一定质量浓度范围内具有清除羟自由基、超氧阴离子自由基和DPPH自由基的抗氧化能力和还原能力,若将其进一步分离纯化研究,可成为一种潜在的天然抗氧化剂。其清除羟自由基、超氧阴离子自由基和DPPH自由基的IC50值分别为17.01 mg/mL、13.21 mg/mL和10.42 mg/mL。试验为提高羊肝深加工及开发生物活性肽提供了理论依据,但有关羊肝酶解液中抗氧化活性成分的分离纯化与鉴定、抗氧化机理以及体内抗氧化试验有待进一步研究。
[1]李黎,马俪珍,唐燕.明目羊肝口服液关键工艺优化参数研究[J].食品科技,2012,37(5):92-95.
[2]韩志慧,隋姣,马俪珍.明目羊肝羹的工艺技术研究[J].山西农业科学,2013,41(3):254-258.
[3]KECHAOU E S,DUMAY J,DONNAY-MORENO C,et al.Enzymatic hydrolysis of cuttlefish(Sepiaofficinalis)andsardine(Sardina pilchardus)viscera using commercial proteases:Effects on lipid distribution and amino acid composition[J].J Biosci Bioeng,2009,107(2): 158-164.
[4]BARKIA A,BOUGATEF A,KHALED H B,et al.Antioxidant activities of sardinelle heads and/or viscera protein hydrolysates prepared by enzymatic treatment[J].J Food Biochem,2010,34:303-320.
[5]郭芳,方婷,陈锦权.鲍鱼脏器酶解工艺条件的优化[J].中国酿造,2015,34(12):101-104.
[6]刘旺旺,侯银臣,程永霞,等.羊胎盘多肽的制备及其清除自由基能力的研究[J].中国酿造,2014,33(9):89-93.
[7]王艳梅,万全,赖年悦,等.黄缘盒龟肉的酶解工艺优化及其体外抗氧化活性研究[J].水产学报,2013,37(4):622-630.
[8]尹利端,黄静,王立志.鲤鱼鱼鳞胶原蛋白肽抗氧化活性研究[J].明胶科学与技术,2015,35(3):133-136.
[9]徐怀德,殷金莲,陈沁.甲鱼酶解产物抗氧化功能的研究[J].中国食品学报,2007,7(4):25-32.
[10]赵谋明,张佳男,吴长平,等.大豆肽的制备及其美拉德反应产物特性研究[J].现代食品科技,2015,31(2):138-144.
[11]XIE Z J,HUANG J R,XU X M,et al.Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J].Food Chem,2008,111 (2):370-376.
[12]赵强忠,刘丹.秋刀鱼抗氧化肽制备及其抗氧化活性的研究[J].现代食品科技,2014,30(10):165-171.
[13]李俊江,潘道东,郭宇星,等.鹅肉蛋白酶解条件优化及酶解产物抗氧化活性研究[J].食品科学,2012,33(3):126-130.
[14]李桂峰,王向东,赵国建,等.酶解双孢菇蛋白制备抗氧化肽的研究[J].中国食品学报,2011,11(5):37-43.
[15]胡学智,王俊.蛋白酶生产和应用的进展[J].工业微生物,2008,38(4):49-61.
[16]徐曼,马寒冰,李铮,等.响应面法优化豆粕蛋白酶解条件[J].中国酿造,2013,32(3):56-60.
[17]刘艳,段振华,罗伟,等.无花果蛋白酶酶解牡蛎肉的工艺优化及其抗氧化活性研究[J].食品工业科技,2015,36(18):182-185.
[18]罗伟,段振华,万斌,等.贻贝煮汁液酶解工艺的研究[J].食品研究与开发,2014,35(3):39-43.
[19]宋茹,冯婷立,谢超.海产小杂鱼抗氧化肽制备工艺[J].食品科学,2011,32(12):29-33.
[20]肖怀秋,李玉珍,林亲录,等.Box-Behnken响应面优化冷榨花生粕酶解制备花生肽工艺[J].中国粮油学报,2014,29(10):106-111.
[21]李玉珍,肖怀秋,杨涛,等.响应面优化低值豆粕液态制备多肽工艺[J].大豆科学,2012,31(4):649-654.
[22]张艳萍,戴志远,张虹.贻贝蛋白的酶解及其酶解物的抗氧化活性研究[J].中国食品学报,2012,12(1):10-18.
[23]王运改,林琳,李明辉,等.鮰鱼皮明胶抗氧化肽的制备工艺研究[J].食品科学,2010,31(19):254-258.
[24]王雪芹,邢荣娥,刘松,等.鲐鱼蛋白酶解工艺优化及酶解物的抗氧化活性测定[J].现代食品科技,2013,29(5):1023-1028.
[25]郭善广,荣婧,郭利平,等.罗非鱼内脏蛋白酶解超滤产物的抗氧化活性研究[J].食品与机械,2014,30(1):179-183.
Optimization of hydrolysis conditions of sheep liver proteins and antioxidant activities of its hydrolysates
WEN Fei,MU Yingchun,LI Jingwen,ZHAO Xu,TANG Suting,YANG Xuhui,SU Wei*(College of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China)
In order to optimize the sheep liver enzymolysis technology and explore itsin vitroantioxidant activity,using hydrolysis degree as evaluation index,sheep liver was hydrolysed by alkaline protease.On the basis of single factor experiments,the enzymatic hydrolysis conditions of sheep liver proteins were optimized by response surface methodology.The results showed that the optimum enzymatic hydrolysis conditions were as follow: hydrolysis temperature 51℃,pH 8.5,hydrolysis time 4.1 h and enzyme addition 0.40%.Under the conditions,through three validation tests,the actual hydrolysis degree of sheep liver hydrolysates was(40.31±0.24)%.The results ofin vitroantioxidant experiments showed that sheep liver hydrolysates had a certain antioxidant activities.The IC50of its scavenging hydroxyl radical,superoxide anion and DPPH free radical were 17.01 mg/ml, 13.21 mg/ml and 10.42 mg/ml,respectively.Sheep liver hydrolysates had a certain reduction capacity.
sheep liver;protein;hydrolysis;antioxidant activity
TS251.95
0254-5071(2017)01-0157-07
10.11882/j.issn.0254-5071.2017.01.033
2016-08-29
贵州大学研究生创新基金项目(研理工2016057);黔西南州科技计划重点项目(2016-1-117)
文飞(1987-),男,硕士研究生,研究方向为食品营养与安全。
*通讯作者:苏伟(1974-),男,副教授,博士,研究方向为食品加工与安全。

