SD大鼠骨髓间充质干细胞原代培养条件的选择
李倩晓 那荣妹 刘百亭 于 勤
(杭州市红十字会医院,浙江 杭州 310000)
SD大鼠骨髓间充质干细胞原代培养条件的选择
李倩晓 那荣妹1刘百亭1于 勤1
(杭州市红十字会医院,浙江 杭州 310000)
目的 探讨分离及培养SD大鼠骨髓间充质干细胞(BMSCs)的最佳条件。方法 选取不同周龄(2、3、4、8 w)的SD大鼠;采用全骨髓贴壁筛选法对不同的培养基(L-DMEM、DMEM/F12),血清体积分数(7.5%、10%、12.5%、15%、17.5%),首次换液时间(48、72、96 h),换液方法(全换液、半换液)分组进行培养,每日于倒置显微镜下观察细胞形态、数目的变化,细胞融合80%~90%时进行消化计数,记录达到传代要求的时间,取第三代细胞绘制BMSCs生长曲线,各组间免疫荧光检测CD34、CD44的表达率。结果 ①第2~3周SD大鼠达到传代要求时BMSCs数目最多、所需时间最短,第8周BMSCs含量明显减少,难以形成集落生长,细胞融合不到50%;DMEM/F12培养基中的细胞贴壁早、活性强,L-DMEM培养基中的细胞生长缓慢,两组相比差异显著(P<0.05);72 h全换液和48 h半换液组细胞数目多,二者相比无统计学意义(P>0.05),24 h全换液细胞数目少,72 h半换液杂细胞多,细胞呈全分布,二者增值速度慢,与前者相比差异显著(P<0.05);体积分数越高细胞生长分化越快,时间越短,但各组间比较无统计学意义(P>0.05),传代培养中高体积分数的细胞易老化。②接种圆形BMSC培养6 h后贴壁,分化成圆形、类圆形或多角形;72 h后有少量短梭形、星形细胞分散、贴壁生长,部分细胞伸出一支或多支伪足,类似于成纤维细胞;约6 d后BMSCs细胞集落呈放射状排列,伸出长短及粗细均不规则,伴形态各异的伪足、细胞胞核大、核仁清晰;约10 d细胞能融合80%~90%培养面;传代后24 h内可见细胞已完全贴壁,3 d可见以梭形为主的细胞铺满80%~90%培养面;经过1~2次传代后,细胞呈放射状或平行排列,形态趋于一致。③传代2 d后,细胞缓慢生长,处于生长停滞期;3 d起细胞转入对数生长期,4~5 d至高峰后转入平台期,细胞倍增时间约39.5 h。④传代BMSc存在CD44抗原表达,阳性率98.3%,而CD34呈阴性表达。结论 全骨髓贴壁筛选法是一种获得高纯度BMSCs简单、有效的方法;在适宜的培养条件下(SD大鼠育龄为2~3 w,接种密度80%~90%培养面,培养基为DMEM/F12,合适血清体积分数为10%,72 h首次全换液)BMSCs在体外生长状态良好,增殖速度快,DAPI可作为标记BMSCs的一种有效手段,也可作为细胞免疫组化的基础染色。
骨髓间充质干细胞;原代培养
骨髓间充质干细胞(BMSCs)是一种骨髓基质内分布的经中胚层细胞分化而来的细胞亚群,其来源广泛,有多种分化潜能和低免疫原性,可分离及体外扩增为各类骨骼、组织、器官细胞及造血干细胞等的基质细胞〔1〕,是组织工程首选种子细胞〔2〕。现今,BMSCs体外扩增和纯化趋于成熟,培养条件参差不齐,缺乏统一的标准,本实验旨在比较各种培养条件,初步确定BMSCs体外培养的标准,对其体外培养过程中注意事项加以说明。
1 材料和方法
1.1 材料 2、3、4、8周龄清洁级SD大鼠。主要试剂:L-DMEM 、DMEM /F12、胰蛋白酶、双抗(美国 Thermo 公司),DAPI(美国Sigma 公司),胎牛血清(天津TBD公司),兔抗大鼠CD44、CD34抗体,FITC标记的山羊抗兔抗体(北京博奥森生物技术有限公司)、四甲基偶氮唑盐。主要仪器:CO2培养箱(北京安捷来科学仪器设备有限公司),超净工作台(苏州苏洁净化设备有限公司),医用离心机(长沙湘锐离心机有限公司TDZ5-BP),激光共聚焦显微镜(COIC XDS-1B) ,移液枪(Dragon DX20284、DP31238),试管、吸管、培养瓶25 cm3(美国Corning),储物柜(洛阳市宇龙办公机具有限公司),冰箱(Hisense)。
1.2 实验方法
1.2.1 大鼠BMSCs分离和培养 大鼠断颈处死后置于碘伏内泡3~5 min,取出75%乙醇脱碘。无菌条件下用生理盐水冲洗干净,剥离、脱下双下肢皮肤,取下双下肢后用生理盐水冲洗,将股骨、胫骨剥离和干骺端剪除,用5 ml注射器吸、注磷酸盐缓冲液(PBS)冲洗骨髓腔5~10次,收集冲洗液于培养皿内后吹打混匀,1 200 r/min离心 5 min,弃上清液。根据各组要求制备细胞悬液,置于高倍镜下调整细胞浓度,至细胞铺满目镜视野80%~90%止,液体装瓶(4 ml/瓶)后接种于25 cm3培养瓶内,置于37℃、5%CO2下培养。根据不同培养基、血清体积分数、首次换液时间、换液方法分组接种培养。半换液后24 h全换液,首次换液后每隔3 d换液一次,细胞铺满80%~90%培养面时消化传代,记录原代培养时间及细胞数目。
1.2.2 细胞分组 按照培养基、血清体积分数、首次换液时间、首次换液方法分为4组,每组两瓶细胞。(1)不同培养基:采取全骨髓贴壁法,以细胞铺满培养面80%~90%密度进行接种,分别使用10% FBS-DMEM/F12培养基、10%FBS-L-DMEM培养基进行贴壁培养,首次换液时间为72 h并采取全换液,以后每隔3 d换液一次。(2)不同血清体积分数:采取全骨髓贴壁法,以细胞铺满培养面80%~90%密度进行接种,分别在血清体积分数为7.5%、10%、12.5%、15%的DMEM/F12培养基中贴壁培养,首次换液时间为72 h并采取全换液,以后每隔3 d换液一次。(3)不同换液方法:采取全骨髓贴壁法,以细胞铺满培养面80%~90%密度进行接种,10%FBS-DMEM/F12培养基中贴壁培养,首次换液时间为72 h,分别行全换液、半换液,以后每隔3 d换液一次。(4)不同换液时间:采取全骨髓贴壁法,以细胞铺满培养面80%~90%密度进行接种,10%FBS-DMEM/F12培养基中贴壁培养,分别于48、60、72 h进行全换液,以后每隔3 d换液一次。
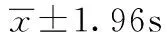
1.2.4 细胞原代培养时间计算及传代方法 记录各组达到80%~90%融合时的原代培养时间并进行消化,悬浮细胞后按1∶2比例传代。
1.2.5 大鼠BMSCs形态学观察 原代及传代BMSCs置于倒置显微镜下,400倍观察细胞形态结构。
1.2.6 传代BMSCs生长曲线绘制并计算细胞倍增时间 取培养至3代、生长良好的细胞消化,调整细胞浓度至5×103个/ml接种于96孔板(200 μl/孔),5%CO2、100%湿度和37℃培养24 h。每天固定时间取3孔滴入5 μg/μl MTT 液20 μl,37℃孵育4 h后去孔内培养液,每孔滴入150 μl二甲基亚砜(DMSO)振荡均匀至结晶物完全显色,用京德铁HBS-1096A 酶标仪(南京德铁实验设备有限公司)测定细胞570 nm处测吸光度(A570)值,取3次平均值代表细胞相对数量,并以横坐标=时间(d),纵坐标=OD值(细胞相对数量)绘制生长曲线。细胞倍增时间(TD)=t×log 2/(log Nt-log N0)。t:培养时间,N0:接种后细胞数,Nt:培养t h后细胞数。
1.2.7 传代BMSCs的DIPA标记及免疫组化鉴定 取培养至3代、生长良好的细胞消化,调整细胞浓度至1×105/ml,接种至预先放置无菌盖玻片6孔板内,培养4~5 d,待盖玻片80%~90%表面被细胞铺满后,PBS冲洗3次,10 min/次,室温下滴入4%多聚甲醛40 g/L固定30 min,PBS冲洗,滴入0.2%TritonX-100 2 ml/L通透细胞,37℃下封闭30 min,滴加一抗(兔抗大鼠CD44及CD34单克隆抗体,稀释浓度1∶100),37℃下孵育2 h,PBS冲洗3次,10 min/次,滴加二抗(RBITC标记山羊抗兔IgG,稀释浓度1∶100),37℃孵育1 h,PBS冲洗3次,10 min/次,将无菌DAPI储存液滴入MSCs上清液中调整终浓度至50 mg/L,37℃、5%CO2孵育2 h后封片,置于荧光显微镜下观察、拍照。阳性细胞:胞体呈红色荧光、细胞核呈蓝色荧光;阴性细胞:胞体和胞核呈蓝色荧光。随机选取10组视野计算阳性率,每组取3次计数平均值,10组平均值为MSCs纯度。
1.2.8 观察不同培养条件对BMSCs生长的影响 倒置显微镜下观察和记录各组原代及传代BMSCs形态变化、细胞达到传代时间,计算细胞总数。四甲基偶氮唑盐比色法(MTT法)绘制细胞生长曲线,计算细胞倍增时间;免疫组织化学法测定BMSCs CD44、CD34表达。
1.3 统计学方法 组间比较采用t检验。
2 结 果
2.1 大鼠BMSCs原代培养形态学观察 刚接种细胞形态学主要表现为大小不等的圆形及椭圆形,密集悬浮于培养液内,折光性较强;培养6~8 h后贴壁,呈纺锤状或类圆形,24 h后少量细胞贴壁生长,细胞呈纺锤形、三角形、多边形或不规则形等多种形态,72 h内细胞基本完成贴壁,长梭形或纺锤形细胞明显增多,但是仍以三角形、多角形为主,未贴壁细胞仍悬浮于培养液内;3 d后全换液,弃去悬浮的未贴壁细胞。随后贴壁细胞开始分裂增殖,6~8 d后可见贴壁细胞数量明显增加,细胞形态主要为长梭形或纺锤形,部分为短梭形或三角形,呈集落样增殖。其后集落逐渐增大铺开,9~11 d后贴壁细胞可基本铺满培养瓶底,见图1~3。传代后接种12 h后,绝大部分细胞贴壁、生长迅速,形态学表现为梭形,24 h后100%贴壁,4~5 d即可铺满瓶底,细胞为细长梭形呈漩涡状或鱼群样排列。传代1~2次后,细胞表现为单一梭形成纤维样,放射状或平行排列。传至P3代后,显微镜下可见极少量杂质细胞,连续传数代细胞形态类似传代细胞。见图1。

原代培养第3天

原代培养第6天
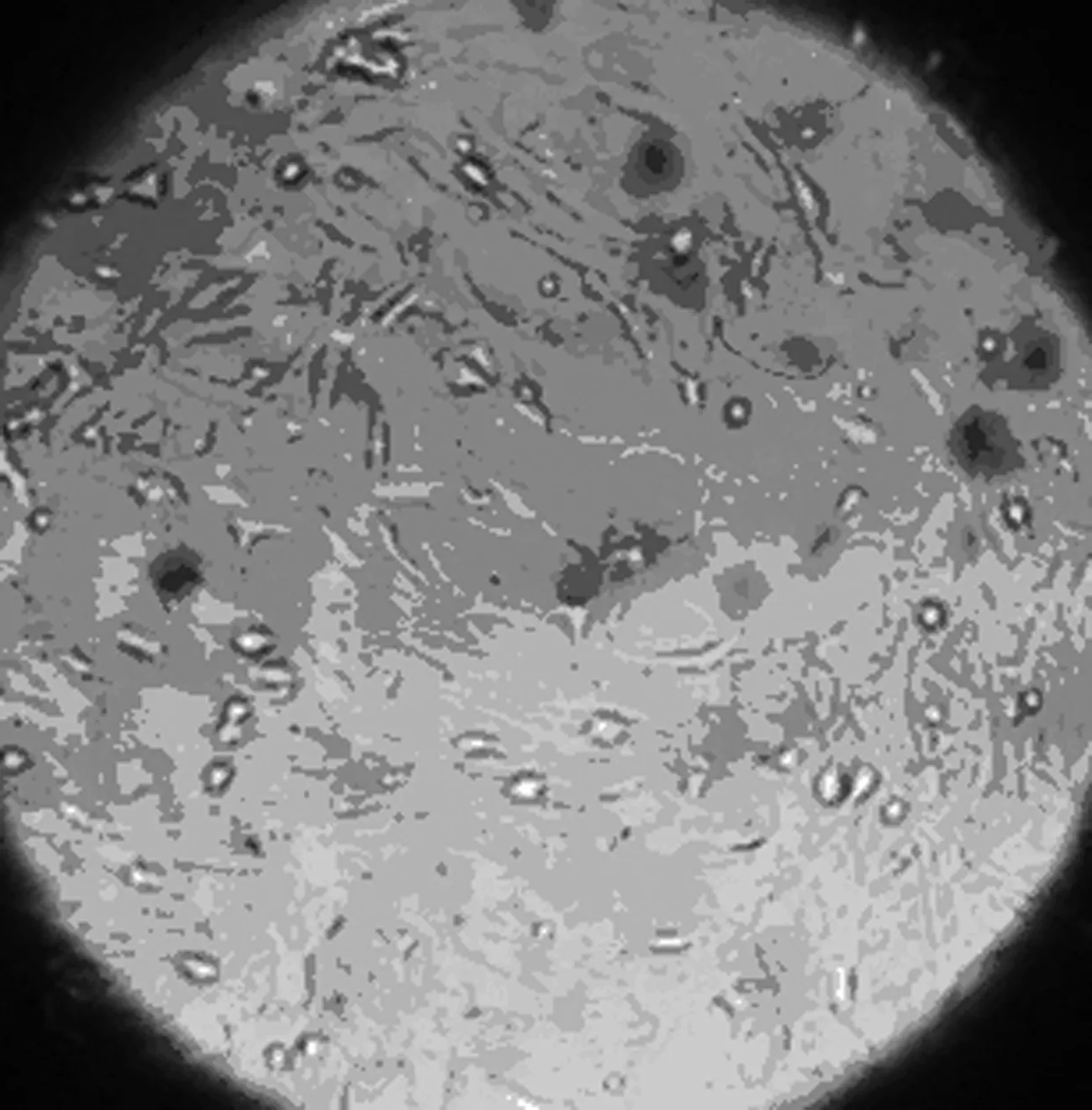
原代培养第9天

传代后第5天 图1 大鼠BMSCs原代培养形态学观察(×200)
2.2 不同培养条件对BMSCs生长的影响 (1)不同培养基:细胞在DMEM/F12中培养增殖速度快,细胞分化快,达到传代培养时间短,高倍视野下细胞数(412.54±12.72),细胞80%~90%融合时间为11 d;在L-DDMEM中培养细胞数为(340.27±14.31),融合时间13,组间相比差异有统计学意义(P<0.05)。(2)不同血清体积分数:10%~15%血清浓度各组间相比细胞数目相似(10%:412.54±12.72,12.5%:420.54±13.34,15%:462.00±7.82),细胞增殖快(融合时间分别为11 d、11 d、10 d),组间比较无统计学意义(P>0.05),但与7.5%血清浓度比较(287.78±10.22;15 d)差异显著(P<0.05)。(3)不同换液时间及方法:48 h全换液难以达到细胞80%~90%融合的要求,细胞总数为124.62±4.23;48 h半换液及72 h全换液细胞达到传代时间最短(均11 d),细胞总数多(390.85±12.67,412.54±12.72),组间相比无统计学意义(P>0.05);72 h半换液与其相比细胞数目少(324.52±6.45),融合时间长(13 d)(P<0.05)。
2.3 传代BMSCs生长曲线测定 传代细胞开始1~2 d细胞生长缓慢,处于生长潜伏期;3~5 d为细胞生长快速至对数增长期;6 d后增殖平缓期;8 d达平台期,计算细胞倍增时间为39.5 h。
2.4 传代BMSCs的免疫鉴定 染色后全部BMSCs细胞核呈蓝色荧光,>90%胞体呈红色荧光。经CD34抗体和DAPI染色后荧光显微镜下见所有BMSCs细胞核均被标记蓝色荧光,细胞膜无荧光显示。表明传代的细胞CD44抗原呈阳性表达CD34抗原呈阴性表达。
3 讨 论
在骨髓中BMSCs的含量较低,与骨髓单核细胞比大约为1∶100 000,数量随年龄增长不断减少〔3〕,其体外易培养、大量增殖并可诱导分化为成骨细胞、成软骨细胞、脂肪细胞和成肌细胞等,具有多分化的潜能,而且避免了胚胎干细胞应用的伦理学争议。目前BMSCs体外培养条件各异,缺乏统一的标准,不同的培养方法、培养基种类、种植密度、血清体积分数等均能影响到BMSCs的体外生长,因此只有寻找到最适培养条件,才有利于获取更高质量的BMSCs。
分离纯化BMSCs的方法主要包括全骨髓贴壁培养法、密度梯度离心法、流式细胞仪分离法和免疫磁珠法。流式细胞技术和免疫磁珠法可致较高的细胞丢失量,操作复杂、费用较高〔4〕,因此全骨髓贴壁培养法和密度梯度离心法应用范围较广。全骨髓贴壁法分离培养法具有操作快速、效果可靠、简便稳定等优点,相比之下更优于密度梯度离心法〔5〕。骨髓内BMSCs较其他细胞更易贴壁,这是因为造血干细胞可释放生长因子及相关促贴壁介质,引导BMSCs贴壁生长〔6〕,因此利用骨髓贴壁培养法培养的细胞贴壁快,72 h内基本上完全贴壁,获得的细胞活性好、增殖力较强。虽然初始获取的BMSCs纯度较低,杂质细胞含量多,但是通过反复的换液和传代的方法可以除去杂质细胞并逐步纯化BMSCs,第三代BMSCs纯度可以接近100%。
L-DMEM和DMEM/F12是BMSCs培养的常用培养基,二者均能促进BMSCs的生长和增殖,原代培养过程中DMEM/F12培养基中细胞增殖速度快,细胞总数明显大于L-DMEM培养基(P<0.05);L-DMEM培养基中细胞贴壁亦较好,但是细胞活性差,颗粒含量重,诸如换液、胰酶消化等外界环境的轻微变化即可引起细胞的死亡。原因可能与DMEM/F12中营养成分相关,DMEM/F12是DMEM和F12的1∶1混合制剂,具有F12含有较丰富的成分和DMEM含有较高浓度的营养成分的双重优势,同时含有铁、铜、钙等金属离子及HEPES缓冲成分,更适宜BMSCs的体外培养。采用全骨髓贴壁培养法培养细胞,细胞悬浮液中含红血细胞、白细胞、脂肪细胞、造血干细胞等多种细胞成分,细胞形态、大小各异,显微镜下难以计数,选取2~3 w SD大鼠双侧股骨及胫骨骨髓制成细胞悬液后接种3瓶25 cm3,以高倍镜细胞体满80%~90%培养面为宜,如接种2瓶则可见细胞全部铺满培养面,部分细胞相互重叠,接种密度过大;如接种4瓶,细胞总数少。换液后二者贴壁细胞数目明显少于前者,其原因可能是细胞接种密度过大,大量细胞贴壁,包括非BMSCs,营养大量消耗的同时细胞之间存在相互竞争,抑制周围细胞的增殖;但是如果接种密度过低,细胞本身数目少,造血干细胞分泌的生长因子和促贴壁物质不足,BMSCs之间缺乏相互刺激,难以形成集落生长。不同体积分数培养结果的原因可能是高浓度的血清营养含量大,更能促进细胞增殖和贴壁生长,但是过高的胎牛血清浓度也能促进细胞过早分化〔7〕,因此10%血清浓度的培养基在节约成本本的同时既能满足细胞正常的生长繁殖又能连续传代。原代培养首次换液时间对BMSCs生长增殖一定影响〔8〕,而首次换液时采用半量换液的方法,有助于保留部分贴壁不紧密的细胞〔9〕,本研究说明BMSCs在24 h时仍有部分未贴壁,在72 h时已贴壁完全。
现今,研究尚未确定统一的BMSCs特异性抗原表型〔10〕,但是其表面分子内存在间质、内皮、上皮和肌肉细胞特征〔11〕,而且体外扩增的BMSCs不表达造血细胞的CD34、CD45 或CD14 等分子〔12〕,常规间接鉴定BMSCs以排除法为准。同时本实验培养得到的BMSCs对塑料器皿具有贴附特性;免疫组化结果表明本研究分离培养大鼠骨髓细胞分化为骨髓BMSCs。
综合上述,BMSCs传至P3代时杂质细胞基本消失,细胞形态呈均匀分布、单一、梭形成纤维样细胞。
1 Pavon LF,Sibov TT,de Oliveira DM,etal.Mesenchymal stem cell-like properties of CD133+ glioblastomainitiating cells〔J〕.Oncotarget,2016;7(26):40546-57.
2 Gu W,Hong X,Potter C,etal.Mesenchymal stem cells and vascular regeneration〔J〕.Microcirculation,2017;24(1):1-15.
3 Zhang K,Ikeda Y,Kasugai S,etal.Extended culture conditions for multipotent bone marrow-derived mesenchymal stem cells〔J〕.Kokubyo Gakkai Zasshi,2016;83(1):13-24.
4 陈祁青,金红婷,应 俊,等.右归饮含药血清对骨髓间充质干细胞成软骨分化的促进作用及其microRNA表达谱分析〔J〕.中华中医药杂志,2015;30(5):1380-6.
5 傅淑平,杨 丽,洪 浩,等.梓醇促进大鼠骨髓间充质干细胞增殖过程中Wnt信号通路的变化〔J〕.中国病理生理杂志,2014;30(9):1656-60.
6 Pashoutan Sarvar D,Shamsasenjan K,Akbarzadehlaleh P.Mesenchymal stem cell-derived exosomes:new opportunity in cell-free therapy〔J〕.Adv Pharm Bull,2016;6(3):293-9.
7 Mizuno M,Katano H,Otabe K,etal.Platelet-derived growth factor(PDGF)-AA/AB in human serum are potential indicators of the proliferative capacity of human synovial mesenchymal stem cells〔J〕.Stem Cell Res Ther,2015;6:243.
8 孙江森,李 彪,龚跃昆,等.骨髓间充质干细胞标记及示踪技术的研究与进展〔J〕.中国组织工程研究,2012;16(6):1107-10.
9 刘萍萍,轩小燕,朱敬松,等.异基因骨髓间充质干细胞移植对EAE小鼠的治疗作用〔J〕.细胞与分子免疫学杂志,2013;29(8):798-801.
10 Opiela J,Samiec M,Bochenek M,etal.DNA aneuploidy in porcine bone marrow-derived mesenchymal stem cells undergoing osteogenic and adipogenic in vitro differentiation〔J〕.Cell Reprogram,2013;15(5):425-34.
11 Thompson B,Varticovski L,Baek S,etal.Genome-wide chromatin landscape transitions identify novel pathways in early commitment to osteoblast differentiation〔J〕.PLoS One,2016;11(2):e0148619.
12 Mishra DK,Veena U,Kaliki S,etal.Differential expression of stem cell markers in ocular surface squamous neoplasia〔J〕.PLoS One,2016;11(9):e0161800.
〔2016-10-31修回〕
(编辑 郭 菁)
杭州市医疗卫生及重点专科专病科科研攻关专项(20140733Q26)
于 勤(1966-),女,博士,主任医师,主要从事心血管内科的临床科研和教学工作。
李倩晓(1986-),女,硕士,医师,主要从事心血管内科的临床研究。
R3
A
1005-9202(2017)05-1084-04;
10.3969/j.issn.1005-9202.2017.05.020
1 大连大学附属中山医院

