多器官细胞共同培养方法检测参麦及喘可治注射液的细胞毒性
于海明,阎政礼,付 虎,于风江,朱勇飞
(1.湖南师范大学第一附属医院(湖南省人民医院)重症医学科,长沙410006;2.湖南师范大学医学院预防医学系,长沙410013;3.湖南师范大学化学与化工学院,长沙410086)
多器官细胞共同培养方法检测参麦及喘可治注射液的细胞毒性
于海明1,阎政礼2,付 虎2,于风江3,朱勇飞2
(1.湖南师范大学第一附属医院(湖南省人民医院)重症医学科,长沙410006;2.湖南师范大学医学院预防医学系,长沙410013;3.湖南师范大学化学与化工学院,长沙410086)
目的:观察参麦、喘可治注射液对人类体外不同器官细胞增殖的影响,以期发现其潜在的毒性和靶器官。方法:应用人类多器官细胞共培养模型,观察参麦、喘可治注射液分别作用24、48、72 h后,对WI-38、HepG2、HEK293、SH-SY5Y和HCF细胞增殖的影响。结果:参麦和喘可治注射液分别处理24、48、72 h后,两种药物的高剂量均抑制所有细胞的增殖;在两种药物处理后的各时点各种细胞的相对增殖率均随剂量的降低而升高、并有较好的剂量-效应关系。处理48、72 h后,次低~高剂量的参麦注射液均抑制WI-38细胞增殖,中剂量2组~高剂量组中的该药则对HEK293细胞的增殖均有抑制作用,中剂量1组~高剂量组中的该药可抑制HepG2和SHSY5Y这两种细胞的增殖。喘可治注射液处理72 h后,次低~高剂量均抑制WI-38细胞增殖。结论:多器官细胞共培养模型发现两种药物对人胚肺均可能具有潜在的毒性,参麦注射液可能还对人胚肾有潜在的毒性;较大剂量的参麦注射液可能具有肝脏和神经毒性。
多器官细胞共培养方法;参麦注射液;喘可治注射液;细胞毒性
近年来有关中成药(尤其是中药注射剂)引起毒性反应时有发生,社会各界对中成药毒性的关注也日益增多[1],国家食品药品安全监督管理局也于前些年下发了《关于开展中药注射剂安全性再评价工作的通知》(国食药监办[2009]28号)。然而,对中成药再评价的报道基本是临床研究资料,目前关于其药理、毒理、药代动力学的资料较少[2]。多器官细胞共同培养方法(integrated discrete multiple organ cell culture,IdMOC)能较好地模拟体内代谢,系统、快速地进行化学物的体外药理、毒理学检测[3],以人源细胞建立的共培养系已用于药物毒性靶器官的筛选[4]。参麦注射液是临床不良反应报道较多的一个中成药[5],而喘可治注射液几乎没有不良反应报道;因此,本研究拟利用该方法对这2种药物的细胞毒理学进行筛选,以期为临床不良反应的研究提供毒理学佐证,并探索其潜在的毒性和靶器官。
1 材料与方法
1.1 主要仪器和试剂 CO2培养箱(Thermo公司),倒置显微镜(Lecia公司),多功能酶标仪(BioTek公司),48孔培养板(Corning公司);参麦注射液(生药含量为:红参50 mg/mL,麦冬50 mg/mL;河北某药业有限公司),喘可治注射液(含巴戟天提取液50μg/mL,淫羊藿提取液100μg/mL;广东某药业有限公司);噻唑兰(MTT)购自Sigma公司,胰蛋白酶,DMEM(高糖)培养基购
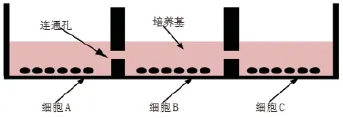
图1 多器官细胞共培养板侧边示意图
自Hyclone公司;胎牛血清(FBS)为Gibco公司产品。共培养板为自己改制的48孔培养板,每6孔为一组,在6个孔与孔之间孔壁底部打一洞,当孔内培养基超过0.3 cm高度时使6个孔之间培养基能相互连通(见图1)。
1.2 培养液配制 细胞单培养和共培养时,均采用同一种培养液,即在DMEM高糖培养基,加入10%的FBS和1%青霉素链霉素。
1.3 细胞共培养模型的建立及分组 参照文献[6],先将WI-38细胞(人正常胎儿肺细胞)、HepG2细胞(人肝癌细胞)、HEK293细胞(人胚肾细胞)、SH-SY5Y细胞(人神经母细胞瘤细胞)、HCF细胞(人心脏成纤维细胞)复苏并分别培养,待细胞增殖到足够数量时将其共同接种于各孔连通的共培养板,待细胞全部贴壁后加入药物。参麦注射液(主要成分为红参、麦冬)、喘可治注射液(主要成分为巴戟天、淫羊藿)临用前分别用培养液进行稀释,参麦注射液各剂量组生药的浓度分别为:0(阴性对照组),高剂量组:25.0 mg/mL(红参)+25.0 mg/mL(麦冬),次高剂量组:12.50 mg/mL(红参)+12.50 mg/mL(麦冬),中剂量1组:6.25 mg/mL(红参)+6.25 mg/mL(麦冬),中剂量2组:3.13 mg/mL(红参)+3.13 mg/mL(麦冬),次低剂量组:1.57 mg/mL(红参)+1.57 mg/mL(麦冬),低剂量组:0.78 mg/mL(红参)+0.78 mg/mL(麦冬);喘可治注射液各剂量组巴戟天和淫羊藿提取液的浓度分别为0(阴性对照组),高剂量组:25.0μg/mL(巴戟天)+50.0μg/mL(淫羊藿),次高剂量组:12.50μg/mL(巴戟天)+25.0μg/mL(淫羊藿),中剂量1组:6.25μg/mL(巴戟天)+12.50μg/mL(淫羊藿),中剂量2组:3.13μg/mL(巴戟天)+6.25μg/mL(淫羊藿),次低剂量组:1.57μg/mL(巴戟天)+3.13μg/mL(淫羊藿),低剂量组:0.78μg/mL(巴戟天)+1.57μg/mL(淫羊藿);所有受试物每个剂量组设3个平行实验孔。将所有受试物加入共培养板以后,立即置于37 ℃、5% CO2培养箱中培养,分别于24、48、72 h后检测细胞相对增殖率。
1.4 MTT法检测相对增殖率 参照文献[7]提供的方法,配制MTT溶液,并在加入受试物24 h后,每孔加入MTT溶液(5 g·L-1)20ul,于37 ℃孵育4 h,弃孔内培养上清液,每孔加二甲亚砜(DMSO)150 μL,震荡,用酶标仪于490 nm波长测定各孔吸光度(OD)。细胞相对增殖率(relative growth rate,RGR)的计算公式:RGR(%)=(试验组平均OD值)/(对照组平均OD值)×100%。
1.5 统计学方法 采用SPSS18.0软件进行统计学分析,计量资料数据以均数±标准差表示;同种物质作用下,同种细胞的所有剂量比较采用单因素方差分析(one-way ANOVA);比较两个剂量的RGR时,采用独立样本t检验;差异性显著率以0.05为标准。
2 结果
2.1 参麦注射液处理24 h后对各种细胞的影响表1显示,参麦注射液处理24 h后,各种细胞的增殖率随着剂量的降低而升高,有较好的剂量-效应关系(P<0.05);除中剂量1组的参麦注射液不影响SHSY5Y细胞增殖、中剂量2组的该药使SH-SY5Y细胞增殖率升高外,中剂量2组~高剂量组各种细胞的增殖均受到抑制;次低剂量组中WI-38、HEK293、SH-SY5Y细胞增殖率升高,HepG2细胞的增值率降低;低剂量组中的各种细胞增殖率高于对照组。
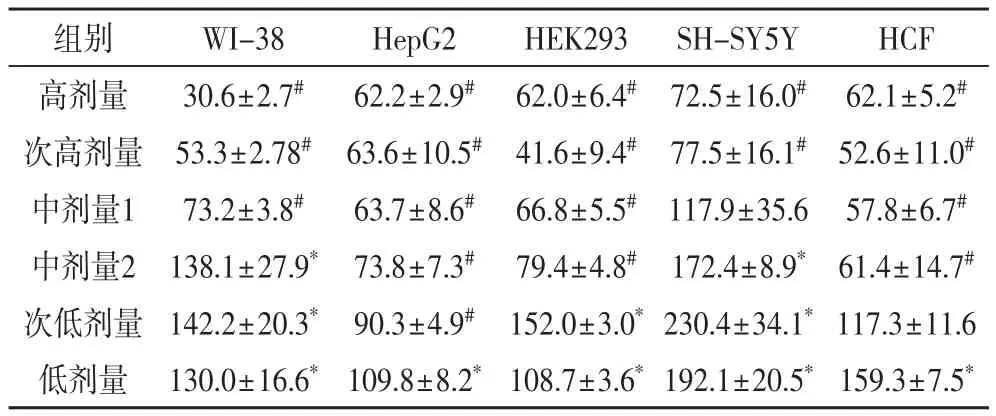
表1 参麦注射液处理24小时后各种细胞的相对增殖率(%)
2.2 参麦注射液处理48 h后对各种细胞的影响表2显示,参麦注射液处理后48 h,各种细胞的增殖率随着剂量的降低而升高,有较好的剂量-效应关系(P<0.05);除中剂量2组的参麦注射液不影响SHSY5Y细胞外,中剂量2组~高剂量组的该药使各种细胞的增殖均受到抑制;次低剂量组的该药使WI-38、HepG2细胞受到抑制,对HEK293、SH-SY5Y细胞无影响,使HCF细胞增殖率升高;低剂量组的参麦注射液对WI-38依然具有抑制作用,对HepG2、HEK293细胞无影响,但使SH-SY5Y、HCF细胞的增殖率升高。
由表3可知,参麦注射液处理后72 h,各种细胞的增殖率随着剂量的降低而升高,有较好的剂量-效应关系(P<0.05);中剂量2组~高剂量组的参麦注射液除了使HepG2细胞增殖率升高外,抑制了其余各种细胞的增殖均;次低剂量组中SH-SY5Y细胞不受影响,WI-38、HEK293、HCF细胞增殖受到抑制,HepG2细胞增殖率却升高;低剂量组的的参麦注射液对WI-38、HEK293、HCF细胞无影响,使HepG2、SH-SY5Y细胞增殖率升高。
表4提示,喘可治注射液处理24 h后,各种细胞的增殖率随着剂量的降低而升高,有较好的剂量-效应关系(P<0.05)。所有浓度的喘可治对HEK293细胞均无影响;高剂量组的该药抑制WI-38细胞增殖,低剂量组则升高该细胞的增殖率,其余浓度对WI-38细胞无影响;次低剂量组~高剂量组的喘可治注射液抑制HepG2、SH-SY5Y和HCF细胞增殖,低剂量组的该药则升高SH-SY5Y和HCF细胞增殖率、但对HepG2细胞无影响。
2.3 参麦注射液处理72 h后对各种细胞的影响
2.4 喘可治注射液处理24 h后对各种细胞的影响
2.5 喘可治注射液处理48 h后对各种细胞的影响
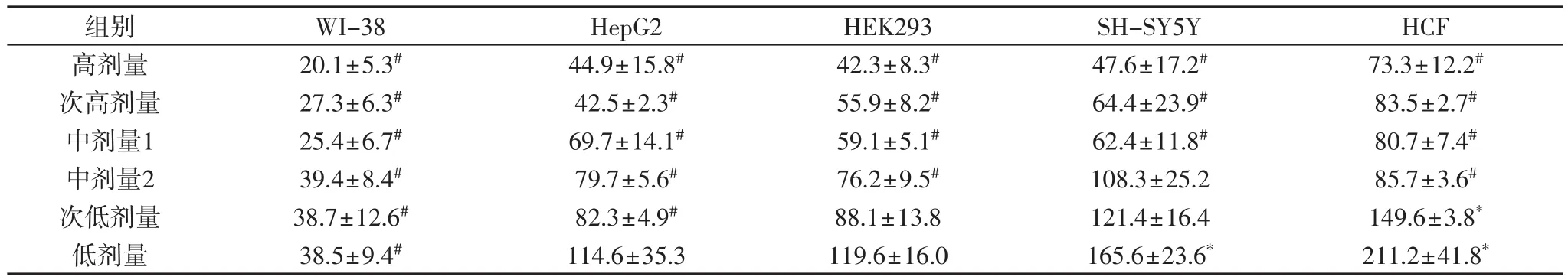
表2 参麦注射液处理48小时后各种细胞的相对增殖率(%)
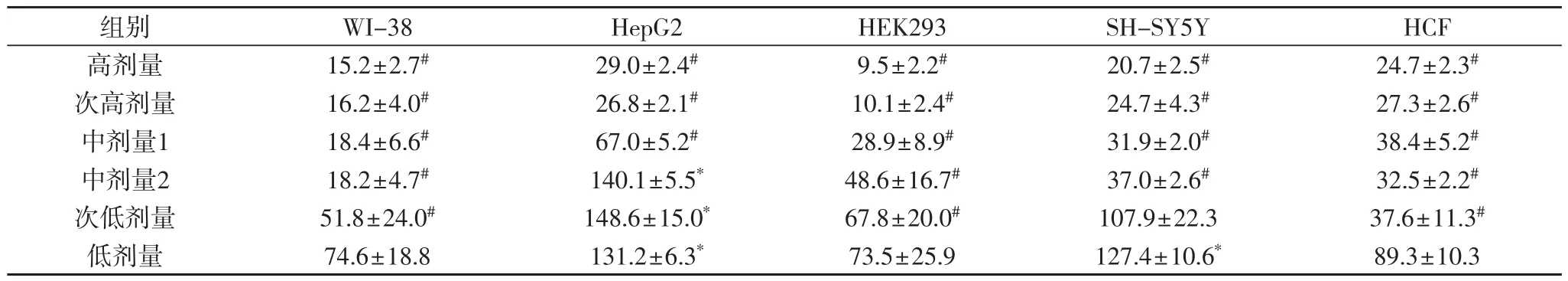
表3 参麦注射液处理72小时后各种细胞的相对增殖率(%)
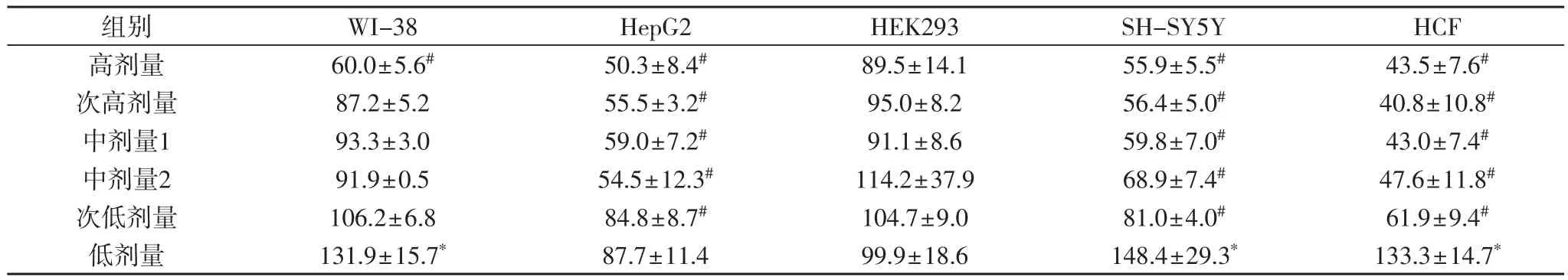
表4 喘可治注射液处理24小时后各种细胞的相对增殖率(%)
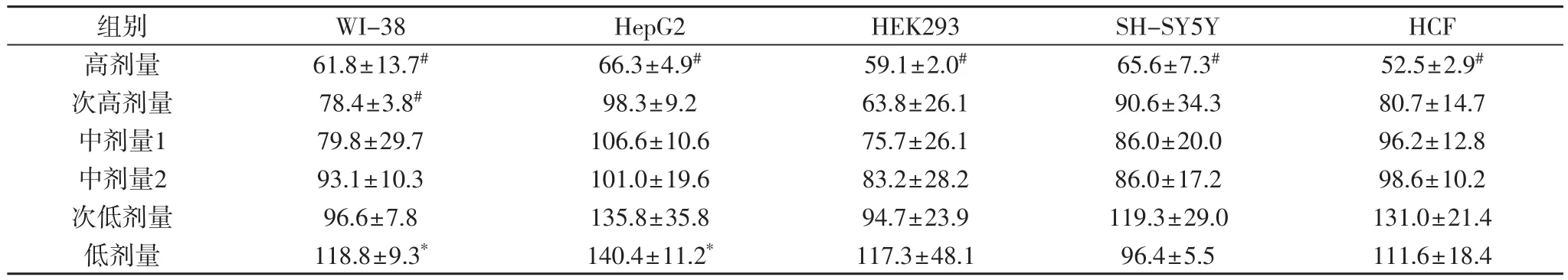
表5 喘可治注射液处理48小时后各种细胞的相对增殖率(%)
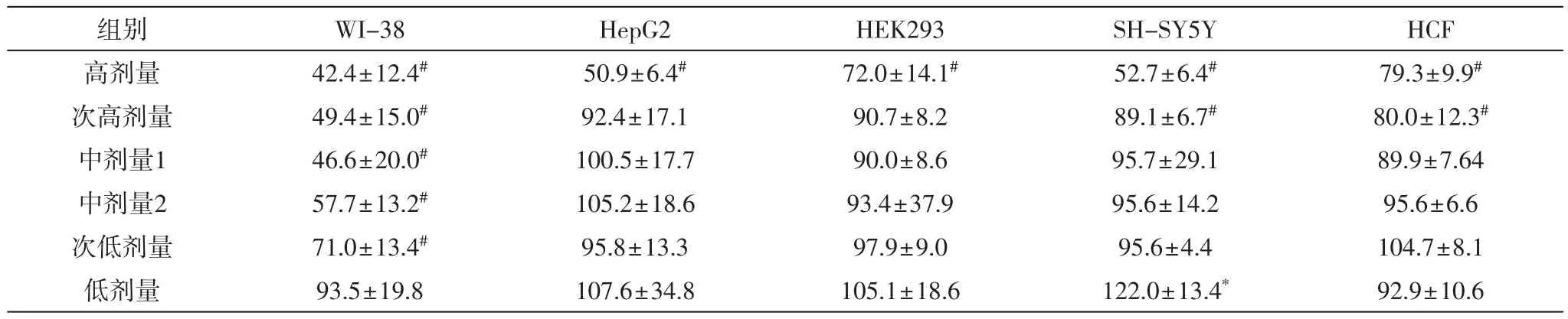
表6 喘可治注射液处理72小时后各种细胞的相对增殖率(%)
喘可治处理各种细胞72 h后,各种细胞的增殖率随着剂量的降低而升高,有较好的剂量-效应关系(P<0.05);次低剂量组~高剂量组中的WI-38细胞均被抑制,而低剂量组的该药对其无影响;高剂量组中的HepG2、HEK293、SH-SY5Y和HCF细胞受到抑制;次高剂量组中的该药使SH-SY5Y和HCF细胞抑制,但对HepG2、HEK293细胞无影响;除低剂量组的喘可治注射液可使SH-SY5Y细胞增殖率升高外,低剂量组~中剂量1组的该药对HepG2、HEK293、SH-SY5Y和HCF细胞均无影响。
3 讨论
张天宝教授等发展了大鼠肝、肾、神经、心、肺等多器官原代细胞共同培养的方法,表明可作为靶器官毒性的筛选方法[8]。我们将该方法用于几种上市多年的化学药物(红霉素、链霉素、多柔比星和白消安)的毒性研究,可较好地反映靶器官并发现了这些药物的某些潜在毒性[6]。王磊利用人源细胞系共培养模型对盐酸阿霉素、硫酸链霉素、羟基多巴胺和白消安等药物的毒性靶器官筛选进行了可行性研究,发现了上述药物的潜在毒性靶器官[4]。基于以前的研究,我们将人类WI-38、HepG2、HEK293、SH-SY5Y和HCF细胞共同培养,用于检测参麦注射液和喘可治注射液潜在的毒性和靶器官。
参麦注射液的临床不良反应主要有:全身心损害,皮肤及其附件损害,心率及心律紊乱,消化、呼吸、神经系统损害等[9],提示该药可能具有皮肤、心脏、消化器官、呼吸器官、神经毒性等。本研究发现,参麦注射液处理24、48、72 h后,除SH-SY5Y 细胞72 h后未受影响外,中剂量1组~高剂量组中的该药对WI-38、HepG2、HEK293、SH-SY5Y、HCF细胞的增殖率均有抑制作用,且在该药处理后的各时点各种细胞的增殖率均随剂量的降低而升高、并有较好的剂量-效应关系。有研究发现该药可通过抑制纤维化等途径而保护心肌细胞[11]、抑制体外培养神经元的凋亡[12]和人气管平滑肌细胞的增殖[13]等。综上所述,我们推测较大剂量的该药由于过度抑制纤维化、使细胞基本的纤维形成减少而导致各种细胞的死亡,肺、肝、肾、神经、心脏可能是参麦注射液潜在的毒性靶器官。
处理后48 h,参麦注射液的各剂量对WI-38细胞的增殖都有抑制作用;处理后72 h,该药对低剂量组中的细胞增殖率的统计学无影响(但绝对数值下降),而次低剂量组~高剂量组中WI-38细胞的增殖均被抑制,由此我们推测较长时间(无论剂量大小)使用参麦注射液可能损伤发育中的肺组织。次低和低剂量的参麦注射液处理48 h后、低剂量处理72 h后对HEK293细胞的增殖率的统计学无影响(但绝对数值下降),其余剂量在处理48、72 h后对该细胞的增殖均有抑制作用,提示剂量稍大、较长时间用药对发育中的肾脏可能会有损伤。
我们尚未发现喘可治注射液不良反应的报道。有报道认为喘可治对小鼠腹腔巨噬细胞NO的分泌和IL-6、IL-10、MCP-1、IFN-γ、TNF-α 5种细胞因子的生成具有双向调节作用[13],还有研究发现该药可抑制猴免疫缺陷病毒(SIV)感染的淋巴组织纤维化[14],由此提示我们大剂量的该药可能具有细胞毒性。我们发现,喘可治注射液处理24、48、72 h后,高剂量可抑制所有细胞的增殖;且在该药处理后的各时点各种细胞的增殖率均随剂量的降低而升高、并有较好的剂量-效应关系,由此我们认为此药可能有一定的细胞毒性,但相对较弱。
该药处理WI-38细胞24、48 h后,仅高浓度对细胞有抑制作用;而处理72 h后,除低剂量外的所有剂量均抑制细胞增殖,提示较长时间使用喘可治注射液可能导致发育中的肺组织损伤。喘可治注射液作用24 h后,
次低~高剂量的该药抑制HepG2、SH-SY5Y、HCF细胞增殖,但48、72 h后仅有高剂量或次高~高剂量抑制细胞增殖,说明通过细胞代谢可清除其毒作用,提示该药毒性较弱。
[1] Williamson EM, Lorenc A, Booker A, et al. The rise of traditional Chinese medicine and its materia medica: a comparison of the frequencyand safety of materials and species used in Europe and China [J]. J Ethnopharmacol, 2013, 149(2): 453-462.
[2] 衣冉. 中药注射剂安全性评价体系的研究[D]. 山东大学, 2009.
[3] Li AP. The use of the Integrated Discrete Multiple Organ Coculture(IdMOC)system for the evaluation of multiple organ toxicity [J]. Altern Lab Anim, 2009, 37(4): 377-385.
[4] 王磊. 多器官人源细胞系共培养模型的建立与运用[D]. 第二军医大学, 2014.
[5] 黎颖然, 潘泰先.170例参麦注射液不良反应文献分析[J]. 中国药物警戒, 2010, 7(10): 623-625.
[6] 魏会妙, 尹洪萍, 阎政礼, 等. 利用大鼠体外多器官细胞共培养方法检测红霉素、链霉素、多柔比星和白消安的细胞毒性[J]. 中国药理学与毒理学杂志, 2015, 29(1): 98-104.
[7] 司徒镇强, 吴军正. 细胞培养[M]. 北京: 世界图书出版公司, 2004.250-252.
[8] 许桂凤, 朱江波, 郑怡文, 等. 大鼠体外多器官细胞共培养模型的建立[J]. 中华劳动卫生职业病杂志, 2010, 28(7): 482-487.
[9] 万凯化, 高菁, 付辉政, 等. 参麦注射液致349例不良反应病例报告分析[J]. 中国药物滥用防治杂志, 2014, 20(2): 71-73.
[10] Ni Q, Wang J, Li EQ, et al. Study on the protective effect of shengmai san(see text)on the myocardium in the type 2 diabetic cardiomyopathy model rat [J]. J Tradit Chin Med, 2011, 31(3): 209-219.
[11] 李晓峰, 张红, 董艳玲, 等. 参麦注射液对大鼠神经元内质网应激诱导凋亡的影响[J]. 中国老年医学杂志, 2010, 30(2): 187-190.
[12] Zhao LM, Ma LJ, Zhang LX, et al. Shenmai injection inhibiting the extracellular signal regulated kinase-induced human airway smooth muscle proliferation in asthma [J]. Chin J Integr Med, 2010, 16(4): 331-336.
[13] 孙成宏, 张亚兴, 宋 兵, 等. 中药喘可治注射液对小鼠腹腔巨噬细胞的影响. 暨南大学学报(医学版)[J].2010, 31(6): 572-576.
[14] 陈滢宇, 陈颂, 符林春, 等. 中药注射液“喘可治”通过TGF-β通路改善慢性猴艾滋病的淋巴组织纤维化[J]. 中华中医药杂志, 2014, 29(5): 1734-1739.
Investigating cytotoxicity induced by Shenmai injection and Chuankezhi injection with the human IdMOC model
Yu Hai-ming, Yan Zheng-li, Fu Hu, Yu Feng-jiang, Zhu Yong-fei
(1. Department of Critical Care Medicine, the First Affiliated Hospital(The People’s Hospital of Hunan province), Changsha 410005, China; 2. School of Medicine, Hunan Normal University, Changsha 410013, China; 3. School of Chemistry and Chemical Engineering, Hunan Normal University, Changsha 410013, China)
Objective Add different dose Shenmai injection or Chuankezhi injection to human’s different organs cells cultured in vitro separately and observing the proliferation of these cells, in order to discover the potential toxicity and target organs of the two drugs. Methods After the human IdMOC(integrated discrete multiple organ cell culture)model was administrated with Shenmai injection and Chuankezhi injection for 24 hours, 48 hours and 72 hours, the growth of WI-38, HepG2, HEK293, SH-SY5Y and HCF cells was detected. Results After Shenmai injection and Chuankezhi injection were treated the cells for 24, 48, 72 hours respectively, the two drugs with their high dose inhibited the proliferation of all kinds of cells. And at different times, the relative growth rates of all kinds of cells were increased with the two drugs’ concentration reducing, and there is a good dose-response relationship. After administrated by Shenmai injection for 48 and 72 hours respectively, the proliferation of WI-38 cells was inhibited among the sub-low ~ high dose of this drug, and that of HEK293 cells was inhibited among middle dose 1~high dose. After treated by Chuankezhi injection for 72 hours, the proliferation of WI-38 cells was inhibited among the sub-low ~ high dose of the drug. Conclusion The potential lung toxicity of the two drugs was detected by the IdMOC model, and Shenmai injection maybe cause the toxicity to kidney; The Chuankezhi injection maybe induced liver and nerve toxicity.
IdMOC(integrated discrete multiple organ cell culture)model; Shenmai injection; Chuankezhi injection; cytotoxicity
R114
A
1673-016X(2017)01-0011-05
2016-12-28
湖南省科技计划项目课题(2015SK2036)
朱勇飞,E-mail:njzhu70@163.com

