大麻素受体1介导人类中性粒细胞dHL60的迁移功能
樊晓婷 田 蕾 杨 琳 李丽英
(首都医科大学细胞生物学系 ‘肝脏保护与再生调节’北京市重点实验室,北京 100069)
· 基础研究 ·
大麻素受体1介导人类中性粒细胞dHL60的迁移功能
樊晓婷 田 蕾 杨 琳 李丽英*
(首都医科大学细胞生物学系 ‘肝脏保护与再生调节’北京市重点实验室,北京 100069)
目的 研究大麻素受体(cannabinoid receptors, CBs)对人类中性粒细胞(dHL60)迁移的影响。方法 体外培养人早幼粒白血病细胞系HL60,使用二甲基亚砜(dimethylsulphoxide, DMSO)诱导为类中性粒细胞(dHL60),运用实时荧光定量聚合酶链反应检测其分化标志物CD11b mRNA的表达;应用琼脂糖凝胶电泳、Western blotting法及免疫荧光技术检测其大麻素受体1(CB1)及受体2(CB2)的表达;ACEA、AM281分别为CB1的药理学激动剂和拮抗剂,JWH133、AM630分别为CB2的药理学激动剂和拮抗剂,应用Boyden chamber法检测ACEA和JWH133对dHL60迁移的影响,并从药理学阻断CB1、CB2后,检测其迁移功能的变化;使用鬼笔环肽染细胞肌动蛋白纤维,并应用高内涵扫描分析的方法对肌动蛋白纤维的聚合进行分析。结果 dHL60在mRNA和蛋白质水平上均表达CB1、CB2;ACEA能够诱导dHL60的迁移及其细胞骨架的聚合,且其所诱导的迁移能够被CB1的药理学阻断剂AM281所阻断,而CB2的药理学阻断剂AM630对ACEA所诱导的迁移并无影响;给予CB2的激动剂JWH133对dHL60的迁移及细胞骨架的聚合无明显作用。结论 激活CB1能够促进dHL60的迁移。
大麻素受体;人类中性粒细胞;细胞迁移
中性粒细胞属于天然免疫的第一道防线,是人体内最主要的固有免疫细胞之一,主要来源于骨髓。当机体受到刺激发生炎性反应时,中性粒细胞被激活并进入外周循环系统,后将会朝着趋化梯度区域的上游迁移[1]。当其迁移到炎性反应部位,可以通过吞噬、脱颗粒作用及中性粒胞外诱捕网来发挥其功能[2]。由于中性粒细胞属于终末分化细胞,难以在体外培养,而人早幼粒细胞白血病细胞系HL60,经药物体外诱导后,可表现出不同程度地向粒细胞、单核细胞分化的现象。使用二甲基亚砜(dimethylsulphoxide, DMSO)进行体外诱导,可分化为类中性粒细胞(dHL60)[3]。dHL60可替代中性粒细胞进行体外实验。
内源性大麻素是一类脂质分子,主要包括2-花生四烯甘油(2-arachidonoyl glycerol,2-AG) 和N-花生四烯乙醇胺(N-arachidonoyl ethanolamine,AEA),在多种疾病中发挥重要作用[4-5],包括能量代谢性疾病、疼痛以及抑郁、心血管疾病等。大麻素受体(cannabinoid receptors, CBs)是一种G 蛋白偶联受体,可分为受体1(cannabinoid receptor 1,CB1)和受体2(cannabinoid receptor 2, CB2)两个亚型。目前已有文献[6-9]报道,CB1在细胞迁移过程中发挥着至关重要的作用。CB1可以调控白细胞向真皮的浸润,使用CB1基因敲除的小鼠,给予博来霉素的刺激,发现在其所诱导的真皮癌症中损伤部位的白细胞数减少[6];激活CB1可以通过Gα(i/o)并且激活下游小G蛋白RhoA,从而促进巨噬细胞迁移[7]。同时,激活CB1能够诱导单核巨噬细胞系J774A.1的迁移[8]。对于CB2受体,有文献[9-10]报道其在缓减炎性反应、缓减氧化应激方面发挥重要作用。
然而,大麻素受体如何影响中性粒细胞的迁移并不清楚。因此本研究拟采用dHL60为研究对象,以CBs为靶分子,探讨激活CBs对dHL60迁移的影响。
1 材料与方法
1.1 试剂与仪器
Histopaque©-1077、Histopaque©-1119(Sigma公司,美国);1640培养基(Corning Cellgro公司,美国);ACEA、AM281和AM630 (TOCRIS/R&D,美国);BCATMprotein assay kit(Pierce公司,美国);兔抗CB1多克隆抗体(Cayman Chemical公司,美国),兔抗CB2多克隆抗体(Cayman Chemical公司,美国),抗β-Tublin单克隆抗体(全式金公司,中国);胎牛血清(Excell,中国);Cy3标记的二抗(Jackson Immunoresearch公司,美国);Boyden chamber(BD Biosciences公司,美国);M-MLV反转录试剂盒(Invitrogen公司,美国);Calcein-AM (Life Technologies,美国);N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸(N-FORMYL-MET-LEU-PHE, fMLP)(Sigma公司,美国);人纤连蛋白Fibronectin(Calbiochem公司,美国);Alexa Fluor 488 鬼笔环肽(Life Technologies公司,美国);德国Heraeus公司CO2 培养箱(BB16);Fluoroskan AscentTMFL 荧光和化学发光分析仪;美国LI-COR公司Odyssey 红外荧光扫描成像系统;美国Thermo Fisher公司高内涵分析仪(Cell Insight公司);美国 Bio-Rad公司Gel-Doc凝胶成像系统;美国ABI公司Real-time PCR仪(AB Prism 7300)。
1.2 细胞培养
HL60购买于中国医学科学院基础医学研究所细胞资源中心细胞库。使用20%(体积分数)胎牛血清和1%(体积分数)双抗的1640培养基培养HL60,并于37 ℃、5%(体积分数)CO2培养箱中培养。
1.3 反转录多聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)鉴定dHL60 中 CD11b mRNA 的变化情况

表1 引物序列Tab.1 Sequences of primers for real time RT-PCR
CB1: cannabinoid receptor 1;CB2: cannabinoid receptor 2.
检测的临界点设定在PCR扩增过程中,荧光信号由本底进入指数增长阶段的拐点所对应的循环数(Ct)作为模板初始浓度的间接指标,溶解曲线分析采用默认条件。结果以18S rRNA 进行校正,用ΔΔCt 法计算相对基因表达量。
1.4 Western blotting法检测dHL60中CB1、CB2 的表达
提取细胞总蛋白:收集诱导后的dHL60,加入20μL RIPA裂解液,置于冰上15 min,后13 200转离心15 min,使用BCATMprotein assay kit对待测样本浓度进行检测,后99 ℃蛋白变性10 min。上样,20 μL蛋白样品进行SDS-PAGE电泳,DNA 预染Marker 加入7 μL,电泳完成后并转移到PVDF膜上,5%(质量分数)脱脂奶粉室温封闭1 h,anti-Tublin按1∶1 000用脱脂奶粉稀释,anti-CB1按1∶200用脱脂奶粉稀释, anti-CB2按1∶200用脱脂奶粉稀释。4 ℃过夜,TBS洗。二抗按1∶10 000用脱脂奶粉稀释,避光平摇1 h,TBS洗,用Odyssey 红外荧光扫描成像系统扫描。
1.5 细胞免疫荧光鉴定 dHL60 中CB1、CB2 的表达
接种dHL60于96孔板中(10 000/孔),用4%(质量分数)多聚甲醛4 ℃固定细胞40 min。PBS洗。0.5%(质量分数)PBST室温打孔15 min,2%(质量分数)牛血清白蛋白37 ℃封闭30 min,分别用一抗CB1(1∶100, Cayman Chemical)、CB2(1∶100, Santa Cruze公司),4 ℃孵育过夜。PBS洗。Cy3标记的二抗(1∶1 000)37 ℃孵育1 h。PBS洗。DAPI染核,高内涵扫描分析并获取图像。
1.6 琼脂糖凝胶电泳检测 dHL60 表达CB1和CB2
dHL60的CB1和CB2的RT-PCR产物进行电泳,凝胶浓度为2%,100 V恒压电泳40 min,暗室内紫外拍照。引物序列见表1。
1.7 F-actin 染色
接种dHL60于Fibronectin包被过的板子中进行细胞爬片(2×105/孔),给予不同浓度的ACEA(CB1激动剂)及 fMLP(阳性对照)刺激细胞,后用4%(质量分数)多聚甲醛4 ℃固定细胞40 min。PBS洗 3次,每次5 min。0.5%(质量分数)PBST室温打孔15 min,2%(质量分数)牛血清白蛋白37 ℃封闭30 min,Alexa Fluor 488 鬼笔环肽(1∶100 PBS稀释)室温染色20 min,PBS洗3次,每次5 min。DAPI染色5 min,高内涵扫描分析并获取图像。
1.8 Boyden chamber assay 检测 dHL60 的迁移能力
dHL60 用2 μmol/L Calcein-AM 4 ℃孵育30 min,后用含2.5%(体积分数)血清的培养基重悬。经处理过的细胞悬液200μL,加在 Transwell 小室的上室中(膜孔径3μm)并接种在24孔板上。含有2.5%(质量分数)血清以及趋化因子的培养基700 μL加在下室中。迁移一定时间后,弃去小室,收集下室液体,1 200 r/min, 5 min 离心,弃上清,用100 μL PBS 重悬并将重悬液加入到不透光的96孔板(白色底板)中,使用Fluoroskan AscentTMFL 荧光和化学发光分析仪检测板485/530 nm处的荧光值。
1.9 统计学方法
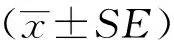
2 结果
2.1 体外诱导 HL60 分化为 dHL60,其分化标志物CD11b的表达明显增加
使用1.3%(体积分数)二甲基亚砜(DMSO)诱导后,HL60中CD11b的表达明显上升,DMSO诱导1 d后,与对照组相比CD11b的表达上升2.36倍,2 d时上升5.99倍,3 d时上升11.9倍,4 d时上升9.22倍,诱导至第5天与原代中性粒细胞CD11b的表达最为接近(P<0.05)(图1)。

图1 HL60经DMSO诱导后CD11b的表达明显增加Fig.1 CD11b mRNA expression up-regulated in dHL60
HL60 cell was cultivatedinvitroand stimulated by 1.3% DMSO for 5 days. CD11b mRNA expression was determined by real time RT-PCR. Representatives of three independent experiments are shown.*P<0.05vsunstimulated,n=3; RT-PCR:reverse transcription-polymerase chain reaction; DMSO:dimethylsulphoxide.
2.2 dHL60在mRNA和蛋白质水平上均表达CB1和CB2
图2A中NO-RT为阴性对照,显示dHL60在mRNA水平上表达CB1和CB2。进一步确认dHL60在蛋白质水平表达CB1和CB2,Western blotting法检测结果见图2,其中脑和脾脏分别为CB1和CB2的阳性对照;如图2C为免疫荧光的结果,dHL60在蛋白质水平表达CB1(红色荧光)和CB2(红色荧光)。
2.3 CB1介导dHL60的迁移
使用Boyden chamber 细胞迁移,分别给予0.5、1.0、5.0mol/L CB1的激动剂ACEA及CB2的激动剂JWH133诱导迁移,0.5、1.0、5.0mol/L的ACEA能够诱导dHL60的迁移;0.5mol/L的ACEA促迁移倍数为1.52倍, 1mol/L时促迁移倍数为2.20倍,在5mol/L的浓度时,ACEA的促迁移能力最大,上调为对照组的3.24倍(P<0.05),而给予CB2的激动剂JWH133对其迁移并无明显影响(图3)。
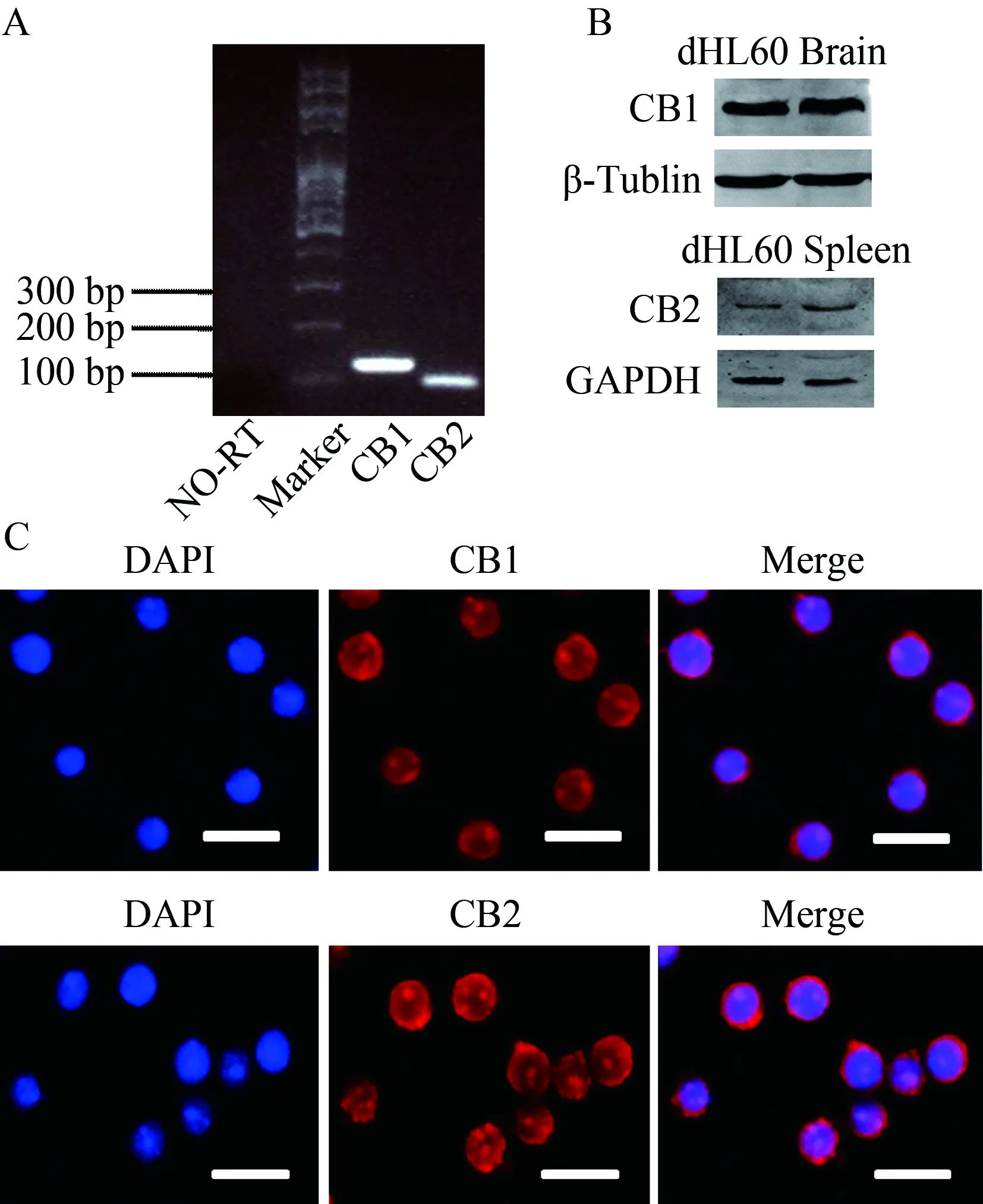
图2 dHL60在mRNA和蛋白质水平上均表达CB1和CB2Fig.2 dHL60 expressed CB1 and CB2
A: RT-PCR production of CB1 or CB2 was size fractionated in a 2% agarose gel; B: CB1 and CB2 protein was evaluated by Western blotting. β-Tublin and GAPDH served as loading controls; C: Representative images of dHL60 for CB1 or CB2 (red) were shown by immunofluorescence. Scale bars: 25m;Nuclei were stained with DAPI for 5 mins. CB1: cannabinoid receptor 1; CB2: cannabinoid receptor 2; RT-PCR:reverse transcription-polymerase chain reaction.

图3 CB1介导dHL60的迁移Fig.3 CB1 mediates the migration of dHL60
Boyden chamber assay was performed in dHL60. 100 nmol/L fMLP as positive control. dHL60 (4×104cells/chamber) were allowed to migrate for 2 hours and incubated with ACEA (CB1 agonist) or JWH133 (CB2 agonist).Migration values were determined by fluorescence of each well. Fluorescence was measured using Fluoroskan AscentTMFL analysis.*P<0.05vscontrol.n=3.CB1: cannabinoid receptor 1; CB2: cannabinoid receptor 2.
2.4 阻断CB1能够抑制dHL60的迁移
给予dHL60 CB1或CB2的药理学阻断剂AM281或AM630预孵育,后在Boyden chamber下室中加入终浓度为5 μmol/L ACEA。使用CB1的药理学阻断剂AM281后,dHL60的迁移受到明显抑制,使用CB2的药理学阻断剂AM630,其对ACEA诱导的迁移并无影响(图4)。
图4 阻断CB1能够抑制dHL60的迁移Fig.4 Blockade of CB1 rather than CB2 reduces ACEA-mediated migration of dHL60
dHL60 were incubated with AM281or AM630 (CB2 antagonist, 10 μmol/L) for 1 hour prior to ACEA treatment (5μmol/L). Data were presented as the mean± SE of three independent experiments.*P<0.05vscontrol;#P<0.05vsACEA treatment.n=3. CB1: cannabinoid receptor 1; CB2: cannabinoid receptor 2.
2.5 激活CB1促进dHL60骨架聚合,而激活CB2并无明显作用
分别用0.5、1.0、5.0 μmol/L的ACEA及JWH133刺激dHL60,后进行罗丹明标记的鬼笔环肽染色以观察细胞内F-actin的聚合情况。高内涵扫描荧光图图5A,F-actin荧光强度的统计结果见图5B。不同浓度的ACEA刺激后F-actin的表达增强,聚合水平明显升高;0.5μmol/L的ACEA 刺激后F-actin的表达上升倍数为2.44倍,1μmol/L的ACEA 刺激后F-actin的表达上升倍数为2.50倍, 5μmol/L的ACEA 刺激后F-actin的表达上升倍数为2.73倍。而JWH133刺激后F-actin的表达无明显变化,且不同浓度对于F-actin的表达并无影响。
3 讨论
中性粒细胞在免疫相关疾病的发生及发展中具有重要作用[11]。当炎性反应发生时,在趋化因子作用下会第一时间迁移到炎性反应部位从而发挥功能。组织定居的巨噬细胞、坏死的组织细胞、细菌等均可以产生趋化信号以此介导中性粒细胞向损伤部位的定向迁移[12]。然而,中性粒细胞向损伤部位的过渡浸润及有毒介质的大量释放均可能带来损伤,例如在败血症、内毒素血症、缺血性再灌注损伤以及乙醇、病毒引发的肝脏疾病中,由中性粒细胞所引发的炎性反应均有可能加重肝组织的损伤[13]。尽管中性粒细胞在炎性反应中发挥着重要的功能,但其向损伤部位募集的分子机制并不十分清楚。
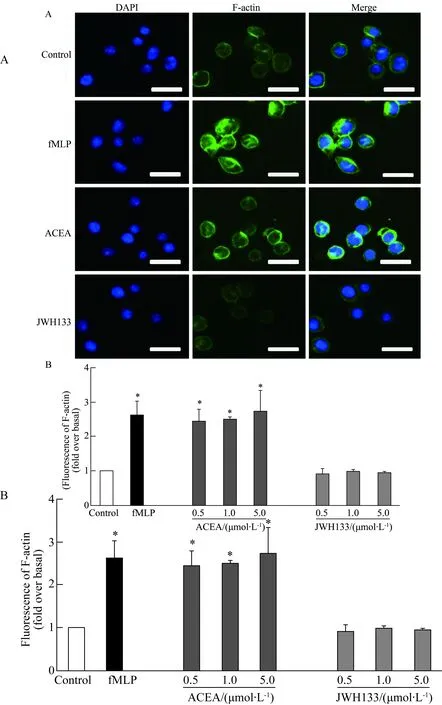
图5 激活CB1促进dHL60骨架聚合,而激活CB2并无明显作用Fig.5 Activation of CB1 caused an increase of F-actin remodeling in dHL60
High content analysis was performed in dHL60. fMLP as positive control. Scale bars: 25μm.*P<0.05vscontrol group;n=3.CB1: cannabinoid receptor 1; CB2: cannabinoid receptor 2.
内源性大麻素系统包括其合成酶、降解酶以及内源性大麻素的配体及G蛋白偶联的大麻素受体(CB1和CB2)。大麻素发挥其功能主要是通过激活G蛋白偶联受体CB1和CB2。文献[14-16]表明,关于内源性大麻素系统参与炎性反应的研究主要聚焦在CB2受体上,但近年来研究[17]显示内源性大麻素通过CB1影响免疫系统的功能,在多种免疫疾病中发现CB1发挥着非常重要的作用,包括多发性硬化和Crohn病。本研究首先明确了dHL60表达CB1及CB2。使用ACEA激活CB1可以诱导dHL60的迁移,且能够被CB1的药理学阻断剂AM281所阻断;由于CB1与CB2具有高度的同源性,因此ACEA对CB2有弱的亲和力,笔者使用CB2的药理学阻断剂AM630,发现其对ACEA诱导的迁移并无影响。当给予CB2的激动剂JWH133,发现其对dHL60并无促迁移作用。细胞迁移与细胞骨架重构息息相关[14],而肌动蛋白F-actin是细胞骨架的重要组成。本研究也发现,对照组中F-actin的表达较少,在给予ACEA刺激后其F-actin的表达明显增强,而给予JWH133则无明显变化,表明CB1介导细胞骨架重构从而促进了细胞迁移。以上结果提示,激活CB1能够促进dHL60的迁移而激活CB2则无明显的促迁移作用。
本研究在体外验证了激活CB1能够诱导dHL60的迁移,为中性粒细胞参与的炎性反应提供了新的分子机制。
[1] Borregaard N. Neutrophils, from marrow to microbes[J].Immunity, 2010, 33(5):657-670.
[2] Bardoel B W, Kenny E F,Sollberger G, et al.The Balancing Act of Neutrophils[J].Cell Host Microbe,2014,15(5):526-536.
[3] Zou W, Chu X, Cai C, et al. AKT-mediated regulation of polarization in differentiated human neutrophil-like HL-60 cells[J].Inflamm Res, 2012, 61(8):853-862.
[4] Clapper J R, Moreno-Sanz G, Russo R, et al. Anandamide suppresses pain initiation through a peripheral endocannabinoid mechanism[J]. Nat Neurosci, 2010, 13(10): 1265-1270.
[5] Di Marzo V. Targeting the endocannabinoid system: to enhance or reduce?[J]. Nat Rev Drug Discov, 2008, 7(5): 438-455.
[6] Marquart S, Zerr P, Akhmetshina A, et al. Inactivation of the cannabinoid receptor CB1 prevents leukocyte infiltration and experimental fibrosis[J]. Arthritis Rheumatol,2010,62(11):3467-3476.
[7] Mai P, Yang L, Tian L, et al. Monocytes/macrophages in a CB1-dependent of bone marrow-derived liver injury and inflammation by activation endocannabinoid[J]. J Immunol,2015, 195(7):3390-3401.
[8] 赵中新,常娜,阵青青,等.激活大麻素受体1诱导的单核巨噬细胞J774A.1的迁移依赖RNA结合蛋白HuR[J].首都医科大学学报, 2016, 37 (1): 76-82.
[9] Murikinati S, Jüttler E, et al. Activation of cannabinoid 2 receptors protects against cerebral ischemia by inhibiting neutrophil recruitment[J].FASEB J,2010, 24(3): 789-798.
[10]Wang L L, Zhao R, Li J Y,et al. Pharmacological activation of cannabinoid 2 receptor attenuates inflammation, fibrogenesis, and promotes re-epithelialization during skin wound healing[J].Eur J Pharmacol,2016,786:128-136.
[11]Pollard T D, Borisy G. Cellular motility driven by assembly and disassembly of actin filaments[J]. Cell, 2003,112 (4):453-465.
[12]Amulic B, Cazalet C, Hayes G L, et al. Neutrophil function: from mechanisms to disease[J]. Annu Rev Immunol, 2012, 30:459-489.
[13]Kube P, Mehal W Z. Sterile Inflammation in the liver[J]. Gastroenterology, 2012,143(5):1158-1172.
[14]Liu Z X, Han D, Gunawan B, et al. Neutrophil depletion protects against murine acetaminophen hepatotoxicity[J]. Hepatology,2006, 43(6):1220-1230.
[15]王喜钟,王艳香,毕廷民,等.大麻素Ⅱ型受体激动剂对A375细胞增殖的影响[J]中国煤炭工业医学杂志,2015,18(5):1359-1362.
[16]赵中新,常娜,盖菁菁,等.激活大麻素受体1诱导的单核巨噬细胞J774A.1的迁移依赖RNA结合蛋白HuR[J].首都医科大学学报,2016,37(1):76-82.
[17]Wong B S, Camilleri M, Eckert D, et al. Randomized pharmacodynamic and pharmacogenetic trial of dronabinol effects on colon transit in irritable bowel syndrome-diarrhea[J]. Neurogastroenterol Motil,2012, 24(4):358-e169.
编辑 慕 萌
Cannabinoid receptor 1 mediated the migration of human neutrophil-like cell line dHL60
Fan Xiaoting, Tian Lei, Yang Lin, Li Liying*
(1.DepartmentofCellBiology,MunicipalLaboratoryforLiverProtectionandRegulationofRegeneration,CapitalMedicalUniversity,Beijing100069,China)
Objective To investigate the effect of cannabinoid receptors (CBs) on migration of human neutrophil-like cell line dHL60. Methods HL60 cell was cultivated in vitro and stimulated by dimethylsulphoxide (DMSO) to differentiate into neutrophil-like cells (dHL60), RT-PCR was used to detect the CD11b mRNA expression as a differentiation marker. Western blotting and agarose gel electrophoresis were used to detect the expression of CB1 and CB2. Boyden chamber was used for cell migration assay. Filamentous actin (F-actin) stained with phalloidin was examined by high content analysis. Results In this study, we present evidence that dHL60 significantly expressed CB1 and CB2; the treatment of ACEA (agonist of CB1) caused an increase in dHL60 migration and F-actin remodeling, the pharmacological inhibition of CB1 markedly attenuated ACEA-induced migration; the treatment of JWH133 (agonist of CB2) has no effect on migration and F-actin remodeling. Conclusion CB1 mediated the migration of human neutrophil-like cell line dHL60.
cannabinoid receptors (CBs); human neutrophil-like cell; cell migration
国家自然科学基金(81430013), 北京市属高等学校创新团队建设与教师职业发展计划项目(IDHT20150502)。 This study was supported by National Natural and Science Foundation of China (81430013), Project of Construction of Innovative Teams and Teacher Career Development for Universities and Colleges Under Beijing Municipality (IDHT20150502).
时间:2017-06-09 17∶26 网络出版地址:http://kns.cnki.net/kcms/detail/11.3662.r.20170609.1726.008.html
10.3969/j.issn.1006-7795.2017.03.018]
Q2
2016-08-05)
*Corresponding author, E-mail:liliying@ccmu.edu.cn

