CM-DiI标记人骨髓间充质干细胞并检测其移植后产生脑源性神经营养因子的实验研究
赵春松 邹海强 李晓波 闫晓明 关云谦* 张 愚
(1.首都医科大学宣武医院细胞生物室,北京 100053;2.教育部神经变性病重点实验室,北京 100053; 3.广州军区广州总医院神经内科,广州 510010; 4.苏北人民医院神经内科,江苏扬州 225001; 5.首都医科大学宣武医院功能神经外科,北京 100053)
· 基础研究 ·
CM-DiI标记人骨髓间充质干细胞并检测其移植后产生脑源性神经营养因子的实验研究
赵春松1,2邹海强3李晓波4闫晓明5关云谦1,2*张 愚1,2
(1.首都医科大学宣武医院细胞生物室,北京 100053;2.教育部神经变性病重点实验室,北京 100053; 3.广州军区广州总医院神经内科,广州 510010; 4.苏北人民医院神经内科,江苏扬州 225001; 5.首都医科大学宣武医院功能神经外科,北京 100053)
目的 观察荧光染料 (CM-DiI)标记人骨髓间充质干细胞(bone marrow mesenchymal stem cells, BM-MSC)后,是否会脱落造成周围细胞被污染,标记细胞经静脉移植入脑梗死大鼠后是否会造成宿主脑内神经元被误染色;以及是否可以鉴定人BM-MSC产生脑源性神经营养因子(brain derived neurotrophic factor, BDNF)。方法 应用不同浓度CM-DiI分别标记培养的人BM-MSC,观察标记效率。将转染绿色荧光蛋白(green fluorescence protein, GFP)的人胚肾293T细胞和CM-DiI标记的人BM-MSC细胞共培养,7 d之后观察CM-DiI的红色荧光和293T细胞是否双标记。将CM-DiI标记的人BM-MSC经静脉移植入脑梗死大鼠体内,观察植入细胞的红色荧光是否会沾染宿主细胞以及和BDNF免疫荧光的双标记。结果 不同浓度CM-DiI(1 000、200、100、20 nmol/L)均可成功标记人BM-MSC,其中1 000、200 nmol/L 浓度标记24 h后观察标记效率均达到98%以上, 比100、20 nmol/L 标记的效率明显升高(P<0.01)。CM-DiI标记后的人BM-MSC与GFP 标记的293T细胞共培养,7 d之内没有发现红色荧光沾染绿色的293T细胞。移植后第3天,静脉植入脑梗死大鼠的标记细胞的红色荧光没有沾染宿主脑内神经元, 而且可以和BDNF的绿色荧光形成双标记。结论 CM-DiI可以高效地标记人BM-MSC。采用200 nmol/L 浓度标记的人BM-MSC细胞在体外培养和移植入脑梗死大鼠后都未发现对周围细胞造成污染,植入细胞的CM-DiI荧光可以鉴定产生BDNF的人BM-MSC。
间充质干细胞;CM-DiI ;移植;脑梗死;脑源性神经营养因子
人类骨髓可以提取和扩增出大量间充质干细胞,已有研究[1-2]证实人骨髓间充质干细胞(bone marrow mesenchymal stem cells, BM-MSC)具有免疫调节和产生营养因子两种主要作用,前者包括抑制T淋巴细胞增生、抑制促炎因子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、干扰素-γ(interferon-γ,IFN-γ)等生成/抑制B细胞产生抗体、抑制自然杀伤(natural killer,NK)细胞的功能等;营养作用包括MSC本身产生多种营养性的细胞因子,还包括MSC经血管移植后还可以促进宿主脑内产生各种营养因子[3]。MSC或者宿主产生的脑源性神经营养因子(brain derived neurotrophic factor, BDNF)、胶质源性神经营养因子(glial cell derived neurotrophic factor, GDNF)、胰岛素样生长因子-1(insulin-like growth factor, IGF-1)等因子都对神经系统退行性疾病的恢复具有明显益处[4-9]。其中BDNF在脑梗死恢复中的重要性已有了广泛的研究[6-7]。判断来自于移植细胞和宿主自身的营养性细胞因子在疗效中的权重,对于今后提高MSC移植治疗神经系统退行性疾病的疗效具有重要的意义。这就涉及到对移植细胞进行标记,并用标记信号检测产生营养因子的细胞。
对细胞常用的标记方法有使培养细胞摄入5-溴脱氧尿嘧啶核苷(5-bromo-2’-deoxyuridine,BrdU)标记法,转染绿色荧光蛋白(green fluorescence protein, GFP)基因标记法以及生物染料标记法。前两种标记方法操作比较复杂,而且标记率较低;利用病毒载体转入GFP基因后的干细胞常常在分化后丢失绿色荧光,造成使用上的限制。生物染料标记方便且效率高,但是随着细胞分裂次数的增加,荧光染料会被稀释、导致荧光减弱;而且还有荧光染料脱落沾染宿主细胞的可能。
氯甲基-1,1十八烷基-3,3,3′,3′-四甲基-吲哚-羧花青-高氯酸盐(chlormethylbenzamido-1,1-dioctadecyl-3,3,3′,3′-tetramethylin-docarbocyamine, CM-DiI)作为一种生物染料,有强而稳定的红色荧光(激发峰553nm/发射峰570nm)。CM-DiI对细胞无毒,通过与膜结构的脂质分子结合而标记细胞,标记效果稳定长效,能很好地长期示踪细胞。它水溶性比DiI更好,所以对于培养细胞染色更为方便。研究[10]证实,CM-DiI标记后荧光在胞内表达稳定,对多种细胞的阳性标记率达98%以上,标记细胞形态良好,能有效地观察细胞在体外的诱导分化情况;如果将标记的细胞注入体内,可以有效的显示移植细胞在活体组织中的迁移及分化。另外,其氯甲基替代基团(CM基团)能与多肽及蛋白上的巯基反应从而使该分子在醛类物质中保持稳定,所以CM-DiI标记细胞后再进行固定、破膜及石蜡包埋操作都不会影响其荧光。
CM-DiI标记MSC虽然已有应用[11],但适宜方法还没有明确的报道,标记后是否会因为荧光染料脱落造成假阳性也需要实验检验。本文首先探讨了不同浓度CM-DiI标记BM-MSC的标记效率;随后探讨体外实验中,CM-DiI标记MSC的红色荧光是否会造成与之共培养的细胞的沾染以及静脉输注的MSC进入脑内,其红色荧光是否会沾染宿主脑内细胞。最后,观察了CM-DiI是否可用于鉴定移植细胞BDNF的产生。
1 材料与方法
1.1 材料
人骨髓来自首都医科大学宣武医院产科外伤流产的胎儿,胎龄16~18周,并获得知情同意。
实验动物SPF级SD雄性大鼠6只(体质量260~280 g),由北京维通利华实验动物技术有限公司提供,动物许可证号为SCXK(京)2016-0004。大鼠自由进水进食。实验动物分2组、每组3只,分别是缺血对照组[缺血后尾静脉给予0.9%(质量分数)氯化钠注射液]、人BM-MSC组[缺血后尾静脉给予CM-DiI标记BM-MSC的0.9%(质量分数)氯化钠注射液]。
培养基低糖DMEM、RPMI 1640、αMEM,胎牛血清(fetal bovine serum, FBS),抗生素,左旋谷氨酰胺(L-glutmax),0.25%(质量分数)胰蛋白酶(trypsin),DPBS均来自美国Life technology公司。培养箱、超净工作台购自美国Thermo公司;全波长酶标仪购自美国Bio-Rad公司;4000B显微镜和照相系统购自德国Leica 公司。CM-DiI购自美国Molecular probe 公司。
1.2 方法
1.2.1 胚胎骨髓人BM-MSC提取
人BM-MSC的基础培养液为低糖DMEM +10%(体积分数)FBS +100 U/mL青霉素+100 μg/mL链霉素 +2 mmol/L L-谷氨酰胺。在无菌条件下,分离胚胎下肢长骨,用基础培养液通过注射器冲洗出骨髓液,将细胞悬液以1.0×106个/mL接种到100 mm培养皿,置37 ℃,5% (体积分数)CO2培养箱。培养4 d后弃去未贴壁细胞,以后每2~3 d半量换液待细胞贴壁生长至80%汇合时,以0.25%(质量分数)胰蛋白酶-EDTA消化,1∶3传代。
1.2.2 CM-DiI 标记细胞
配制浓度为1 mmol/L的CM-DiI 储存液,然后用人BM-MSC培养基稀释为多个工作浓度,分别为 1 000、200、100、20 nmol/L。取100 mm培养皿中培养的第3~5代的细胞,待细胞贴壁生长至80%汇合时(细胞量为3×106~4×106)。用含有不同浓度CM-DiI的培养液(8 mL/100 mm培养皿)培养细胞24 h。用15 mL PBS洗3遍,用基础培养基继续培养。每个标记浓度设置3个复孔,实验重复2次。
1.2.3 CM-DiI 标记的人BM-MSC细胞和293T细胞共培养
分别用1 000、200、100、20 nmol/L浓度的CM-DiI标记人BM-MSC,标记方法同上,标记后传代时,按照1∶1的数量比例,分别将CM-DiI 标记的人BM-MSC细胞和GFP 标记的293T细胞共培养7 d,进行荧光显微镜观察是否有GFP标记的绿色细胞被CM-DiI红色荧光沾染的情况。
1.2.4 CM-DiI标记的人BM-MSC静脉植入脑梗死大鼠
采用远端大脑中动脉梗阻(distal middle cerebral artery occlusion,dMCAO)模型[12]。dMCAO局灶性脑缺血模型的制作:雄性SD大鼠260~280 g,周龄为9~11周,正常进食饮水。5%(体积分数)恩氟烷诱导麻醉,1%~2%恩氟烷维持麻醉。颈部正中切口,分离双侧颈总动脉,穿线待用。动物置左侧卧位,于左耳与左眼间垂直切口,分离颞部肌肉暴露颅骨,高速钻头磨去大部分颞骨,咬骨镊打开骨窗约3 mm×3 mm,暴露脑膜,显微镜下挑开脑膜,开颅暴露大脑中动脉(moddle cerebral artery, MCA);动物再置仰卧位,微血管夹夹闭双侧颈总动脉(common carotid artery,CCA);动物换至左侧卧位,电凝后剪断MCA。缝合颞部肌肉,皮肤。半小时后放开CCA血管夹,即制作成功dMCAO局灶性脑缺血模型。梗死后1 h, 取不同浓度CM-DiI 标记人BM-MSC重悬在1 mL 0.9%(体积分数)氯化钠注射液中,缓慢推入大鼠尾静脉。缺血对照组推入等量不含人BM-MSC的0.9%(体积分数)氯化钠注射液。
1.2.5 抗人类细胞核抗体和BDNF 抗体与脑内CM-DiI标记的人BM-MSC双标染色
大鼠脑梗死模型植入不同浓度CM-DiI 标记的人BM-MSC后3 d,深麻醉后4%(质量分数)多聚甲醛灌注固定取脑。40 μm厚度连续冰冻切片。切片用0.01 mol/L PBS清洗2次,使用含有0.3% (体积分数)Triton X-100的PBS作用30 min,使用封闭液[含有1.5%(体积分数)的山羊血清和1%(质量分数) BSA的0. 01 mol/L PBS]室温孵育1 h,使用含有抗人细胞核抗体或抗BDNF抗体的缓冲液4 ℃孵育过夜。次日,用0.01 mol/L PBS清洗3次,使用含有FITC-荧光标记的二抗(1∶200)的封闭液室温孵育1 h,用0.01 mol/L PBS缓冲液清洗3次。使用浓度为100 ng/mL的 DAPI-PBS溶液做细胞核染色15 min,用0.01 mol/L PBS缓冲液清洗3次,用含有10%(体积分数) 甘油的0.01 mol/L PBS溶液封片[3,13]。
1.3 统计学方法
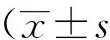
2 结果
2.1 MSC生长和标记
分离的原代人BM-MSC培养3~5 d,可见有梭形、多角形细胞贴壁。去除非贴壁细胞之后,进一步增长成为形态相对均一的梭形细胞, 在培养瓶底部呈现旋涡状。原代培养第10~12 d培养细胞达到80%融合,此时即可进行胰蛋白酶消化并按1∶3传代,之后每3~5 d需要传代1次。不同浓度CM-DiI(1 000、200、100、20 nmol/L)CM-DiI均可成功标记人BM-MSC,24 h后观察标记效率均分别达到99.95%±0.076%,97.67%±2.70%, 88.23%±3.08%, 77.63%±3.11% (图1)。其中100、20 nmol/L浓度的标记效率和1 000 nmol/L浓度相比已经显著降低(t=2.447,P=3.60×10-6;t=2.446,P=2.17×10-6)。200 nmol/L 浓度的标记效率也显著高于100、20 nmol/L(t=2.10,P=1.03×10-5;t=2.18,P=5.22×10-8)。

图1 各浓度CM-DiI 标记人BM-MSC的标记效率Fig.1 The efficiency of CM-DiI labeling human BM-MSC at different concentrations
A、D、G、J: CM-DiI labeled cells;B、E、H、K: phase contrast images of BM-MSC; C、F、I、L:merged images of red fluorescence and phase contrast images; M: labelling efficiency of different CM-DiI concentrations;**P<0.01vs1 000 nmol/L group;##P<0.01vs200 nmol/L group;n=6, scale bar=100 μm;BM-MSC:bone marrow mesenchymal stem cells.
2.2 CM-DiI标记的BM-MSC与GFP-293T细胞共培养
不同浓度CM-DiI(1 000、200、100、20 nmol/L)标记人BM-BMSC和绿色荧光蛋白标记的293T细胞共培养7 d。最高浓度1 000 nmol/L标记的BM-MSC和293T细胞明显发生荧光污染的现象。通过仔细观察发现,在绿色视野中出现的和红色标记的人BM-MSC完全重合的影像(图2 A~D),属于过强的红色荧光绿二色通道间串色(crosstalk)造成。
次高浓度200 nmol/L标记后的BM-MSC,荧光显微镜的视野下BM-MSC细胞没有明显串色效应(图2 E~H),相比1 000 nmol/L CM-DiI标记时接近100% 的串色效应已经明显减轻,可以被较容易地识别开来。另外2个浓度(100,20 nmol/L)的CM-DiI标记的细胞和绿色的293T细胞也没有发现染色交叉污染的现象(图2I~L,2M~P)。

图2 CM-DiI标记的人BM-MSC细胞和绿色荧光蛋白标记的293T细胞共培养Fig.2 Co-culture of CM-DiI labeled human BM-MSC and GFP labeled 293T
A,E,I,M: red florescence of BM-MSC labeled by CM-DiI at different concentrations; B,F,J,N: GFP images in the green channel; C,G,K,O:merged images of GFP and phase contrast; D,H,L,P:merged images of channel red and green; scale bar=100 μm;BM-MSC:bone marrow mesenchymal stem cells; GFP:green fluorescence protein.
2.3 CM-DiI标记的BM-MSC静脉植入后迁移到脑梗死大鼠脑内未造成宿主神经元误染色
从上面实验中可以看出,按照 1 000 nmol/L浓度CM-DiI标记的BM-MSC 红色荧光过强,而100、20 nmol/L 2个浓度不足以完全标记BM-MSC。所以笔者在移植实验中采用了次高浓度,即200 nmol/L CM-DiI 对植入细胞进行标记。经静脉移植后7 d,脑梗死区40 μm厚切片在显微镜下观察,在梗死区域可以看到植入细胞的红色荧光(图3A)。这些红色荧光与神经元特异性抗原NeuN 的免疫荧光染色(图3B)无明显重合(图3C)。CM-DiI 标记的移植细胞和NeuN 标记的宿主神经元都可以和细胞核染色DAPI 很好地重合(图3D)。这一结果说明,植入细胞的红色荧光仍然固定在植入细胞上,至少不会污染宿主的神经元使其携带红色。没有植入细胞的动物只可见到宿主神经元的NeuN染色,未发现明确的红色荧光(图3 E~H)。
2.4 CM-DiI标记的BM-MSC静脉植入后迁移到脑梗死大鼠脑内被抗人核抗体鉴定
为了鉴定静脉植入的人BM-MSC迁移到达脑内后,梗死区的这些CM-DiI红色荧光的确是由植入细胞所携带,笔者对其进行抗人类细胞核特异性抗体的染色,结果可见绿色的抗人核抗体染色与CM-DiI重合良好(图4 A~D);无细胞植入的对照组脑组织经染色则没有红色荧光,也没有抗人核抗体阳性的绿色荧光(图4 E~H)。
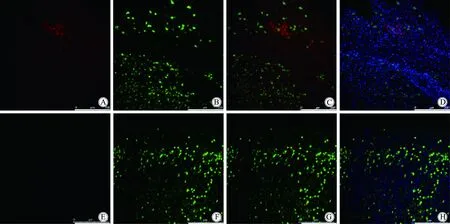
图3 迁移至皮质梗死区的植入细胞携带的CM-DiI荧光与宿主神经元NeuN 免疫染色不重合Fig.3 CM-DiI fluorescence of BM-MSC migrateal into the cerebral infarct area was not overlapped with the NeuN immunostaining of host neuron
A:CM-DiI labeled BM-MSC in the infarct area of cerebral ischemia rat; B: NeuN staining of the same view field. C: merged image of A and B, No double staining of CM-DiI and NeuN were found; D:merged image of DAPI and C; E: without cell transplantation, the red fluorescence of CM-DiI could not be observed; F: NeuN staining in the field of E; G: merged image of E and F;H: merged image of DAPI and G; scale bar=250 μm;BM-MSC:bone marrow mesenchymal stem cells.
A-D:cell transplantation group; E-H:control group without cell transplantation;A,E: red fluorescence was used in identifying CM-DiI labeled BM-MSC in the infarct area of cerebral ischemia rat; B,F: immuno-staining of anti-human nucleus antibody in the same view field of A and E; C,G: merged image of red and green fluorescence; D,H: merged image of red, green and DAPI; scale bar=100μm;BM-MSC:bone marrow mesenchymal stem cells.
2.5 CM-DiI标记的BM-MSC静脉植入后迁移到脑梗死大鼠脑内与BDNF双标记鉴定
为了鉴定静脉植入的人BM-MSC迁移到达脑内后是否可以产生BDNF,笔者对脑切片进行了BDNF抗体免疫荧光染色,镜下观察梗死区和BDNF抗体染色的绿色荧光的双标记情况。结果显示,植入细胞所携带的CM-DiI红色荧光在梗死区域内可见(图5A),BDNF的免疫荧光染色主要存在于梗死周边皮质区,在梗死区也有较多染色阳性细胞存在(图5B)。表达BDNF的细胞中部分带有CM-DiI红色荧光(图5C),说明表达BDNF的细胞既来自于宿主自身,也来自于植入的BM-MSC细胞。这些双标记的细胞可以和DAPI细胞核染色较好地重合(图5D),是具有细胞核结构的细胞。未植入细胞的动物脑内没有红色荧光(图5E),但有BDNF的绿色荧光染色(图5F~G),说明脑梗死后动物脑内有表达BDNF的细胞,这些细胞也具有细胞核结构,表现为DAPI阳性(图5H)。

图5 脑梗死大鼠的脑内CM-DiI标记的人BM-MSC和anti-BDNF双标记鉴定Fig.5 CM-DiI labeled human BM-MSC in the infarct area of ischemia rat brain were identified by anti-BDNF double labeling
A-D:cell transplantation group; E-H:control group without cell transplantation; A,E: Red fluorescence was used in identifying CM-DiI labeled BM-MSC in the infarct area of cerebral ischemia rat; B,F: immuno-staining of anti-BDNF antibody in the same view field of A and E; C,G: merged image of red and green fluorescence; D,H: merged image of red,green and DAPI; scale bar=75μm;BM-MSC:bone marrow mesenchymal stem cells; BDNF:brain derived neurotrophic factor.
3 讨论
目前认为细胞移植治疗脑梗死产生疗效的机制主要有3点:①植入细胞分化成为神经细胞。以MSC为例,植入的MSC大多数会在肺部、脾脏滞留,而且植入细胞的信号迅速减弱,通常在移植后1周消失,根据这些实验证据可以推断,植入的细胞大量分化成为神经元的可能性很小[14];②MSC减弱炎性反应的作用[15-16]; ③植入细胞产生多种营养性的细胞因子,可以保护神经细胞,促进血管新生等[2-3]。
植入的细胞可以产生大鼠来源的细胞因子,也可以诱导宿主产生大鼠源性的细胞因子。目前的研究[3]结果更多地倾向于认为是植入细胞刺激大鼠产生的营养性细胞因子在发挥减轻梗死后脑组织损伤的作用。Karlupia等[3]将5×106个人类脐带来源的MSC细胞或者单个核细胞经动脉植入大鼠,没有检测到明显的人类来源的细胞因子;但也有研究[17]明确表明,经血管植入的MSC细胞可以迁移到脑内,主要集中在梗死周边区(infarct boundary zone, IBZ),也有一部分可以进入梗死区,而且进入脑内的MSC数量和疗效有明确的正相关[2,18]。可见,进入脑内的MSC如何发挥在脑梗死中的治疗作用还没有明确的结论,为了研究这个问题,对移植细胞进行标记就非常重要。对移植细胞的标记多采用病毒将GFP基因转入MSC的方法,这种方法比较费时费力,另外转染效率通常不能达到90%以上;最大的问题是GFP荧光在细胞分化后常常丢失。
生物染料一直是常用的细胞标记试剂。对于标记后的细胞是否会泄露出这些生物染料并造成周围细胞,特别是在体的宿主细胞的污染,一直是一个必须慎重考虑的问题。本实验显示,按照200 nmol/L浓度CM-DiI标记的人BM-MSC,可以达到接近100%的标记效率;无论和其他细胞共培养还是移植入动物体内,标记细胞都没有造成对未标记细胞的明确污染。这就说明,这种标记方式基本可以满足观察植入细胞的迁移的要求。
出乎预料的是当CM-DiI浓度较高的时候(1 000 nmol/L),会造成被标记的人BM-MSC 红色荧光较强,这就会造成在荧光显微镜下和绿色通道串色的现象。通过降低标记浓度可以较好地解决这一问题。最终和BDNF的双标记实验显示,移植细胞携带的CM-DiI可以和BDNF免疫染色双标,由此证实, CM-DiI不仅可以高效标记人BM-MSC, 还适用于鉴定产生细胞因子的干细胞。
笔者发现在脑内梗死区域中表达的BDNF的细胞,部分被 CM-DiI 标记,换言之就是来自于移植细胞。这就说明在脑梗死后3 d,和宿主细胞产生营养因子相比,移植细胞产生营养因子BDNF在脑梗死恢复中的作用也是比较重要的。
本文的主旨是确定CM-DiI适用于鉴定人BM-MSC移植后产生BDNF,以及找到适宜的CM-Dil工作浓度,倾向于定性而非具体定量。本实验发现部分带有CM-DiI红色荧光的细胞同时产生BDNF,说明表达BDNF的细胞既来自于宿主自身,也来自于植入的人BM-MSC细胞。下一个问题是,脑内BDNF有多少由植入细胞产生,有多少由宿主自身产生。这是个非常重要的问题,本课题组将在今后的工作中逐步回答。
被标记的细胞分裂增生后以及分化后是否还可以有效地被观察到依然没有定论,这也是今后的工作将要回答的问题。
[1] Takahashi M, Li T S, Suzuki R, et al. Cytokines produced by bone marrow cells can contribute to functional improvement of the infarcted heart by protecting cardiomyocytes from ischemic injury[J]. Am J Physiol Heart Circ Physiol, 2006, 291(2): H886-H893.
[2] Yavagal D R, Lin B, Raval AP, et al. Efficacy and dose-dependent safety of intra-arterial delivery of mesenchymal stem cells in a rodent stroke model[J]. PLoS One, 2014, 9: e93735.
[3] Karlupia N, Manley N C, Prasad K, et al. Intraarterial transplantation of human umbilical cord blood mononuclear cells is more efficacious and safer compared with umbilical cord mesenchymal stromal cells in a rodent stroke model[J]. Stem Cell Res Ther, 2014, 5(2): 45.
[4] Bake S, Selvamani A, Cherry J, et al. Blood brain barrier and neuroinflammation are critical targets of igf-1-mediated neuroprotection in stroke for middle-aged female rats[J]. PloS One, 2014, 9(3): e91427.
[5] Lanfranconi S, Locatelli F, Corti S, et al. Growth factors in ischemic stroke[J]. J Cell Mol Med, 2011, 15(8): 1645-1687.
[6] Kurozumi K, Nakamura K, Tamiya T, et al. Mesenchymal stem cells that produce neurotrophic factors reduce ischemic damage in the rat middle cerebral artery occlusion model[J]. Mol Ther, 2005, 11(1): 96-104.
[7] Kurozumi K, Nakamura K, Tamiya T, et al. Bdnf gene-modified mesenchymal stem cells promote functional recovery and reduce infarct size in the rat middle cerebral artery occlusion model[J]. Mol Ther, 2004, 9(2): 189-197.
[8] Wang J, Yang Z, Liu C, et al. Activated microglia provide a neuroprotective role by balancing glial cell-line derived neurotrophic factor and tumor necrosis factor-alpha secretion after subacute cerebral ischemia[J]. Int J Mol Med, 2013, 31(1): 172-178.
[9] Shen L H, Li Y, Chopp M. Astrocytic endogenous glial cell derived neurotrophic factor production is enhanced by bone marrow stromal cell transplantation in the ischemic boundary zone after stroke in adult rats[J]. Glia, 2010, 58(9): 1074-1081.
[10]Singleton C D, Casagrande V A. A reliable and sensitive method for fluorescent photoconversion[J]. J Neurosci Methods, 1996, 64(1): 47-54.
[11]Capitelli C S, Lopes C S, Alves A C, et al. Opposite effects of bone marrow-derived cells transplantation in mptp-rat model of parkinson’s disease: a comparison study of mononuclear and mesenchymal stem cells[J]. Int J Med Sci, 2014, 11(10): 1049-1064.
[12]Bernaudin M, Marti H H, Roussel S, et al. A potential role for erythropoietin in focal permanent cerebral ischemia in mice[J]. J Cereb Bood Flow Metab, 1999, 19(6): 643-651.
[13]Chen Z, Phillips L K, Gould E, et al. Mhc mismatch inhibits neurogenesis and neuron maturation in stem cell allografts[J]. PloS one, 2011, 6(3): e14787.
[14]Harting M T, Jimenez F, Xue H, et al. Intravenous mesenchymal stem cell therapy for traumatic brain injury[J]. Neurosurg, 2009, 110(6): 1189-1197.
[15]Bliss T M, Andres R H, Steinberg G K. Optimizing the success of cell transplantation therapy for stroke[J]. Neurobiol Dis, 2010, 37(2): 275-283.
[16]涂雪松. 干细胞移植治疗缺血性脑血管病实验研究进展[J]. 中国脑血管病杂志, 2014, 11(8): 440-445.
[17]Tyndall A, Gratwohl A. Adult stem cell transplantation in autoimmune disease[J]. Curr Opin Hematol, 2009, 16(4): 285-291.
[18]Toyoshima A, Yasuhara T, Kameda M, et al. Intra-arterial transplantation of allogeneic mesenchymal stem cells mounts neuroprotective effects in a transient ischemic stroke model in rats: analyses of therapeutic time window and its mechanisms[J]. PloS One, 2015, 10(6): e0127302.
编辑 孙超渊
CM-DiI labeling human bone marrow mesenchymal stem cells and was used in identifying BNDF expressing cell after transplantation
Zhao Chunsong1,2, Zou Haiqiang3, Li Xiaobo4, Yan Xiaoming5, Guan Yunqian1,2*, Zhang Yu1,2
(1.DepartmentofCellBiology,XuanwuHospital,CapitalMedicalUniversity,Beijing100053,China; 2.KeyLaboratoryofNeurodegeneration,MinistryofEducation,Beijing100053,China; 3.DepartmentofNeurology,TheGeneralHospitalofGuangzhouMilitaryCommandinGuangzhou,Guangzhou510010,China; 4.DepartmentofNeurosurgery,NorthernJiangsuPeople’sHospital,Yangzhou225001,JiangsuProvince,China; 5.DepartmentofFunctionNeurosurgery,XuanwuHospital,CapitalMedicalUniversity,Beijing100053,China)
Objective To observe whether the CM-DiI carried by human bone marrow mesenchymal stem cells (BM-MSC) after labeling will contaminate the surrounding cells in vitro and in vivo and be used in identifing brain derived neurotrophic factor (BDNF) production. Methods The human bone marrow derived mesenchymal stem cells were labeled by CM-DiI at different concentrations and the labeling percentages were observed. The CM-DiI labeled human BM-MSCs were co-cultured with green fluorescence protein (GFP) labeled 293T cell for 7 days. Then the contamination of 293T cells by CM-DiI was observed. The cerebral ischemia rat model
CM-DiI labeled human BM-MSCs intravenously transplantation, the overlapping of red fluorescence with host neurons and brain derived neurotrophic factor BDNF in the host brain were observed. Results The human BM-MSCs could be successfully labeled by CM-DiI at 1 000, 200,100, and 20 nmol/L. The concentrations of 1 000 and 200 nmol/L reached more than 98% labeling percentages which were significantly higher than that labeled by 100 and 20 nmol/L(P<0.01). After 7 days co-culture of GFP labeled 293T cells, the CM-DiI labeled human BM-MSCs didn’t contaminate the 293T cells. Three days after transplantation, the CM-DiI labeled human BM-MSCs migrated into the infarct area of brain ischemia rats, but didn’t bring any red fluorescence into the host cells. CM-DiI labeled human BM-MSCs could be double labeled by BDNF. Conclusion CM-DiI could label human BM-MSCs effectively. The 200 nmol/L CM-DiI labeled human BM-MSCs will not contaminate the surrounding cells both in vitro and in vivo. The CM-DiI (200 nmol/L) labeling can be used in identifying transplanted BM-MSCs which are expressing BDNF.
mesenchymal stem cells;CM-DiI; transplantation;cerebral infarct; brain derived neurotrophic factor
国家自然科学基金(81371377),北京市科委健康培育项目(Z111107067311033),北京市科技新星项目(2009B22)。This study was supported by National Natural Science foundation of China (81371377), Beijing Municipal Science and Technology Commission (Z111107067311033),Beijing Nova Program of Science and Technology (2009B22).
时间:2017-06-09 17∶26 网络出版地址:http://kns.cnki.net/kcms/detail/11.3662.r.20170609.1726.018.html
10.3969/j.issn.1006-7795.2017.03.019]
Q2
2016-10-17)
*Corresponding author, E-mail:guanyunqian@aliyun.com

