IL-33活性调节及在疾病中的调控作用
刘善辉,张世超,吉尚戎
(兰州大学 生命科学学院, 兰州 730000)
IL-33活性调节及在疾病中的调控作用
刘善辉,张世超,吉尚戎
(兰州大学 生命科学学院, 兰州 730000)
IL-33是近期发现的IL-1家族新成员,与传统的细胞因子有所不同,其N端结构域具有核定位信号,具有转录调节活性。IL-33可通过IL-33/ST2L信号途径促进2型免疫反应参与心血管疾病、阿尔茨海默症、癌症、肥胖等多种重大疾病的调节。综述近年IL-33研究进展,阐释不同剪切形式和二硫键分子“开关”对IL-33活性的影响,介绍IL-33/ST2L在一些重大疾病中的调控作用,为后续IL-33在疾病诊断治疗中的应用提供参考。
IL-1家族;IL-33/ST2L信号;2型免疫反应;二硫键
白细胞介素是一类介导白细胞同其他细胞间相互作用的细胞因子[1],具有活化机体免疫细胞而促进机体抵抗外界病原菌入侵、消除自身免疫抗原等作用。IL-33是2005年发现的IL-1家族最新成员(IL-1F11),在内皮细胞中高表达[2-3]。通常IL-33表达并储存于细胞核内,当细胞受到损伤或坏死时,可作为预警素被大量释放至胞外。释放到胞外后IL-33的活性受到多种因素的调节,如IL-33可以被Caspase-3/7、cathepsin G、elastase等酶剪切[4-8],不同的剪切形式可以导致IL-33活性丧失或增强;近期发现IL-33分子内的二硫键也可作为“分子开关”调节其活性[9]。IL-33可通过IL-33/ST2信号途径诱导Th2细胞分化[3, 10],还可通过活化调节性T细胞、巨噬细胞、固有淋巴样型细胞(ILC2s)[11]等免疫细胞发挥调节作用,促进2型细胞因子产生。IL-33通过活化免疫细胞产生2型免疫应答对多种疾病有重要的调节作用,主要可以分为3类:自身免疫疾病、过敏性反应疾病和心血管疾病。近期发现IL-33可缓解阿尔茨海默病(Alzheimer’s disease,AD)。本文将重点介绍IL-33的结构特点和作用机理,为后续IL-33在疾病的诊断治疗中的开发应用提供参考。
1 IL-33结构
IL-33是IL-1家族第11号新成员(IL-1F11)。人源IL-33定位于9号染色体(9p24.1),包含的7个外显子编码270个氨基酸多肽,1~3号外显子编码N端核定位结构域,4~7号外显子编码C端细胞因子结构域。C端细胞因子结构域折叠成由12个β链组成IL-1家族蛋白典型的β-三叶草结构[12-13]。IL-33 C端具有典型的细胞因子活性(细胞因子结构域),即IL-33的C端结构域能与IL-33受体ST2结合。通过对IL-33 N端截短突变体研究,发现N端40~58位氨基酸为染色质结合基序(chromatin-binding motif,CBM)(图1),其中的M45、L47、R48、 S49、 G50和I53是结合的重要位点。对比人、小鼠、狗的IL-33序列发现,M45、L47、R48、S49、G50高度保守[14]。CBM可通过识别H2A-H2B酸性口袋从而结合染色质并调节染色质固缩[10]。IL-33的CBM是否能同IL-1家族其他成员一样,结合到某些靶基因上[15],调节靶基因转录,尚未见报道。
2 IL-33活性影响因素
2.1 酶切对IL-33活性的影响
当细胞受损或坏死时,IL-33可以作为预警素被大量释放。通常认为IL-33同IL-1家族成员IL-1β、IL-18类似,需要caspase-1的剪切加工成熟[8]。点突变(D178A)IL-33发现,caspase-1剪切IL-33的位点位于IL-1样结构域的ASP178位置。对应的酶切产物IL-331-178与 IL-33179-270丧失活化ST2下游信号的能力,而未经剪切的IL-331-270具有激活ST2下游信号的活性[16],除了caspase1外,caspase-3、caspase-7也能在ASP178位置剪切IL-33(图1)[4]。此外,中性粒细胞产生的弹性蛋白酶(Elastase)和组织蛋白酶G(cathepsin G)也可参与IL-33活性的调节。cathepsin G 可在F94、L108处酶解IL-33,Elastase可在 I98处酶解IL-33。3种酶切产物IL-3395-270、IL-33109-270和IL-3399-270相比于IL-331-270活性增强10倍左右[7]。此外,中性粒细胞表达的PR3(Neutrophil proteinase 3)也可酶切IL-33,酶切产物IL-33117-270拥有很强促炎活性,刺激HMC-1、Raw264.7细胞后将促进IL-8、TNF-α、IL-6等大量产生[6]。
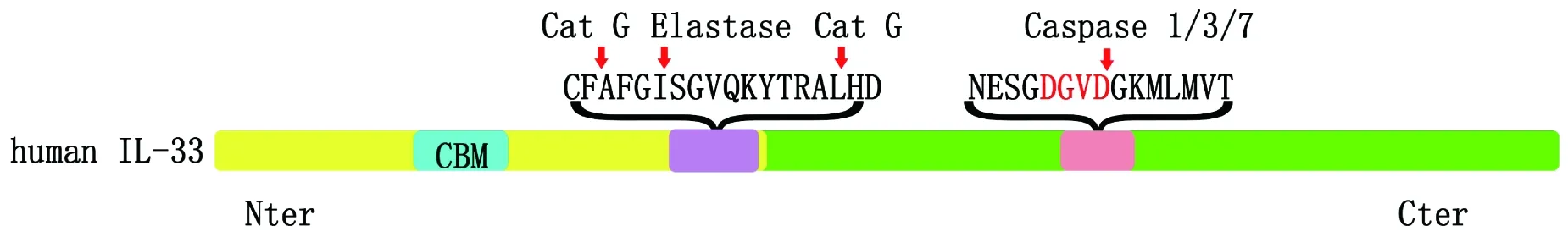
图1 1L-33结构及不同形式剪切
2.2 二硫键“分子开关”对IL-33活性影响
二硫键的形成与否对蛋白质的结构稳定性、功能活性具有重要影响[17]。二硫键对IL-33活性同样有重要调节作用。IL-33分子中含有4个半胱氨酸(C208、C227、C232、C259),4个半胱氨酸可以形成两个分子内二硫键(C208-C259、C227-C232)。近期研究发现,当IL-33的两个二硫键形成时,IL-33同ST2L结合位点处的构象发生变化,将导致IL-33丧失同其受体ST2L的结合能力。即氧化还原驱动IL-33二硫键的形成可以作为一个分子开关,通过调节其与配体ST2L的结合,以精确调控其活性[9]。
3 IL-33/ST2L信号途径
ST2属于IL-1R超家族成员,其基因通过可变剪切产生多种产物,目前研究较多的是分泌型sST2蛋白和跨膜型ST2L蛋白这两种蛋白[18]。相对于ST2L,sST2缺乏跨膜区和胞内结构域。炎症条件下,sST2血清浓度升高,并参与炎症应答调控,故sST2也被作为心力衰竭(congestive heart failure,HF)、心血管死亡(cardiovascular mortality)等的风险指标。IL-33作用于ST2L,首先IL-33同细胞表面的ST2L结合,随后IL-33/ST2L二聚物招募IL-1RacP,IL-1RacP结合到该二聚物后可稳定IL-33/ST2L的结合[19]。该复合物的形成将招募MyD88、IRAK1、IRAK4、TRAF6等信号分子,最终通过活化NF-κB和MAPK信号通路促进炎症相关因子转录表达[20];而sST2分子也可与IL-33结合,通过捕获游离的IL-33,抑制IL-33/ST2L信号通路[21](图2)。
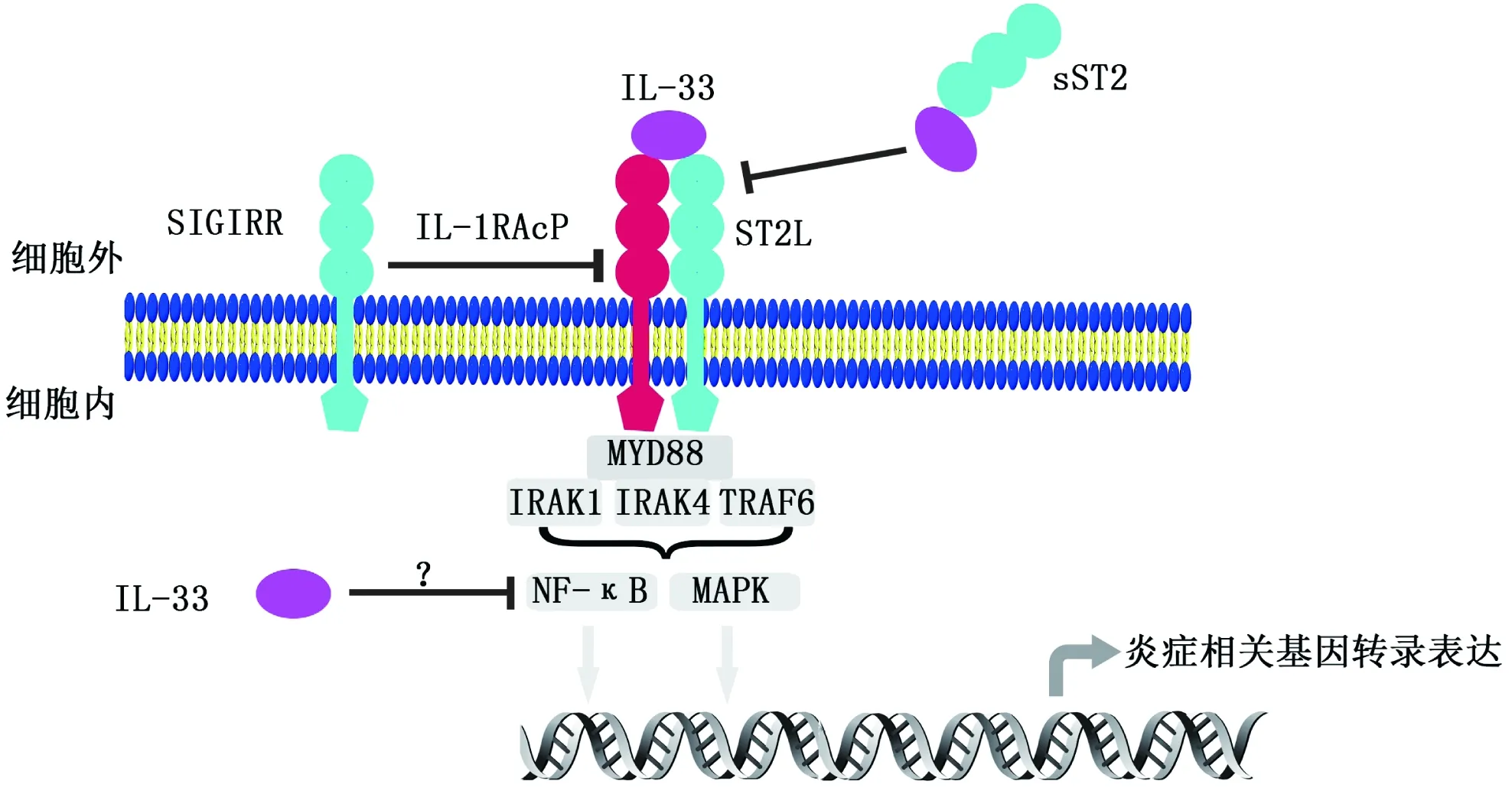
图2 1L-33/ST2L信号途径
4 IL-33可通过IL-33/ST2L信号途径调控多种疾病
过去大量研究阐明了IL-33可通过IL-33/ST2L信号途径影响体内先天、后天免疫细胞(图3)[11, 22-24],促进机体2型炎症反应的发生和发展,进而导致多种疾病。本文将重点介绍近些年IL-33通过IL-33/ST2L信号途径调节2型细胞因子表达,并进一步调节动脉粥样硬化、肥胖、类风湿性关节炎等疾病的研究进展,同时介绍IL-33在阿尔茨海默病的发生中的作用。
4.1 IL-33同动脉粥样硬化
动脉血管壁的慢性炎症反应被认为在动脉粥样硬化斑的形成中起到关键性的作用[25-26]。除内皮细胞、平滑肌细胞外,动脉血管壁还被巨噬细胞、T/B淋巴细胞、DC细胞和中性白细胞等免疫细胞浸润。细胞免疫、体液免疫及机体非特异性免疫反应均参与动脉粥样硬化的调控[20, 27]。
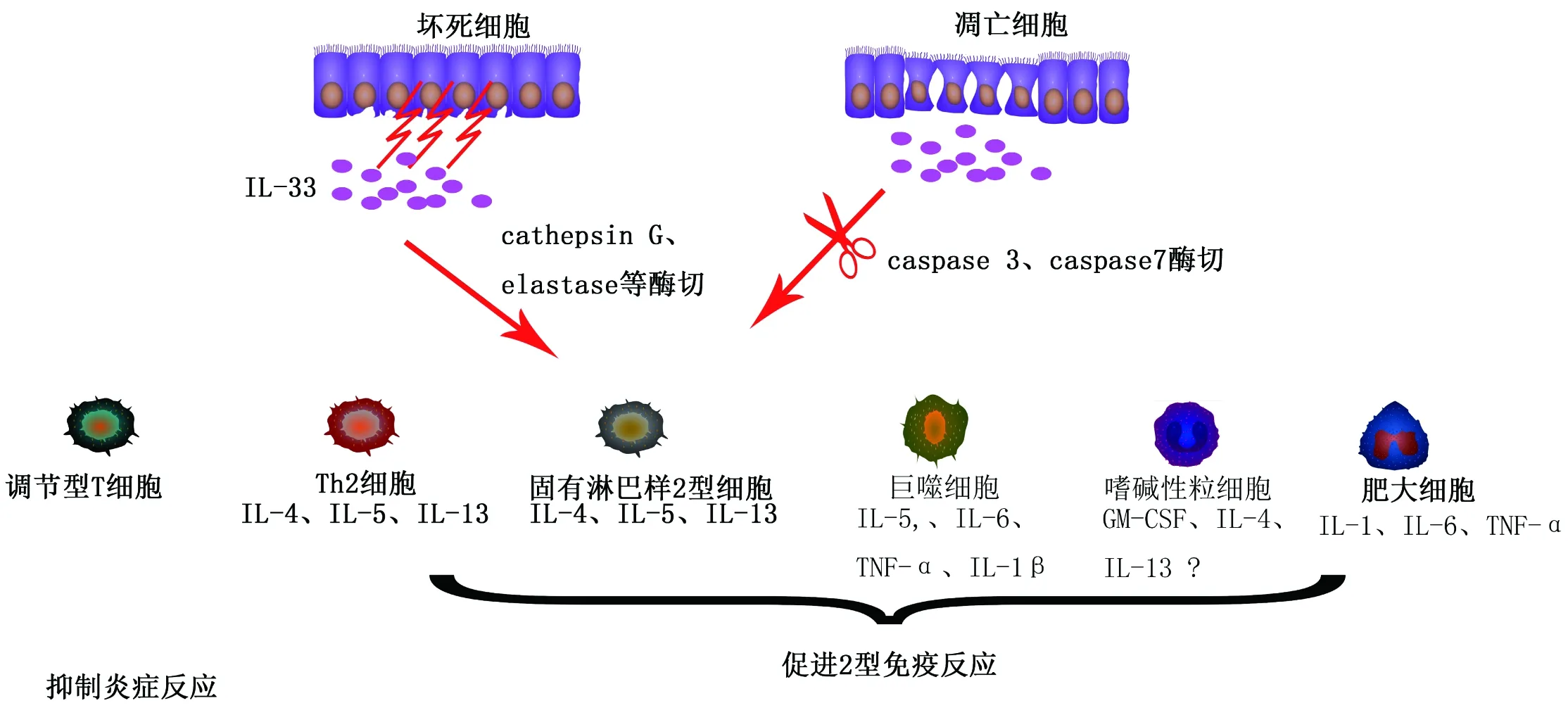
图3 1L-33可活化多种免疫细胞调控2型免疫反应
IL-33可通过IL-33/ST2L信号途径抑制动脉粥样硬化的发展。对动脉粥样硬化模型ApoE-/-小鼠连续6周腹腔注射IL-33,小鼠主动脉窦处的动脉粥样硬化斑明显减小。该模型中,IL-33促进Th1/Th2平衡向后者偏移;且动脉粥样硬化斑块处的F4/80+巨噬细胞和CD3+T细胞明显减少,小鼠体内的oxLDL抗体IgM表达水平升高[28]。小鼠腹腔注射IL-33受体sST2发现,IL-33抑制动脉粥样硬化的作用受到抑制,暗示sST2可通过抑制IL-33/ST2信号通路抑制IL-33在动脉粥样硬化疾病中的作用(图2)[29]。
此外,IL-33还可影响巨噬细胞形成泡沫细胞而抑制动脉粥样硬化的发展[4]。IL-33可降低泡沫细胞对乙酰低密度脂蛋白和ox-LDL的摄取,并增加胆固醇外流。近期的研究表明ILC2细胞在IL-33的刺激下(图3),通过分泌IL-4、IL-9和IL-13,促进嗜酸性粒细胞、巨噬细胞活化,从而抑制动脉粥样硬化发展[30]。
4.2 IL-33同肥胖
脂肪组织可分为白色脂肪组织和褐色脂肪组织[30]。白色脂肪组织是能量贮存场所;褐色脂肪组织为脂肪分解消耗场所,褐色脂肪细胞可通过线粒体解偶联蛋白1(UCP-1)促进脂肪燃烧产生热量及能量。除此外,另外的一种中间态脂肪细胞米色脂肪细胞也能表达UCP-1蛋白,促进脂肪分解。
肥胖表现为白色脂肪组织处的脂肪细胞脂肪含量增加,脂肪细胞体积增大。并伴随着较低水平的炎症反应。IL-33可以通过IL-33/ST2信号通路调节ILC2和Treg分化(图3),进而调控白色脂肪组织代谢,此代谢过程发生紊乱时,将发展为慢性炎症,最终导致肥胖、胰岛素耐受等。近期研究显示, Rnase ω1能诱导肥胖患者的脂肪细胞释放IL-33,除此之外,脂肪组织内皮细胞也表达大量的IL-33,释放出的IL-33通过识别受体ST2在脂肪组织处诱导2型免疫反应,即IL-33活化ILC2,活化后的ILC2分泌甲硫氨酸脑啡肽诱导脂肪细胞产生Ucp1,促进米色脂肪向褐色脂肪分化[31]。
4.3 IL-33同关节炎
类风湿性关节炎(Rheumatoid arthritis,RA)是一种常见的慢性自身免疫疾病。主要表现为关节滑膜处持续的炎症反应。即关节滑液中渗出的炎症细胞释放的炎症性细胞因子和蛋白酶侵蚀关节组织,造成关节滑膜增生、骨和软骨破坏。在RA病人关节滑膜组织、成纤维母细胞以及CIA模型小鼠的关节中能检测到IL-33大量存在。这些大量表达的IL-33可以通过IL-33/ST2信号通路活化肥大细胞(图3),促进肥大细胞分泌炎症性细胞因子IL-6、IL-1、TNF-α。这些炎症因子又可通过Th17等放大炎症效应。对CIA小鼠注射IL-33,可加剧小鼠的病情[32],而当沉默IL-33或使用IL-33受体ST2的中和抗体阻断IL-33/ST2信号通路时,都能抑制病情的发展[33]。对CIA模型小鼠短期注射sST2-Fc融合蛋白即能抑制炎症因子IFN-gamma、TNF-α、IL-6、IL-12等的表达,逆转病情[34]。因此在RA中,IL-33被作为一个潜在的药物靶标[34-36]。
4.4 IL-33参与调控阿尔茨海默病
阿尔茨海默病(Alzheimer’s disease,AD)是一种慢性神经退行性疾病,患者主要表现为记忆能力降低,认知能力减弱,AD的具体发病机理尚不清楚,目前尚无有效治疗手段。越来越多的证据暗示IL-33也参与了AD的调控。首先,在AD病人的脑内IL-33表达降低。IL-33转染人成神经母细胞瘤(SY5Y-APP695WT)后,Aβ1-40分泌量下降30%[37];其次,MCI(Mild cognitive impairment)病人血液中sST2含量显著高于正常人群,这些结果暗示IL-33参与AD的调控,目前的研究结果显示IL-33可能通过两条途径作用于AD。不依赖于IL-33/ST2信号途径的调控[37];依赖于IL-33/ST2信号途径的调控[38]。进一步研究发现,IL-33可通过动员神经胶质细胞(CD11b+CD45hi)吞噬并清除Aβ,减少淀粉样蛋白斑块;还可诱导脑啡肽酶表达,促进可溶性Aβ降解[38]。
5 展望
正常情况下,机体IL-33作为“预警素”被大量储存于细胞内,当细胞凋亡或坏死时才被大量释放出体外。IL-33具有转录调节活性和细胞因子活性,自发现以来,大量研究仍旧停留于IL-33的C端细胞因子活性上。即IL-33可通过IL-33/ST2L信号途径募集MyD88、IRAK1、IRAK4、TRAF6等信号分子,活化NF-κB和MAPK(图2),促进炎症相关基因应答,目前这条途径研究较为清楚。而IL-33 N端具有转录调节活性,其是否参与某些靶基因的表达调控[33]?这些靶基因在炎症相关疾病中扮演什么角色?还有待进一步研究。凋亡细胞、粒细胞等产生的Caspase-1/3/7、Elastase、Cathepsin G等酶对IL-33剪切(图1),使其与ST2L结合能力丧失或增强。这种作用避免了机体因为自身细胞正常凋亡引起过度的免疫反应,也促进了机体在炎症状态下炎症反应的放大,有利于机体对外来抗原等的清除,体现了机体在不同逆境条件下的一种自我保护机制。IL-33受体ST2表达于多种免疫相关细胞表面(图3),因此IL-33在自身免疫炎症、代谢相关疾病中都可通过“免疫开关”的作用诱导2型细胞因子表达,调节疾病的发生与发展。IL-33的这种作用,对于治疗由于免疫失衡引起的疾病指明了一个新的方向;此外,新发现IL-33在治疗AD中的作用,为AD研究与治疗提供了新的方向。
[1]BROCKER C, THOMPSON D, MATSUMOTO A, et al. Evolutionary divergence and functions of the human interleukin (IL) gene family [J]. Human Genomics, 2010, 5(1): 30-55.
[2]BAEKKEVOLD E S, ROUSSIGNE M, YAMANAKA T, et al. Molecular characterization of NF-HEV, a nuclear factor preferentially expressed in human high endothelial venules [J]. The American Journal of Pathology, 2003, 163(1): 69-79.
[3]SCHMITZ J, OWYANG A, OLDHAM E, et al. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines [J]. Immunity, 2005, 23(5): 479-490.
[4]LUTHI A U, CULLEN S P, MCNEELA E A, et al. Suppression of interleukin-33 bioactivity through proteolysis by apoptotic caspases [J]. Immunity, 2009, 31(1): 84-98.
[5]TALABOT-AYER D, LAMACCHIA C, GABAY C, et al. Interleukin-33 is biologically active independently of caspase-1 cleavage [J]. The Journal of Biological Chemistry, 2009, 284(29): 19420-19426.
[6]BAE S, KANG T, HONG J, et al. Contradictory functions (activation/termination) of neutrophil proteinase 3 enzyme (PR3) in interleukin-33 biological activity [J]. The Journal of Biological Chemistry, 2012, 287(11): 8205-8213.
[7]LEFRANCAIS E, ROGA S, GAUTIER V, et al. IL-33 is processed into mature bioactive forms by neutrophil elastase and cathepsin G [J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(5): 1673-1678.
[8]AFONINA I S, MÜLLER C, MARTIN S J, et al. Proteolytic processing of interleukin-1 family cytokines: variations on a common theme [J]. Immunity, 2015, 42(6): 991-1004.
[9]COHEN E S, SCOTT I C, MAJITHIYA J B, et al. Oxidation of the alarmin IL-33 regulates ST2-dependent inflammation [J]. Nature Communications, 2015, 6:8327.
[10]ZHU J, WANG Y, YANG F, et al. IL-33 alleviates DSS-induced chronic colitis in C57BL/6 mice colon lamina propria by suppressing Th17 cell response as well as Th1 cell response [J]. International Immunopharmacology, 2015, 29(2): 846-853.
[11]LU J, KANG J, ZHANG C, et al. The role of IL-33/ST2L signals in the immune cells [J]. Immunology Letters, 2015, 164(1): 11-17.
[12]LIU X, HAMMEL M, HE Y, et al. Structural insights into the interaction of IL-33 with its receptors [J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(37): 14918-14923.
[13]LINGEL A, WEISS T M, NIEBUHR M, et al. Structure of IL-33 and its interaction with the ST2 and IL-1RAcP receptors-insight into heterotrimeric IL-1 signaling complexes [J]. Structure, 2009, 17(10): 1398-1410.
[14]ROUSSEL L, ERARD M, CAYROL C, et al. Molecular mimicry between IL-33 and KSHV for attachment to chromatin through the H2A-H2B acidic pocket [J]. EMBO Reports, 2008, 9(10): 1006-1012.
[15]HU B, WANG S, ZHANG Y, et al. A nuclear target for interleukin-1alpha: interaction with the growth suppressor necdin modulates proliferation and collagen expression [J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(17): 10008-10013.
[16]CAYROL C, GIRARD J P. The IL-1-like cytokine IL-33 is inactivated after maturation by caspase-1 [J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(22): 9021-9026.
[17]PATIL N A, TAILHADES J, HUGHES R A, et al. Cellular disulfide bond formation in bioactive peptides and proteins [J]. International Journal of Molecular Sciences, 2015, 16(1): 1791-1805.
[18]PASCUAL-FIGAL D A, JANUZZI J L. The biology of ST2: the international ST2 consensus panel [J]. The American Journal of Cardiology, 2015, 115(7, Suppl): 3B-7B.
[19]CHACKERIAN A A, OLDHAM E R, MURPHY E E, et al. IL-1 receptor accessory protein and ST2 comprise the IL-33 receptor complex [J]. Journal of Immunology, 2007, 179(4): 2551-2555.
[20]GAO Q, LI Y, LI M. The potential role of IL-33/ST2 signaling in fibrotic diseases [J]. Journal of Leukocyte Biology, 2015, 98(1): 15-22.
[21]MUELLER T, JAFFE A S. Soluble ST2-analytical considerations [J]. The American Journal of Cardiology, 2015, 115(7 Suppl): 8B-21B.
[22]LUNDERIUS-ANDERSSON C, ENOKSSON M, NILSSON G. Mast cells respond to cell injury through the recognition of IL-33 [J]. Frontiers in Immunology, 2012, 3:82.
[23]SCHIERING C, KRAUSGRUBER T, CHOMKA A, et al. The alarmin IL-33 promotes regulatory T-cell function in the intestine [J]. Nature, 2014, 513(7519): 564-568.
[24]AHMED A, KOMA M K. Interleukin-33 triggers B1 cell expansion and its release of monocyte/macrophage chemoattractants and growth factors [J]. Scandinavian Journal of Immunology, 2015, 82(2): 118-124.
[25]ROSS R. The pathogenesis of atherosclerosis-an update [J]. The New England Journal of Medicine, 1986, 314(8): 488-500.
[26]ROSS R. Atherosclerosis-an inflammatory disease [J]. The New England Journal of Medicine, 1999, 340(2): 115-126.
[27]HANSSON G K, LIBBY P. The immune response in atherosclerosis: a double-edged sword [J]. Nature Reviews Immunology, 2006, 6(7): 508-519.
[28]KUNES P, MANDAK J, HOLUBCOVA Z, et al. Actual position of interleukin(IL)-33 in atherosclerosis and heart failure: Great Expectations or En attendant Godot? [J]. Perfusion, 2015, 30(5): 356-374.
[29]DIEPLINGER B, MUELLER T. Soluble ST2 in heart failure [J]. Clinica Chimica Acta, International Journal of Clinical Chemistry, 2015, 443:57-70.
[30]CHALUBINSKI M, LUCZAK E, WOJDAN K, et al. Innate lymphoid cells type 2-emerging immune regulators of obesity and atherosclerosis [J]. Immunology letters, 2016, 179:43-46.
[31]DUNNE A, O′NEILL L A. The interleukin-1 receptor/Toll-like receptor superfamily: signal transduction during inflammation and host defense [J]. Science′s STKE : signal transduction knowledge environment, 2003, 2003(171): re3.
[32]MACEDO R B, KAKEHASI A M, ANDRADE M V. IL33 in rheumatoid arthritis: potencial contribution to pathogenesis [J]. Revista Brasileira de Reumatologia, 2016, 56(5):451-471.
[33]LEE E J, SO M W, HONG S, et al. Interleukin-33 acts as a transcriptional repressor and extracellular cytokine in fibroblast-like synoviocytes in patients with rheumatoid arthritis [J]. Cytokine, 2016, 77:35-43.
[34]ROGALA B, GLÜCK J. The role of interleukin-33 in rhinitis [J]. Current Allergy and Asthma Reports, 2013, 13(2): 196-202.
[35]THEOHARIDES T C, PETRA A I, TARACANOVA A, et al. Targeting IL-33 in autoimmunity and inflammation [J]. The Journal of Pharmacology and Experimental Therapeutics, 2015, 354(1): 24-31.
[36]XU W D, ZHANG M, ZHANG Y J, et al. IL-33 in rheumatoid arthritis: potential role in pathogenesis and therapy [J]. Human Immunology, 2013, 74(9): 1057-1060.
[37]CHAPUIS J, HOT D, HANSMANNEL F, et al. Transcriptomic and genetic studies identify IL-33 as a candidate gene for Alzheimer′s disease [J]. Molecular Psychiatry, 2009, 14(11): 1004-1016.
[38]FU A K, HUNG K W, YUEN M Y, et al. IL-33 ameliorates Alzheimer′s disease-like pathology and cognitive decline [J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(19): E2705-E2713.
IL-33:activation, regulation and function
LIU Shan-hui, ZHANG Shi-chao, JI Shang-rong
(School of Life Sciences, Lanzhou University, Lanzhou 730000, China)
IL-33, a novel member of the IL-1 family, mediates its biological effects via the ST2 receptor (also known as IL-1RL1), and initiates a type 2 immune response during cardiovascular disease, Alzheimer′s disease, cancer and obesity. IL-33 is a dual-function protein that act both as a cytokine and as an intracellular nuclear factor. Here, we review the recent advances on how IL-33 activity is regulated by proteolysis and oxidation-driven conformational change of two disulphide bonds formation, and the newly discovered roles of IL-33 in atherosclerosis, obesity, rheumatoid arthritis, and Alzheimer′s disease. IL-33 mobilizes innate immunity and acquires immunity to initiate type-2 immune response by the IL-33/ST2L pathway. Therapeutic strategy targeting IL-33 may be an effective strategy to ameliorate these diseases.
IL-1 family; IL-33/ST2L signal; type 2 immune response; two disulphide bonds
2016-09-04;
2016-09-29
中央高校基本科研业务费专项资金(lzujbky-2016-k11)
刘善辉,博士研究生, 研究方向为蛋白质结构功能与自身免疫疾病,E-mail: liushh2014@lzu.edu.cn;张世超,博士研究生,研究方向为蛋白质的功能及表达调控,E-mail:zhangshch08@lzu.edu.cn
吉尚戎,教授,博士,研究方向为蛋白质结构功能及重要蛋白质参与慢性炎症疾病调控的分子机制,E-mail: jsr@lzu.edu.cn
R392
A
2095-1736(2017)03-0078-04
doi∶10.3969/j.issn.2095-1736.2017.03.078

