铁调素和IL-6在非酒精性脂肪性肝病大鼠模型肝脏炎症进程中的表达水平及相关性分析
赵 睿, 李 娟, 王 亮, 孔 银, 丁 洁, 王娟霞, 李光明, 张岭漪
(兰州大学第二医院 肝病科, 兰州 730030)
铁调素和IL-6在非酒精性脂肪性肝病大鼠模型肝脏炎症进程中的表达水平及相关性分析
赵 睿, 李 娟, 王 亮, 孔 银, 丁 洁, 王娟霞, 李光明, 张岭漪
(兰州大学第二医院 肝病科, 兰州 730030)
目的利用非酒精性脂肪性肝病(NAFLD)大鼠模型观察铁调素(Hepc)、IL-6在肝脏炎症进程中表达水平的变化。方法NAFLD肝组织标本均来自本课题组前期利用高脂乳剂灌胃法成功构建的大鼠NAFLD模型(M组)及同期生理盐水灌胃替代构建的正常大鼠对照组(C组)。Hepc、IL-6单克隆抗体应用免疫组织化学法分别检测4、8、12周M组(M4、M8、M12)和12周C组大鼠肝组织中Hepc、IL-6的表达水平,同期评估各组肝脂肪炎症程度积分。检测2组大鼠肝组织Hepc和IL-6的表达水平,并计算肝组织NAS积分。多组间比较采用单因素方差分析,组间进一步两两比较采用LSD-t相关法。相关性分析均采用Pearson相关法。结果随试验周期延长,Hepc和IL-6在M4组、M8组、M12组表达水平呈逐渐升高的趋势,且与C12组相比差异均有统计学意义(Hepc:0.372±0.216、1.213±0.193、2.390±0.192 vs 0.166±0.192;IL-6:0.499±0.218、1.290±0.210、2.644±0.441 vs 0.240±0.109,P值均<0.05);M组大鼠肝组织Hepc和IL-6表达呈正相关(r=0.944,P<0.05);M组大鼠肝组织Hepc和IL-6表达水平均与NAS呈正相关(r值分别为0.927和0.907,P值均<0.001)。结论初步观察到实验性NAFLD炎症进程可影响肝组织Hepc、IL-6表达且Hepc与肝组织炎症损伤因子IL-6表达强度相关性明显。Hepc和IL-6作为NAFLD疾病进展的预测因子值得进一步研究。
脂肪肝; 铁调节蛋白质类; 白细胞介素6
非酒精性脂肪性肝病(NAFLD)是以肝细胞脂肪变性和肝脂毒性炎症为特征的代谢应激性肝损伤,铁代谢紊乱被认为是其损伤机制之一[1];铁稳态调节因子铁调素(hepcidin, Hepc)是铁代谢调节依赖的主要相关蛋白,在肝细胞中正常表达[2];胰岛素抵抗及氧化应激不仅是NAFLD形成机制中重要的打击因素,同时可刺激Hepc异常高表达,致肝组织中铁异常沉积,后者反过来又促进NAFLD炎症进展[3],其中,细胞因子IL-6是介导Hepc表达上调的主要炎性信号因子[4];但是,NAFLD炎症进程与Hepc及IL-6相关性研究较少。因此,本研究旨在利用NAFLD大鼠模型初步探讨Hepc、IL-6在实验性NAFLD肝脏炎症进程中表达强度的变化。
1 材料与方法
1.1 标本来源 本实验所用NAFLD大鼠肝组织蜡块标本源于本课题组前期应用高脂乳剂灌胃法成功构建的NAFLD模型组(M组)和同期应用生理盐水灌胃替代构建的正常对照组(C组)大鼠[5]。
1.2 主要试剂 兔浓缩型单克隆抗体Hepcidin-25 (ab30760)一抗(Abcam公司);兔浓缩型单克隆抗体IL-6 (ab83339)一抗(Abcam公司);免疫组化二抗采用通用型试剂(ZSGB-BIO公司)。
1.3 分组 M组分别随机选用4周(M4组)、8周(M8组)、12周(M12组)各10只NAFLD大鼠的肝组织蜡块标本;C组(C12组)为10只正常对照组大鼠的肝组织蜡块标本(本研究仅选取12周大鼠作为对照观察)。
1.4 实验方法
1.4.1 检测NAFLD大鼠肝组织Hepc、IL-6的表达
标本常规脱蜡、水化、3%双氧水、37 ℃孵育、PBS冲洗、正常山羊血清封闭、37 ℃孵育;根据预实验结果,选取Hepcidin-25一抗浓度1∶100、单克隆抗体IL-6一抗浓度1∶50;应用免疫组化分别检测M组(M4、M8、M12)和C组大鼠肝组织(各10张2~5 μm切片)Hepc、IL-6表达结果,采用免疫组化积分计量观察方法:(1)每张切片在400倍显微镜下随机采集10个视野(避开边缘效应),每个观察视野包含一个汇管区或一个中央静脉并选择细胞表达最密的地方观察,计算Hepc、IL-6的阳性细胞数百分比,以百分数表示;(2)同时观察阳性着色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;(3)相乘计算综合积分,采用计算公式:(+)%×1 +(++)%×2+(+++)%×3,总数值<1.0者为(+),1.0~1.5者为(++), >1.5者为(+++),随机观察5个高倍视野[6]。
1.4.2 NAFLD大鼠肝组织炎症程度积分 依据《非酒精性脂肪性肝病诊疗指南》[7]中NAFLD炎症程度积分(NAFLD activity score,NAS)标准,对肝组织病理切片在高倍镜下进行观察。(1)肝细胞脂肪变NAS0~8分;(2)小叶内炎症NAS(高倍镜下坏死灶数),0分(无),1分(<2个),2分(2~4个),3分(>3个);(3)肝细胞气球样变:0分(无),1分(少见),2分(多见);NAS<3分可诊断细胞脂肪变性,NAS>4分诊断非酒精性脂肪性肝炎(NASH)。
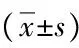
2 结果
2.1 NAFLD大鼠肝组织Hepc、IL-6表达水平的变化 与C组相比,M组Hepc和IL-6表达均随着时间的延长明显高表达,且炎症表现也越来越强(图1)。Hepc在M4组、M8组、M12组表达水平呈逐渐升高的趋势,且与C12组相比差异均有统计学意义(P值均<0.05),M8组、M12组与M4比较,M12组与M8组比较差异均有统计学意义(P值均<0.05);IL-6在M4组、M8组、M12组表达水平呈逐渐升高的趋势,且与C12组相比差异均有统计学意义(P值均<0.05),M12组与M4组、M8组比较差异均有统计学意义(P值均<0.05)(表1)。
2.2 NAFLD大鼠肝组织Hepc和IL-6的相关性 对M组(M4、M8、M12)肝组织Hepc与IL-6进行相关性分析,结果显示Hepc与IL-6呈正相关(r=0.944,P<0.05)(图2)。
2.3 NAFLD大鼠NAS HE染色观察到M4组肝细胞索以肝小叶中央静脉为中心,呈放射状排列,汇管区未见炎性细胞浸润及纤维组织增生,肝细胞可见少量脂肪空泡形成;M8组肝细胞大部分脂肪变性,细胞增大,胞质内可见大小不一、数量不等的脂肪空泡,细胞核被推向周边,汇管区部分炎症细胞浸润;M12肝腺泡3区大泡性或以大泡为主的混合性肝细胞脂肪变,伴有肝细胞气球样变、小叶内炎症细胞,但未见窦周纤维化;C12组肝小叶结构清晰,无脂肪空泡形成(图3)。各组NAS积分见表2,M4组NAS主要集中在2分,M8组NAS主要集中在4和5分,M12组NAS主要集中在6分,而C12组NAS主要集中在0分。








图1 NAFLD大鼠肝组织M组和C组Hepc、IL-6表达水平变化(免疫组化,×400) a、c、e、g:Hepc-C12、M4、M8、M12;b、d、f、h:IL-16-C12、M4、M8、M12

注:与C12组比较,1)P<0.05;与M4组比较,2)P<0.05;与M8组比较,3)P<0.05

图2 NAFLD大鼠M组肝组织Hepc与IL-6综合计量积分的相关性


图3 NAFLD大鼠M组和C组大鼠肝组织形态变化(HE染色,×400) a: M4;b:M8;c:M12; d: C12,细红色箭头表示炎症细胞浸润的部分, 炎症细胞被染成蓝色并聚集;粗红色箭头表示肝细胞气球样变:细胞极度水肿,胞核肿胀,被推向周边

2.4 NAFLD大鼠肝组织Hepc、IL-6表达水平与NAS积分的相关性 NAFLD大鼠肝组织Hepc、IL-6表达水平与NAFLD肝组织NAS积分均呈显著正相关(r值分别为0.927、0.907,P值均<0.001)(图4)。


图4 Hepc、IL-6综合计量积分与NAS积分的相关性
3 讨论
NAFLD是一组多病理状态的慢性炎症性肝病,从肝脂肪变性到更具进展性的疾病状态包括NASH和肝硬化,许多患者可能最终进展至肝衰竭和肝细胞癌[8-9]。肝脏是体内铁代谢的重要器官,肝细胞分泌铁代谢调节依赖相关蛋白,其中Hepc的正常表达是维持机体铁稳态最主要的物质。NAFLD和铁代谢之间的关系仍然存在争议。尽管近期有研究[10]表明肥胖、NAFLD/NASH引发的肝脏慢性低水平炎症状态可致肝细胞内铁稳定受到破坏,反过来又增加了肝脏Hepc的产生。然而,迄今为止尚无更多的研究证实NAFLD炎症进程中Hepc及IL-6表达的变化。
NAFLD所产生的一系列病理状态势必会引起体内相关炎症细胞因子的表达发生一定的显著变化,其中IL-6就是这一病理过程中重要的致炎因子之一。IL-6是由单核细胞、巨噬细胞、内皮细胞、成纤维细胞、脂肪细胞等产生,可能在NAFLD 疾病的发生与发展中起到一定的作用,同时又可介导巨噬细胞浸润。IL-6炎症因子水平的升高是 NAFLD 患者普遍存在的一个现象,并对NAFLD的病情进展起到正反馈的效应,即随着脂肪肝程度的逐渐加重IL-6的表达水平也逐渐增加[11],这一点在本研究结果中也得到了进一步证实,同期观察到IL-6随着脂肪变性及炎症程度的进展而逐渐加深,与疾病的进程呈正相关。Hepc被认为是一种介导与感染和炎症相关的急性期蛋白,Ganz等[12]阐述了IL-6是Hepc在肝脏表达的信号通路中的关键诱导因子,IL-6可以通过与其相应的受体结合并通过一定的细胞因子信号转导通路影响Hepc的表达。进一步研究[13]显示,IL-6可能是通过BMP/SMD信号通路的参与或STAT3通路来刺激Hepc转录。尽管本实验在大鼠NAFLD模型中初步观察到实验性NAFLD炎症进程可影响肝组织Hepc,IL-6表达上调且Hepc与肝组织炎症损伤因子IL-6表达强度相关性明显,但在NAFLD肝脏炎症中Hepc与IL-6之间相互作用的关系还需进一步探讨。
综上所述,NAFLD病情进展与肝脏炎症程度息息相关,但目前仍缺乏判断NAFLD炎症程度可靠的血清生物学指标,血清Hepc、IL-6是否可做为NAFLD疾病进展的预测因子值得进一步研究。
[1] DATZ C, FELDER TK, NIEDERSEER D, et al. Iron homeostasis in the metabolic syndrome[J]. Eur J Clin Investig, 2013, 43(2): 215-224.
[2] DONGIOVANNI P, FRACANZANI AL, FARGION S, et.al. Iron in fatty liver and in the metabolic syndrome: a promising therapeutic target[J]. Hepatol, 2011, 55(2): 920-932.
[3] ANTONELLO P. Hepcidin in human iron disorders: therapeutic implications[J]. Hepatology, 2011, 54(2): 173-181.
[4] WANG J, PANTOPOULOS K. Regulation of cellular iron metabolism[J]. Biochem, 2011, 434(2): 365-381.
[5] DING J, WANG L, LI J, et al. Reliability of metabolic and pathologic parameters in the high fat diet-induced nonalcoholic fatty liver disease rat model established by gastric perfusion[J]. J Clin Hepatol, 2012, 7(2): 531-534. (in Chinese) 丁洁, 王亮, 李娟, 等. 高脂乳剂灌胃构建大鼠非酒精性脂肪肝病模型可靠性的再研究[J].临床肝胆病杂志, 2012, 7(2): 531-534.
[6] FU Q, LI P, XIONG F, et al. Dicussion of enhancement of normal SP immunohistochemical staining[J]. J Hubei Univ Chin Med, 2013, 15(5): 24-26. (in Chinese) 富青, 李萍, 熊凡, 等. 改良常规SP免疫组化染色法的探讨[J]. 湖北中医药大学学报, 2013, 15(5): 24-26.
[7] Group of Fatty Liver and Alcoholic Liver Diseases, Society of Hepatology, Chinese Medical Association. Guidelines for management of non-alcoholic fatty liver disease[J]. J Clin Hepatol, 2010, 26(2): 120-124.(in Chinese) 中华医学会肝病学分会. 非酒精性脂肪性肝病诊疗指南[J]. 临床肝胆病杂志, 2010, 26(2): 120-124.
[8] AIGNER E, WEISS G, DATZ C. Dysregulation of iron and copper homeostasis in nonalcoholic fatty liver[J]. World J Hepatol, 2015, 7(2): 177-188.
[9] WANG FG, LIANG WF, XI JJ. Establishment and applications of non-alcoholic steatohepatitis animal models[J]. Chin J Clin Pharmacol Ther, 2015, 20(7): 835-840. (in Chinese) 王福根, 梁伟峰, 席建军, 等. 非酒精性脂肪性肝炎动物模型的建立与应用[J]. 中国临床药理学与治疗学, 2015, 20(7): 835-840.
[10] BOQA S, ALKIN H, ALKIN C, et.al. The relationship of serum hemojuvelin and hepcidin levels with iron overload in nonalcoholic fatty liver disease[J]. Gastrointestin Liver Dis, 2015, 24(3): 293-300.
[11] RAVASI G, PELUCCHI S, TROMBINI P, et al. Hepcidin expression in iron overload diseases in variably moclulated by circulating[J]. PLos One, 2012, 7(5): e36425.
[12] GANZ T. Hepcidin and iron regulation,10 years later[J]. Blood, 2011, 117(17): 4425-4433.
[13] GANZ T. Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation[J]. Blood, 2003, 102(3): 783-788.
引证本文:ZHAO R, LI J, WANG L, et al. Expression of hepcidin and interleukin-6 and their correlation in liver inflammation process in a rat model of nonalcoholic fatty liver disease[J]. J Clin Hepatol, 2017, 33(9): 1774-1777. (in Chinese) 赵睿, 李娟, 王亮, 等. 铁调素和IL-6在非酒精性脂肪性肝病大鼠模型肝脏炎症进程中的表达水平及相关性分析[J]. 临床肝胆病杂志, 2017, 33(9): 1774-1777.
(本文编辑:王 莹)
Expressionofhepcidinandinterleukin-6andtheircorrelationinliverinflammationprocessinaratmodelofnonalcoholicfattyliverdisease
ZHAORui,LIJuan,WANGLiang,etal.
(DepartmentofHepatology,LanzhouUniversitySecondHospital,Lanzhou730030,China)
ObjectiveTo investigate the changes in the expression of hepcidin (Hepc) and interleukin-6 (IL-6) in liver inflammation process in a rat model of nonalcoholic fatty liver disease (NAFLD).MethodsThe rats were given high-fat emulsion by gavage to establish the model of NAFLD (group M) and normal rats were given normal saline by gavage as controls (group C). Liver tissue samples were collected from these rats, and immunohistochemistry was used to measure the expression of Hepc and IL-6 in liver tissue in group M at 4, 8, and 12 weeks (M4, M8, and M12groups) and in group C at 12 weeks (C12group). The NAFLD activity score (NAS) was assessed for both groups. The expression of Hepc and IL-6 in liver tissue was measured, and NAS was calculated. A one-way analysis of variance was used for comparison between multiple groups, and the least significant differencet-test was used for comparison between two groups. Pearson correlation analysis was also performed.ResultsOver the course of treatment, the M4, M8, and M12groups had gradual increases in the expression of Hepc and IL-6, and there were significant differences between these groups and the C12group (Hepc: 0.372±0.216/1.213±0.193/2.390±0.192 vs 0.166±0.192, allP<0.05; IL-6: 0.499±0.218/1.290±0.210/2.644±0.441 vs 0.240±0.109, allP<0.05). In group M, the expression of Hepc was positively correlated with that of IL-6 (r=0.944,P<0.05), and the expression Hepc and IL-6 was positively correlated with NAS (r=0.927 and 0.907, bothP<0.001).ConclusionBased on the results of this preliminary study, liver inflammation process in NAFLD can upregulate the expression of Hepc and IL-6 in liver tissue, and Hepc is significantly correlated with the inflammatory factor IL-6. Further studies are needed to investigate the roles of Hepc and IL-6 in predicting the progression of NAFLD.Keywords:fater liver; iron-regulatory proteins; interleukin-6
10.3969/j.issn.1001-5256.2017.09.030
2017-06-10;
:2017-07-10。
2014年甘肃省自然科学基金项目(145RJZA147);中央高校基本科研业务费专项资金(223000-861240)
赵睿(1980-),女,副主任医师,主要从事非酒精性脂肪性肝病的研究。
张岭漪,电子信箱: zhanglymd@126.com。
R575.5
:A
:1001-5256(2017)09-1774-04

