肺癌患者血小板中VEGF与TSP-1测定的临床应用价值
董行 罗以勤 叶书来
肺癌患者血小板中VEGF与TSP-1测定的临床应用价值
董行 罗以勤 叶书来
目的 探讨血小板中血管内皮细胞生长因子(VEGF)与凝血酶敏感蛋白-1(TSP-1)测定在肺癌进展中的临床应用价值。方法 采用酶联免疫吸附实验(ELISA)检测71例最终确诊为肺癌的患者及35例健康体检者的血小板与贫血小板血浆(PPP)中的VEGF与TSP-1水平。结果 与正常对照组比较,肺癌未转移与转移患者血小板中VEGF水平及VEGF/ TSP-1比值均明显升高(P<0.05);肺癌转移患者血小板中VEGF及VEGF/TSP-1比值高于肺癌未转移患者(P<0.05);肺癌未转移与转移患者血小板中TSP-1水平明显低于对照组(P<0.05);肺癌组与对照组所有个体的贫血小板血浆中的VEGF与TSP-1均低于检测下限而未能检出。结论 肺癌患者血小板中VEGF与TSP-1平衡关系发生改变,并且血小板VEGF与VEGF/TSP-1水平有助于反映肺癌的转移情况。
肺癌血管内皮细胞生长因子 凝血酶敏感蛋白-1 血小板
目前,肺癌的发病率和病死率迅速上升,已跃居全世界癌症死因的第一位,严重危及人类的身体健康。20世纪70年代,Folkman提出了肿瘤的生长和转移依赖于新生血管形成的理论[1]。肿瘤血管的生成依赖于血管形成促进因子和抑制因子之间的平衡调节[2]。研究发现外周血血管形成调节因子水平能够反映肿瘤生长、转移及预后,所以血管形成调节因子有可能成为一种新的肿瘤标记物[3]。然而,血液中大部分血管形成调节因子来源于血小板,如血管形成促进因子(VEGF)70%以上由血小板释放,这也就是除具有止血、组织修复等功能外,血小板在肿瘤进展中发挥重要作用的原因之一[4]。血管形成相关的调节蛋白存在于血小板α颗粒,避免血液中各种血浆蛋白酶的降解[5],因此相对于血清、血浆,检测血小板中此类蛋白能更好地反映肿瘤进程中血管生成调节因子的真实水平[5,6]。本研究通过检测肺癌患者血小板中具有代表性的VEGF和抑制因子(TSP-1)的水平,初步探讨血小板中血管形成调节因子在肺癌进展中的临床应用价值。
对象与方法
1 对象
1.1 肺癌组:按照最新的肺癌病理诊断标准,收集2015年5月~2016年5月的肺癌患者71例,男44例,女27例。其中肺癌未转移患者33例,年龄32~71岁,平均年龄52.64岁;肺癌转移患者38例,年龄45~79岁,平均年龄62.85岁。
1.2 对照组:在采集肺癌患者血液标本的同时,在排除具有各种血管病变的疾病(如糖尿病、高血压等)后,随机选取性别、年龄均相近的体检者35例为对照组,其中男21例,女14例,年龄41~68岁,平均年龄56.75岁。
2 仪器与试剂 CTAD(枸橼酸盐、茶碱、腺苷、潘生丁)抗凝管(上海科华公司);Sysmex KX-2100血球分析仪(日本Sysmex公司);Thermo scientific恒温离心机(美国);RIPA裂解液(上海碧云天);CUSABIO ELISA试剂盒(美国CUSABIO BIOTECH公司)
3 方法
3.1 血标本采集:使用CTAD抗凝管采集空腹静脉血约3ml。CTAD抗凝血用于制备贫血小板血浆和一定浓度的血小板。所采集的血液标本须在2h内进行处理。
3.2 定量血小板的制备:3 mlCTAD抗凝血颠倒混匀后于24℃条件下离心(150 g,10 min)。提取约1ml富血小板血浆(避免吸入红细胞)于24℃条件下离心(900 g,20 min)。将上层的贫血小板血浆转移至一个新EP管中,血小板沉淀通过含有CTAD的缓冲液清洗2次后,加入一定量的CTAD缓冲液以形成血小板悬液。此悬液通过Sysmex血球分析仪检测血小板浓度后,对其调整为2×108/ ml浓度的血小板悬液。编号并分装保存于–80℃冰箱待测。
3.3 贫血小板血浆的提取:由3.2步骤中所获得的贫血小板血浆,经再次离心(900 g,20 min)吸取上层血浆后编号,并分装保存于-80℃冰箱中保存待测。
3.4 血小板、血浆中VEGF与TSP-1水平检测:将分装的血小板悬液和贫血小板血浆从低温冰箱中取出,置于室温下充分溶解,在血小板悬液中RIPA裂解液于4℃条件下充分裂解血小板。 然后将裂解后的血小板与血浆在室温下离心(10 000 g,5 min)。吸取100 ul标准品和离心后的样本上清加入微量孔中;37℃温育2 h后弃去反应板中的液体,在标准品和样本孔中分别加入100 ul生物素标记抗体,37℃温育1 h。洗板后,每孔加入辣根过氧化物酶标记的亲和素抗体100 ul,37℃温育1 h。温育洗板后,依序每孔加入底物溶液90ul,37℃避光显色。30 min内,若肉眼可见标准品的前3~4孔有明显的梯度蓝色,即可终止反应。用酶标仪在450 nm波长测量各孔的光密度值,根据标准孔的浓度及其光密度值制作标准曲线,通过样本光密度值和标准曲线得出各个样本浓度。将由血小板样本所得到的浓度换算成每106个血小板来表示。
4 统计学处理 应用SPSS17.0软件对数据进行统计分析,数据以“均数±标准差(
结 果
1 肺癌未转移组与转移组血小板中VEGF高于对照组(P<0.05),而两组的血小板中TSP-1水平分别低于对照组(P<0.05),见表1。肺癌转移组血小板中VEGF高于未转移组(P<0.05),但血小板中TSP-1在两组间的差异无统计学意义(P>0.05)。此外,肺癌未转移组与转移组血小板中VEGF/ TSP-1比值高于对照组(P<0.05),且肺癌转移组血小板中VEGF/TSP-1比值高于肺癌未转移组(P<0.05)。
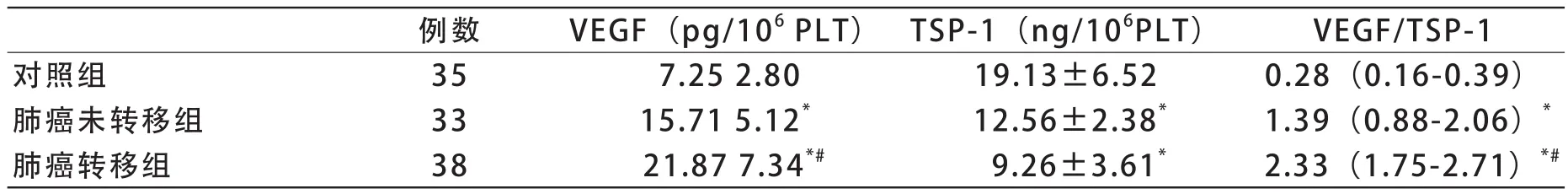
表1 肺癌组与对照组血小板中VEGF、TSP-1检测结果比较
2 肺癌组与对照组中所有实验对象的贫血小板血浆VEGF与TSP-1水平均低于检测限,结果表明采用CTAD的抗凝血中血小板并没有发生活化而释放VEGF。
肺癌是一种富含丰富血管的肿瘤,其生长和转移依赖于新生血管的生成。在肿瘤微环境中,新生血管的生成受到血管生成促进因子和血管生成抑制因子的平衡调控。作为最具有代表性的血管生成促进因子,VEGF在促进肺癌的血管生成以及肺癌的生长和转移等方面发挥了重要作用[7]。TSP-1是最早发现的一种具有代表性的内源性血管生成抑制因子[8]。目前,对于VEGF和TSP-1在肺癌患者血小板中量的变化以及两者之间的平衡关系还未见报道。
VEGF主要由血管内皮细胞生成,肺癌组织及其周围细胞也能够分泌VEGF[9]。因此,在肺癌患者的血循环中,VEGF升高可能主要来自于肿瘤组织及其周围细胞。通过研究发现,血小板具有选择性的吸收血液中血管生成调节因子的作用[10]。以血小板为媒介,通过血小板传递VEGF到达肿瘤的微环境以促进肿瘤的血管生成[11,12]。有研究表明,相对于血小板外的血浆成份,血小板的α颗粒中存在着各种高浓度的血管形成调节蛋白,如VEGF、PDGF、TSP-1等[5]。Peterson等通过研究发现,在血小板中VEGF浓度是相应血浆的215倍[5]。因此,在肿瘤患者血小板中VEGF的浓度变化比其对应的血浆浓度变化可能更加敏感。通过本研究发现,在肺癌组和对照组的所有贫血小板血浆样本中,VEGF含量均低于试剂盒检测下限而未能检出,可见,采用CTAD的抗凝血中血小板并没有发生活化而释放VEGF。而且肿瘤的存在并没有影响血浆样本中VEGF量的变化,这主要是由于血小板选择性吸收VEGF将其聚集到血小板内;其次,在采集血标本与提取血小板标本时,血小板并没有因为人为操作而引起活化以至于释放VEGF到血浆中。表1结果显示,肺癌未转移组和转移组血小板中的VEGF含量均明显高于对照组,而肺癌转移组血小板VEGF含量高于肺癌未转移组。可见,在肺癌的进展和转移中,VEGF量的变化不仅反映肿瘤的存在和进展,而且相对于贫血小板血浆,VEGF在血小板中量的变化也显得尤为敏感。
TSP-1作为一种具有代表性的抑制肿瘤血管形成的内源性抑制因子[8]。虽然外周血中TSP-1的量与肺癌组织中表达量的关系需要进一步研究,但本研究结果显示,血小板中TSP-1含量在肺癌患者中降低较明显。此外,TSP-1与VEGF在肺癌患者外周血中的平衡关系也发生了较明显的变化。目前,在血小板α颗粒中已经发现存在着很多血管形成的促进和抑制因子[4],其中具有代表性的就有VEGF与TSP-1。另外,作为反映血小板是否活化的敏感指标,在相应的贫血小板血浆中,TSP-1在各组中的水平均低于检测限以下。可见,在血小板提取的过程中并没有发生活化。
本研究采用CTAD抗凝血来避免血小板活化,通过研究血小板中VEGF与TSP-1的含量及其变化来反映肺癌的血管形成与肿瘤进展,以此研究肺癌及其他类型的肿瘤提供了潜在的肿瘤标记物。此外,本研究也为如何使用VEGF的抗体作为药物,以及如何构建含有高浓度TSP-1的血小板来治疗肿瘤提供了依据。
1 Folkman J. Tumor angiogenesis:therapeutic implications[J]. N Engl J Med,1971,285(21):1182-1186.
2 Folkman J. Angiogenesis[J]. Annu Rev Med,2006,57(1):1-18.
3 Zaslavsky A,Baek KH,Lynch RC,et al. Plateletderived thrombospondin-1 is a critical negative regulator and potential biomarker of angiogenesis[J]. Blood,2010,115(22):4605-4613.
4 Sabrkhany S,Griffioen AW,Oude Egbrink MG. The role of blood platelets in tumor angiogenesis[J]. Biochim Biophys Acta,2011,1815(2):189-196.
5 Peterson JE,Zurakowski D,Italiano JE,et al. Normal ranges of angiogenesis regulatory proteins in human platelets[J]. Am J Hematol,2010,85(7):487-493.
6 Niers TM,Richel DJ,Meijers JC,etal. Vascular endothelial growth factor in the circulation in cancer patients may not be a relevant biomarker[J]. PLoS One,2011,6(5):e19873.
7 Shimanuki Y,Takahashi K,Cui R,et al. Role of serum vascular endothelial growth factor in the prediction of angiogenesis and prognosis for non-small cell lung cancer[J]. Lung,2005,183(1):29-42.
8 Good DJ,Polverini PJ,Rastinejad F,et al. A tumor suppressor-dependent inhibitor of angiogenesis is immunologically and functionally indistinguishable from a fragment of thrombospondin[J]. Proc Natl Acad Sci USA,1990,87(17):6624-6628.
9 Sennino B,Kuhnert F,Tabruyn SP,et al. Cellular source and amount of vascular endothelial growth factor and platelet-derived growth factor in tumorsdetermine response to angiogenesis inhibitors[J]. Cancer Res,2009,69(10):4527-4536.
10 Klement GL,Yip TT,Cassiola F,et al. Platelets actively sequester angiogenesis regulators[J]. Blood,2009,113(12):2835-2842.
11 Battinelli EM,Markens BA,Italiano JE Jr,et al. Release of angiogenesis regulatory proteins from platelet alpha granules:modulation of physiologic and pathologic angiogenesis[J]. Blood,2011,118(5):1359-1369.
12 Pietramaggiori G,Scherer SS,Cervi D,et al. Tumors stimulate platelet delivery of angiogenic factors in vivo:an unexpected benefit[J]. Am J Pathol,2008,173(6):1609-1616.
The Application Value of Platelet VEGF and TSP-1 Detections in the Lung Cancers
DONG Hang,LUO Yi-qin,YE Shu-lai.
Department of Laboratory Medicine,Anhui Provincial Hospital(Southern Branch)230001
Objective To investigate the clinical application of platelet vascular endothelial growth factor(VEGF)and TSP-1 determination in the progression of lung cancers. Methods The levels of VEGF and TSP-1 in platelets and platelet-poor plasma(PPP)in 71 patients with lung cancers and 35 healthy controls were determined by ELISA method. Results The levels of platelet VEGF and VEGF/TSP-1 in patients with unmetastatic lung cancers and metastatic lung cancers were significantly higher than those in healthy controls (P<0.05); the levels of platelet VEGF and VEGF/ TSP-1 in patients with metastatic lung cancers were significantly higher than those in patients with unmetastatic lung cancers (P<0.05). Moreover,the levels of platelet TSP-1 in patients with unmetastatic lung cancers and metastatic lung cancers were remarkably lower than those in healthy controls (P<0.05). However,the PPP VEGF and TSP-1 in the patients and control group were undetactable (<7.18 pg/ml). Conclusions The balance between the levels of VEGF and TSP-1 is shifted in the peripheral blood of patients with lung cancers,and the levels of platelet VEGF and VEGF/TSP-1 will help to reflect the progression of lung cancers.
Lung cancer VEGF TSP-1 Platelet
R734.2 R446.11
A
1671-2587(2017)04-0397-04
2016-11-25)
(本文编辑:王敏)
10.3969/j.issn.1671-2587.2017.04.025
230001 安徽省立医院南区检验科
董行(1984–),男,安徽宿松人,检验师,主要从事血液病检验诊断,(E-mail)258028284@qq.com。

