术前纤维蛋白原联合淋巴细胞与单核细胞比值对非小细胞肺癌患者预后的评估价值
黄武浩 张华 王长利
术前纤维蛋白原联合淋巴细胞与单核细胞比值对非小细胞肺癌患者预后的评估价值
黄武浩 张华 王长利
目的:探讨术前纤维蛋白原(fibrinogen,Fbg)联合淋巴细胞与单核细胞比值(lymphocyte to monocyte ratio,LMR)评分(FLMR)与非小细胞肺癌(non-small cell lung cancer,NSCLC)患者预后的相关性。方法:回顾性分析2006年1月至2009年12月天津医科大学肿瘤医院行根治性手术切除的589例NSCLC患者的临床病例资料。根据受试者工作特征(ROC)曲线判定Fbg及LMR的界限值,根据F-LMR评分原则将患者分为3组:F-LMR 0分、F-LMR 1分、F-LMR 2分。通过χ2检验分析其与患者临床病理因素的关系,Kaplan-Meier法进行生存分析,运用Log-rank法进行差异性检验,Cox比例风险模型进行单因素与多因素回归分析。结果:根据ROC曲线,3.48 g/L、3.23分别作为Fbg和LMR的界值。F-LMR 0分215例、F-LMR 1分228例、F-LMR 2分146例,术前F-LMR评分与年龄、性别、吸烟史、肿瘤位置、手术类型、病理分期、病理类型、肿瘤大小有显著相关(P<0.05)。单因素分析显示:肿瘤位置、手术类型、病理分期、肿瘤大小、F-LMR评分、LMR及Fbg水平是影响NSCLC患者预后的危险因素(P<0.05);多因素分析结果表明:病理分期(DFS:HR:1.700,95%CI:1.483~1.950,P<0.001;OS:HR:1.703,95%CI:1.486~1.952,P<0.001)和F-LMR评分(DFS:HR:1.264,95%CI:1.077~1.484,P=0.004;OS:HR:1.301,95%CI:1.107~1.528,P=0.001)是影响患者预后的独立危险因子。结论:术前F-LMR评分可作为预测行根治性切除的非小细胞肺癌患者预后的指标。
非小细胞肺癌 纤维蛋白原 淋巴细胞与单核细胞比例 F-LMR评分 预后
AbstractObjective:This study aims to evaluate the correlation of combined preoperative plasma levels of fibrinogen(Fbg)and lymphocyte to monocyte ratio(LMR)(F-LMR)with the prognosis of patients with non-small cell lung cancer(NSCLC)after complete resection.Methods:The clinical data of 589 patients with NSCLC who underwent complete resection in our hospital were retrospectively analyzed.Receiver operating characteristic curve(ROC)analysis was used to select the cut-off values of Fbg and LMR.Based on the criteria of F-LMR,we divided the patients into three groups:F-LMR 0 score,F-LMR 1 score,and F-LMR 2 score.The association between F-LMR and the clinicopathological characteristics was analyzed by the χ2test.Kaplan-Meier analysis was used to analyze the prognostic factors,and the log-rank test was used to determine the differences in survival rates.Prognostic factors were assessed by univariate and multivariate analyses(Cox's proportional hazards regression model).Results:According to the ROC curve,the cut-off values of Fbg and LMR were 3.48 g/L and 3.23,respectively.F-LMR 0 score hadn=215,F-LMR 1 score hadn=228,and F-LMR 2 score hadn=146.Preoperative F-LMR was closely related to age,gender,smoking history,tumor location,surgical type,pathological stage,pathological type,and tumor size(P<0.05).Univariate analysis showed that tumor location,surgical type,pathological stage,tumor size,F-LMR score,LMR,and Fbg were associated with survival(P<0.05).Multivariate analysis showed that the pathological stage[disease-free survival(DFS):hazard ratio(HR)=1.700,95%confidence interval(CI)=1.483-1.950,P<0.001;overall survival(OS):HR=1.703,95%CI=1.486-1.952,P<0.001]and F-LMR score(DFS:HR=1.264,95%CI=1.077-1.484,P=0.004;OS:HR=1.301,95%CI=1.107-1.528,P=0.001)were the independent prognostic factors of NSCLC patients.Conclusion:The preoperative F-LMR score may be a useful blood marker for predicting the prognosis of patients with NSCLC with radical resection.
Keywords:non-small cell lung cancer,fibrinogen,lymphocyte to monocyte ratio,F-LMR score,prognosis
作者单位:天津医科大学肿瘤医院肺部肿瘤科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心,天津市肺癌诊治中心(天津市300060)
肺癌为世界范围内肿瘤相关性死亡的首要原因,肺癌病理类型中大约80%为非小细胞肺癌(nonsmall cell lung cancer,NSCLC)[1]。虽然目前在肺癌的诊断和治疗方面有所进展,但其预后仍不理想,术后复发及转移的发生率较高。准确的术前预后判断及治疗方案的确立对患者的预后及个体化治疗起着重要的作用。近年来,尽管许多研究已经发现了大量与NSCLC患者相关的预后指标,但大多数指标是不可获得的或处于实验研究阶段。凝血及全身炎症反应在肿瘤的进展和转移过程中起着重要的作用[2-3]。纤维蛋白原(fibrinogen,Fbg)是由肝细胞合成和分泌的糖蛋白,是参与凝血过程的重要物质。近年来许多研究表明,在肺癌、食管癌、胃癌、结肠癌中,血浆中纤维蛋白原的增加能够增强肿瘤的侵袭性[4-7]。因此,高纤维蛋白原血症与恶性肿瘤患者的进展及不良预后有关[4-7]。淋巴细胞与单核细胞是炎症反应过程中的重要免疫细胞,淋巴-单核比(lymphocyteto monocyte ratio,LMR)指外周静脉血淋巴细胞与单核细胞比值,是全身炎症反应的有效指标之一。许多研究表明,包括肺癌在内的多种实体肿瘤如鼻咽癌、胰腺癌等中,LMR可以作为判断预后的有效指标[8-10]。因此,本研究提出一种新的预后指标,即Fbg联合LMR评分(F-LMR),旨在探讨F-LMR与NSCLC患者临床病理特征及预后的关系,以期为指导肿瘤治疗及预后判断提供更好的依据。
1 材料与方法
1.1 临床资料
收集天津医科大学肿瘤医院2006年1月至2009年12月行根治性切除术的NSCLC患者589例。纳入标准:1)术后病理确诊为原发性NSCLC;2)行根治性切除术;3)术前未接受任何新辅助放疗或化疗。排除标准:1)手术切缘阳性;2)患有血液系统疾病、自身免疫性疾病及感染的患者;3)术前3个月内发生静脉或动脉栓塞或血栓形成、持续抗凝治疗。男性390例,女性199例,年龄24~82岁,平均年龄(60.4±9.5)岁。吸烟390例,不吸烟199例;中心型肺癌165例,周围型肺癌424例;淋巴结转移者242例,无淋巴结转移者347例;520例行肺叶切除术,69例行全肺切除术。根据经修订的世界卫生组织(WHO)分类法及第七版TNM分类法确定了肺癌的病理诊断和分期[11-12]。其中鳞癌273例,腺癌241例,其他75例;Ⅰ期278例,Ⅱ期120例,ⅢA期191例。
1.2 方法
1.2.1分组 术前7天内抽取患者外周静脉血进行血液学分析,检测纤维蛋白原、淋巴细胞、单核细胞等指标。运用SPSS 18.0软件,根据受试者工作特征(ROC)曲线分析,选定LMR及Fbg的分界值。根据ROC曲线,得出Fbg和LMR的分界值分别为3.48 g/L和 3.23。血浆Fbg:术前 Fbg<3.48 g/L 为正常,Fbg≥3.48 g/L为升高。F-LMR:Fbg联合LMR评分,Fbg正常且高LMR为F-LMR 0分,Fbg升高或低LMR为FLMR 1分,Fbg升高且低LMR为F-LMR 2分。
1.2.2 随访 所有患者从术后开始随访,截止至2012年6月30日,采用门诊或电话方式,根据病情行CT或胸片、彩超等检查。总生存期(overall survival,OS)定义为从手术日期到死亡或最后一次随访日期;无病生存期(disease free survival,DFS)定义为从手术日期到第一次进展或最后一次随访日期。
1.3 统计学分析
采用SPSS 18.0软件进行统计学分析,根据受试者工作特征(ROC)曲线分析,选定Fbg及LMR分界值。计数资料组间比较采用χ2检验。Kaplan-Meier方法计算生存曲线,用Log-rank法进行差异性检验。生存分析采用Cox单因素及多因素分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 Fbg和LMR最佳截点的确定
根据ROC曲线(图1A、B),Fbg和LMR的最佳截点分别为3.48 g/L和3.23,其曲线下面积分别为0.595和 0.576。Fbg≥3.48 g/L者 314例,占 53.3%;Fbg<3.48 g/L者275例,占46.7%;LMR>3.23者383例,占65%;LMR≤3.23者206例,占35%。

图1 确定术前Fbg和LMR最佳截点的ROC曲线Figure 1 ROC curve analysis was performed to identify the optimal cutoff values of Fbg and LMR
2.2 术前F-LMR评分与NSCLC患者临床病理特征的相关性
根据F-LMR的评分标准,589例患者分为3组:F-LMR 0分215例,F-LMR 1分228例,F-LMR 2分146例。术前F-LMR与年龄(P<0.001)、性别(P<0.001)、吸烟史(P<0.001)、肿瘤位置(P<0.001)、手术类型(P=0.008)、病理分期(P<0.001)、病理类型(P<0.001)、肿瘤大小(P<0.001)有显著相关;而与肿瘤侧别(P=0.340)及淋巴结转移(P=0.311)无显著相关性(表1)。

表1 非小细胞肺癌患者术前F-LMR评分与临床病理特征的相关性 例数(%)Table 1 The correlation between preoperative F-LMR score and clinicopathologic characteristics of patients with NSCLCn(%)
2.3 术前Fbg、LMR及F-LMR与预后的关系
本研究中所有NSCLC患者的5年生存率为50.3%,中位生存时间为44个月。其中Fbg正常组与Fbg升高组患者的5年生存率分别为59.4%和41.7%,中位生存期分别为48个月和39.5个月,差异具有统计学意义(P<0.001,图2A)。低LMR组与高LMR组患者的5年生存率分别为42.3%和54.1%,中位生存期分别为39个月和46个月,差异具有统计学意义(P<0.001,图2B)。F-LMR 0分、F-LMR 1分、F-LMR 2分患者的5年生存率分别为58.8%、50.8%和34.7%,中位生存时间分别为48个月、43个月和30.5个月,差异具有统计学意义(P<0.001,图3A)。在DFS的比较中,差异也同样具有统计学意义。

图2 术前LMR及Fbg水平与NSCLC患者预后关系Figure 2 The correlation between preoperative LMR or Fbg level and prognosis of patients with NSCLC
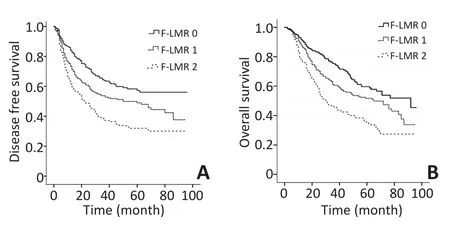
图3 术前F-LMR评分与NSCLC患者预后关系Figure 3 The correlation between preoperative F-LMR score and prognosis in patients with NSCLC
2.4 影响术后DFS和OS的单因素及多因素分析
单因素分析结果显示:肿瘤位置(DFS:P=0.023,OS:P=0.014)、手 术 类 型(DFS:P=0.041,OS:P=0.038)、病理分期(DFS:P<0.001,OS:P<0.001)、肿瘤大小(DFS:P<0.001,OS:P<0.001)、F-LMR(DFS:P<0.001,OS:P<0.001)、LMR(DFS:P=0.001,OS:P<0.001)、Fbg(DFS:P<0.001,OS:P<0.001)是 影 响NSCLC患者预后的危险因素,而其他因素与患者的预后无关(P>0.05,表2)。将单因素分析中有统计学意义的因素纳入Cox比例风险模型进行多因素分析,结果表明:病理分期(DFS:P<0.001,OS:P<0.001)和F-LMR评分(DFS:P=0.004,OS:P=0.001)是影响患者预后的独立危险因子(表3)。

表2 影响肺癌预后的单因素Cox回归分析Table 2 Univariate Cox regression analysis of prognostic factors in patients with NSCLC
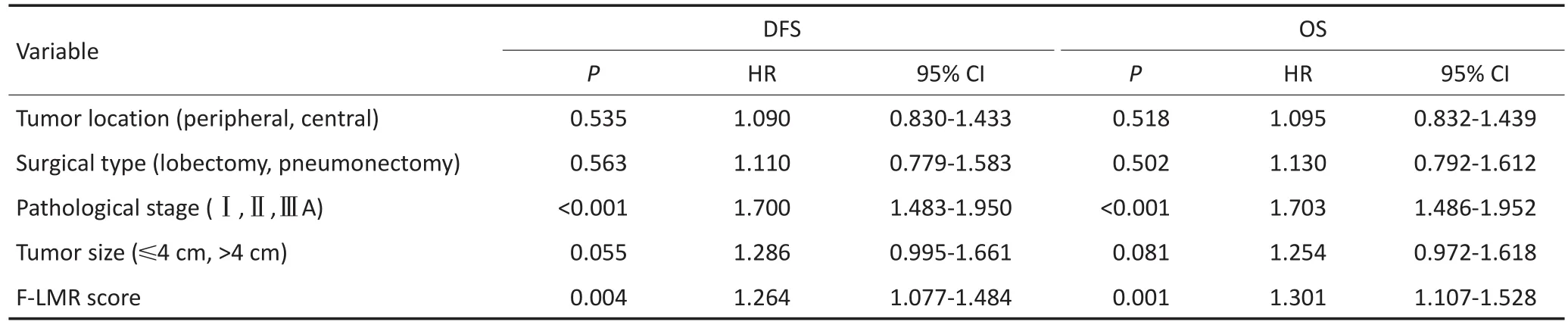
表3 影响肺癌预后的多因素 Cox回归分析Table 3 Multivariate Cox regression analysis of prognostic factors in patients with NSCLC
3 讨论
虽然目前肺癌的诊断和治疗已经取得很大进展,但是NSCLC的预后仍不令人满意,准确的术前预后判断及治疗方案的确立对患者的预后及个体化治疗起着重要的作用。众所周知,肿瘤的进展及预后不单由肿瘤本身的特性(如分化程度、大小、侵袭性等)所决定,患者本身的一些相关因素(如免疫反应等)也起着重要的作用。近年来,许多研究表明LMR及血浆中的Fbg与各种恶性肿瘤的进展和预后相关,可以作为判断预后的有效指标[4-10]。既往关于纤维蛋白原及LMR在肿瘤预后的研究都是将两者分开,本研究将术前血浆Fbg和LMR联合构建新的F-LMR评分,首次探讨了F-LMR与NSCLC临床病理特征及预后的关系,研究表明术前F-LMR评分与肿瘤位置、病理分期、病理类型、肿瘤大小有密切关系,而且术前F-LMR评分可以作为NSCLC患者的一项独立预后指标。
恶性肿瘤患者通常存在不同程度的血液高凝状态,约90%的癌症伴转移患者以及约50%的癌症患者存在凝血指标异常现象[13]。虽然许多研究涉及恶性肿瘤引起血液高凝状态的原因及两者相互关系,但其机制尚未完全清楚。相关研究表明,血液高凝状态在一定程度上可以影响肿瘤细胞的增殖、侵袭及转移[14]。纤维蛋白原是血浆中含量最高的凝血因子,由肝脏合成,在凝血过程中起着重要的作用。作为凝血过程中重要的一员,纤维蛋白原一定程度上影响肿瘤的发生、发展,并且与肿瘤的转移及黏附关系密切[15]。研究表明[16-17],由肿瘤细胞产生的炎症介质白细胞介素6(IL-6)能够促进肝脏分泌Fbg,而且,肿瘤细胞本身也能够合成Fbg[18]。最终,通过与成纤维蛋白生长因子-2和血管内皮生长因子相互作用,Fbg反过来促进肿瘤细胞生长和血管生成[18-19]。多项研究表明,在包括肺癌在内的多种实体肿瘤如食管癌、胃癌、结肠癌等中,Fbg与肿瘤进展有着密切联系,是影响患者预后的独立危险因素[4-7]。在非小细胞肺癌中,Jiang等[4]通过分析184例经根治性手术治疗的NSCLC患者,表明血浆纤维蛋白原活性增加能够提高NSCLC患者肿瘤进展及转移的风险,认为NSCLC患者术前血浆Fbg水平是一个预测肿瘤复发及转移的有效指标。
近年来,研究已发现全身炎症反应在肿瘤的进展及预后中同样起着重要的作用[20]。一些研究表明,炎症相关细胞能够向肿瘤微环境中分泌细胞因子,进而促进肿瘤生长、血管生成、侵袭及转移[21-23]。而且,与癌症相关的一些全身症状,如体重减轻、恶病质、贫血,也受到全身炎症反应的影响[24]。因此,在癌症预后因素方面,与炎症相关的指标受到广泛的关注。作为炎症反应中重要的免疫细胞,许多研究表明,在包括肺癌在内的多种实体肿瘤如鼻咽癌、胰腺癌等中,LMR可以作为判断预后的有效指标[8-10]。通过分析1 356例Ⅰ期至Ⅲ期的NSCLC患者,Hu等[8]发现LMR是一个独立的预后因素。同样,在鼻咽癌研究中,Li等[9]也得到与之类似的结论。
以上大量基础和临床研究表明,Fbg及LMR与肿瘤的进展和预后有着密切的联系。因此,本研究进一步探讨了将Fbg与LMR联合组成的F-LMR与NSCLC进展及预后的相关性。高Fbg患者和低LMR的预后显著差于低Fbg患者和高LMR患者。同时,本研究发现术前F-LMR评分与肿瘤位置、病理分期、病理类型、肿瘤大小等关系密切。生存分析表明随着NSCLC术前F-LMR分值的增高,患者的预后也随之变差,F-LMR 2分的患者生存率显著低于F-LMR 1分和F-LMR 0分的患者(P<0.001)。进一步的多因素Cox分析也表明F-LMR是NSCLC患者预后的独立危险因素(DFS:P=0.004,OS:P=0.001)。因此,在行根治性切除的NSCLC患者中,术前F-LMR可作为判断肿瘤进展和预后的重要指标。通过F-LMR对NSCLC患者术前的评估可以为患者的个体化治疗提供指导意义。由于本研究为回顾性研究,仍需继续开展大样本多中心及前瞻性研究进一步验证。
[1]Siegel R,Ma J,Zou Z,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
[2]Bystricky B,Reuben JM,Mego M.Circulating tumor cells and coagulation-Minireview[J].Crit Rew Oncol Hematol,2017,114:33-42.
[3]Mantovani A,Allavena P,Sica A,et al.Cancer-related inflammation[J].Nature,2008,454(7203):436-444.
[4]Jiang HG,Li J,Shi SB,et al.Value of fibrinogen and D-dimer in predicting recurrence and metastasis after radical surgery for nonsmall cell lung cancer[J].Med Oncol,2014,31(7):22.
[5]Suzuki T,Shimada H,Nanami T,et al.Hyperfibrinogenemia is associated with inflammatory mediators and poor prognosis in patients with gastric cancer[J].Surg Today,2016,46(12):1394-1401.
[6]Zhang D,Zhou X,Bao W,et al.Plasma fibrinogen levels are correlated with postoperative distant metastasis and prognosis in esophageal squamous cell carcinoma[J].Oncotarget,2015,6(35):38410-38420.
[7]Sun ZQ,Han XN,Wang HJ,et al.Prognostic significance of preoperative fibrinogen in patients with colon cancer[J].World J Gastroenterol,2014,20(26):8583-8591.
[8]Hu P,Shen H,Wang G,et al.Prognostic Significance of systemic inflammation-based lymphocyte-monocyte ratio in patients with lung cancer:based on a large cohort study[J].PLoS One,2014,9(9):e108062.
[9]Li J,Jiang R,Liu WS,et al.A large cohort study reveals the association of elevated peripheral blood lymphocyte-to-monocyte ratio with favorable prognosis in nasopharyngeal carcinoma[J].PLoS One,2013,8(12):e83069.
[10]Stotz M,Szkandera J,Stojakovic T,et al.The lymphocyte to monocyte ratio in peripheral blood represents a novel prognostic marker in patients with pancreatic cancer[J].Clin Chem Lab Med,2015,53(3):499-506.
[11]Brambilla E,Travis WD,Colby TV,et al.The new World Health Organization classification of lung tumors[J].Eur Respir J,2001,18(6):1059-1068.
[12]Detterbeck FC,Boffa DJ,Tanoue LT.The new lung cancer staging system[J].Chest,2009,136(1):260-271.
[13]Goad KE,Gralnick HR.Coagulation disorders in cancer[J].Hematol Oncol Clin North Am,1996,10(2):457-484.
[14]Marinho FC,Takagaki TY.Hypercoagulability and lung cancer[J].J Bras Pneumol,2008,34(5):312-322.
[15]Tian Y,Hong M,Jing S,et al.Clinical and prognostic effect of plasma fibrinogen in renal cell carcinoma:A meta-analysis[J].Biomed Res Int,2017,DOI:10.1155/2017/9591506.
[16]Yamaguchi T,Yamamoto Y,Yokota S,et al.Involvement of interleukin-6 in the elevation of plasma fibrinogen levels in lung cancer patients[J].Jpn J Clin Oncol,1998,28(12):740-744.
[17]Gao CH,Gao QS,Peng LH.Study of dynamic changes of peripheral blood D-dimer,IL-6 and Fibrinogen of patients with ovarian cancer[J].Chinese Journal of Immunology,2015,31(4):534-536.[高翠红,高庆双,彭利红.卵巢癌患者外周血D-二聚体、FIB水平与IL-6动态变化的研究[J].中国免疫学杂志,2015,31(4):534-536.]
[18]Sahni A,Simpson-Haidaris PJ,Sahni SK,et al.Fibrinogen synthesized by cancer cells augments the proliferative effect of fibroblast growth factor-2(FGF-2)[J].J Thromb Haemost,2008,6(1):176-183.
[19]Sahni A,Francis CW.Vascular endothelial growth factor binds to fibrinogen and fibrin and stimulates endothelial cell proliferation[J].Blood,2000,96(12):3772-3778.
[20]Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[21]Petruzzi MN,Cherubini K,Salum FG,et al.Role of tumour-associated macrophages in oral squamous cells carcinoma progression:an update on current knowledge[J].Diagn Pathol,2017,12(1):32.
[22]Grivennikov SI,Greten FR,Karin M.Immunity,inflammation,and cancer[J].Cell,2010,140(6):883-899.
[23]Qian BZ,Pollard JW.Macrophage diversity enhances tumor progression and metastasis[J].Cell,2010,141(1):39-51.
[24]Douglas E,McMillan DC.Towards a simple objective framework for the investigation and treatment of cancer cachexia:The Glasgow Prognostic Score[J].Cancer Treat Rev,2014,40(6):685-691.
(2017-03-11收稿)
(2017-05-31修回)
(编辑:杨红欣 校对:武斌)
Prognostic value of the combined preoperative plasma levels of fibrinogen and lymphocyte to monocyte ratio(F-LMR)in patients with non-small cell lung cancer
Wuhao HUANG,Hua ZHANG,Changli WANG

10.3969/j.issn.1000-8179.2017.17.277
Correspondence to:Changli WANG;E-mail:wangchangli@medmail.com.cn
Department of Lung Cancer,Tianjin Medical University Cancer Institute and Hospital;National Clinical Research Center for Cancer;Key Laboratory of Cancer Prevention and Therapy,Tianjin;Tianjin's Clinical Research Center for Cancer;Tianjin Lung Cancer Center,Tianjin 300060,China
王长利 wangchangli@medmail.com.cn
黄武浩 专业方向为肺部肿瘤的早期诊断、以手术治疗为主的肺部肿瘤综合治疗等。
E-mail:13622180106@163.com

