干扰长单一序列区83基因对人巨细胞病毒感染后人脑血管平滑肌促血管生成素及血管内皮生长因子表达的影响
刘磊,王佳伟,2
脑血管病严重威胁着人类健康和生命,约68%的缺血性脑血管病患者伴有动脉粥样硬化(atherosclerosis,AS)[1]。一项AS危险因子调查提示人巨细胞病毒(human cytomegalovirus,HCMV)感染是免疫功能正常人群发生AS的独立危险因子[2]。而HCMV脱氧核糖核酸(deoxyribonucleic acid,DNA)主要见于AS斑块内皮及血管平滑肌细胞核内[3]。许多急性心脑血管事件源于易损斑块破裂[4]。已知HCMV感染后,可使血管平滑肌细胞(vascular smooth muscle cells,VSMC)释放大量血管内皮生长因子(vascular endothelial growth factor,VEGF)[5],后者可促进血管新生及渗漏,最终导致斑块破裂。本研究通过HCMV感染人脑VSMC,随后干扰其感染后再激活的标志——长单一序列区(unique long region 83,UL83)基因,探索该基因对促血管生成素-1(angiopoietin-1,Ang-1)、促血管生成素-2(angiopoietin-2,Ang-2)以及VEGF-A表达的影响及其与血管新生可能存在的联系。
1 材料与方法
1.1 材料 病毒和细胞株HCMV AD169株(军事医学科学院);人脑VSMC(ScienCell);扩增病毒所需人胚肺成纤维细胞(中国医学科学院)。
主要试剂:人脑VSMC培养基,多聚赖氨酸(ScienCell);DMEM培养基(Gibco);胎牛血清(Hyclone);Lipofectamin 2000;Opti-MEM,TRIZOL Reagent,SuperScript II Reverse Transcriptase(Invitrogen);BCA蛋白定量试剂盒(Pierce);胰蛋白酶(Merck);Taq DNA Polymerase,dNTP(Takara);抗体:抗HCMV pp65、抗人Ang-1、Ang-2、VEGF-A(Abcam);抗人β-actin(Santa Crz)。
1.2 人胚肺成纤维细胞培养 细胞置于含有10%胎牛血清DMEM培养液中,在37℃、5%CO2条件下培养。细胞贴壁生长至铺满90%后,以0.25%胰蛋白酶对细胞进行消化,取对数生长期细胞进行实验。

表1 RT-PCR引物设计与合成(上海生物工程公司)
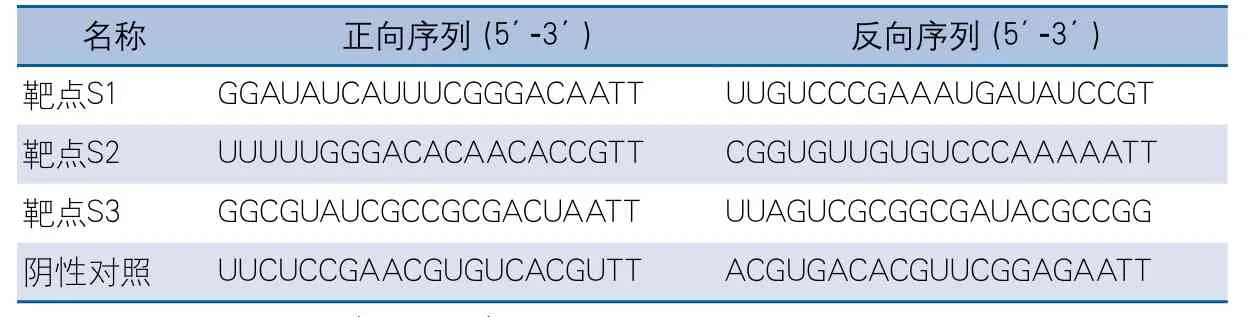
表2 HCMV UL83基因siRNA设计与合成(上海吉玛制药技术有限公司)
1.3 病毒扩增与毒力滴定 将10~15代人胚肺成纤维细胞接种于75 cm2培养瓶中,待细胞生长至80%汇合状态时接种HCMV AD169病毒液,感染滴度为5 0半数细胞感染量(median tissue cultureinfective dose,TCID50)=10-5/0.1 ml,当完全出现细胞病变(cytopathogenic effect,CPE)时收集细胞,冻存于-70℃备用。将系列稀释好的病毒液接种于含人胚肺成纤维细胞的96孔板中,每个稀释度滴定6个复孔,每孔100 μl。于37℃、5%CO2培养箱培养7~10 d。每天观察并记录出现CPE(细胞病变)的孔数,直到CPE不再发展为止,进行毒力测定。
1.4 流式细胞仪检测小干扰核糖核酸转染人脑VSMC 6 h后转染效率 将人脑VSMC以2×105/孔密度接种于6孔板内培养40 h。转染前2 h,将陈旧培养基吸出,每孔加入1.5 ml不含抗生素及血清的人脑VSMC培养基;将10 μl 20 μM FAM荧光标记小干扰核糖核酸(small interfering ribonucleic acid,siRNA)与250 μl Opti-MEM在EP管中混合;将Lipofectamine 2000轻柔摇匀,取5 μl与稀释的siRNAs混合均匀,室温静置20 min,形成siRNA——转染试剂混合物。将siRNA——转染试剂混合物加入6孔板中,使siRNAs终浓度为100 nM,轻轻摇动6孔板使其混合均匀;将6孔板置入37℃、5%CO2培养箱中,6 h后吸出上清。胰酶消化后制备血细胞悬浊液,使用流式细胞仪检测siRNA转染效率。
1.5 HCMV感染人脑VSMC后干扰UL83基因表达实验分组 此部分实验共分6组进行:①空白组(未接毒未转染),②接毒组(只接毒未转染),③接毒无效干扰组,④接毒干扰S1靶点组,⑤接毒干扰S2靶点组,⑥接毒干扰S3靶点组。最终筛选出干扰效率最高的靶点。
1.5.1 HCMV AD169感染 将人脑VSMC以2×105/孔密度接种于6孔板内培养24 h;使用HCMV AD169(MOI=10)病毒液吸附人脑VSMC,每孔加入病毒液约1 ml,37℃、5%CO2培养箱孵育1 h后吸走残余病毒液;加入含4%胎牛血清培养基置于37℃、5%CO2培养箱继续培养16 h。
1.5.2 siRNA转染HCMV AD169感染后人脑VSMC 将无效干扰siRNA以及针对UL83基因S1、S2、S3靶点siRNA分别转染至感染后人脑VSMC。再加入含4%胎牛血清培养基继续培养48 h或72 h。
1.5.3 RT-PCR检测各组UL83基因mRNA表达情况 Trizol法提取总RNA,利用逆转录试剂盒将mRNA逆转录为cDNA,得到的cDNA用于逆转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)反应,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase)为内参,检测各组U L 8 3基因信使R N A(messenger RNA,mRNA)的表达。
1.5.4 Western Blot检测各组UL83基因编码pp65蛋白表达 以1500rpm离心5 min收集人脑VSMC后用PBS洗涤2次。向各组加入细胞裂解液重悬细胞,于冰上放置30 min后,以12 000 rpm离心20 min。将离心获得上清中的蛋白进行BCA定量后,加入5×蛋白上样缓冲液,100℃煮沸5 min变性处理。各组蛋白样品进行SDS-PAGE电泳,转印至PVDF膜上进行Western Blot检测。以β-actin作为内参蛋白。对曝光胶片进行扫描,用ImageJ 1.38x图像分析系统对每例样品的不同蛋白条带分别进行面积和平均灰度的测量,以二者乘积表示某样品中某蛋白的绝对含量;将其与内参(该样品中actin蛋白的绝对含量)之比作为最终蛋白含量测量数据,进行统计学分析。
1.6 HCMV感染人脑VSMC后各时间点Ang-1,Ang-2以及VEGF-A表达情况 参照前述方法,分别采用RT-PCR及Western Blot对HCMV感染人脑VSMC后0 h、6 h、12 h、24 h、48 h以及72 h Ang-1、Ang-2、VEGF-A的mRNA及蛋白进行检测。
1.7 HCMV感染人脑VSMC后UL83基因高效干扰组Ang-1、Ang-2以及VEGF-A表达情况此部分实验共分4组进行:①空白组(未接毒未转染),②接毒高效干扰组,③接毒无效干扰组,④接毒组(只接毒未转染)。
RT-PCR检测各组干扰48 h后Ang-1,Ang-2及VEGF-A的mRNA表达情况。
Western Blot检测各组干扰72 h后Ang-1,Ang-2及VEGF-A蛋白表达情况。
1.8 统计学方法 使用中位数描述非正态分布资料,对于正态分布资料使用
表示其平均水平。每项实验重复3遍。SSPS 14.0软件应用秩和检验进行总体和(或)组间比较分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1 siRNA转染人脑VSMC 6 h后转染效率流式细胞仪显示细胞悬浊液当中95.59%人脑VSMC内有FAM荧光标记siRNA,表明转染效率理想,该脂质体介导化学合成siRNA转染体系可靠。
2.2 siRNA干扰48 h后各组UL83基因mRNA表达效率 HCMV感染人脑VSMC后18 h转染siRNA,转染后48 h收集细胞。结果显示分别转染siRNA的S1、S2、S3组中UL83mRNA表达与接毒组相比均被抑制,分别为后者的62.5%、27.6%和21.3%;空白组由于未接毒,故不表达UL83mRNA;接毒无效干扰组UL83mRNA表达量为接毒组93.7%(图1A)。因此,S2及S3干扰UL83基因转录mRNA的效率最高,分别为72.4%和78.7%。
2.3 siRNA干扰72 h后各组UL83基因编码pp65蛋白表达效率 HCMV感染人脑VSMC后18 h转染siRNA,转染后72 h收集细胞。发现分别转染siRNA的S1、S2、S3组中UL83编码pp65蛋白表达与接毒组相比均被抑制,分别为后者的68.2%、25.4%和18.7%;空白组由于没有接毒,因此不表达pp65蛋白;接毒无效干扰组pp65蛋白表达量为接毒组96.3%(图1B)。因此S2及S3干扰UL83基因编码pp65蛋白效率最高,分别为74.6%和81.3%。

图1 HCMV AD169(MOI=10)感染人脑VSMC后各组UL83 mRNA和UL83基因编码pp65蛋白的表达情况
2.4 HCMV感染人脑VSMC 0~72h后Ang-1、Ang-2以及VEGF-A mRNA表达变化Ang-1 mRNA在感染后0 h、6 h、12 h、24 h、48 h、72 h相对表达量分别为0.768±0.007,0.712±0.009,0.542±0.003,0.436±0.006,0.302±0.004和0.287±0.008(组间P<0.01)。
Ang-2 mRNA在感染后0 h、6 h、12 h、24 h、48 h、72 h相对表达量分别为0.213±0.002,0.286±0.004,0.364±0.002,0.638±0.004,0.827±0.015,0.852±0.017(组间P<0.01)。
VEGF-A mRNA在感染后0 h、6 h、12 h、24 h、48 h、72 h相对表达量分别为0.201±0.003、0.292±0.007、0.317±0.009、0.527±0.008、0.754±0.016、0.801±0.014(组间P<0.01)(图2A)。

图2 HCMV AD169(MOI=10)感染人脑VSMC后不同时间点Ang-1、Ang-2及VEGF-A mRNA表达变化
2.5 HCMV感染人脑VSMC 0~72 h后Ang-1、Ang-2及VEGF-A蛋白表达变化 Ang-1蛋白在感染后0 h、6 h、12 h、24 h、48 h、72 h相对表达量分别为1.215±0.006、1.172±0.004、0.984±0.007、0.785±0.005、0.638±0.007、0.614±0.003(组间P<0.01)。
Ang-2蛋白在感染后0 h、6 h、12 h、24 h、48 h、72 h相对表达量分别为0.593±0.003、0.645±0.006、0.732±0.007、0.917±0.006、1.035±0.009、1.270±0.012(组间P<0.01)。
VEGF-A蛋白在感染后0 h、6 h、12 h、24 h、48 h、72 h相对表达量分别为0.483±0.005、0.627±0.006、0.675±0.008、0.752±0.010、1.187±0.013、1.213±0.018(组间P<0.01)(图2B)。
2.6 HCMV感染人脑VSMC后UL83基因高效干扰组Ang-1,Ang-2以及VEGF-A mRNA表达情况 Ang-1 mRNA在空白组、接毒高效干扰组、接毒无效干扰组及接毒组的相对表达量分别为0.875±0.004、0.832±0.003、0.289±0.002、0.276±0.005。接毒高效干扰组分别与接毒无效干扰组及接毒组相比,组间P值均<0.01。
Ang-2 mRNA在空白组、接毒高效干扰组、接毒无效干扰组及接毒组的相对表达量分别为0.312±0.007、0.304±0.006、0.873±0.008、0.921±0.012。接毒高效干扰组分别与接毒无效干扰组及接毒组相比,组间P值均<0.01。
VEGF-A mRNA在空白组、接毒高效干扰组、接毒无效干扰组及接毒组的相对表达量分别为0.272±0.003、0.284±0.012、0.753±0.009、0.791±0.008。接毒高效干扰组分别与接毒无效干扰组及接毒组相比,组间P值均<0.01(图3A)。
2.7 HCMV感染人脑VSMC后UL83基因高效干扰组Ang-1,Ang-2及VEGF-A蛋白表达情况
Ang-1蛋白在空白组、接毒高效干扰组、接毒无效干扰组及接毒组的相对表达量分别为0.838±0.009、0.775±0.006、0.192±0.004、0.018±0.003。接毒高效干扰组分别与接毒无效干扰组及接毒组相比,组间P值均<0.01。
Ang-2蛋白在空白组、接毒高效干扰组、接毒无效干扰组及接毒组的相对表达量分别为0.593±0.008、0.784±0.003、1.274±0.004、1.342±0.003。接毒高效干扰组分别与接毒无效干扰组及接毒组相比,组间P值均<0.01。
VEGF-A在空白组、接毒高效干扰组、接毒无效干扰组及接毒组的相对表达量分别为0.542±0.005、0.779±0.003、1.373±0.006、1.392±0.002。接毒高效干扰组分别与接毒无效干扰组及接毒组相比,组间P值均<0.01(图3B)。
3 讨论
HCMV属于疱疹病毒β亚科,是免疫抑制、器官移植患者的严重致病、致死因素[6]。目前,HCMV慢性感染及其潜伏感染再激活与动脉粥样硬化之间的关系也日益得到学术界的重视。HCMVUL83基因编码65kDa的磷酸化蛋白pp65(phosphoprotein 65)在病毒潜伏-再激活感染状态中起着关键作用。国际公认将pp65抗原检测定为明确HCMV激活感染的标准方法。本课题组前期发现HCMVUL83基因通过某种途径激活了血管紧张素ⅡAT1受体基因表达,由于已知后者通过结合血管紧张素Ⅱ经NF-B信号途径影响易损斑块稳定性,因此提示HCMV感染后,UL83基因与易损斑块的稳定性可能存在密切关系[7]。
易损斑块与稳定斑块相比,存在明显的血管新生现象。斑块内的新生血管大多是不成熟的,由于缺乏细胞间的紧密连接,因此容易发生渗漏,使得炎症细胞和红细胞进入斑块甚至血管腔[8-9]。血管新生需要多种因子参与,其中VEGF-A是公认最有效、快速的血管渗透机制诱导因子。Ang是第一个被确定来源于人肿瘤组织并具有促血管生成作用的细胞因子家族[10],其中Ang-1、Ang-2与血管生成关系最为密切。质谱分析发现HCMV的分泌蛋白质组包括1000多种由该病毒诱导产生的促进血管和组织修复的新生蛋白,其中包括VEGF及Ang[11]。
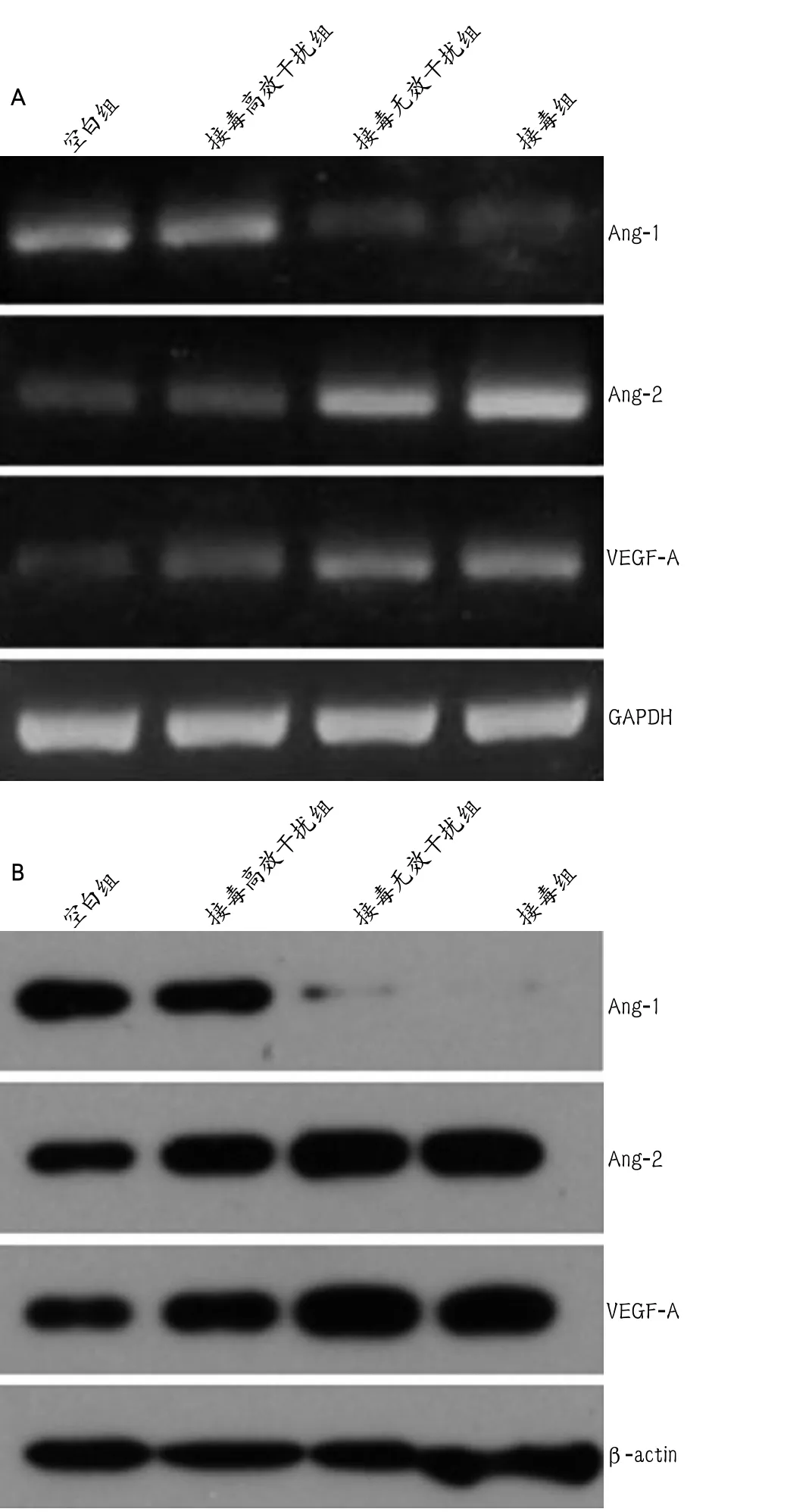
图3 空白组、接毒高效干扰组、接毒无效干扰组和接毒组HCMV AD169(MOI=10)感染人脑VSMC后Ang-1、Ang-2及VEGF-A的mRNA和蛋白的表达情况
目前已知Ang-1和Ang-2及其受体Tie-2对新生血管的成熟至关重要。Ang-1和Ang-2主要由包括人脑VSMC、血管周细胞在内的壁细胞以及内皮细胞产生。其中Ang-1是Tie-2生理状态下的主要配体,参与调控新生血管的管径和数目,并通过增加内皮细胞和壁细胞的联系来达到稳定新生血管,抑制内皮细胞凋亡,减少其渗漏[12-13]。Ang-2作为Ang-1拮抗剂,虽也可结合Tie-2,但不引起后者磷酸化,从而使内皮细胞容易对VEGF等促生长因子发生反应,诱导肿瘤血管生长。此外,Ang-2的作用相比Ang-1更具有多样性:在没有VEGF存在的情况下,Ang-2拮抗Ang-1,使血管退化;而当VEGF存在时,Ang-2则促进新生血管出芽[14]。目前已经在易损斑块内发现Ang-2/Ang-1比例升高[15]。血管新生依赖于内皮细胞迁移、增殖以及血管周细胞对新生血管芽的包裹覆盖,这一过程需要VEGF和血小板源性生长因子(plateletderived growth factor,PDGF)的相互协调[16]。VEGF不仅干扰内皮细胞之间的紧密连接而且通过抑制PDGF介导血管周细胞覆盖新生血管芽来干扰新生血管的成熟[17-18]。本实验表明,人脑VSMC被HCMV感染后的极早期(6 h后),其本身便创造了促进血管新生并阻碍其成熟的微环境,即Ang1表达下调,而Ang-2及VEGF-A表达上调,并且这一趋势随时间而延续。但是,本实验没有观察到Ang-2较VEGF提前表达这一在肿瘤组织和动物脑缺血后血管新生模型当中遇到的现象[19]。
本实验中接毒有效干扰组Ang-1、Ang-2、VEGF-A mRNA及蛋白表达量受到明显抑制,表明UL83基因至少在HCMV感染18 h后参与了上述基因表达的变化,反向证明UL83基因参与创造促进血管新生并阻碍其成熟的微环境。
未来为了进一步明确UL83基因作用,还需正向单独转染其进入人脑VSMC,观察并印证Ang-1、Ang-2、VEGF-A的后续表达情况。此外,在正向及反向实验均证实UL83基因对Ang-1、Ang-2、VEGF-A表达的作用基础上,应当继续探讨UL83基因是通过具体哪一种信号途径参与到上述病理生理过程的。
[1] PACIARONI M,CASO V,VENTI M,et al.Outcome in patients with stroke associated with internal carotid artery occlusion[J].Cerebrovasc Dis,2005,20(2):108-113.
[2] SORLIE P D,ADAM E,MELNICK S L,et al.Cytomegalovirus/herpesvirus and carotid atherosclerosis:the ARIC Study[J].J Med Virol,1994,42(1):33-37.
[3] CHEN R Z,XIONG S D,YANG Y Z,et al.The relation between human cytomegalovirus infection and atherosclerosis development[J].Molecular and Celluar Biochemistry,2003,249:91-96.
[4] STOLL G,BENDSZUS M.Inflammation and atherosclerosis:novel insights into plaque formation and destabilization[J].Stroke,2006,37(7):1923-1932.
[5] REINHARDT B,SCHAARSCHMIDT P,BOSSERT A,et al.Upregulation of functionally active vascular endothelial growth factor by human cytomegalovirus[J].J Gen Virol,2005,86(1):23-30.
[6] SWEET C.The pathogenicity of cytomegalovirus[J].FEMS Microbiol Rev,1999,23(4):457-482.
[7] WANG J,TUO H,WANG R,et al.The expression of human brain vascular smooth muscle cell AT receptor after the UL83 gene of HCMV inhibition by small interfering RNAs[J].Neurol Res,2008,30(9):903-909.
[8] DUNMORE B J,MCCARTHY M J,NAYLOR A R,et al.Carotid plaque instability and ischemic symptoms are linked to immaturity of microvessels within plaques[J].J Vasc Surg,2007,45(1):155-159.
[9] SLUIMER J C,KOLODGIE F D,BIJNENS A P,et al.Thin-walled microvessels in human coronaryatherosclerotic plaques show incomplete endothelial junctions relevance of compromised structural integrity for intraplaque microvascular leakage[J].J Am Coll Cardiol,2009,53(17):1517-1527.
[10] FETT J W,STRYDOM D J,LOBB R R,et al.Isolation and characterization of angiogenin,an angiogenic protein from human carcinoma cells[J].Biochemistry,1985,24(20):5480-5486.
[11] DUMORTIER J,STREBLOW D N,MOSES A V,et al.Human cytomegalovirus secretome contains factors that induce angiogenesis and wound healing[J].J Virol,2008,82(13):6524-6535.
[12] DAVIS S,ALDRICH T H,JONES P F,et al.Isolation of angiopoietin-1,a ligand for the TIE2 receptor,by secretion-trap expression cloning[J].Cell,1996,87(7):1161-1169.
[13] SURI C,MCCLAIN J,THURSTON G,et al.Increased vascularization in mice overexpressing angiopoietin-1.[J].Science,1998,282(5388):468-471.
[14] HOLASH J,WIEGAND S J,YANCOPOULOS G D.New model of tumor angiogenesis:dynamic balance between vessel regression and growth mediated by angiopoietins and VEGF[J].Oncogene,1999,18(38):5356-5362.
[15] POST S,PEETERS W,BUSSER E,et al.Balance between angiopoietin-1 and angiopoietin-2 is in favor of angiopoietin-2 in atherosclerotic plaques with high microvessel density[J].J Vasc Res,2008,45(3):244-250.
[16] JAIN R K.Molecular regulation of vessel maturation[J].Nat Med,2003,9(6):685-693.
[17] SUAREZ S,BALLMER-HOFER K.VEGF transiently disrupts gap junctional communication in endothelial cells[J].J Cell Sci,2001,114(PT6):1229-1235.
[18] GREENBERG J I,SHIELDS D J,BARILLAS S G,et al.A role for VEGF as a negative regulator of pericyte function and vessel maturation[J].Nature,2008,456(7223):809-813.
[19] YANCOPOULOS G D,DAVIS S,GALE N W,et al.Vascular-specific growth factors and blood vessel formation[J].Nature,2000,407(6801):242-248.

