40%氯虫·噻虫嗪水分散粒剂在辣椒及土壤中的残留消解动态
王运儒, 秦玉燕, 杨秀娟, 马 婧, 邓有展, 时鹏涛, 农耀京, 陆仲烟, 吴 凤
(广西壮族自治区亚热带作物研究所,农业部农产品质量安全风险评估实验室<南宁>,农业部亚热带果品蔬菜质量监督检验测试中心,广西 南宁 530001)
40%氯虫·噻虫嗪水分散粒剂(福戈)是新一代高效、广谱杀虫混剂,其有效成分为20%氯虫苯甲酰胺和20%噻虫嗪。氯虫苯甲酰胺是第一个具有邻酰胺基苯甲酰胺类化学结构的广谱杀虫剂[1],化学名称为3-溴-N-[4-氯-2-甲基-6-[(甲氨基甲酰基)苯]-1-(3-氯吡啶-2-基)-1-氢-吡啶-5-甲酰胺[2]。氯虫苯甲酰胺的主要作用途径是胃毒和触杀[3],对害虫活性高,毒性低,杀虫谱广,持效长,耐雨水冲刷,对鳞翅目害虫有很好的控制效果,其应用范围越来越广泛[4-5]。噻虫嗪是第二代烟碱类杀虫剂,适用于叶面喷雾或者灌根,具有很好的内吸作用,可用于防治同翅目、缨翅目、鞘翅目和鳞翅目的害虫,特别是对蚜虫、叶蝉、粉虱、飞虱等的防治效果较好[6]。氯虫苯甲酰胺和噻虫嗪这2种农药混配,不仅具备单剂的特点,而且扩大了杀虫谱,其防治效果也优于单剂[7]。辣椒是南方地区主要蔬菜品种之一,常受蚜虫、粉虱、潜叶蝇、夜蛾等害虫危害,导致产量和质量下降,氯虫苯甲酰胺和噻虫嗪都能够有效防治辣椒上的害虫[8]。
关于同时检测氯虫苯甲酰胺和噻虫嗪残留的方法及其在农作物中降解行为的报道[9-10]较少,大多是单独研究这2种农药的残留消解动态,如陈小军[11]和秦冬梅[12]分别研究氯虫苯甲酰胺在甘蓝和番茄中的残留消解动态,吴绪金[13]和梁旭阳[14]分别研究噻虫嗪在小麦和棉花中的残留消解动态。目前,对氯虫苯甲酰胺和噻虫嗪的检测多采用液相色谱法(HPLC)[15-16]和液相色谱-串联质谱法(HPLC-MS/MS)[17-19],但目前关于这2种杀虫剂或复配制剂在辣椒上残留降解的研究较少。本研究拟采用QuEChERS作为前处理方法,建立氯虫苯甲酰胺和噻虫嗪在辣椒及土壤中残留的分析方法,并对这2种农药的复配剂在辣椒及土壤中的残留消解动态进行研究,以期为氯虫苯甲酰胺和噻虫嗪在辣椒上使用的安全性评价提供科学依据。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器 本研究采用的主要仪器有:超高效液相色谱仪LC-20A(岛津公司产品)、API3200质谱仪(AB SCIEX公司产品)、T18高速均质仪(IKA公司产品)、纯水仪(上海洋沦精密设备科技有限公司产品)、小型旋涡混匀仪(IKA公司产品)。
1.1.2 材料 试验地位于广西南宁市,试验作物品种为指天椒(CapsicumfrutescensL.var),40%氯虫·噻虫嗪水分散粒剂(氯虫苯甲酰胺和噻虫嗪有效成分的质量分数均为20%)由先正达(中国)投资有限公司提供,氯虫苯甲酰胺和噻虫嗪标准品由农业部环境保护科研监测所提供,乙腈和甲酸均为HPLC级,由Themo Fisher公司提供,乙二胺-N-丙基硅烷(PSA)(40~60 μm)由博纳艾杰尔科技有限公司提供,无水硫酸镁和氯化钠(分析纯)由光复精细化工有限公司提供,三官能十八烷基/硅胶基体(C18)由Aglient公司提供。
1.2 处理方法
田间试验参照《农药登记残留田间试验标准操作规程》和《农药残留试验准则》(NY/T-788-2004)进行。于2016年6-7月在广西南宁市进行田间试验,所用药剂为40%氯虫·噻虫嗪水分散粒剂。试验设立空白对照区,每个处理区3个重复。空白对照区与处理区之间设立隔离区,消解试验小区面积为30 m2,最终残留试验小区面积为20 m2。
1.2.1 消解试验 辣椒:喷药剂量为0.015 0 g/m2(推荐剂量),采用电动喷雾器兑水稀释,于辣椒成熟期施药一次。施药后2 h、1 d、3 d、5 d、7 d、10 d、14 d、21 d、28 d和35 d采集辣椒样品。随机多点取样,每次不少于1 kg,同时采集不施药对照样品。采样时分别在植株上下、内外、向阳和背阴部位取样,果实密集的部位相对多取。去除辣椒柄后用四分法缩分,取200 g样品切碎匀浆,所有样品用塑料袋包装,放入-20 ℃冰箱低温保存。
土壤:在试验地附近选一块10 m2表面平整且地质一样的土地进行消解试验。与辣椒的消解试验同时施药处理一次,喷药剂量为0.015 0 g/m2,施药后2 h、1 d、3 d、5 d、7 d、10 d、14 d、21 d、28 d和35 d采集土壤样品2 kg,采集深度为 0~10 cm,充分碾磨后过40目筛混匀,按照四分法取样200 g,所有样品用塑料袋包装,放入-20 ℃冰箱中保存。
1.2.2 最终残留试验 40%氯虫·噻虫嗪水分散粒剂按照推荐剂量(0.015 0 g/m2)和推荐剂量的1.5倍(0.022 5 g/ m2),于辣椒生长至采收期兑水稀释后首次施药,施药2次,施药间隔期7 d。分别于末次施药后的3 d、5 d和7 d采集辣椒及土壤样品,样品预处理同消解试验。
1.2.3 空白对照小区 选取未施药的辣椒地,采集土壤和辣椒样品作为对照,样品处理同材料与方法1.2.2。
1.3 分析方法
1.3.1 提取净化 称取10 g辣椒或土壤,加入20.0 ml乙腈,辣椒匀浆(土壤漩涡振荡10 min)后过滤,转出滤液至装有3 g NaCl的具塞量筒,振摇具塞量筒1 min,静置0.5 h,吸取乙腈上清液1.0 ml到装有150 mg无水硫酸镁、50 mg PSA和50 mg C18的2.0 ml离心管中,4 000 r/min离心5 min。取0.5 ml上清液,加入0.5 ml水,混匀,过0.22 μm有机滤膜,超高压液相色谱-串联质谱测定。
1.3.2 添加回收率 分别称取10 g辣椒和土壤(均为空白样品)于匀浆杯中,向样品中分别添加氯虫苯甲酰胺和噻虫嗪标准溶液(浓度均为100 mg/L),设3个浓度梯度(2.00 mg/kg、0.50 mg/kg和0.05 mg/kg),再加入20 ml乙腈,将待处理的辣椒和土壤在匀浆器上高速匀浆3 min,同时设置空白对照,每个处理重复3次。
1.3.3 检测条件 液相色谱条件:色谱柱为岛津Shim-pack XR-ODSⅡ(2.0 mm×75.0 mm,2.2 μm),流动相由乙腈和水(含体积分数为0.1%的甲酸)组成,梯度洗脱程序为:0~0.1 min 乙腈-水(98∶2,V/V),0.1~5.0 min 乙腈-水(98∶2,V/V)匀速梯度至乙腈-水(85∶15,V/V),5.0~7.0 min 乙腈-水(85∶15,V/V),7.0~8.0 min 乙腈-水(85∶15,V/V)匀速梯度至乙腈-水(98∶2,V/V),8.0~10.0 min 乙腈-水(98∶2,V/V)。柱温40 ℃,进样量5 μl,整个分析时间为10.0 min。
质谱条件:电喷雾离子源(ESI),采用正离子多反应监测(MRM)扫描模式采集数据。以全扫描、子离子扫描等方式优化每种农药母离子和子离子的强度。优化后的质谱分析条件:电喷雾电压(IS)5 500.0 V,离子源温度(TEM)550 ℃,气帘气压力(CUR)379 225 Pa,雾化气压力(Gas 1)379 225 Pa,加热气(Gas 2)379 225 Pa。氯虫苯甲酰胺和噻虫嗪母离子分别为484.0和292.1。氯虫苯甲酰胺定性离子对和定量离子对的质荷比分别为484.0/177.0(去簇电压、碰撞能量和出口能量分别为71.0 V、61.0 V和3.0 V)和484.0/286.0(去簇电压、碰撞能量和出口能量分别为71.0 V、22.0 V和3.0 V),噻虫嗪定性离子对和定量离子对的质荷比分别为292.1/181.2(去簇电压、碰撞能量和出口能量分别为44.0 V、27.0 V和3.2 V)和292.1/211.2(去簇电压、碰撞能量和出口能量分别为44.0 V、16.0 V和3.4 V)。
1.4 标准溶液的配制
准确称取氯虫苯甲酰胺和噻虫嗪标准品,用乙腈溶解标准品,配制成500.00 mg/L的标准母液,再用乙腈将其稀释成10.00 mg/L的混合标准工作溶液。用流动相将其浓度稀释为0.01 mg/L、0.05 mg/L、0.10 mg/L、0.50 mg/L、1.00 mg/L、5.00 mg/L,按照材料与方法1.3.3检测条件进行测定,以进样浓度为横坐标,以定量离子峰面积为纵坐标绘制标准曲线。
1.5 计算公式
氯虫苯甲酰胺和噻虫嗪降解反应动力学方程按一级动力学方程计算。
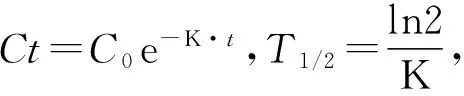
2 结果与分析
2.1 线性范围
氯虫苯甲酰胺和噻虫嗪的标准曲线分别为y=86 578.00x-171.26(R2=0.999 1)和y=88 499.00x-90.90(R2=0.999 3),表明当氯虫苯甲酰胺和噻虫嗪浓度为 0.01~5.00 mg/L时,氯虫苯甲酰胺浓度和噻虫嗪浓度与相应峰面积之间的线性关系良好,满足外标法定量检测的要求。氯虫苯甲酰胺和噻虫嗪的色谱图(图1)显示,氯虫苯甲酰胺和噻虫嗪在优化的色谱条件下的出峰时间分别为4.98 min和3.09 min,谱峰峰形尖锐且对称性好,满足测定的要求。

A:氯虫苯甲酰胺;B:噻虫嗪。图1 氯虫苯甲酰胺和噻虫嗪标样的正离子多反应监测色谱图Fig.1 Multiple reaction monitoring chromatograms from standard solution of chlorantraniliprole and thiamethoxam
2.2 回收率及检出限
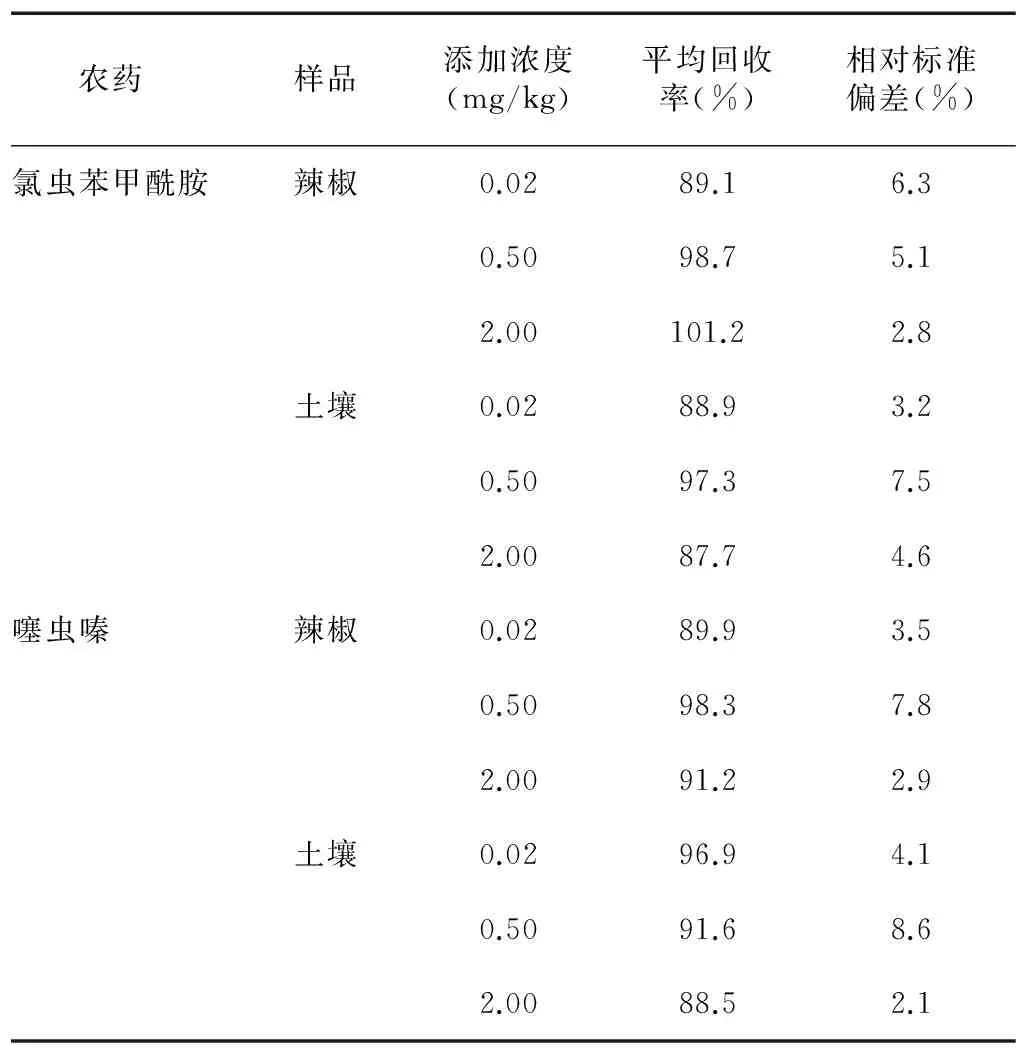
在辣椒及土壤中添加氯虫苯甲酰胺和噻虫嗪标准溶液进行回收率测定试验,结果(表1)表明,在 0.02~2.00 mg/kg的添加水平下,辣椒上氯虫苯甲酰胺的平均回收率为 89.1%~101.2%,相对标准偏差为 2.8%~6.3%,噻虫嗪的平均回收率为 89.9%~98.3%,相对标准偏差为 2.9%~7.8%。土壤中氯虫苯甲酰胺的平均回收率为 87.7%~97.3%,相对标准偏差为 3.2%~7.5%,噻虫嗪的平均回收率为 88.5%~96.9%,相对标准偏差为 2.1%~8.6%。
表1氯虫苯甲酰胺和噻虫嗪在辣椒和土壤中的添加回收率及相对标准偏差(n=5)
Table1Recoveriesandrelativestandarddeviationofchlorantraniliproleandthiamethoxaminpepperandsoil(n=5)
农药样品添加浓度(mg/kg)平均回收率(%)相对标准偏差(%)氯虫苯甲酰胺辣椒0.0289.16.30.5098.75.12.00101.22.8土壤0.0288.93.20.5097.37.52.0087.74.6噻虫嗪辣椒0.0289.93.50.5098.37.82.0091.22.9土壤0.0296.94.10.5091.68.62.0088.52.1
2.3 灵敏度
在优化的超高压液相色谱-串联质谱条件下,以3倍信噪比(S/N)计算检出限(LOD),氯虫苯甲酰胺和噻虫嗪在辣椒中的检出限分别为0.002 mg/kg和0.001 mg/kg。通过在辣椒中添加不同浓度的氯虫苯甲酰胺和噻虫嗪,确定氯虫苯甲酰胺和噻虫嗪在辣椒中的定量限(LOQ)均为0.005 mg/kg。
2.4 40%氯虫·噻虫嗪水分散粒剂在辣椒和土壤中的消解动态
图2和图3显示,氯虫苯甲酰胺和噻虫嗪在辣椒和土壤中的残留量均随着时间的延长而降低,其消解过程均符合动力学一级降解模型。喷药2 h后,氯虫苯甲酰胺和噻虫嗪在辣椒中的原始残留量分别为0.889 mg/kg和0.711 mg/kg,21.0 d后的降解率分别为95.7%和91.8%。表2显示,氯虫苯甲酰胺和噻虫嗪在辣椒中的半衰期分别为5.0 d和6.6 d,在辣椒中均比较容易降解。喷药2 h后氯虫苯甲酰胺和噻虫嗪在土壤中的原始残留浓度分别为1.437 mg/kg和0.947 mg/kg,均比辣椒中的原始残留浓度高。喷药21.0 d后,氯虫苯甲酰胺和噻虫嗪在土壤中的降解率分别为96.2%和97.8%,半衰期分别为4.8 d和4.5 d。氯虫苯甲酰胺和噻虫嗪在辣椒及土壤中的半衰期没有太大的差异。陈国峰等[20]报道的氯虫苯甲酰胺在大豆和土壤中降解的半衰期分别为4.3~10.1 d和3.1~10.2 d。邵建果等[21]报道的噻虫嗪在小麦和土壤中降解的半衰期分别为4.6 d和5.9 d。氯虫苯甲酰胺和噻虫嗪在辣椒及土壤中的降解速率与土壤性质、天气状况关系密切,氯虫苯甲酰胺和噻虫嗪的残留量与辣椒生物量的快速增加有一定的关系。研究发现,在一定的土壤持水量范围内,随着水分含量的增加,农药降解速度加快,同时随着环境温度逐渐接近于微生物生长的最适温度,微生物酶活性大大提高,促进农药的降解[22]。根据化学农药环境安全评价试验准则,土壤中消解半衰期小于等于30.0 d的农药属于易降解农药,本试验中氯虫苯甲酰胺和噻虫嗪在土壤中的半衰期为4.8 d和4.5 d,均属于易消解型农药。

图2 氯虫苯甲酰胺和噻虫嗪在辣椒中的降解曲线Fig.2 Degradation curves of chlorantraniliprole and thiamethoxam in pepper
残留试验设置了2个施药浓度的处理,表3显示,40%氯虫·噻虫嗪水分散粒剂按照正常推荐剂量(0.015 0 g/m2)和正常推荐剂量的1.5倍(0.022 5 g/ m2)在辣椒成熟期分别施药2次,施药间隔期为7 d,采收间隔期为3 d、5 d、7 d。氯虫苯甲酰胺在辣椒中的残留量为 0.122~0.912 mg/kg,在土壤中的残留量为 0.259~0.816 mg/kg。噻虫嗪在辣椒中的残留量为 0.114~0.627 mg/kg,在土壤中的残留量为 0.090~0.889 mg/kg。中国对氯虫苯甲酰胺在辣椒中的最高残留量未有具体规定,只是临时规定在茄果类蔬中的最大残留限量为0.600 mg/kg,而噻虫嗪仅在结球甘蓝和黄瓜中规定有最大残留限量,对辣椒没有具体规定[23]。欧盟规定氯虫苯甲酰胺和噻虫嗪在辣椒中的最高残留限量均为1.000 mg/kg[12]。因此按照1.5倍的最高推荐剂量连续2次在辣椒上喷洒40%氯虫·噻虫嗪水分散粒剂,施药后3 d氯虫苯甲酰胺和噻虫嗪的残留量均低于欧盟规定的最高限量。

图3 氯虫苯甲酰胺和噻虫嗪在土壤中的降解曲线Fig.3 Degradation curves of chlorantraniliprole and thiamethoxam in soil
表2氯虫苯甲酰胺和噻虫嗪在辣椒和土壤中的残留降解方程及降解半衰期
Table2Degradationequationsandhalf-livesofchlorantraniliproleandthiamethoxaminpepperandsoil

农药样品降解方程相关系数降解半衰期(d)氯虫苯甲酰胺辣椒y=0.7305e-0.1390x0.97235.0土壤y=0.8565e-0.1440x0.92234.8噻虫嗪辣椒y=0.5403e-0.1050x0.94726.6土壤y=0.5726e-0.1550x0.91394.5
表3氯虫苯甲酰胺和噻虫嗪在辣椒和土壤中的最终残留量
Table3Finalresiduesofchlorantraniliproleandthiamethoxaminpepperandsoil

距最后一次施药后时间(d)施药有效成分含量(g/m2)施药次数氯虫苯甲酰胺残留量(mg/kg)辣椒土壤噻虫嗪残留量(mg/kg)辣椒土壤30.015020.8030.7370.5020.7700.022520.9120.8160.6270.88950.015020.6540.5450.4100.2400.022520.6420.6890.4610.33670.015020.1220.2590.1140.0900.022520.1500.3210.1230.118
3 结 论
本研究首先对辣椒和土壤样品用乙腈匀浆提取,PSA分散固相萃取剂净化,然后采用超高效液相色谱-串联质谱快速测定氯虫苯甲酰胺和噻虫嗪在辣椒及土壤中的残留量,研究两者在辣椒及土壤中的残留消解动态及最终残留量。该方法重现性好、准确度高、简便、快捷,添加回收率和检出限都能满足农药残留检测分析的要求。
田间试验结果表明,氯虫苯甲酰胺在辣椒及土壤中的半衰期分别为5.0 d和4.8 d,噻虫嗪在辣椒及土壤中的半衰期分别为6.6 d和4.5 d,说明氯虫苯甲酰胺和噻虫嗪均属于易消解农药。以推荐剂量(0.015 0 g/m2)和推荐剂量的1.5 倍(0.022 5 g/m2)在辣椒上连续喷施40%氯虫·噻虫嗪水分散粒剂2次,最后一次施药后3.0 d,氯虫苯甲酰胺和噻虫嗪在辣椒中的残留量符合欧盟规定的。
[1] ZHANG J M, CHAI W G, WU Y L. Residues of chlorantraniliprole in rice field ecosystem[J]. Chemosphere, 2012, 87(2): 132-136.
[2] KAR A, MANDAL K, SINGH B. Environmental fate of chlorantraniliprole residues on cauliflower using QuEChERS technique[J]. Environmental Monitoring and Assessment, 2013, 185(2): 1255-1263.
[3] LAHM G P, STEVENSON T M, SELBY T P, et al. RynaxypyrTM: a new insecticidal anthranilic diamide that acts as a potent and selective ryanodine receptor activator[J]. Bioorganic and Medicinal Chemistry Letters, 2007, 17(22): 6274-6279.
[4] 吴 群,施艳红,操海群,等. 氯虫苯甲酰胺在水溶液中光解的影响因素研究[J]. 农业环境科学学报, 2014, 33(11):2242-2246.
[5] 牛 芳,崔新倩,王开运. 小菜蛾对氯虫苯甲酰胺抗性发展趋势及其种群生物适合度代价初步研究[J]. 农药学学报, 2011, 13(5):543-546.
[6] FENOLL J, GARRIDO I, CAVA J, et al. Photometabolic pathways of chlorantraniliprole in aqueous slurries containing binary and ternary oxides of Zn and Ti[J]. Chemical Engineering Journal, 2015, 264: 720-727.
[7] WANG X, XIANG Z, YAN X, et al. Dissipation rate and residual fate of thiamethoxam in tobacco leaves and soil exposed to field treatments[J]. Bulletin of Environmental Contamination and Toxicology, 2013, 91(2): 246-250.
[8] 李 颖.华南地区辣椒主要病虫害的识别及综合防治[J].广东农业科学, 2006(1): 92-93.
[9] 孟海涛,艾连峰,徐牛生. 在线净化液相色谱-串联质谱法测定蔬菜中噻虫嗪和氯虫苯甲酰胺的残留[J]. 环境化学, 2014, 33(2): 369-371.
[10] 徐 妍,战 瑞,马 超,等. 30%噻虫嗪·氯虫苯甲酰胺悬浮剂高效液相色谱分析[J]. 农药, 2009, 48(7):494-495.
[11] 陈小军,王 萌,范淑琴,等. QuEChERS前处理结合HPLC-MS/MS法分析氯虫苯甲酰胺在甘蓝和土壤中的残留[J].中国农业科学,2012,45(13):2636-2647.
[12] 秦冬梅,秦 旭,徐应明,等. 土壤和番茄中氯虫苯甲酰胺的残留检测与消解动态研究[J].农业环境科学学报, 2010, 29(5): 858-863.
[13] 吴绪金,李 萌,张军锋,等. 小麦和土壤中噻虫嗪残留及消解动态分析[J].麦类作物学报,2014,34(7):1010-1017.
[14] 梁旭阳,刘新刚,徐 军,等. 噻虫嗪在棉花和土壤中的残留动态研究[J]. 植物保护,2013,39(2):101-104.
[15] 贺 敏,贾春虹,马志宏,等. 土壤中噻虫嗪和氯虫苯甲酰胺的残留分析方法[J]. 农药, 2013(6): 431-433.
[16] 刘烨潼,郭永泽,陈秋生,等. 氯虫苯甲酰胺和噻虫嗪在移栽小白菜上的残留趋势[J]. 天津农业科学, 2015, 21(3): 99-104.
[17] 张希跃,吴 迪,潘洪吉,等.氯虫苯甲酰胺和高效氯氟氰菊酯在豇豆和土壤中的残留行为[J].农药学学报, 2016, 18(4): 481-489.
[18] 王 东,侯传金,赵尔成,等. 盐析辅助均相液液萃取/分散固相萃取-超高效液相色谱串联质谱法测定蜂蜜中新烟碱类农药残留[J]. 分析测试学报, 2015,34(6): 681-685.
[19] JOVANOV P, GUZSVNY V, FRANKO M, et al. Multi-residue method for determination of selected neonicotinoid insecticides in honey using optimized dispersive liquid-liquid microextraction combined with liquid chromatography-tandem mass spectrometry[J]. Talanta, 2013, 111: 125-133.
[20] 陈国峰,刘 峰,张晓波,等. 氯虫苯甲酰胺在大豆和土壤中的残留及降解行为[J]. 农业环境科学学报, 2016, 35(5): 894-900.
[21] 邵建果,杨俊柱,王 军. 噻虫嗪在小麦中的残留消解动态及风险评估[J]. 农药学学报, 2013, 15(1): 98-102.
[22] 李晓亮,秦智伟,候利园,等. 土壤环境因素对残留农药降解的影响[J]. 东北农业大学学报, 2009, 40(4): 132-135.
[23] 中华人民共和国国家卫生和计划生育委员会,中华人民共和国农业部.食品中农药最大残留限量: GB 2763—2014[S]. 北京: 中国标准出版社, 2014.

