一株产几丁质酶菌株的筛选鉴定与产酶条件优化
苗 飞,孟 阳,王 悦,袁春营,崔青曼
(天津科技大学 海洋与环境学院,天津市海洋资源与化学重点试验室,天津 300457)
几丁质广泛存在于真菌、细菌、高等植物及甲壳动物等的外壳中,据估计自然界每年生物合成的几丁质约为1×1011t,是自然界中第二丰富的多聚糖[1-3]。几丁质及其降解产物作为重要的有机碳源和氮源参与生态系统的物质交换和能量流动[4],同时作为一种新材料,已广泛应用在化学、医药、食品、农业、环保等领域[5]。目前几丁质的降解产物主要来自于化学方法的降解,但是该方法会引起较严重的环境污染,不符合绿色生产的需要。而几丁质酶可催化水解几丁质的β-1,4糖苷键,生成N-乙酰氨基葡萄糖,具有条件温和、得率高且不污染环境等优点,因此在蟹、虾壳等几丁质废物的转化和利用方面具有广阔的前景[6-8]。自然环境中存在大量几丁质,其降解主要由微生物来完成,那么从自然界中分离筛选几丁质酶产生菌株,无疑是一条较为有效的途径,一些学者已从自然环境中分离出几丁质酶产生菌株,并进行了条件优化、酶学性质及基因能克隆等研究[9-12]。此外,微生物产生的几丁质酶还可用于生物防治上,赵秋敏等[13]从524株芽孢杆菌中筛选出一株几丁质酶活力高的侧孢芽孢杆菌(Bacilluslaterosporus)1.864菌株。研究表明,该菌对小麦赤霉菌等6种病原真菌具有明显的抑制作用。通过几丁质酶抑制剂以及酶活力变化对抑制真菌活性的相关研究,初步认为该菌株的抑菌物质为几丁质酶。生物测定表明1.864的几丁质酶粗酶对蚊幼具有较高的活性,同时对苏云金杆菌(B.thuringiensis)制剂杀虫活性具有明显的增效作用。基于此,笔者从对虾养殖底泥中分离并鉴定一株几丁质酶产生菌株,并采用响应面法对该菌株的产酶条件进行了优化,为该菌株的进一利用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株
该菌株从天津汉沽对虾养殖池底泥中分离得到。
1.1.2 主要材料
K2HPO4、KH2PO4、MgSO4、FeSO4·7H2O、ZnSO4、NaNO3、NaCl、苯酚均为分析纯;琼脂(北京奥博星生物技术有限责任公司);细粉几丁质、GoldViewⅠ型核酸染色剂(北京索莱宝科技有限公司);3,5-二硝基水杨酸(天津市光复精细化工研究所);Taq DNA polymerase、dNTPs(大连宝生物工程有限公司);普通DNA产物纯化试剂盒(北京天根生化科技有限公司)。
胶体几丁质液体发酵培养基(%):KH2PO40.03,K2HPO40.07,FeSO40.002,MgSO4·7H2O 0.05,ZnSO40.001,1%(m/V)胶体几丁质1.5,pH 7.0。
胶体几丁质固体筛选培养基:液体培养基基础上添加1.6%琼脂。
胶体几丁质的制备参考文献[14]的方法并略作修改:1 g几丁质加入少量丙酮研磨至糊状,加入40 mL浓盐酸,使之充分溶解,经玻璃纤维棉过滤,得到的液体溶于5倍体积的50%乙醇溶液中,搅拌至出现胶体悬浮物,反复离心、蒸馏水洗涤直至中性,配制含量为1%(m/V)后,冰箱中4 ℃保存。
1.1.3 主要仪器
立式双层小容量恒温培养摇床(上海新苗医疗器械制造有限公司),全温型多振幅轨道摇床(上海智城分析仪器制造有限公司),立式蒸汽灭菌器(上海博迅实业有限公司医疗设备厂),智能型垂直流超净工作台(上海智城分析仪器制造有限公司),高速冷冻离心机(湖南湘仪离心机仪器有限公司),生物显微镜(麦克奥迪实业集团有限公司),精密pH计(天津市盛邦科学仪器技术公司),CO2培养箱(Thermo Scienrific有限公司),电子分析天平(上海奥豪斯仪器有限公司)。
1.2 试验方法
1.2.1 几丁质酶产生菌株的筛选
平板筛选法,参考文献[15]的方法进行。取少量底泥加入适量无菌水重悬,上清液梯度稀释后涂布于胶体几丁质平板上,30 ℃培养3~5 d,观察在菌落周围是否产生透明圈,挑选透明圈直径较大的菌株,经多次划线纯化后,将初筛菌株接入胶体几丁质液体发酵培养基,测定几丁质酶活力,选取酶活力最高的菌株WY作为试验菌株。
1.2.2 几丁质酶活力的测定
[16]的方法并加以改进。取发酵液3 mL,8000 r/min离心15 min后,取上清液1 mL与1%胶体几丁质1 mL混合,40 ℃反应30 min,取出加入1.5 mL蒸馏水与1.5 mL DNS溶液,混匀,沸水浴5 min后,流水冷却至室温,定容至25 mL,于540 nm处测吸光值,以灭活的酶液作为空白对照。
酶活力单位定义:在上述条件下每分钟产生相当于1 μg N-乙酰氨基葡萄糖所需的酶量,定义为一个酶活力单位(U)。
1.2.3 菌株的鉴定
1.2.3.1 菌株的形态学研究
菌株纯化后接种胶体几丁质筛选培养基,30 ℃恒温培养3 d后观察菌落形态;革兰氏染色后于普通光学显微镜下观察菌体形态;扫描电镜下观察菌体形态。
1.2.3.2 16S rDNA序列分析
细菌总DNA的提取使用试剂盒法。PCR扩增采用16S rDNA通用引物:27 F和1495 R。反应体系(50 μL)为:10×Buffer:5 μL;dNTPs:4 μL;27F:1 μL;1492R:1 μL;Taq酶:0.5 μL;DNA模板:2 μL;蒸馏水:36.5 μL。扩增程序:预变性94 ℃ 5 min;变性94 ℃ 30 s;55 ℃退火30 s;72 ℃延伸1 min;30个循环;72 ℃维持10 min。PCR产物由北京奥科生物公司进行测序,将所得序列提交GenBank数据库并进行BLAST分析比对。
1.2.4 响应面法优化菌株的产酶条件
在单因素试验的基础上,根据 Box-Benhken的中心组合试验设计原理,采用响应面法在3因素3水平上对菌株的产酶条件进行优化,试验因子和水平见表1。
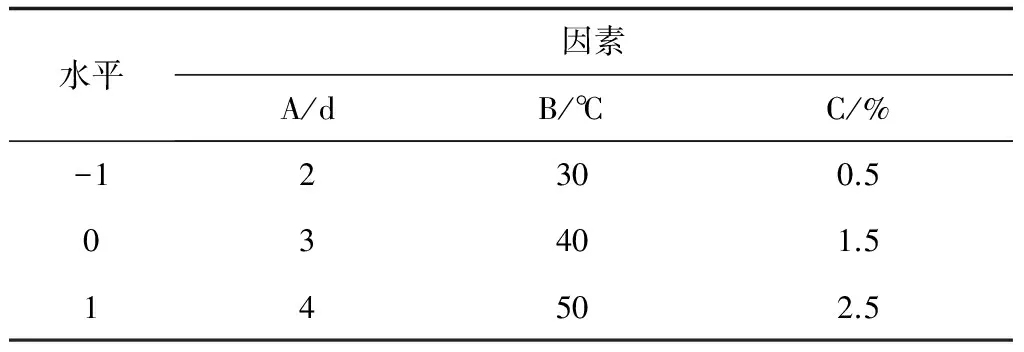
表1 试验因素和水平编码值
注:A,培养时间;B,培养温度;C,胶体几丁质含量.下表同.
2 结果与分析
2.1 菌株的筛选与鉴定
用胶体几丁质为唯一碳源的筛选培养基和透明圈法筛选出产几丁质酶的11个菌株,纯化后测定这些菌株的产酶活力,结合其透明圈直径与菌株直径的比值大小,选取一株比值为2.89、几丁质酶活力7.5 U/mL的菌株WY作为试验菌株。
试验菌株WY在30 ℃胶体几丁质固体筛选培养基上培养1 d后呈乳白色凸起的圆形菌落,光滑,湿润,培养3 d后出现透明圈,菌株和透明圈不断扩大。
光学显微镜观察,试验菌株WY革兰氏染色阳性;扫描电镜观察,菌株呈短杆状,大小(0.4~0.8) μm×(1.5~2.5) μm;表面粗糙,呈单个或不规则群状出现。
试剂盒提取菌株WY的DNA,16S rDNA通用引物进行PCR扩增,扩增产物的琼脂糖电泳图谱见图2。对PCR产物进行测序,将所得序列输入GenBank中,相似性较高的16S rDNA序列均来自芽孢杆菌属,同已知的蜂房芽孢杆菌(Paenibacillusalvei)DSM29 16S rDNA序列相似性超过99%。利用MEGA软件,以邻接法绘制16S rDNA系统发育树(图3)。结合以上菌株WY的菌落形态、亚显微形态特征和16S rDNA序列分析,确定筛选到的菌株WY为蜂房芽孢杆菌。

图1 扫描电镜照片(×9000倍)
2.2 菌株的产酶条件优化
2.2.1 响应面法的结果与分析
以培养时间(A)、培养温度(B)、胶体几丁质含量(C)为自变量,以几丁质酶活力(Y)为响应值,试验方案及结果见表2。
运用 Design expert 7.0软件对上述结果进行整理和数据分析,二次回归模型进行拟合,回归分析结果见表3、表4。
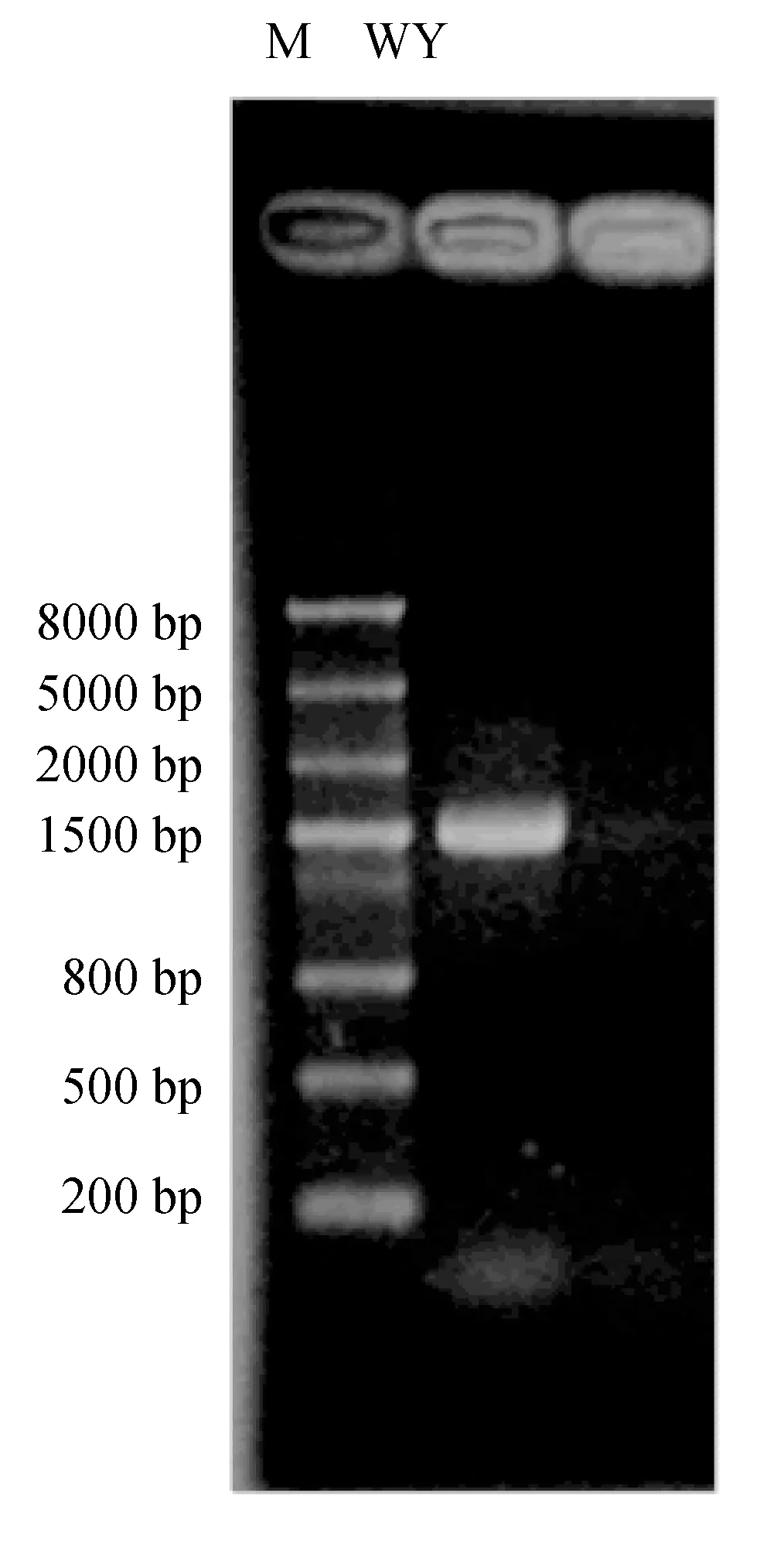
图2 菌株WY的16SrDNA电泳图谱
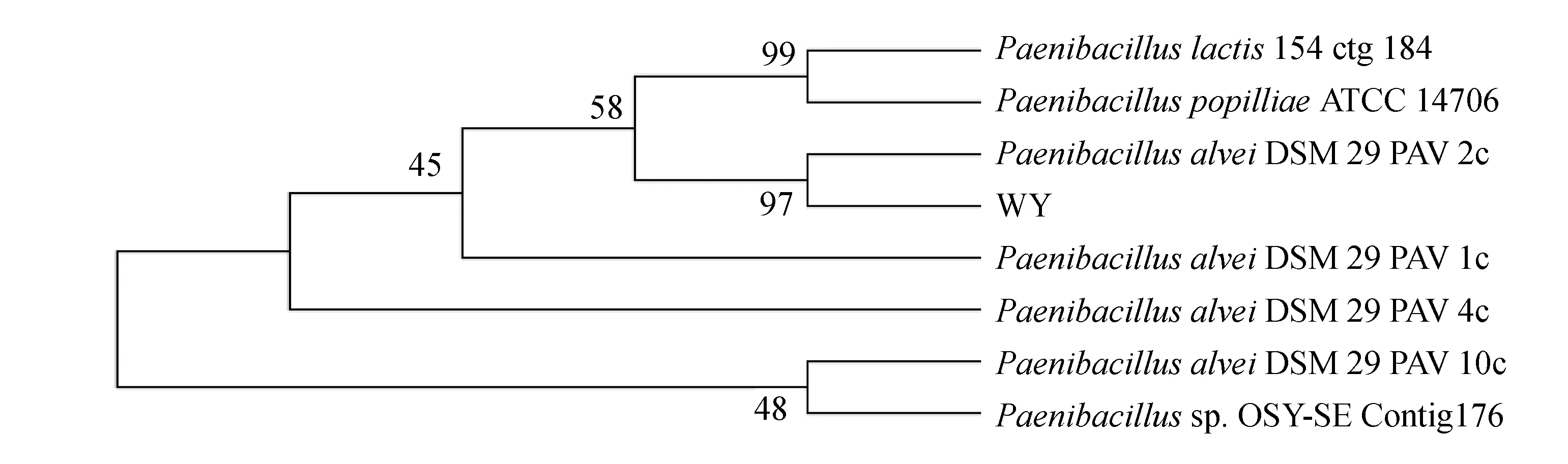
图3 基于16S rDNA序列同源性的菌株WY的系统发育树
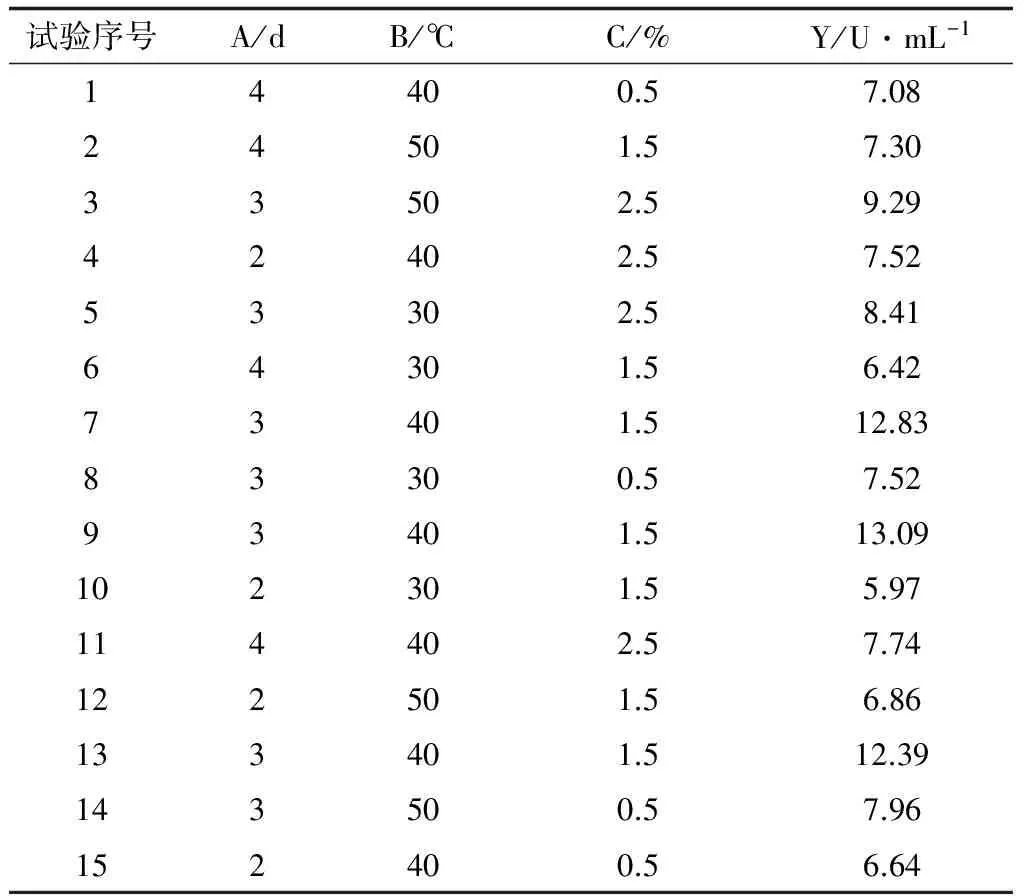
表2 响应面试验方案及结果
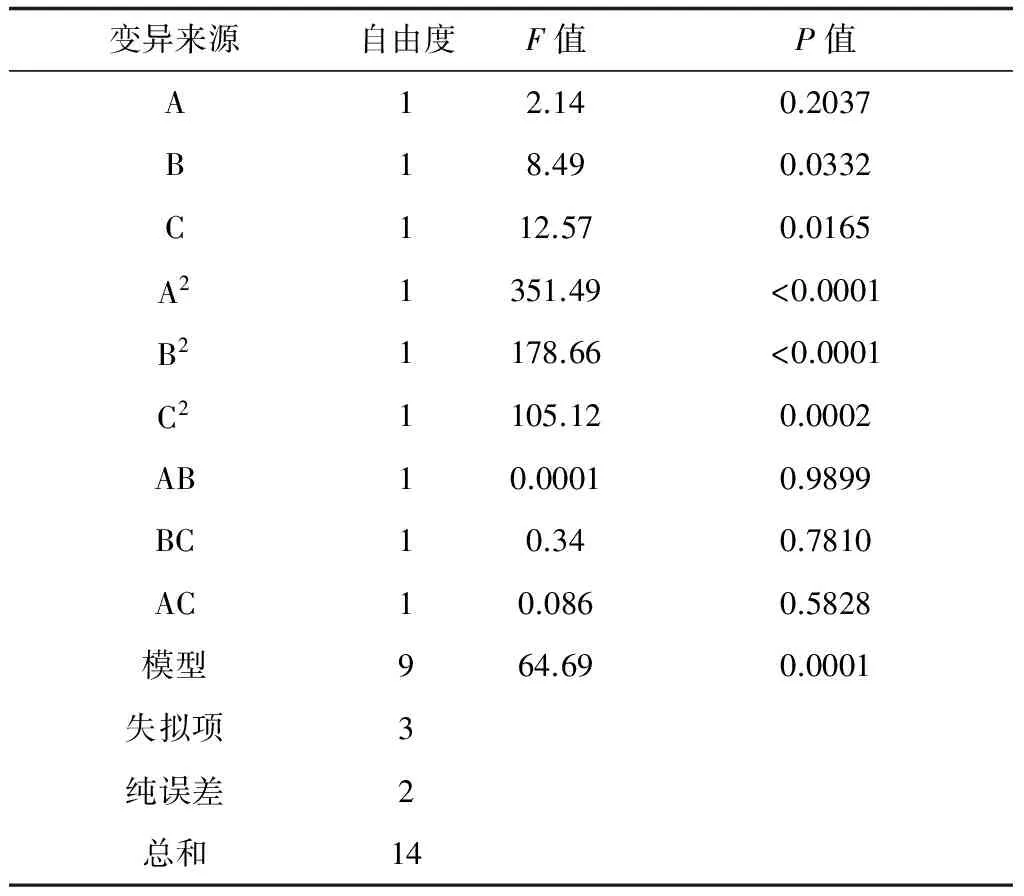
表3 二次响应面回归模型的方差分析
回归模型的方差分析显示(表3),P<0.05,即表示该项指标显著,模型的P=0.0001,说明该模型显著; 一次项中培养温度、胶体几丁质含量的P值分别为0.0332和0.0165,说明培养温度、胶体几丁质含量对响应值的影响显著;二次项A2、B2、C2的P值分别为<0.0001、<0.0001、0.0002,均小于0.05,说明所选3个因素的二次项对响应值影响显著。F值越大,P值越小,说明该系数越重要。由此可见,在所选的各因素中,对几丁质酶活力的影响依次为培养时间>培养温度>胶体几丁质含量。
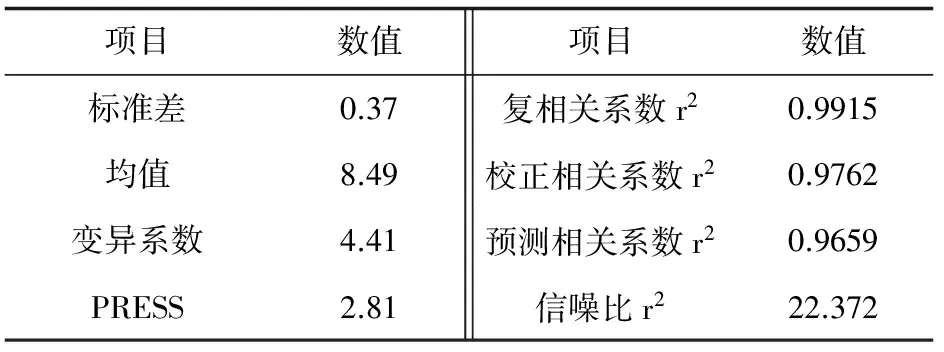
表4 回归模型的可信度分析
回归模型的复相关系数为0.9915,校正相关系数为0.9762,达到了较好水平,说明模型的预测值和试验值拟合较好,Y的变异系数较低,说明试验的可靠性较高。信号与噪音的比率较大,说明这个模型能合适地反映试验结果(表4)。因此,可以利用该回归模型确定最佳产酶条件。最终拟合得到的二次回归方程为:
Y=12.90+0.19A+0.39B+0.47C+0.03AB-0.055AC+0.11BC-3.66A2-2.61B2-2.00C2
响应面回归分析和回归方程拟合,绘出响应面分析图,见图4~6。
由图4可见,随着培养时间和胶体几丁质含量的提高,产酶活力也在增大,当培养时间和胶体几丁质含量升高到一定程度时,产酶活力达到最大,培养时间和胶体几丁质含量继续升高时,产酶活力又会随之下降,说明它们取某个适中值时,可使产酶活力达到最大。同理,图5和图6也存在类似的规律。
通过软件优化、模拟得最佳产酶条件为:培养时间为3.03 d、培养温度为40.77 ℃、胶体几丁质含量为1.62%,预测酶活力为12.95 U/mL。经3次验证试验,实际酶活力为12.99 U/mL。
考虑到操作的便利,将产酶条件修改为:培养时间为3 d、培养温度为40 ℃、胶体几丁质含量为1.62 %,在此条件下进行验证,酶活力为13.07 U/mL。验证试验和修正试验所得酶活力与理论值相差很小,说明利用响应面法优化得到的产酶条件参数准确可靠,模型具有较高的应用价值。
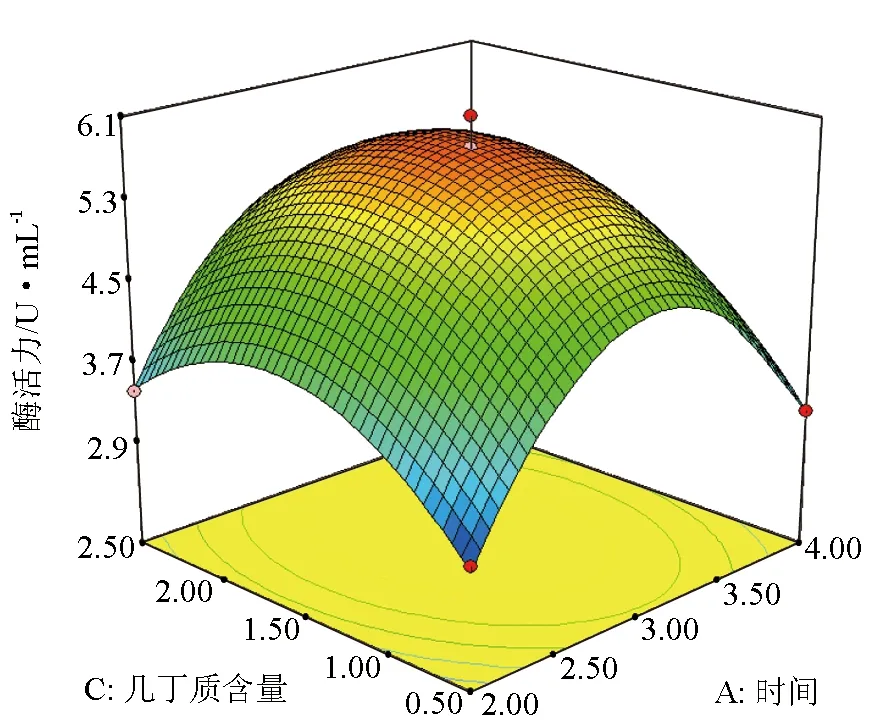
图4 培养时间与胶体几丁质含量对产酶活力的影响
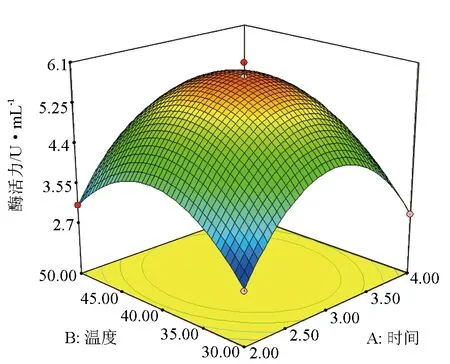
图5 培养时间与培养温度对产酶活力的影响
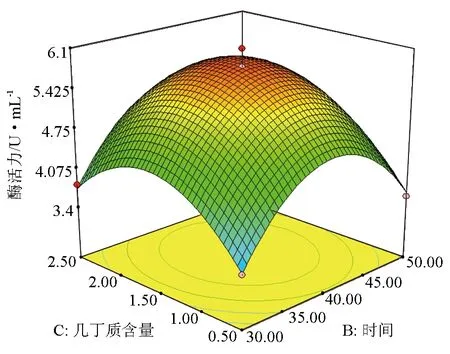
图6 培养温度与胶体几丁质含量对产酶活力的影响
3 讨 论
在自然界,不同类群的微生物能在多种不同的环境中生长繁殖,从环境中吸收营养,并将废物排出,对于环境的变化还能做出很好的适应。薛永常等[17]从大连海域海泥中筛选出1株产几丁质酶海洋细菌,经鉴定为芽孢杆菌属细菌;王晓辉等[18-19]从大连渤海湾的底泥样品中分离到1株高产低温几丁质酶的海洋细菌,鉴定为交替假单胞菌(Pseudoalteromonas),并进行了产酶条件的优化。
一些学者同时研究了几丁质酶产生菌株的生防作用。从草坪土壤中筛选出产几丁酶的放线菌,经过鉴定,确定为皱孢链霉菌(Streptomycesscabrisporus),对4种草坪草根腐病菌的抑制作用进行了探讨[20];徐大可等[21]从笃斯越橘的根部获得1株对12种受试病原真菌都具有拮抗活性的内生细菌DUT菌株,该菌株对菜豆炭疽病病原真菌(Colletotrichumlindemuthianum)抑菌率达70.5%,对2种越橘叶斑病病原菌拟盘多毛孢菌(Pestalotiopsissp.)和柯氏帚梗柱孢霉(Cylindrocladiumcolhounii)的抑制率分别达68.6%和57.7%。通过对其形态特征观察、生理生化特性鉴定及16S rDNA序列同源性分析,鉴定该细菌为粘质沙雷氏菌(Serratiamarcescens),对DUT菌培养特性研究结果表明,该菌培养8 h可达对数生长期,最适生长pH值为7.5,最适生长温度为28~30 ℃,利用双抗生素标记的DUT菌株回接越橘,该菌株可在越橘体内定殖,DUT菌能够产生几丁质酶,发酵36 h后粗酶液的酶活力可达20.11 U/mL。郑志成等[22]从厦门地区牡蛎养殖场滩涂分离筛选到1株产生几丁质酶的蜂房芽孢杆菌B-91,并研究了几丁质酶的产酶条件。以蜂房芽孢杆菌B-91为主要成分,开发了锚头鳋(Lernaea)桡足类特效杀虫剂,对鱼体寄生的中华鳋(Sinergasilus)、锚头鳋、鱼鲺(Argulus)、车轮虫(Trichodina)及水体中水蛛、红虫等浮游动物枝角类、桡足类具有极强的毒杀作用,而对池内饲养的鱼类贝类等特种水产品种无不良影响。
凡纳滨对虾(Litopenaeusvannamei)的变态和生长发育总是伴随幼体的不断蜕皮和幼虾的不断蜕壳进行的。蜕壳(皮)是对虾生长发育的结果,当机体组织生长及营养物质累积到一定程度时必然要进行蜕壳(皮)。正常情况下,每蜕壳(皮)一次,虾体会明显增长,对虾一生中要蜕壳50余次。对虾蜕下的壳除部分被对虾摄食外,其余均沉降在池底,由微生物降解后参与池塘的物质循环。据此,推测池塘底泥中存在着几丁质酶产生菌株,用于降解对虾壳质。本研究从养虾池塘的底泥中筛选几丁质酶产生菌株,根据菌株和菌落的形态以及16S rDNA序列分析,鉴定为蜂房芽孢杆菌,并优化了其产酶条件。下一步拟进行分离菌株对小型甲壳动物(枝角类、桡足类等)的防治效应研究,还要进行分离菌株对凡纳滨对虾的安全性研究,以此开发对虾专用微生态制剂,确保对虾养殖的健康持续发展。
参考文献:
[1] 乔贝贝,裘梁,董德刚,等.1株产几丁质酶菌株的鉴定[J].贵州农业科学,2013,41(7):132-134.
[2] Nicol S.Life after death for empty shells[J].New Scientist,1991,129(1755):46-53.
[3] 李丽,杨雪松,刘红全.微生物几丁质酶的特性及其应用的研究进展[J].广西民族大学学报:自然科学版,2011,17(1): 92-96.
[4] Leake J R,Read D J.Chitin as a nitrogen source for mycorrhizal fungi[J].Mycological Research,1990,94(7):993-995.
[5] 张伟,林红,陈宇岳.甲壳素和壳聚糖的应用及发展前景[J].南通大学学报:自然科学版,2006,5(1):29-33.
[6] 周桂.微生物几丁质酶与壳聚糖酶的研究与应用[J].广西蔗糖,2005(2):32-35.
[7] Vyas P, Deshpande M.Enzymatic hydrolysis of chitin byMyrotheciumverrucariachitinase complex and its utilization to produce SCP[J].Microcirculation,2010,17(8):600-607.
[8] 缑敬轩,董文宾,曾桥.一株可降解几丁质的Bacillussp D23的分离和筛选[J].陕西科技大学学报:自然科学版,2011,29(2):32-35.
[9] 薛永常,张灿.1株产几丁质酶海洋细菌Z-1的分离与鉴定[J].微生物学杂志,2013,33(3): 58-62.
[10] 苏明慧,胡雪芹,顾东华,等.短芽孢杆菌几丁质酶的分离纯化及酶学性质[J].食品科学,2015,36(19): 176-179.
[11] 王振东,罗春艳,杨晨,等.海洋细菌QDC01的鉴定及其几丁质酶基因的克隆与分析[J].农业生物技术学报,2013,21(6):734-744.
[12] 杨绍青,张舒平,闫巧娟,等.高产几丁质酶高温紫链霉菌的筛选和发酵条件优化[J].中国农业大学学报,2013,18(2): 167-173.
[13] 赵秋敏,陈月华,蔡峻,等.一株产几丁质酶、抑真菌的侧孢芽孢杆菌[J].中国生物防治,2006,22(增刊):42-46.
[14] Sun C K,Park S,Dong G L.Purification and characterization of a novel chitinase from the entomopathogenic fungus,Metarhiziumanisopliae[J].Journal of Invertebrate Pathology,1999,73(3):276-281.
[15] Hutadilok N,Mochimasu T,Hisamori H,et al.The effect of N-substitution on the hydrolysis of chitosan by an endo-chitosanase[J].Carbohydrate Research,1995,268(1): 143-149.
[16] 曾润颖,林念炜,连明珠,等.南极产低温几丁质酶菌株的筛选及分子鉴定[J].海洋科学,2006,30(10):35-38.
[17] 薛永常,张灿.1 株产几丁质酶海洋细菌 Z-1的分离与鉴定[J].微生物学杂志,2013,33(3):58-62.
[18] 王晓辉,赵勇,赵小明,等.海洋低温几丁质酶菌株筛选、鉴定及酶谱分析[J].西北农业学报,2014,23(9): 92-97.
[19] 王晓辉,岳敏.交替假单胞菌产几丁质酶的响应面优化[J].食品工业科技,2014(12): 312-315.
[20] 王歧,段碧华,杨瑞,等.产几丁质酶放线菌的筛选、鉴定及其对草坪草根腐病真菌的抑制作用[J].草地学报,2013,21(5): 998-1004.
[21] 徐大可,夏秀英,魏立君,等.1株产几丁质酶的越橘内生拮抗细菌的研究[J].浙江大学学报:农业与生命科学版,2009,35(4):395-400.
[22] 郑志成,周美英,姚炳新.蜂房芽孢杆菌B-91几丁质酶的合成条件[J].厦门大学学报:自然科学版,1995,34(3):447-451.

