乌克兰鳞鲤丙酮酸激酶基因全长cDNA克隆及组织表达分析
方珍珍,段霁航,程镇燕,孙金辉,白东清,乔秀亭
(天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384)
丙酮酸羧激酶(PK)属于丙酮酸激酶超家族的一员,它是糖酵解过程中第三个限速酶,即催化糖酵解最后一步的关键酶:在钾离子和镁离子参与下,丙酮酸激酶催化磷酸烯醇式丙酮酸和二磷酸腺苷转化成丙酮酸和三磷酸腺苷。此反应在生理条件下是不可逆的,其产物丙酮酸可参与多种代谢途径,因此丙酮酸羧激酶在许多需要丙酮酸参与的代谢途径中的作用非常重要。
近年,各种提高鱼类生长率的方法逐步发展起来[1-2]。因此,研究者们转而研究与肌肉生长有关的基因。Johansen等[3]在对虹鳟(Oncorhynchusmykiss)禁食中观察到它与肌肉生长有关的基因表达量大量降低。Ohta等[4]在禁食的鱼体中发现,某些与三磷酸腺苷代谢相关的基因表达量和与肌肉发育相关的基因表达量两者一起提高,但是前者有更为显著的提高,此现象说明饥饿等生理状态会造成三磷酸腺苷代谢信号通路和肌肉发育的信号通路更为敏感,但前者比后者更为敏感。丙酮酸激酶能够使磷酸烯醇式丙酮酸和二磷酸腺苷反应产生三磷酸腺苷,所以为了调节鱼类生长,研究丙酮酸激酶基因表达变化的意义重大。
乌克兰鳞鲤(Cyprinuscarpoio)属于鲤形目、鲤科、鲤亚科、鲤属,是经过综合科学选育而成的优良品种,已经在莫斯科地区的渔场进行大量养殖。1998年全国水产技术推广总站从俄罗斯引进,国家级天津市换新水产良种场经强化培育和选种,生长较快,具有丰富的遗传多样性。2005年经全国水产原种和良种审定委员会审定,农业部批准在全国推广养殖。该品种已在天津、河北、辽宁、黑龙江等省部分地区进行了生产性对比养殖试验,增产效果显著。目前针对乌克兰鳞鲤营养与饲料方面,高妍等[5]研究了不同水平白藜芦醇对乌克兰鳞鲤消化酶及非特异性免疫指标的影响,梁爱军等[6]利用水平式淀粉凝胶电泳法对46尾乌克兰鳞鲤进行了AAT、α-GPD、GPI、IDH、MDH和PGM共6种同工酶以及肌浆蛋白进行了电泳分析;但是在分子营养学方向,针对乌克兰鳞鲤的研究当前尚是空白。
1 材料与方法
1.1 试验鱼
健康试验鱼取自天津市换新水产良种场同一批繁殖的鱼种,平均体质量(20±2) g,平均体长为10 cm,随后运往天津农学院。进行消毒处理后在实验室进行暂养,试验期间水温控制在(30±2) ℃,溶氧量>6 mg/L,pH为7.2,氨氮<0.5 mg/L,养殖箱24 h连续曝气,日投喂2次,日换水1/3~1/2,用虹吸法吸去排泄物。
每日9:00分别向两箱鱼种投喂低糖饲料,使其适应7 d,然后禁食1 d,次日9:00分别投喂低糖、高糖饲料,15:00开始取样。将乌克兰鳞鲤肝胰脏、脑、肾脏、心脏、肌肉取出,提取RNA。
低糖饲料各原料的质量分数:鱼粉8%,豆粕15%,花生粕16%,棉粕8%,菜粕10%,干酒糟高蛋白3%,豆油4%,预混料1%,微晶纤维素25%,麸皮10%,糊精0。
高糖饲料各原料的质量分数:鱼粉8%,豆粕15%,花生粕16%,棉粕8%,菜粕10%,干酒糟高蛋白3%,豆油4%,预混料1%,微晶纤维素0,麸皮10%,糊精25%。
1.2 试剂
RNAisoPlus、PrimeScriptTM1st strand cDNA Synthesis Kit、3’-Full RACE Core Set with PrimeScriptTMRTase、TaKaRa LA Taq购自宝生物工程(大连)有限公司;pGEM-T克隆载体购自普洛麦格生物技术(北京)有限公司;大肠杆菌(Escherichiacoli)DH5α由本校重点实验室提供。其余常规试剂均为国产分析纯。试验所用引物均由苏州金唯智生物科技(北京)有限公司合成。
1.3 乌克兰鳞鲤丙酮酸羧激酶基因全长序列的克隆
取禁食后乌克兰鳞鲤肝胰脏组织,采用Trizol-酚-氯仿法提取肝胰脏总RNA,检索已知鱼类的丙酮酸羧激酶的基因序列,在该序列的中间位置的保守区应用相同原理设计一对具有简并性的上、下游引物。扩增条件:95 ℃ 5 min;94 ℃30 s、57 ℃ 30 s、72 ℃ 1 min,30个循环;72 ℃延伸10 min。用1%的琼脂糖凝胶电泳检测PCR产物。
切胶回收目的片段后连接到pGEM-T载体,连接产物转化感受态细胞DH5α,蓝白斑筛选阳性克隆,菌液PCR检测阳性克隆,提取质粒后送苏州金唯智生物科技(北京)有限公司测序。
根据测序验证后的部分序列设计RACE引物,扩增丙酮酸羧激酶的cDNA的5′和3′末端。PCR反应程序为94 ℃ 30 s、66 ℃ 30 s、72 ℃ 3 min,30个循环。1%琼脂糖凝胶电泳检测PCR产物。切胶回收目的片段后连接到pGEM-T载体,连接产物转化感受态细胞DH5α,蓝白斑筛选阳性克隆,菌液PCR检测阳性克隆,按照试剂盒说明书要求5′末端挑取8个阳性克隆,3′端挑取5个阳性克隆,提取质粒后送苏州金唯智生物科技(北京)有限公司测序。本试验所用引物序列见表1。
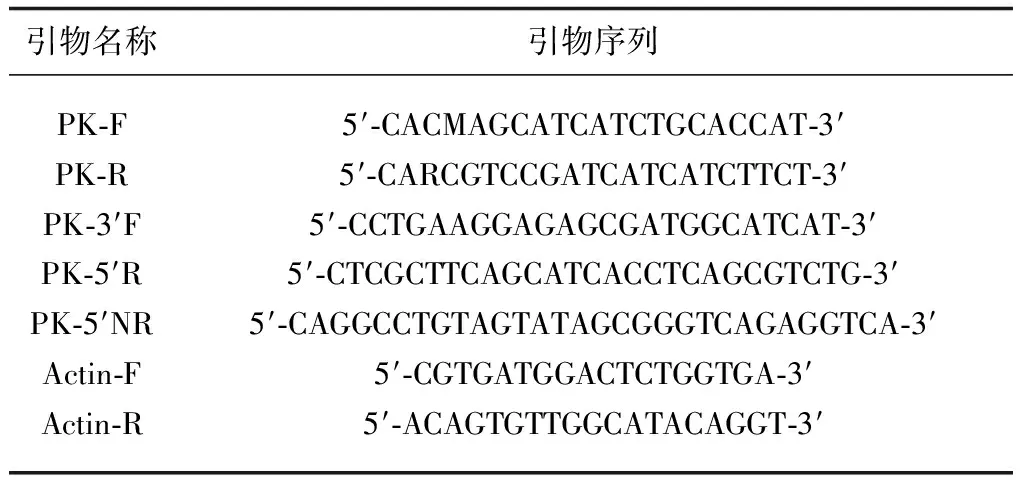
表1 引物
1.4 序列分析
使用DNAStar软件中的EditSeq程序将乌克兰鳞鲤丙酮酸羧激酶基因中间序列、3′端序列和5′端序列的核苷酸数据使用软件将其按顺序拼接起来,得到乌克兰鳞鲤丙酮酸羧激酶基因全长cDNA序列。使用DNAStar软件中的EditSeq程序进行开放阅读框的查询,并对基因进行翻译,同时对蛋白等电点和分子量进行预测。利用NCBI数据库中的Blast工具进行同源性序列搜索,在NCBI数据库的Conserved Domain Search上完成活性位点及结构域的预测。
1.5 乌克兰鳞鲤丙酮酸羧激酶基因在各组织中表达
取低糖组、高糖组乌克兰鳞鲤活体解剖,快速分离肝脏、脑、肾脏、心脏、肌肉和肠等组织,分别提取总RNA,1%变性琼脂糖电泳检测RNA完整性。用PK-F与PK-R为引物进行RT-PCR扩增,同时以β-actin为内标,1.5%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 乌克兰鳞鲤肝胰脏总RNA的制备
肝胰脏总RNA的制备按照TaKaRa RNAisoPlus试剂的说明书进行,经过1%琼脂糖电泳检测,可以看到RNA亮度高,28S条带的亮度约为18S条带亮度的2倍(图1),并且条带清晰,说明本试验制备的RNA质量合格,可以进行后续试验。
2.2 乌克兰鳞鲤丙酮酸羧激酶基因的克隆
以乌克兰鳞鲤正常的肝胰脏组织提取的RNA反转录生成cDNA为模板,以PK-F1和PK-R1为引物,PCR得到约800 bp的中间序列(图2),克隆测序后得822 bp的丙酮酸羧激酶的基因序列,以得到的序列片段为模板设计3′端引物PK-3′ F,得到约1000 bp的3′端序列(图3),克隆测序后为902 bp,并根据中间序列为模板设计5′端引物PK-5′R,PK-5′NR,PCR得到约500 bp的5′端序列(图4),克隆测序后为514 bp。经拼接后得乌克兰鳞鲤丙酮酸羧激酶基因全长序列,其总长为1913 bp,其中开放阅读框1617 bp,翻译539个氨基酸,预测分子质量为58.72 ku,等电点为6.57,3′非翻译区长154 bp及多聚腺苷酸尾巴,5′非翻译区长143 bp。

图1 乌克兰鳞鲤肝胰脏组织总RNA1%琼脂糖凝胶电泳M为DL2000 DNAmarker;1为总RNA.

图2 丙酮酸羧激酶中间片段PCR结果M为DL2000 DNAMarker;1为目的片段.

图3 PK5’端和3’端PCR结果M为DL5000 DNAMarker;1为目的片段.
2.3 乌克兰鳞鲤丙酮酸羧激酶基因的核苷酸组成及推导的氨基酸序列
将各片段的测序结果拼接后,得到乌克兰鳞鲤丙酮酸羧激酶基因全长序列(图5),接下来推导出它的氨基酸序列(图6)。
本试验自乌克兰鳞鲤肝胰脏中分离到了丙酮酸羧激酶基因的cDNA全序列,其开放阅读框长度为1617 bp,共翻译538个氨基酸,预测分子质量为58.72 ku,等电点为6.57。
其中,其氨基酸序列有活性位点1个,其范围包括Arg79和Asn81、Asp119、Phe251、Lys277和Glu279、Asp303、Thr335;其结构域边界包括Asn51和Thr52,Pro113,Ala115,Pro123至Arg126,Val215和Asn216,Val223,Pro226至Asp230,Asp245,Arg253,Ala260,Asn271,Glu307,Asn325和Ser326,Pro330,Gly362,Asp364,Glu393,Ala395和lle396,Arg450,Arg452,Arg454,Gln465,Arg468和Gln469,Gln471,Gln473,Leu475至Gly477。
由NCBI数据库中搜集了斑马鱼(Daniorerio)和草鱼(Ctenopharyngodonidellus)等6种生物丙酮酸羧激酶的氨基酸序列,使用DNAStar中的MegAlign 工具,用Clustal W方法构建了系统进化树,发现乌克兰鳞鲤与草鱼的亲缘关系最接近,其次为斑马鱼和绿河鲀(Tetraodonnigroviridis)(图7)。
2.4 乌克兰鳞鲤丙酮酸羧激酶基因各组织的表达
采用半定量RT-PCR方法对丙酮酸羧激酶基因在肝胰脏、脑、肾脏、心脏、肌肉、肠道等组织的表达进行研究。结果表明,低糖组丙酮酸羧激酶基因在各组织中均有表达,在肝胰脏、脑和心脏中表达较丰富;高糖组丙酮酸羧激酶基因在肝胰脏、脑、肾脏和肠道中有明显表达,其中在肝胰脏和脑中的表达量较丰富,在心脏和肌肉中的表达很微弱(图8~图10)。

图4 丙酮酸羧激酶的核苷酸序列右边数字代表核苷酸编号;阅读框1617 bp,用三联码表示;加尾信号用红色边框表示.

图5 丙酮酸羧激酶所编码的氨基酸序列

图6 丙酮酸羧激酶的各结合位点

图7 乌克兰鳞鲤与部分已知物种的丙酮酸羧激酶系统进化树

图8 低糖组和高糖组半定量PCR结果

图9 低糖组各组织PK表达情况

图10 高糖组各组织PK表达情况
3 讨 论
3.1 乌克兰鳞鲤丙酮酸羧激酶基因的序列分析
乌克兰鳞鲤丙酮酸羧激酶基因的核苷酸序列5′端非翻译区长度为142 bp,草鱼(JQ951928.1)为1 bp,斑马鱼(NM201289.1)为32 bp;该酶的3′端非翻译区长度为154 bp,草鱼为180 bp,斑马鱼为158 bp。
由于在脊椎动物中,丙酮酸羧激酶的同工酶分为四种,分别为M1型、M2型、L型、R型[7-8]。M1型分布于心肌、骨骼肌和脑组织;M2型分布于脑及肝脏等组织[9]。本试验所得的丙酮酸羧激酶基因是从乌克兰鳞鲤肝胰脏中克隆的,因此,可以推断出该酶可能属于M2型同工酶。
丙酮酸羧激酶的作用催化磷酸烯醇式丙酮酸和二磷酸腺苷转化成丙酮酸和三磷酸腺苷,该反应是放能反应。由图6可见,该酶没有三磷酸腺苷结合位点,这印证了该酶在行使其催化功能时不需要三磷酸腺苷的水解供应其能量。
乌克兰鳞鲤与草鱼、斑马鱼和绿河鲀该酶的氨基酸序列在分子结构上均包含1个活性位点和1个结构域边界,各自氨基酸序列上的位置基本一致。
3.2 丙酮酸羧激酶基因组织表达
由图9~图10可见,乌克兰鳞鲤在禁食48 h后,其各组织丙酮酸羧激酶基因的表达水平。丙酮酸羧激酶除在肝胰脏和肾脏中表达水平较高外,还在肠道中表达得较为活跃。这与Pilkis等[10]的研究结果不同,他们发现在饥饿状态下,丙酮酸羧激酶的表达量下降。这个结果表明,乌克兰鳞鲤在饥饿的情况下,机体糖异生所产生的少量丙酮酸会立即进入糖酵解过程,转化为能量供给鱼类的生理活动。乌克兰鳞鲤在进食碳水化合物含量较低的饲料6 h后,其各组织的丙酮酸羧激酶基因的表达水平。丙酮酸羧激酶基因在各组织中均有表达,在肝脏、脑、心脏中表达较丰富,以肝胰脏最多,这与肖玲[11]对松江鲈(Trachidermusfasciatus)丙酮酸羧激酶基因的研究结果基本一致,与Chen等[12]对草鱼丙酮酸羧激酶基因的研究结果一致,与Panserat等[13]对虹鳟(Oncorhynchusmykiss)的研究结果相同,与Knox等[14]对鳕鱼(Gadusmorhua)、欧鲽(Pleuronectesplatessa)的研究结果部分相同,在心脏、脑中含量高,在肝胰脏、肾中相对较低。糖酵解的相关基因丙酮酸羧激酶在肝胰脏、脑、肾脏、肠道中有表达,这也从一个侧面说明当时乌克兰鳞鲤的血糖水平相对较高。
[1] Jobling M,Baardvik B M,Christiansen J S,et al.The effects of prolonged exercise training growth performance and production parameters in fish[J].Aquacul Int,1993,1(2):95-111.
[2] Davison W.The effects of exercise training on teleost fish,a review of recent literature[J].Comp Biochem Physiol A:Physiol,1997,117(1):67-75.
[3] Johansen K A,Overturf K.Alterations in expression of genes associated with muscle metabolism and growth during nutritional restrication and refeeding in rainbow trout[J].Comp Biochem Physiol B:Biochem Mol Biol,2006,144(1):119-127.
[4] Ohta S,Nishikawab A,Imamura K.Molecular cloning and expression of pyruvate kinase from globefish(Fugurubripes)skeletal muscle[J].Comp Biochem Physiol B:Biochem Mol Biol,2003,135(2):397-405.
[5] 高妍,方珍珍,朱国霞,等.不同水平白藜芦醇对乌克兰鳞鲤部分生化指标的影响[J].饲料工业,2015,36(2):25-29.
[6] 梁爱军,王淞,鲍迪,等.乌克兰鳞鲤同工酶及mtDNA D-loop区段的RFLP分析[J].安徽农业科学,2011,39(27):9-13.
[7] Lone Y C,Simon M P,Kahn A,et al.Complete nuclcotide and deduced amino acid sequence of ralt L-type pyruvate kinase[J].FEBS Lett,1986,195(1/2):97-100.
[8] Noguchi T,Yamada K,Inoue H,et al.The L- and R-type isozymes of rat pyruvate kinase are produced from a single gene by use of different promoters[J].J Biol Chem,1987,262(29):14366-14371.
[9] 邵明川.丙酮酸激酶同工酶研究进展[J].生命的化学:中国生物化学会通讯,1983(3):16-18.
[10] Pilkis S,Granner D K.Molecular physiology of the regulation of hepatic gluconeogenesis and glycolysis[J].Annu Rev Physiol,1992,54(1):885-909.
[11] 肖玲.松江鲈(Trachidermusfasciatus)六种糖代谢酶的基因克隆与序列分析[D].济南:山东大学,2011.
[12] Chen Y X,Zhou Y,Liang X F,et al.Molecular cloning,expression and activity of pyruvate kinase in grass carpCtenopharyngodonidella: effects of dietary carbohydrate level[J].Aquaculture,2013,410/411(2):32-40.
[13] Panserat S,Plagnes-Juan E,Kaushik S.Nutritional regulation and tissue specificity of gene expression for proteins involved in hepatic glucose metabolism in rainbow trout(Oncorhynchusmykiss) [J].J Exper Biol,2001,204(13):51-60.
[14] Knox D,Walton M J,Cowey C B.Distribution of enzymes of glycolysis and gluconeogenesis in fish tissues[J].Mar Biol (Berl),1980,56(1):7-10.

