聚肌胞苷酸及地塞米松诱导的胸腺萎缩及胸腺RLR信号通路表达的比较研究*
刘 洋 陈 颂 龚盛强 葛金文 朱惠斌
(湖南中医药大学第一附属医院,长沙 421001)
胸腺作为机体内重要的免疫器官,为迁入胸腺的前体细胞提供基质微环境,指导其增殖、分化成为功能成熟的T淋巴细胞。同时,在人类/猴免疫缺陷病毒(Human immunodeficiency virus or simian immunodeficiency virus ,HIV/SIV)[1]、流感病毒[2]等多种病毒感染后,胸腺可发生萎缩及功能受损,影响T细胞的分化、成熟、迁移以及免疫记忆形成,进而影响整个免疫系统行使正常功能——如通过阻止记忆型CD8+T细胞分化导致中枢免疫耐受[3]。病毒感染后期,胸腺功能损伤还是免疫重建失败的主要机制[4]。因此,研究胸腺功能损伤的机制和调节机制,可促进病毒感染导致胸腺受损的治疗策略和药物的研发。
胸腺萎缩动物模型是研究胸腺功能受损的重要工具。目前国内较多采用糖皮质激素诱导模型,其机制可能与损伤线粒体、诱导胸腺细胞凋亡有关[5];表现为自由基的产生、ATP的减少和线粒体抗氧化防御机制启动;以及细胞色素C依赖的Caspase-9、Caspase-3活化并导致凋亡。近年来研究报道采用聚肌胞苷酸Poly(I∶C)也可诱导胸腺萎缩[6]。Poly(I∶C)是一种病原相关分子模式(Pathogen-associated molecular patterns,PAMP),可部分模拟病毒感染的免疫激活机制。它阻止胸腺细胞从双阴性DN1/DN2阶段往DN3/DN4阶段发育。有意思的是,Poly(I∶C)不仅是TLR-3的特异激活剂,也可激活视黄酸诱导基因1样受体家族(Retinoic-acid-inducible gene Ⅰ like receptors,RLRs)信号通路;文献显示Poly(I∶C)诱导胸腺萎缩的作用依赖于RLR家族[6]。
RLR是一类能识别胞质病毒RNA的模式识别受体,可诱导干扰素和促炎症细胞因子的产生,在抗病毒天然免疫中起着非常重要的作用。该家族包含三个成员:RIG-Ⅰ、黑色素瘤分化相关抗原5(Melanoma differentiation associated gene 5 ,MDA5)以及生理学实验室蛋白2(Laboratory of genetics and physiology 2,LGP2),其中RIG-Ⅰ和MDA5在识别胞质中病毒RNA后,与线粒体外膜的衔接蛋白分子MAVS结合,启动两条信号途径:一是通过活化NF-κB激活促炎症细胞因子基因;二是使干扰素调节因子IRF-3和IRF-7磷酸化,转位后激活Ⅰ型干扰素基因,产生抗病毒效应。此外,RIG-Ⅰ还可激活炎症小体NLRP3并导致IL-1β活化[7]。
根据上述研究报道推测,Poly(I∶C)诱导胸腺萎缩可能通过RLR信号,更接近病毒感染;而DEX的机制可能为直接诱导胸腺细胞凋亡,但缺乏二者的直接比较数据。因此,本研究比较了二者诱导小鼠胸腺萎缩模型的异同及其RLR的改变情况,为在研究病毒感染导致胸腺受损的机制中选择合适的动物模型提供实验依据。
1 材料与方法
1.1材料
1.1.1实验动物 雄性C57BL/6小鼠,8周龄,体质量18~22 g,购于湖南中医药大学第一附属医院动物中心,SPF级动物房饲养。动物许可证号: SCXK-(湘)2015-0003。
1.1.2主要试剂与仪器 Poly(I∶C)(货号:Tllrl-pic-5)购自InvivoGen公司;地塞米松注射液购自湖北天药药业股份有限公司,购自湖南中医药大学第一附属医院,无水乙醇、PBS粉剂、异丙醇、三氯甲烷购自广州化学试剂厂;TRIzol Reagent购自 Life Technologies 公司(货号: 15596026);Primescript RT reagent kit with Gdna Eraser 酶,SYBR Premix EX TaqTMⅡ酶(货号:RR820A,RR047A)购自宝生物TaKaRa公司;全血基因组DNA提取试剂盒购自天根公司(货号DP318);T 细胞受体重排删除环(T cell receptor rearrangementexcision circles,TREC)、β-actin、RIG-Ⅰ、MDA5、LGP2、MAVS、IFNα、IFNβ引物由Primerbank查找,都经过Blast匹对,由华大基因有限公司合成。兔抗小鼠RIG-1(货号:A0545-1ML)购自Cell signaling;兔抗小鼠Actin(货号:A5316)购自美国Sigma公司;二抗:辣根过氧化物酶标记山羊抗兔(货号:#32460)购自美国Thermo Scientific;ECL化学发光显色液购自BIO-RAD公司;SuperSignal West FemtoTrial Kit(货号:#34094)购自美国Thermo Scientific。流式抗体Mouse Naïve/Memory T cell Panel(货号:561609)购于 BD 公司。CFX96 TouchTM实时荧光定量PCR仪为美国BIO-RAD;BHB生物摄影显微镜为日本奥林巴斯;AEL-160型电子天平为日本岛津;流式细胞仪为美国BD FACSCantoⅡ。
1.2方法
1.2.1小鼠胸腺萎缩模型的建立 随机将24只雄性小鼠均分为3组,分别为DEX注射处理组,Poly(I∶C)注射处理组以及正常对照组,每组8只。 DEX注射处理组用 DEX 腹腔注射(20 mg/kg)诱发小鼠胸腺应激性萎缩,隔天1次,共注射2次。Poly(I∶C)注射处理组实验前将Poly(I∶C)粉剂用灭菌生理盐水溶解(1 mg/ml),用于腹腔注射,隔天1次,每次0.2 ml,共注射3次。正常对照组给予等量生理盐水腹腔注射,同为隔天注射。实验期间各组小鼠可自由摄食和饮水。
1.2.2胸腺指数测定 各组小鼠均在末次注射24 h 后,称取小鼠体质量,小鼠麻醉后颈椎脱臼法处死,取胸腺检测。沿小鼠胸部正中线两侧打开胸腔,将胸骨上翻,充分暴露位于胸骨上段后的乳白色胸腺,从根部完整剥离,分离胸腺周边的结缔组织和脂肪后,用滤纸吸取血液,在分析天平上称取质量,按照公式计算胸腺指数。
1.2.3病理组织学观察 留取一侧胸腺,置于4%甲醛溶液中固定24 h后,常规75%、85%、95%、100%乙醇梯度脱水,二甲苯透明,浸蜡,包埋,切片(4 μm),苏木精-伊红染色,在光镜下观察组织的病理改变。
1.2.4外周血T细胞亚群检测 末次注射24 h后,各组小鼠心脏采血100 μl,使用EDTA抗凝管采集,每100 μl外周血加入相应抗体5 μl, 常温避光孵育30 min,加入2 ml溶血素常温避光静置30 min,去除红细胞, PBS清洗1遍,重悬制备成单细胞悬液后,上流式细胞仪检测。分析时,依次选取淋巴细胞群体、CD3+CD4+T细胞群体,根据CD62L和CD44的表达,将CD4细胞分为效应型(CD44+CD62L-)、中央记忆型(CD44+CD62L+)和初始型(CD44-CD62L+)三个亚群。
1.2.5胸腺TREC检测 末次注射24 h后,小鼠心脏采血200 μl,EDTA抗凝后,使用DNA抽提试剂盒,按照试剂盒说明步骤提取血液总DNA,通过紫外分光光度计测定DNA纯度和浓度,将制备好的DNA加入已混有引物的荧光反应液中,进行 PCR 扩增。 反应结束后, 确认实时荧光定量 PCR 的扩增曲线和溶解曲线,得出各试验孔的 Ct 值,并以同一样本中β-actin 的 Ct 值作为内参。引物序列:TREC正向5′-GAAGCTGACAGGGCAGGTTT-3′,反向5′-TGAGCATGGGCAAGCAGTACC-3′;β-actin:正向5′-GAAATCGTGCGTGATCAAAG-3′, 反向5′-TGTAG-TTTCATGCCACAG-3′。 反应条件预变性,95℃、10 min,1个循环;热循环,95℃、15 s,60℃、1 min,40 个循环扩增。
1.2.6RLR/MAVS通路相关基因表达情况 将其取出的另一侧胸腺,放入液氮罐,取出后往组织内加入Trizol研磨,提取总RNA,使用Primescript RT reagent kit with Gdna Eraser 酶试剂盒,在逆转录酶的作用下以RNA为模板逆转录成cDNA,作为Real-time PCR的样本模板,利用SYBR Premix EX TaqTM酶试剂盒,配置含有目标引物的反应液,置于荧光定量PCR 仪扩增。反应条件为 95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40 个循环。RLR/MAVS通路相关基因引物序列为:RIG-Ⅰ:正向5′-CCACCTACATCCTCAGCTACATGA-3′,反向5′-TGGGCCCTTGTT-GTTCTTCT-3′;MDA5:正向5′-AGATCAACACCTGTGGTAACACC-3′,反向5′-CTCTAGGGCCTCCACGAACA-3′;LGP2:正向 5′-GAGACCTGGAACCATCA-3′,反向5′-CCCTCGAGGTGTTTCCAGTA-3′;MAVS正向5′-AGACACCAAGTTGCCCCAAG-3′,反向5′-CTGGA-AGGAAACGGTTGGAGA-3′; Ifna正向5′-GACCTCCACCAGCAGCTCAA-3′,反向5′-ACCCCCACCTGC-TGCAT-3′;Ifnb正向5′-GACGTGGGAGATGTCCTC-AAC-3′,反向5′-GGTACCTTTGCACCCTCCAGTA-3′。 定量PCR的循环温度条件:为 95℃ 15 s,60℃ 1 min,40个循环;并继续以65℃到95℃的溶解曲线以确认无明显非特异性扩增。
1.2.7RLR/MAVS通路相关蛋白表达情况 根据基因表达情况,提取胸腺蛋白,BCA法定量后进行聚丙烯酰胺凝胶电泳、转PVDF膜。5%牛血清白蛋白室温封闭3 h,加入适当浓度的一抗4℃孵育过夜,再置于1∶1 000稀释的辣根过氧化物酶标记的二抗溶液中室温孵育2 h,洗膜后加入ECL发光液显色、扫描,记录下来的照片通过使用Image J软件进行光密度分析。计算时采用RIG-Ⅰ与β-actin的光密度比值的相对表达量
1.3统计学处理 采用SPSS13.0 统计学软件进行数据分析,组间比较采用方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1小鼠胸腺的外观及胸腺指数变化 与正常对照组相比,DEX处理组、Poly(I∶C)处理组小鼠胸腺均呈现不同程度的萎缩,DEX处理组的萎缩程度更明显(图1A),以胸腺质量(mg)/小鼠体质量(g)计算胸腺指数,两组均显著低于正常对照组(P<0.05)(图1B)。表明Poly(I∶C)和DEX均导致胸腺萎缩;DEX组更为严重。
2.2小鼠病理组织学改变 HE染色后观察,可见正常对照组小鼠的胸腺组织结构清晰,皮质髓质分界明显,皮质区淋巴细胞排列整齐、密集,髓质区可见胸腺小体。Poly(I∶C)组胸腺髓质变多(图2短箭头所示),皮髓分界线不明显,单核巨噬细胞增多。DEX组皮质变薄,胸腺细胞数量明显减少(图2长箭头所示),疏松散在,见大量网状上皮细胞;有的细胞胞浆内有空泡形成。可见Poly(I∶C)和DEX诱导的胸腺病理改变特点的差异非常明显,DEX对胸腺皮质的破坏更为明显。
2.3小鼠外周血TREC的定量PCR测定及流式检测初始CD4亚群 定量PCR检测外周血T细胞受体重排删除环(TREC)的表达水平,计算其相对于管家基因β-actin的倍数、判断胸腺输出功能。结果显示,Poly(I∶C)组和DEX组的TREC与正常对照组相比较,减少均非常显著(P<0.01)。而两组之间比较,Poly(I∶C)组的TREC减少更为明显,但差异无统计学意义(图3A)。

图1 各组小鼠的胸腺外观及胸腺指数Fig.1 Thymus and thymus index in each groupNote: A.The appearance of each group of mouse thymus,From the left to the right were normal group,Poly (I∶C) treatment group,DEX treatment group;B.Thymus index chart.**.P<0.01.

图2 各组胸腺的组织形态学Fig.2 Histomorphology of thymus in each groupNote: HE staining of the thyrnustissue,A-C.×100;D-F.×400.
进一步通过流式细胞仪对小鼠外周血CD4比例以及初始/记忆CD4亚群比例的检测发现,Poly(I∶C)导致外周血总CD4以及初始型CD4比例增高,而DEX组的CD4比例略为下降、但无统计学意义;各亚群比例改变不明显。
与DEX相比较,Poly(I∶C)导致的TREC减少有更为严重的趋势,但外周血总CD4比例以及初始型CD4比例增高,提示Poly(I∶C)可能有促进胸腺外初始型CD4增殖的作用。
2.4RLR/MAVS通路相关基因表达情况 与正常对照组相比较,DEX组的RIG-Ⅰ、MDA5、LGP2 mRNA的表达均显著上调(P<0.01),IFN-α/β mRNA的表达也显著升高(P<0.05)。而Poly(I∶C)组这些基因(除IFN-β外)的表达水平虽然略高于正常对照组,但无统计学意义;显著低于DEX组。各组之间MAVS、IL-1β mRNA的差异并不明显(图4)。
2.5RLR/MAVS通路相关蛋白表达情况 由于DEX刺激后RLR家族的RIG-Ⅰ、MDA-5和LGP2 mRNA均上调,我们选择了较有代表性的RIG-Ⅰ进行Western blot验证。结果显示,与管家基因β-Actin相比较,DEX刺激后RIG-Ⅰ蛋白的含量明显增高;Poly(I∶C)刺激后也略有增高、但与正常对照组比较差异并不显著(图5)。
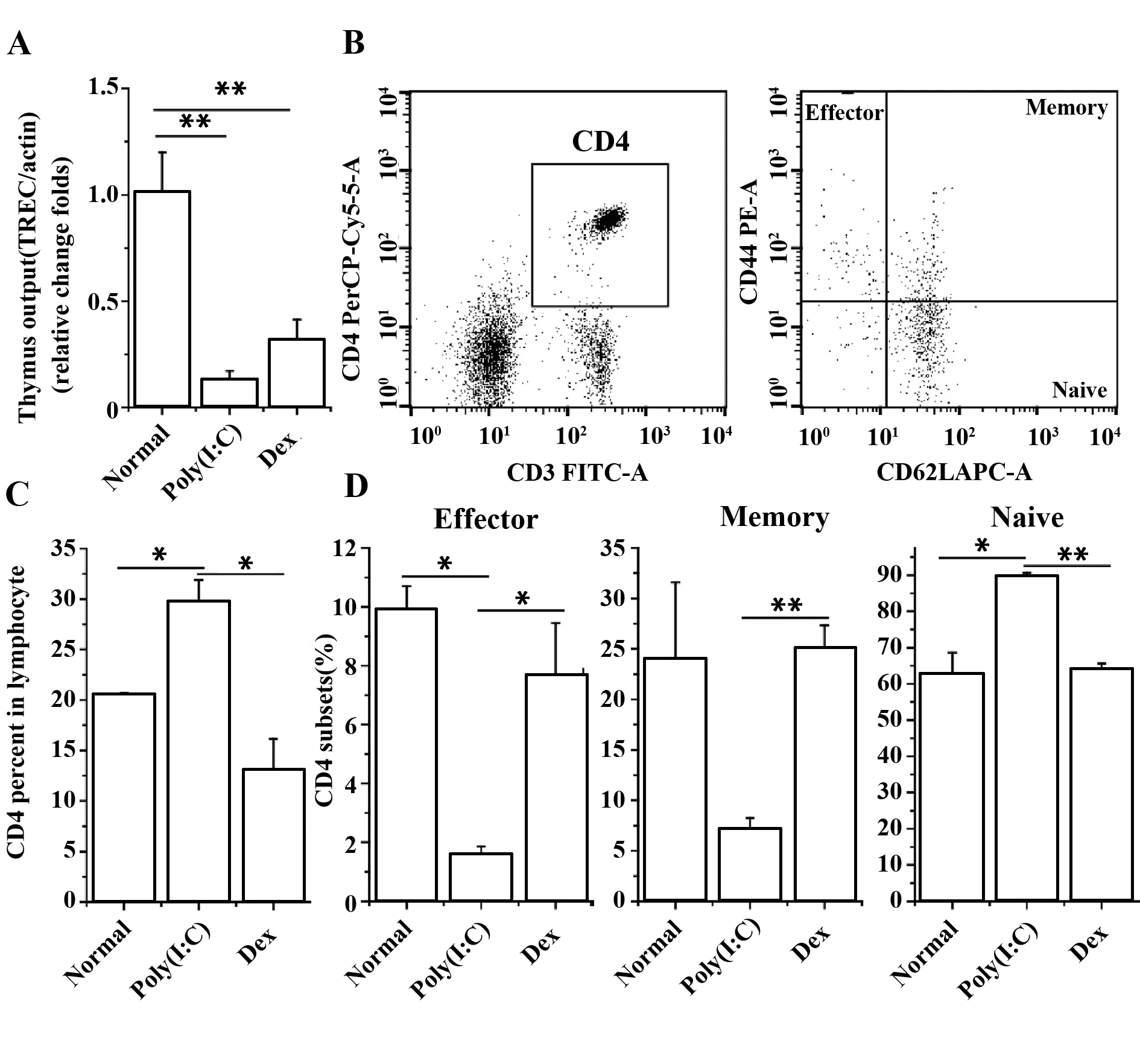
图3 外周血TREC和CD4亚群的检测Fig.3 Detection of TREC and CD4 subgroups in peripheral bloodNote: A.The expression of TREC gene in peripheral blood of mice in each group;B.The flow cytometry of CD4 group in normal group;C.The expression of CD4 T cells in lymphocytes of each group;D.Flow chart of CD4 subgroups.*.P<0.05,**.P<0.01.

图4 胸腺RLR/MAVS/IFN-α/β及IL-1β基因表达的改变Fig.4 Changes of RLR/MAVS/IFN-α/β and IL-1β gene expression in thymusNote: *.P<0.05,**.P<0.01.

图5 胸腺RIG-Ⅰ蛋白水平的检测Fig.5 Detection of thymus RIG-Ⅰ protein levelsNote: *.P<0.01.
3 讨论
胸腺是T细胞发育、分化和成熟的重要场所,在其中发生的事件涉及到抗感染免疫、自身免疫与免疫耐受、免疫重建等重要课题[4]。因此,深入探讨病毒感染导致胸腺萎缩及胸腺功能受损的机制及调节机制,有可能研发出新的治疗靶点及药物。
胸腺萎缩动物模型是研究胸腺功能损伤的重要工具。目前国内常采用肾上腺糖皮质激素(如地塞米松)诱导产生胸腺萎缩模型,其机制可能为诱导CD4+CD8+双阳性(DP)胸腺细胞凋亡,导致强烈的胸腺细胞消耗——糖皮质激素受体信号在胸腺细胞的选择和凋亡中起着重要的调控作用[8],并导致许多基因反式激活或抑制[9,10]。然而,该模型可能与病毒感染导致的胸腺萎缩存在较大差异。还是以HIV/SIV病毒感染为例,如果采用DEX诱导的胸腺萎缩模型来进行研究,存在以下问题:① HIV/SIV感染损伤胸腺功能的机制可能包括:HIV病毒直接感染破坏胸腺细胞、病毒蛋白诱导细胞凋亡[11]、天然免疫系统的激活、炎症及胶原沉着等。显然,糖皮质激素诱导胸腺萎缩有可能代表了HIV/SIV感染导致胸腺细胞凋亡的部分机制[11],但并不全面。②DEX诱导了胸腺的严重萎缩和破坏,而文献中SIV诱导的胸腺萎缩程度并不严重[2],我们推测此差异可能是因为DEX导致的胸腺细胞凋亡远比SIV感染剧烈。③曾有研究采用糖皮质激素治疗HIV感染,在较长时间内维持了免疫系统不被破坏[12];这也提示糖皮质激素可以对抗HIV感染导致免疫破坏的一些机制,如抗炎。因此,必须采用其他模型、才能比较全面地模拟HIV/SIV感染导致的胸腺损伤和进行相应药物的研发。
文献报道聚肌胞苷酸Poly(I∶C)通过MDA5相关的途径引起的胸腺快速萎缩[6],为我们提供了一个重要的工具。MDA5识别高度保守的病原体相关分子模式,如dsRNA,从而启动下游的MAVS分子,进而分泌趋化因子和细胞因子,诱导干扰素的表达。有意思的是,多项研究表明在HIV/SIV感染中,Ⅰ型干扰素参与了胸腺萎缩、胸腺细胞发育受损的形成[13,14]。近期的研究更直接证实Ⅰ型干扰素参与了后期T细胞的胸腺内成熟[15]。据此,我们推测RLR(RIG-Ⅰ/MDA5)-IFN-α/β通路可能在病毒感染介导的胸腺萎缩和胸腺功能损伤中起到重要作用。
本研究发现,DEX和Poly(I∶C)两种造模方法都能使胸腺退化及输出减少;而Poly(I∶C)在胸腺的病理损伤以及初始型CD4+T细胞亚群改变上更接近SIV感染。但是,DEX明显上调了RIG-1、MDA5、LGP2及下游的IFNα/β mRNA;而文献[6]显示MDA5介导Poly(I∶C)引起的胸腺萎缩,因此,我们推测MDA5可能也介导了DEX诱导的胸腺萎缩。跟文献报道不一致的地方在于,本研究Poly(I∶C)造模方法中MDA5-Ⅰ型IFN通路虽然也有一定程度的上调、但差异并不明显。我们推测,是因为该文献采用的是MDA5基因敲除小鼠,而我们研究的是DEX和Poly(I∶C)刺激后MDA5的表达情况,可能存在由于反馈调节对基因表达的抑制。另一方面,Poly(I∶C)导致外周血初始型CD4比例增高,类似于我们在前期研究中发现的SIV病毒感染急性期初始型CD4增高[16];而DEX无此效应。因此推测Poly(I∶C)可能模拟出SIV感染导致外周初始型CD4升高的诱导机制。值得我们进一步研究。
总之,两种造模方式均可造成胸腺萎缩和功能损伤,但机制和病理表现截然不同。深入探讨比较二者的异同,有助于选择合适的模型、理解病毒感染损伤胸腺功能的机制,并最终助力相关疾病的研究和药物研发。
参考文献:
[1] Sodora DL,Milush JM,Ware F,etal.Decreased levels of recent thymic emigrants in peripheral blood of simian immunodeficiency virus-infected macaques correlate with alterations within the thymus[J].J Virol,2002,76:9981-9990.
[2] Liu B,Zhang X,Deng W,etal.Severe influenza A(H1N1)pdm09 infection induces thymic atrophy through activating innate CD8(+)CD44(hi) T cells by upregulating IFN-gamma[J].Cell Death Dis,2014,5:e1440.
[3] Takamura S,Kajiwara E,Tsuji-Kawahara S,etal.Infection of adult thymus with murine retrovirus induces virus-specific central tolerance that prevents functional memory CD8+T cell differentiation[J].PLoS Pathog,2014,10(3): e1003937.
[4] Li T,Wu N,Dai Y,etal.Reduced thymic output is a major mechanism of immune reconstitution failure in HIV-infected patients after long-term antiretroviral therapy[J].Clin Infect Dis,2011,53:944-951.
[5] Venugopalan SK,T SS,VN,etal.Dexamethasone provoked mitochondrial perturbations in thymus: Possible role of N-acetylglucosamine in restoration of mitochondrial function[J].Biomed Pharmacother,2016,83:1485-1492.
[6] Anz D,Thaler R,Stephan N,etal.Activation of melanoma differentiation-associated gene 5 causes rapid involution of the thymus[J].J Immunol,2009,182:6044-6050.
[7] Liu Y,Olagnier D,Lin R.Host and viral modulation of RIG-I-mediated antiviral immunity[J].Front Immunol,2017,7:662.
[8] Prenek L,Boldizsar F,Kugyelka R,etal.The regulation of the mitochondrial apoptotic pathway by glucocorticoid receptor in collaboration with Bcl-2 family proteins in developing T cells[J].Apoptosis,2017,22:239-253.
[9] Xavier AM,Anunciato AK,Rosenstock TR,etal.Gene expression control by glucocorticoid receptors during innate immune responses[J].Front Endocrinol (Lausanne),2016,7:31.
[10] Meijsing SH.Mechanisms of glucocorticoid-regulated gene transcription[J].Adv Exp Med Biol,2015,872:59-81.
[11] Rosenzweig M,Connole M,Forand-Barabasz A,etal.Mechanisms associated with thymocyte apoptosis induced by simian immunodeficiency virus[J].J Immunol,2000,165:3461-3468.
[12] Andrieu JM,Lu W.Long-term clinical,immunologic and virologic impact of glucocorticoids on the chronic phase of HIV infection[J].BMC Med,2004,2:17.
[13] Sivaraman V,Zhang L,Su L.Type I interferon contributes to CD4+T cell depletion induced by infection with HIV-1 in the human thymus[J].J Virol,2011,85:9243-9246.
[14] Dutrieux J,Fabre-Mersseman V,Charmeteau-De Muylder B,etal.Modified interferon-alpha subtypes production and chemokine networks in the thymus during acute simian immunodeficiency virus infection,impact on thymopoiesis[J].AIDS,2014,28:1101-1113.
[15] Xing Y,Wang X,Jameson SC,etal.Late stages of T cell maturation in the thymus involve NF-kappaB and tonic type I interferon signaling[J].Nat Immunol,2016,17:565-573.
[16] 陈 颂,吴小闲,卢耀增,等.中国恒河猴感染SIV后T淋巴细胞初始、记忆亚群的变化[J].中国免疫学杂志,2012,28(6):483-488.
CHEN S,WU XX,LU YZ,etal.Dynamics of T cell memory subtypes in SIV infected Chinese rhesus monkeys[J].Chin J Immunol,2012,28(6):483-488.

