塞来昔布抑制COX-2和PD-1发挥抗肝癌作用
詹 磊 程良斌 蔡 岳
(湖北省中医院肝病科,武汉 430060 )
肝癌的死亡率仅次于肺癌[1],全世界每年有近60万新增肝癌患者,中国的肝癌发病率及死亡率均高居世界首位[1,2]。原发性肝细胞癌(Hepatocellular carcinoma,HCC)的发病机制复杂,其发生、发展和转移与肿瘤细胞的多基因突变、免疫逃避、细胞信号传导通路异常等均有关[2-4]。T淋巴细胞免疫是机体对抗肿瘤细胞的主要免疫机制[2,4]。报道指出,肝癌细胞能通过修饰自身表面抗原改变肝癌的微环境,从而逃避免疫监视。程序性死亡蛋白1(Programmed death 1,PD-1)主要由T淋巴细胞表达。PD-1通过与PD-L1及PD-L2的结合传递信号,从而抑制T淋巴细胞激活,诱导T淋巴细胞凋亡[5]。报道指出,肝癌组织中PD-1/PD-L1的高表达可抑制CD8阳性T淋巴细胞的增殖、诱导T淋巴细胞凋亡,引起机体抗肿瘤免疫反应下降[6]。另外,PD-1/PD-L1信号通路可抑制IL-2与γ干扰素的产生,从而刺激T淋巴细胞分泌IL-10,抑制T淋巴细胞活性[7]。PD-1或PD-L1抗体已被应用于临床,并取得了一定的疗效。美国FDA已批准PD-1抗体作为治疗黑色素瘤、非小细胞肺癌的临床用药[8]。
COX-2可通过前列腺素途径在肿瘤免疫应答中发挥抑制免疫的作用[9]。塞来昔布(Celecoxib)是一种特异性环氧化酶2(COX-2)抑制剂,现已被广泛应用于各类肿瘤的化疗及放疗增敏治疗[10]。近期的研究指出,黑色素瘤中COX-2的表达与PD-L1呈显著正相关[11]。而关于COX-2能否影响PD-1的功能以及塞来昔布的抗肝癌机制是否依赖PD-1尚无人报道。
1 材料与方法
1.1材料
1.1.1资料来源 本次研究共纳入2012年2月~2016年6月我院收治的65例行手术治疗的原发性肝细胞癌患者作为研究对象;所有患者中男性58例,女性7例;患者的年龄介于30~72岁之间,平均(50.3±7.6)岁;所有患者HBsAg(乙肝表面抗原)均为阳性;参照2011版原发性肝细胞癌的诊疗规范进行诊断,所有患者均确诊为原发性肝细胞癌;术后诊断显示所有患者的肝癌标本均为肝细胞癌;所有患者均接受核苷酸类似物抗病毒治疗,入院后检测HBV DNA均为阴性;排除临床资料不完整的患者;排除长期营养不良患者;排除长期卧床患者;排除近期及长期服用影响机体免疫药物患者;排除并发其他肿瘤患者。另选取15例我院肝胆外科提供的肝脏正常组织标本作为对照;对照组患者的年龄介于30~48岁之间,平均(45.6±11.9)岁。纳入研究的所有患者均告知本次研究的目的及方法,所有患者均签署知情同意书,研究获得医院伦理委员会批准。
1.1.2材料与设备 主要试剂包括塞来昔布(美国辉瑞公司),COX-2抗体(美国Santa Cruz公司),PD-1抗体、CD8抗体(美国Abcam公司),Foxp3抗体(武汉博士德生物工程有限公司),β-actin抗体(武汉三鹰生物技术有限公司)。流式抗体包括:FITC标记的CD8抗体、APC标记的CD4抗体、PE标记的CD25抗体(美国BioLegend公司)。SDS-PAGE试剂(上海碧云天生物技术有限公司)。DMEM培养基、胎牛血清(FBS)(美国Gibco公司),青霉素、链霉素(美国Sigma公司)。小鼠淋巴细胞分离液(天津灏洋生物制品科技有限公司)。Lipofectamine®2000转染试剂(Thermo Fisher)。PD-1及对照siRNA(广州锐博生物科技有限公司)。BALB/c小鼠购自武汉大学实验动物中心。H22细胞(H22-H8D8)购自美国ATCC公司。主要设备包括CO2培养箱、超净工作台、流式细胞仪、Bio-Rad垂直电泳仪,Bio-Rad、Western blot化学发光成像系统。
1.2方法
1.2.1小鼠模型的建立 从液氮中取出冻存的H22小鼠肝癌细胞,37℃水浴中迅速复苏,用注射器(2 ml)抽取后迅速注入BALB/c雌性小鼠(共10只)腹腔内。取接种肿瘤7 d后生长良好的H22荷瘤小鼠,颈椎脱臼处死,消毒后剪开并剥去皮肤,用无菌注射器(5 ml)穿过腹壁肌层抽取腹水,用PBS液将肿瘤细胞稀释至1×107cells/ml。另选取45只BALB/c雌性小鼠,每只背部皮下注射腹水稀释液0.2 ml。
1.2.2分组及给药 接种后第2天将H22荷瘤小鼠随机分为对照组、塞来昔布组和PD-1抗体组,每组15只。对照组小鼠不予任何特殊处理;塞来昔布组小鼠每天以200 mg/kg塞来昔布进行灌胃,连续用药28 d;PD-1抗体组给予PD-1抗体腹腔注射,100 μl/只,每3天给药一次,共9次。每隔1天进行1次肿瘤大小测量,测量肿瘤的最长径(a)与最短径(b),按(a×b2/2)公式计算肿瘤的体积(V),绘制肿瘤的生长曲线与小鼠的生存曲线。末次给药24 h后将所有存活小鼠脱臼处死,用EDTA-K2抗凝剂采血管收集小鼠静脉血,置于冰盒中保存,取100 μl用于流式细胞检测。完整取出肿瘤组织,多聚甲醛固定,用于病理检测及免疫组化染色。
1.2.3免疫组化染色 将石蜡切片常规脱蜡至水,0.01 mol/L枸橼酸缓冲液(pH6.0)高压锅抗原热修复,加3%H2O2室温避光孵育30 min,PBS洗5 min×3次。采用SP法检测COX-2、PD-1、CD8及Foxp3水平。即用10%正常非免疫羊血清37℃孵育60 min,滴加一抗工作液4℃冰箱过夜,PBS洗5 min×3次。滴加二抗工作液,37℃孵育60 min,PBS洗5 min×3次。滴加辣根过氧化物酶标记的链霉卵白素,37℃孵育60 min,PBS洗5 min×3次。DAB显色、苏木素复染、脱水、二甲苯透明、中性树胶封片。每个切片随机选取5个视野,显微镜下观察染色阳性细胞所占百分比。
1.2.4流式细胞术检测 取100 μl加入抗凝剂的小鼠静脉血,根据说明书加入适当比例的待测抗体(CD8、CD4、CD25),混匀后室温避光孵育30 min。向每管中加入1 ml红细胞裂解液,室温避光溶血10 min。1 500 r/min离心5 min,弃上清。加1 ml PBS洗涤,1 500 r/min离心3 min,弃上清。加0.5 ml PBS重悬细胞,混匀上流式仪检测。CD4+CD25+T细胞即为Treg。
1.2.5小鼠PBMC分离及检测 小鼠PBMC的分离严格按照产品说明书进行。将分离的PBMC进行体外培养,分别转染PD-1与对照siRNA,使用100 μmol/L塞来昔布或空白处理各组细胞,37℃、5% CO2培养箱继续培养36 h后收细胞样。Western blot检测各组细胞COX-2、PD-1、CD8及Foxp3水平。

2 结果
2.1患者的基本信息 研究初期共纳入93例HCC患者,其中9例临床资料不完整,6例长期营养不良,3例长期卧床,2例为恶性肿瘤患者,5例有近期服用影响机体免疫药物史,3例并发其他肿瘤。最终65例患者被纳入本次研究。所有患者中40例(61.5%)患者的年龄≥50岁;58例(69.8%)为男性。所有患者均为肝硬化及HBsAG阳性患者。患者的临床病理分级与分期等情况见表1所示。
2.2肝癌组织COX-2与PD-1的表达及相关性分析 对HCC患者及正常组织标本进行IHC分析,光密度分析结果显示,HCC患者肿瘤组织中COX-2与PD-1的表达水平均显著高于对照组(P<0.001)。Pearson相关性分析显示,HCC患者肿瘤组织中COX-2的表达水平与PD-1呈显著正相关(R2=0.673,P<0.001),见图1。
2.3小鼠模型的建立与分析 皮下注射H22细胞后所有小鼠均成功建模。给药4周后对照组、塞来昔布组和PD-1抗体组分别有6只、12只和13只存活。塞来昔布、PD-1抗体治疗小鼠的肿瘤生长曲线和生存曲线均显著优于对照组(P<0.05),塞来昔布组、PD-1抗体组小鼠的肿瘤生长曲线和生存曲线相比差异均无统计学意义(P>0.05)。IHC与流式分析显示,塞来昔布能显著降低肿瘤组织中PD-1的表达(P<0.001);塞来昔布与PD-1抗体均能使肿瘤组织及外周血CD8+T细胞显著增多(P<0.001),使Treg细胞显著减少(P<0.001),见图2、3。
表1患者的基本信息
Tab.1Basicdataofpatients

Parameters[n(%)]Parameters[n(%)]Age≥50y40(61.5)HBsAG65(100.0)Male58(89.2)BCLCstageCirrhosis65(100.0)A17(26.2)Child-PughclassB22(33.8)A27(41.5)C15(23.1)B21(32.3)D11(16.9)C17(26.2)PathologicalgradeAFP(μg/L)Welldifferentiated21(32.3)≥40049(75.4)Moderatelydifferentiated26(40.0)<40016(24.6)Poorlydifferentiated18(27.7)
Note:AFP.alpha-fetoprotein;HBsAG.The hepatitis B surface antigen;BCLC.Barcelona clinic liver cancer.

图1 肝癌组织中COX-2与PD-1表达水平及相关性分析Fig.1 Expression and correlation of COX-2 and PD-1 in the tissue of liver cancerNote:A.Immunohistochemical results of COX-2 and PD-1;B.IOD analysis of IHC staining;C.Correlation analysis.**.P<0.001.
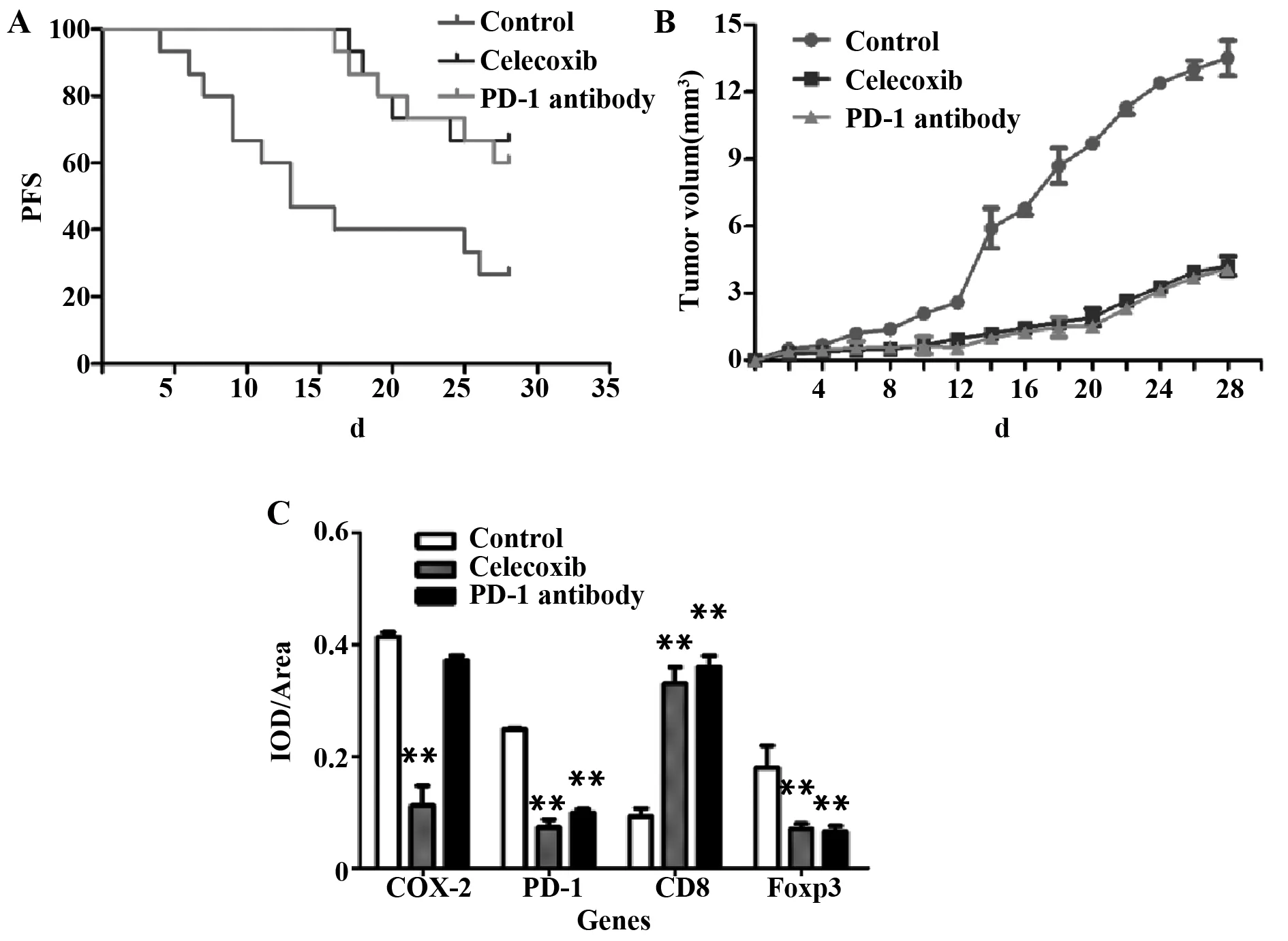
图2 小鼠模型分析Fig.2 Mice model analysisNote:A.Survival curve;B.Tumor growth curve;C.IOD analysis of IHC staining.**.P<0.001.

图3 小鼠模型分析Fig.3 Mice model analysisNote:A,B.Results offlow cytometry analysis of peripheral blood.**.P<0.001.

图4 Western blot检测小鼠PBMC中COX-2、PD-1、CD8与Foxp3水平Fig.4 Western blot analysis of COX-2,PD-1,CD8 and Foxp3 level in PBMC
2.4PBMC中COX-2、PD-1、CD8与Foxp3水平检测 Western blot结果显示,塞来昔布能显著降低小鼠PBMC的COX-2、PD-1、CD8及Foxp3水平,而不影响转染PD-1 siRNA后PBMC的CD8及Foxp3水平,如图4所示。
3 讨论
塞来昔布为非甾体类抗炎药,能特异性抑制COX-2 的合成,具有特异性强、副作用小的特点。大量临床、体内外实验及流行病学分析均证明塞来昔布能针对多种肿瘤发挥促进肿瘤细胞凋亡、抑制肿瘤细胞增殖、抑制肿瘤新生血管形成以及预防肿瘤发生的作用[9]。COX-2在多种肿瘤细胞中表达增强,对肿瘤的发生、发展中起重要作用[9,10]。临床数据分析表明COX-2的表达量与肿瘤的大小、分期及淋巴结转移数目紧密相关[11]。报道指出,COX-2可通过前列腺素途径在肿瘤的免疫应答中发挥免疫抑制作用[12]。COX-2诱导的地诺前列酮能抑制自然杀伤细胞活性和T淋巴细胞、B淋巴细胞的增殖,从而降低干扰素γ与IL-2的合成,促进肿瘤细胞的生长[7,10,13]。
近期的研究指出,使用塞来昔布能有效抑制小鼠肝癌的生长,降低荷瘤小鼠肿瘤浸润淋巴细胞及外周血中的Treg比例[14]。塞来昔布抑制肿瘤生长可能与其下调Treg水平及参与肿瘤免疫调节有关。目前尚无报道对COX-2抑制剂是通过何种信号传导机制调节Treg水平的研究。
本次研究发现,HCC患者肿瘤组织中COX-2与PD-1的表达水平均显著高于正常肝脏标本。同时,HCC患者肿瘤组织中COX-2的表达水平与PD-1呈显著正相关。这些结果表明COX-2与PD-1可能在肝癌的发生发展中均发挥重要作用,同时,提示这两种分子之间可能存在一定的联系。PD-1和其配体PD-L1、PD-L2是免疫检查点信号的重要分子,其介导的免疫抑制是肿瘤细胞逃避免疫细胞识别与杀伤的重要方式[5,6,15]。PD-1在肿瘤特异性T细胞、肿瘤浸润淋巴细胞及一些损伤相关的T细胞中高表达,其配体PD-L1在多种肿瘤细胞中均有表达。采用抗PD-1/PD-L1的免疫疗法在黑色素瘤、肾癌、非小细胞肺癌等多种肿瘤中均取得了显著疗效。已有文献指出,在肝炎向肝癌转化过程中PD-1及其配体PD-L1、PD-L2的表达水平显著上调,并且PD-1、PD-L1与PD-L2均与肝癌细胞的恶性程度显著相关[16]。
本次小鼠模型实验显示,塞来昔布与PD-1抗体治疗均能显著改善小鼠的肿瘤生长曲线和生存曲线。另外,塞来昔布与PD-1抗体组小鼠的肿瘤生长曲线和生存曲线相比差异均无统计学意义。塞来昔布能显著降低肿瘤组织中PD-1的表达;塞来昔布与PD-1抗体均能使肿瘤组织及外周血中Treg细胞显著减少,同时使CD8+T细胞显著增多。这些结果表明塞来昔布的确可以通过影响肿瘤免疫发挥抗肿瘤的效果,且其调节肿瘤免疫的机制可能与PD-1抗体类似。为了进一步研究塞来昔布的作用机制,我们分离了小鼠PBMC进行体外实验,结果表明,塞来昔布能显著降低小鼠PBMC的COX-2、PD-1、CD8及Foxp3水平,而对转染了PD-1 siRNA后的PBMC则不能进一步降低CD8及Foxp3水平。
综上所述,HCC患者肿瘤组织中COX-2与PD-1均显著增高。塞来昔布能降低PD-1的表达水平,这可能是其调节肿瘤免疫从而发挥抗肝癌作用的机制之一。
参考文献:
[1] Burkhart RA,Ronnekleiv-Kelly SM,Pawlik TM.Personalized therapy in hepatocellular carcinoma:molecular markers of prognosis and therapeutic response [J].Surg Oncol,2017,26(2):138-145.
[2] 许 洋,刘子荣,张雅敏.原发性肝癌的免疫治疗进展[J].山东医药,2017,6(2):177-180.
Xu Y,Liu ZR,Zhang YM.Progression in immunotherapy of primary liver cancer[J].Shandong Med J ,2017,6(2):177-180.
[3] 易永祥,王 建,张 彤,等.肝细胞癌患者外周血CD33+HLA-DR-MDSCs的监测及临床意义[J].中国免疫学杂志,2015,31(11):1520-1523.
Yi YX,Wang J,Zhang T,etal.Study on detection and clinical significance of CD33+HLA-DR-MDSCs cells in hepatocellular carcinoma[J].Chin J Immunol ,2015,31(11):1520-1523.
[4] Longo V,Gnoni A,Casadei Gardini A,etal.Immunotherapeutic approaches for hepatocellular carcinoma [J].Oncotarget,2017,8(20):33897-33910.
[5] Boussiotis VA,Chatterjee P,Li L.Biochemical signaling of PD-1 on T cells and its functional implications [J].Cancer J,2014,20(4):265-271.
[6] Park HJ,Park JS,Jeong YH,etal.PD-1 upregulated on regulatory T cells during chronic virus infection enhances the suppression of CD8+T cell immune response via the interaction with PD-L1 expressed on CD8+T cells [J].J Immunol,2015,194(12):5801-5811.
[7] Porichis F,Hart MG,Zupkosky J,etal.Differential impact of PD-1 and/or interleukin-10 blockage on HIV-1-specific CD4 T cell and antigen-presenting cell functions [J].J Virol,2014,88(5):2508-2518.
[8] McDermott J,Jimeno A.Pembrolizumab:PD-1 inhibition as a therapeutic strategy in cancer [J].Drugs Today(Barc),2015,51(1):7-20.
[9] Vosooghi M,Amini M.The discovery and development of cyclooxygenase-2 inhibitors as potential anticancer therapies [J].Expert Opin Drug Discov,2014,9(3):255-267.
[10] 杨文静,王 璐,孙 锐.不同浓度柚皮苷对人宫颈癌HeLa细胞体外增殖及其COX-2表达影响[J].中国免疫学杂志,2016,32(8):1200-1203.
Yang WJ,Wang L,Sun R.Effect of naringin on growth and COX-2 expressions in human cervical cancer Hela cell line[J].Chin J Immunol ,2016,32(8):1200-1203.
[11] Botti G,Fratangelo F,Cerrone M,etal.COX-2 expression positively correlates with PD-L1 expression in human melanoma cells [J].J Transl Med,2017,15(1):46.
[12] Liu X,Ji Q,Ye N,etal.Berberin inhibits invasion and metastasis of colorectal cancer cells via COX-2/PGE2 mediated JAK2/STAT3 signaling pathway [J].PLoS One,2015,10(5):e0123478.
[13] Hermankova B,Zajicova A,Javorkova E,etal.Suppression of IL-10 production activated B cells via a cell contact-dependent cyclooxygenase-2 pathway upregulated in IFN-γ-treated mesench-ymal stem cells [J].Immunobiology,2016,221(2):129-136.
[14] 徐大恒,陈 霖,唐承薇等.COX-2抑制剂塞来昔布对肝癌小鼠CD4+CD25+调节T细胞的影响[J].四川大学学报(医学版),2013,44(4):545-549.
Xu DH,Chen L,Tang CW,etal.Effect of cyclooxygenase-2 inhibitor on CD4+CD25+regulatory T cells in mouse hepatocellular carcinoma[J].J Sichuan Uni (Medical Science Edition),2013,44(4):545-549.
[15] Topalian SL,Drake CG,Pardoll DM.Targeting the PD-1/B7-H1(PD-L1)pathway to activate anti-tumor immunity [J].Curr Opin Immunol,2012,24(2):207-212.
[16] Wang BJ,Bao JJ,Wang JZ,etal.Immunostaining of PD-1/PD-Ls in liver tissues of patients with hepatitis and hepatocellular carcinoma [J].World J Gastroenterol,2011,17(28):3322-3329.

