应用PCR-DGGE技术分析不同性状窖泥的细菌群落结构
卢 振,孟 镇,钟其顶*,张世伟,吕志远,肖冬光
(1.天津科技大学 生物工程学院,天津 300457;2.中国食品发酵工业研究院,北京 100015;3.济南趵突泉酿酒有限责任公司,山东 济南 250115)
我国白酒历史悠久,多种微生物混合发酵及独特的生产工艺形成了白酒不同的风格与香型,其中浓香型白酒以窖香浓郁,绵甜醇厚等特点赢得了消费者的青睐,在白酒行业中占据主导地位。在浓香型白酒酿造过程中,新窖泥、窖底泥和窖壁泥因水分活度、静压强度、厌氧环境[1-2]等原因逐渐形成了窖泥微生物生长繁殖的微生态系统。窖池泥对白酒呈香呈味起着至关重要的作用,然而窖泥板结、结晶、钙化等现象[3-5]有一定的延滞性,工厂无法及时发现窖泥质量退化进而影响原酒品质。岳媛媛等[6-7]分析了正常窖泥的优势微生物,但仅限于可培养微生物,加之培养要求高、耗时长等原因而无法作为工厂检测窖泥质量的有效指标。现代分子生物学方法克服了可培养方法的弊端,如黄莹娜等[8]基于高通量测序技术比较了两种不同窖龄窖泥的主要细菌组成结构;袁玉菊等[9]利用聚合酶链反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)方法分析了新窖泥、老窖泥的细菌群落结构差异,极大丰富了对窖泥中微生物的认识,但多数报道是从研究角度分析不同窖龄、不同性状、不同地区窖泥微生物群落结构差异的,而工厂应用方面的案例相对较少,在实际应用中工厂要综合时间、成本和可靠性选择一种技术手段来判定窖泥的性质,以保证酿造车间窖泥的正常使用。
本研究以新窖泥、窖壁泥和窖底泥作为研究对象,应用PCR-DGGE技术对窖泥进行细菌群落结构分析,以期找到指示不同类型窖泥的微生物指纹图谱或条带,以期为工厂深入探究窖泥质量评价方法和人工养护提供参考,进而正确指导工厂稳定酿造白酒。
1 材料与方法
1.1 材料与试剂
样品取自山东某酒厂浓香型白酒酿造车间的窖壁泥、窖底泥以及培育好待入池的新窖泥,新窖泥X、P取自不同的酵房。窖泥样品如表1所示。

表1 窖泥样品编号Table 1 Number of pit mud samples
窖底泥和新窖泥采用“五点取样法”,即取四周的四个点与中心一点混合均匀。窖壁泥则从距窖池顶部50 cm的窖壁四周取样,混合均匀后置于-20℃冰箱备用,每组窖泥取2个平行样品提取基因组DNA。
四甲基乙二胺、过硫酸铵、尿素(均为分析纯),溶菌酶、蛋白酶K(均为生化试剂):生工生物工程(上海)股份有限公司;DNA Marker、Gel Stain染料、Trans Taq HIFIDNA Polymerase、pEASY-T1 Cloning Kit试剂盒:北京全式金生物技术有限公司;所有引物合成及测序由生工生物(上海)股份有限公司完成。
LB(Luria Bertani)液体培养基:酵母浸粉5 g,胰蛋白胨10 g,氯化钠10 g,去离子水定容至1 000 mL,调节pH至7.5,121℃灭菌20 min后加入氨苄青霉素,使其终浓度为10μg/mL;LB固体培养基再加入20 g琼脂粉;北京陆桥技术有限公司。
1.2 仪器与设备
T100型PCR扩增仪、DYCP-31E型琼脂糖电泳仪:北京六一仪器厂;DCodeTM System变性梯度凝胶电泳系统、凝胶成像仪:美国Bio-Rad公司。
1.3 实验方法
1.3.1 窖泥基因组提取及PCR扩增
在无菌条件下,称取0.3 g样品于2 mL的离心管中,加1 mL脱色液,漩涡振荡3~5 min后,37℃水浴15 min,10 000 r/min离心10 min,弃上清,重复上述步骤3~4次,直至上清液较浅。参考孟镇等[10]的方法,提取窖泥总DNA,琼脂糖凝胶电泳检测后,置于-20℃保存。
以提取的窖泥基因组DNA为模板,利用F338GC/R518通用引物扩增16SrRNA V3区,目的片段长度约230 bp[11]。扩增体系为:DNA模板1μL,10×PCR Buffer缓冲液5 μL,dNTP 4μL,正反向引物各1μL,Taq酶0.5μL,ddH2O补平至50μL。为减少非特异性扩增,采用降落PCR扩增程序即:95℃预变性5min;94℃变性5min,65~55℃50s(每个循环后退火温度下降0.5℃),72℃、3min,20个循环;94℃、1min,55℃、50 s,72℃、3 min,10个循环;72℃延伸10 min。PCR产物经2.5%的琼脂糖凝胶电泳检测后置于-20℃糖凝保存,以备后续DGGE检测。
1.3.2 变性梯度凝胶电泳
制备浓度为8%的聚丙烯酰胺凝胶,变性剂浓度梯度为40%~60%(100%变性剂为7 mol/L尿素,40%去离子甲酰胺),PCR产物上样量为45μL。待1×TAE缓冲液加热至60℃后,先在20V电压条件下电泳30min再调至120 V,电泳6 h。电泳结束后的凝胶置于Gelstain染液中染色60 min,清水脱色20 min后置于成像系统中观察,拍照。
1.3.3 DGGE图谱分析
利用Quantity one4.6.2软件根据图谱中条带光密度值进行数据处理分析。本研究主要使用Shannon-Wiener多样性指数(H),Simpson辛普森指数(D),Pielou均匀度指数(E)来反映群落个体分布的均匀性、种群之间的多样性变化[12]。利用UPGMA算法[13]对不同窖泥样品进行聚类,分析窖泥样品间的相似性系数(CS)。
1.3.4 DGGE条带的回收、克隆、测序
从凝胶上切取目的条带,加入超纯水4℃过夜,取1μL上清液,以不带GC夹子的通用引物再次扩增DNA片段,扩增体系及程序同1.3.1。扩增产物经纯化后,采用pEASY-T1 Cloning Kit试剂盒将目的片段与载体连接,连接产物与大肠杆菌Trans1-T1感受态细胞融合后在37℃、180 r/min培养10h,然后转接至LB固体平板上,从平板上挑取阳性克隆子至2mLLB液体培养基中,菌液送生工测序公司进行测序。
2 结果与分析
2.1 窖泥16SrRNA V3区PCR扩增结果

图1 16S rRNA片段扩增琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of 16S rRNA fragment amplification
由图1可知,不含样品DNA模板的空白对照干净无条带,12个样品的16SrRNA V3区目的片段长度在230 bp左右,与理论结果一致,并且获得的扩增片段亮度高,清晰无杂带,可满足后续的DGGE分析。
2.2 DGGE指纹图谱的丰度及优势度比较

图2 窖泥细菌的16S rRNA V3区PCR-DGGE指纹图谱Fig.2 PCR-DGGE fingerprints of 16S rRNA V3 region from bacterial community in pit mud
由图2可知,不同性状的窖泥样品经过电泳均可分离出多条电泳条带。图中2~12号是正常窖壁泥、窖底泥和新窖泥中的共有条带。除了共有条带外,1号和18号为正常窖壁泥中的特有条带;13号条带仅存在于窖底泥中;14号、15号、16号和17号是新窖泥(X、P)的特有条带;退化窖壁泥(B)仅有1号、2号和6号三条明显条带;退化窖底泥(F)除10号条带比正常窖底泥(E)亮度高外,其他优势条带的亮度相对较暗。
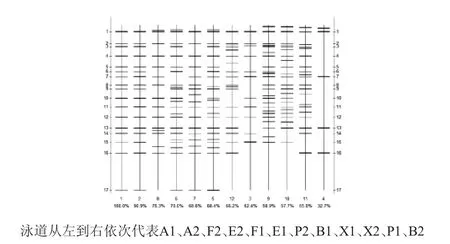
图3 PCR-DGGE图谱细菌群落丰度示意图Fig.3 Schematic diagram of bacterial community abundance by PCR-DGGE fingerprints
由图3可知,与正常窖壁泥泳道条带相似程度由高到低依次是正常窖底泥、退化窖底泥、新窖泥和退化窖壁泥;不同类型窖泥的丰度为5~24,其中新窖泥最高,4个新窖泥样品的平均丰度值为21,窖底泥和窖壁泥次之,平均丰度值为18.5,退化窖壁泥最低,最低丰度值仅为5。DGGE指纹图谱中,18个条带的优势度都>5%,可以作为窖泥中生物量较高的微生物,即优势菌。
2.3 窖泥细菌DGGE指纹图谱多样性指数以及相似性比较
Shannon-Wiener多样性指数,Simpson辛普森指数(D),Pielou均匀度指数(E)是用来表征微生物群落多样性的重要参数,已经广泛应用于评价土壤、污水等环境质量[14]。对窖泥样品微生物多样性的统计结果见表2。由表2可知,新窖泥Shannon-Wiener多样性指数在2.47左右,辛普森指数和均匀度指数均高于窖壁泥和窖底泥,微生物种类最丰富,个体分布最均匀;2组窖壁泥之间、2组窖底泥之间的多样性指数差异明显。通常认为相似指数高于0.60的群体具有较好的相似性[15],本研究基于DGGE指纹图谱的条带光密度值对12个样品进行聚类,聚类结果如图4。由图4可知,4个新窖泥(X1、X2、P1、P2)单独聚为一类,相似度高于0.66;窖底泥(E1、E2、F1、F2)聚为一类,相似度达到0.67;窖壁泥(A1、A2)与窖壁泥(B1、B2)分别聚类,相似度为0.61与0.68。由此可以看出,不同类型窖泥的细菌指纹图谱差异明显,杜礼泉等[16]研究发现丰谷酒业白酒窖泥质量与细菌的相似性指数呈正相关,图中也发现窖底泥退化前后的相似值为0.67,窖壁泥退化前后的相似值<0.45,由此验证了优势微生物数量变少、群落结构多样性降低是窖泥退化引起质量差异的主要原因,因此可利用PCR-DGGE细菌指纹图谱方法对退化窖泥进行快速、高效判定,及时更换新窖泥,以保证白酒的正常酿造。
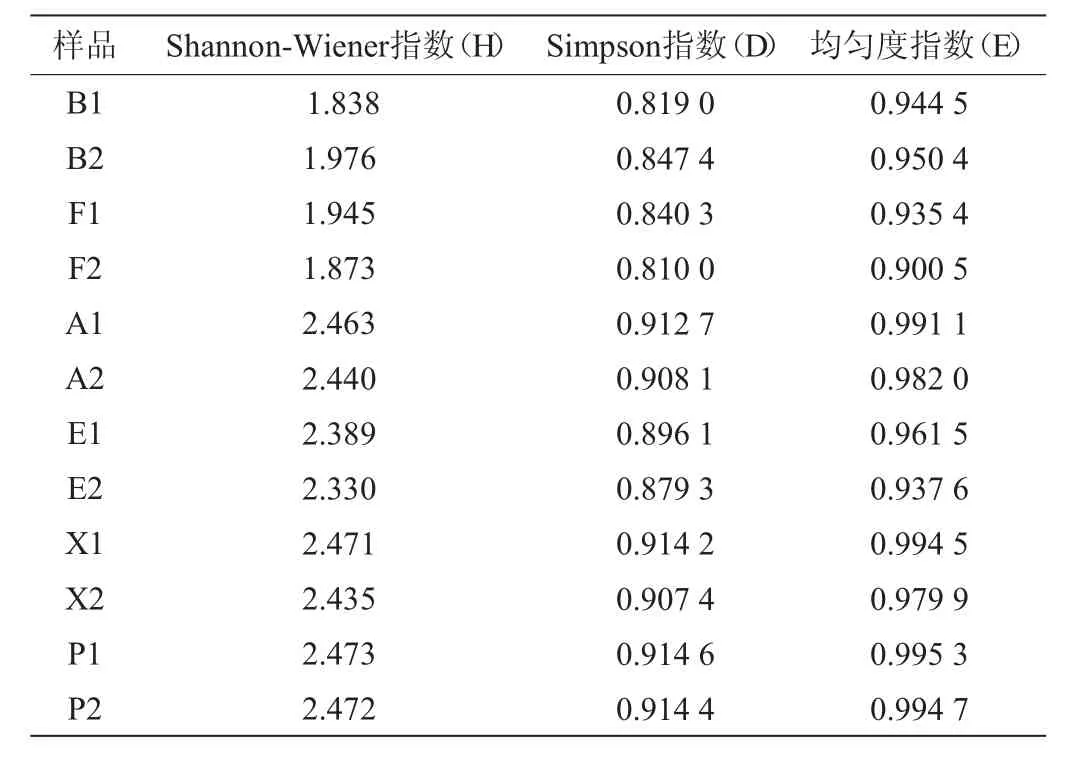
表2 窖泥细菌群落多样性指数Table 2 Diversity indexes of bacterial community in pit mud
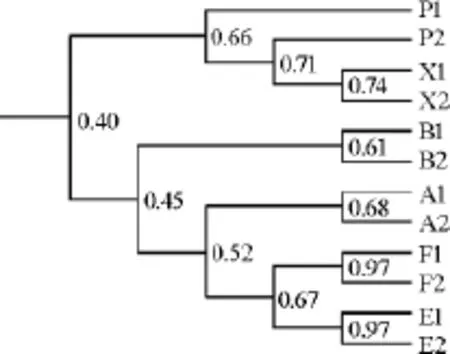
图4 不同窖泥细菌群落相似性指数树状图Fig.4 Similarity dendrogram of bacterial community of different pit mud
2.4 窖泥细菌DGGE图谱优势菌的测序分析
从浓香型窖壁泥、窖底泥和新窖泥中选取18个标记的亮度高、分离清晰的条带(见图2),经过切胶回收、纯化连接、克隆转化、测序后,将测序结果在NCBI上进行BLAST比对,测序结果见表3。由表3可知,在所测的18个条带中得到的最相似序列主要有互营单胞菌属(Syntrophomonas)、梭状芽胞杆菌(Clostridium)、组织菌属(Tissierella)、Alkaliflexus、乙酸氧化菌属(Syntrophaceticus)、热厌氧杆菌属(Thermacetogenium)、四联球菌属(Tetragenococcus)、里氏杆菌属(Riemerella)、双歧杆菌属(Bifidobacterium)和Tumebacillus等。由此说明使用基于免培养方法的分子生物学技术可直接对窖泥样品总DNA分析,丰富白酒发酵微生物的菌种资源,为更好地揭示白酒发酵微生物群落结构及探究窖泥质量提供强有力的技术手段。

表3 DGGE优势条带的细菌16S rRNA基因测序结果Table 3 16S rRNA bacterial gene sequencing results of predominant bands by DGGE
2.5 窖泥DGGE图谱优势条带系统发育学分析

图5 窖泥中细菌16S rRNA的系统发育树Fig.5 Phylogenetic tree based on the 16S rRNA of bacteria obtained from pit mud
不同类型窖泥中优势微生物共14个属(种),由图5可知,各菌侏分别属于4个门:拟杆菌门(ClusterⅠ)、放线菌门(ClusterⅡ)、厚壁菌门(ClusterⅢ)、变形菌门(ClusterⅣ)。窖壁泥、窖底泥和新窖泥中共有的优势微生物属于厚壁菌门类(Firmicutes)和拟杆菌门类(Bacteroides),包括四联球菌属(Tetragenococcus)、互营单胞菌属(Syntrophomonas),该属菌能将长链脂肪酸转化成氢气、乙酸,与其共生的产甲烷菌能利用氢气改变分压以促进己酸合成[17],此菌属在该厂窖泥中含量丰富,而且在四川浓香型窖池窖泥中也有报道[18];梭菌(Clostridiales),能代谢产生乙酸、丁酸、乙醇、丁醇等产物[19],与浓香型白酒中香气成分相关;泰氏菌(Tissierella)能够将肌酸酐、多肽、氨基酸等转化为乙酸、丁酸和异戊酸等成分;互营乙酸氧化菌(Syntrophaceticus schinkii)和热厌氧杆菌(Thermacetogenium)严格厌氧,以乙醇、糖类化合物、氨基酸为底物,能将乙酸转化为甲烷[20-21];瘤胃菌(Ruminococcaceae)能够降解纤维素。新窖泥中微生物最丰富,涵盖了上述4个门类,其特有优势微生物为嗜热双歧杆菌(Bifidobacteriumthermophilum)、托木尔假单胞菌(Pseudomonastuomuerensis)、Riemerell属和Enterobacterale科。Alkaliflexus属为退化窖壁泥中的优势菌属,该属能够代谢糖类、醇类和丙酮酸合成乙酸。Tumebacillus属微生物只存在于窖壁泥中。紫单孢菌科(Porphyromonadaceae),仅存在与窖底泥中,该微生物能够分解葡萄糖产生CO2,进而调节窖泥的pH,促进窖泥的成熟。
3 结论
利用PCR-DGGE技术对不同性状浓香型白酒窖泥进行微生物群落结构分析。从DGGE指纹图谱中可以看出,新窖泥、窖壁泥和窖底泥有11个共同条带,新窖泥的丰度和多样性最高,窖底泥次之,窖壁泥最低。根据窖泥的类型进行细菌群落间的相似度分析,发现新窖泥能够单独聚为一簇,窖底泥聚为一簇;2组窖壁泥间相似性差异明显。
对不同类型窖泥的优势微生物进行测序后发现,窖泥中优势微生物包含拟杆菌门(Bacteroides)、放线菌门(Actinomyces)、变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)4个门类,其中新窖泥中微生物最丰富,涵盖上述门类,假单胞菌Pseudomonas属、Enterobacterale科,Riemerella属和双歧杆菌属(Bifidobacterium)为新窖泥特有的优势微生物。窖池泥中主要是拟杆菌门(Bacteroides)和厚壁菌门(Firmicutes)2类。从窖池窖泥中检测到的互营单胞菌属(Syntrophomonas)、丙酮丁醇梭杆菌(C.acetobutylicum)、互营乙酸氧化菌(S.schinkii),都与浓香型白酒香气成分形成有关,此外互营单胞菌属(Syntrophomonas)在该厂窖泥中含量丰富,为多条优势条带的最高相似菌属。Alkaliflexus属在退化窖壁泥中含量高,Tumebacillus属微生物只存在于窖壁泥中。
因此工厂可以利用PCR-DGGE方法开展窖泥微生物群落结构分析,总结DGGE图谱规律,及时发现退化窖泥。研究中发现退化窖泥中优势微生物种类减少,与正常窖泥的DGGE指纹图谱可明显区分,为了验证其差异,将继续探究窖泥的真菌、古菌群落结构,同时会采用荧光定量手段对各类窖泥的优势菌、特征菌进行定量检测,通过定性定量信息建立不同类型、不同质量等级窖泥的指纹图谱数据库,并跟踪窖泥的感官评分、理化指标以及原酒成分,探究退化窖泥的理化特征,出具窖泥综合质量信息报告,为工厂预防窖泥退化提供数据参考。
参考文献:
[1]谢 军,朱莉莉,邓 波,等.浓香型白酒窖泥水分含量与水分活度的对比研究[J].中国酿造,2018,37(1):79-81.
[2]李 良,郑桂朋,吴 昊,等.浓香型白酒夏冬两季生产车间及大曲中霉菌与放线菌的分离纯化[J].中国酿造,2017,36(11):54-58.
[3]吴树坤,刘 梅,邓 杰,等.不同品质浓香型窖泥的酶活与微生物群落的相关性[J].食品与发酵工业,2018,44(1):19-24.
[4]张家庆,宋瑞滨,曹敬华,等.人工老窖窖泥结晶初步分析[J].中国酿造,2014,33(3):21-23.
[5]陈 彬,闫寅卓,王德良,等.浓香型白酒窖泥钙化成因及缓解措施的初步探究[J].中国酿造,2016,35(10):36-40.
[6]岳元媛,张文学,刘 霞,等.浓香型白酒窖泥中兼性厌氧细菌的分离鉴定[J].微生物学通报,2007(2):251-255.
[7]任道群,唐玉明,易 彬,等.浓香型酒建窖窖泥厚度与微生物菌种群的关系研究[J].中国酿造,2012,31(10):49-51.
[8]黄莹娜,熊小毛,胡远亮,等.基于PCR-DGGE和高通量测序分析白云边酒窖泥细菌群落结构与多样性[J].微生物学通报,2017(2):375-383.
[9]袁玉菊,张倩颖,曾丽云,等.不同性状窖泥的细菌群落结构与酸酯含量分析[J].食品与发酵工业,2017,43(1):44-48.
[10]孟 镇,熊正河,钟其顶,等.应用PCR-DGGE技术解析白酒大曲细菌群落结构[J].食品与发酵工业,2010,36(10):159-162.
[11]AMPE F,BEN OMAR N,MOIZAN C,et al.Polyphasic study of the spatial distribution of microorganisms in Mexican pozol,a fermented maize dough,demonstrates the need for cultivation-independent methodsto investigatetraditional fermentations[J].Appl Environ Microbiol,1999,65(12):5464-5473.
[12]ZOETENDAL EG,AKKERMANSA D L,VOSW M D.Temperature gradient gel electrophoresis analysis of 16S rRNA from human fecal samples reveals stable and host-specific communities of active bacteria[J].Appl Environ Microbiol,1998,64(10):3854-3589.
[13]GRONAUI,MORANS.Optimal implementationsof UPGMA and other common c-lustering algorithms[J].Inform Process Lett,2007,104(6):205-210.
[14]李延茂,胡江春,张 晶,等.杉木连栽土壤微生物多样性的比较研究[J].应用生态学报,2005(7):1275-1278.
[15]陈法霖,张 凯,郑 华,等.PCR-DGGE技术解析针叶和阔叶凋落物混合分解对土壤微生物群落结构的影响[J].应用与环境生物学报,2011,17(2):145-151.
[16]杜礼泉,罗惠波,黄治国,等.不同质量窖泥细菌群落的研究[J].中国酿造,2014,33(10):113-117.
[17]ZHANGCY,LIU X L,DONGX Z.Syntrophomonas curvata sp.nov.,an anaerobethat degradesfatty acidsin co-culturewith methanogens[J].Int J Syst Evol Microbiol,2004,54(3):969-973.
[18]刘 颖,刘茂柯,任道群,等.利用DGGE分析窖泥复合功能菌液的细菌群落结构[J].中国酿造,2016,35(10):88-90.
[19]何景昌,张正波,裘娟萍.生物丁醇合成途径中关键酶及其基因的研究进展[J].食品与发酵工业,2009,35(2):116-120.
[20]WESTERHOLM M,ROOSS,SCHNÜRERA.Syntrophaceticus schinkii gen.nov.,sp.nov.,an anaerobic,syntrophic acetate-oxidizing bacterium isolated from a mesophilic anaerobic filter[J].FEMS Microbiol Lett,2010,309(1):100-104.
[21]WESTERHOLM M,ROOSS,SCHNÜRERA.Tepidanaerobacter acetatoxydans sp.nov.,an anaerobic,syntrophic acetate-oxidizing bacterium isolated from two ammonium-enriched mesophilic methanogenic processes[J].Syst Appl Microbiol,2011,34(4):260-266.

