真菌发酵液中纤维素酶分离提取工艺研究
李秋园,代淑梅,杨 明
(中溶科技股份有限公司研发中心,河北省非粮乙醇工程技术研究中心,河北 唐山 064000)
目前,世界各国都在积极研究利用非粮手段生产生物燃料,用以解决日益严重的能源危机、气候问题以及粮食短缺问题。木质纤维素作为地球上储量最丰富的多糖类物质,利用其生产燃料乙醇已成为各国研究的热点领域[1-5]。但由于木质纤维素结构致密复杂,大多数微生物并不能将其作为直接碳源来生产乙醇,只有将其水解成可发酵单糖类物质后,才能被微生物利用[6-8]。酶解法由于其反应条件温和、效率高、能耗低、选择性强以及环保效果好等优点,被广泛应用于纤维素水解过程中[9-10]。但由于纤维素酶体系复杂,加大了从发酵液中分离提取较高纯度的纤维素酶的难度,目前文献报道的纤维素酶提取工艺大多是为了获得纯纤维素酶组分并进行酶学性质的研究,其工艺很难在工业中进行应用。在传统的酶粗提方法中,盐析法过程温和,不会使酶分子发生变性,硫酸铵由于其具有较强的盐析能力、较高的水溶性以及较低的温度系数,因此在蛋白质及酶的盐析过程中常被使用[11];但盐析过程适合小规模酶的分离提取过程,而当生产规模较大时,由于需要大量的无机盐,会对后续环保处理带来较大压力;而膜分离过程不需要添加化学试剂,而且整个过程温和,不会造成酶分子的变性失活,当然,膜分离过程也存在投资成本偏高,膜易堵塞等问题。因此,在实际生产中可根据需要选择适宜的工艺路线。本试验对纤维素酶的分离提取工艺中的盐析工艺路线和膜分离路线均进行了研究,并在纤维素酶的粗分离基础上,对其进行了凝胶色谱分离,使其满足生产需要,以期对纤维素酶的工业化生产提供指导意义。
1 材料与方法
1.1 材料与试剂
里氏木霉(Trichoderma reesei):中溶科技股份有限公司研发中心保藏。
硫酸铵、磷酸二氢钾、磷酸氢二钾(均为分析纯):天津市致远化学试剂有限公司。
1.2 仪器与设备
0.22 μm微滤膜、截留分子质量分别为6×104Da中空纤维超滤膜(记为膜1)和1×104Da中空纤维超滤膜(记为膜2)(膜面积均为1.2 m2,最大操作压力均为0.065 MPa):合肥信达膜科技有限公司;KU-T5紫外可见分光光度计:南京肯凡电子科技有限公司;FA2004电子天平:上海舜宇恒平科学仪器有限公司;SHY-2A水浴恒温振荡器:江苏金坛市金城国胜实验仪器厂;PHS-3C精密酸度计:上海仪电科学仪器股份有限公司;G-75凝胶色谱:北京瑞达恒辉科技发展有限公司。YZ1515X蠕动泵:保定兰格恒流泵有限公司;HD-21-88紫外检测仪:上海淇特分析仪器有限公司;N2000双通道色谱工作站:浙江大学智达信息工程有限公司;FD-1A-50真空冷冻干燥机:上海利闻科学仪器有限公司。
1.3 实验方法
1.3.1 纤维素酶发酵液制备及预处理方法
利用实验室保藏的里氏木霉(Trichoderma reesei)菌种制备纤维素酶发酵液,所用培养基和培养方法参考文献[12]中纤维素酶的制备方法进行。将所得发酵液经过0.22μm微滤膜除去菌体及固形物,收集滤液,备用。
1.3.2 纤维素酶液的(NH4)2SO4盐析处理
向经过预处理的纤维素酶液中缓慢加入(NH4)2SO4,边加边搅拌,使(NH4)2SO4充分溶解,并使其饱和度分别达到10%、20%、30%、40%、50%、60%、70%、80%、90%,充分搅拌,将其置于4℃冰箱中冷藏过夜;然后于5 000 r/min离心10 min,收集上清液,测定上清液中纤维素酶活性和蛋白质浓度,同时将沉淀进行冷冻干燥并称质量,测定沉淀中纤维素酶活性和蛋白质浓度,并计算酶活收率和纯化倍数。
1.3.3 纤维素酶液的二级超滤分离
在室温条件下,将经过预处理的纤维素酶液首先以不同的操作压力(0.01 MPa、0.02 MPa、0.03 MPa、0.04 MPa、0.05 MPa、0.06 MPa)通过截留分子质量为6×104Da的超滤膜(记为膜1),收集透过液,计算膜通量并测定透过液中纤维素酶活性;再将透过液以不同的操作压力流过截留分子质量为1×104Da的超滤膜(记为膜2),收集截留液,计算膜通量及测定截留液中纤维素酶活性。膜通量计算公式如下:

1.3.4 G-75凝胶色谱层析法
将经过二级盐析和二级超滤的纤维素酶进行冷冻干燥,分别用0.2 mol/L pH7.4的磷酸缓冲液溶解,使纤维素酶溶液的质量分数为20%,以0.5柱体积(bed volume,BV)的上样量进行G-75凝胶色谱层析,用0.2 mol/L pH7.4的磷酸缓冲液以1.0 mL/min的流速进行洗脱,收集各洗脱峰,测定各洗脱峰的纤维素酶活性,将具有纤维素酶活性的洗脱峰合并,并将其冷冻干燥,测定其纤维素酶活性,计算纤维素酶活收率及纯化倍数。
1.3.5 纤维素酶活性测定方法
参考中华人民共和国能源行业标准NB/T 13005—2016《用于生物燃料乙醇制备的纤维素酶酶活力测定方法》[13]中规定的方法测定纤维素酶活力。
1.3.6 检测方法
蛋白质浓度测定:采用考马斯亮蓝法[14]。
纤维素酶活收率、纯化倍数、蛋白质浓度比计算公式[15]如下:

式中:U1、U2为分离前、后纤维素酶液中纤维素酶活性,U/mL;V1、V2为分离前、后酶液体积,mL;m1、m2为分离前后纤维素酶液冷冻干燥后酶粉的质量,g;P2为分离后纤维素酶粉中纤蛋白质含量,mg/g。
总酶活收率为各步分离纯化的酶活收率乘积;总纯化倍数为各步分离纯化的纯化倍数乘积。
2 结果与分析
2.1 (NH4)2SO4盐析饱和度的确定
向预处理后的纤维素酶液中加入(NH4)2SO4,使之达到不同的饱和度,沉淀之后分别测定上清液和沉淀中蛋白质浓度和纤维素酶活性,结果如图1、图2所示。

图1 上清液和沉淀中纤维素酶活性随(NH4)2SO4饱和度的变化Fig.1 Changes of cellulase activity in supernatant and precipitate with saturation level of(NH4)2SO4
由图1可知,当(NH4)2SO4饱和度在0~20%范围内时,上清液和沉淀中纤维素酶活性变化不大,沉淀中纤维素酶活性很低,说明纤维素酶仅有很少量的沉淀,而图2显示在此饱和度范围内,上清液中蛋白质含量逐渐下降,沉淀中蛋白质含量逐渐增大,可能是预处理后纤维素酶液中有部分杂蛋白发生了沉淀;当(NH4)2SO4饱和度在20%~80%范围内时,随着(NH4)2SO4饱和度的增大,上清液中纤维素酶活性急剧下降,沉淀中纤维素酶活性迅速增大,其蛋白质浓度的变化趋势与其相似,当(NH4)2SO4饱和度>80%时,上清液中蛋白质浓度继续下降,沉淀中蛋白质浓度持续增加,但此时上清液和沉淀中的纤维素酶活性变化较小,说明上清液中的纤维素酶已几乎完全沉淀。因此,选择向预处理后的纤维素酶液中初始加入20%饱和度的(NH4)2SO4,可使部分杂蛋白沉淀,再将(NH4)2SO4饱和度增加至80%,使上清液中的纤维素酶沉淀,此过程即为(NH4)2SO4二级盐析过程,该过程不仅能使纤维素酶得到浓缩,而且能去除部分杂蛋白,经计算,该过程纤维素酶纯化倍数为4.28,纤维素酶活收率为95.50%。
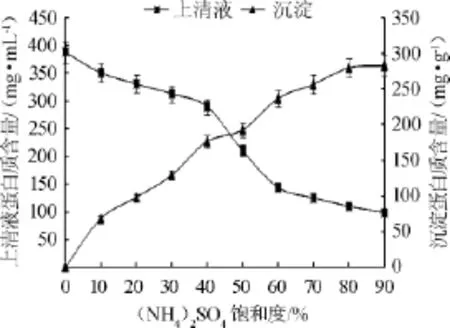
图2 上清液和沉淀中蛋白质含量随(NH4)2SO4饱和度的变化Fig.2 Changes of protein concentration in supernatant and precipitate with the saturation level of(NH4)2SO4
2.2 操作压力对超滤膜通量的影响
将预处理后的纤维素酶液以不同的操作压力通过膜1和膜2,其膜通量随操作压力的变化曲线如图3所示。
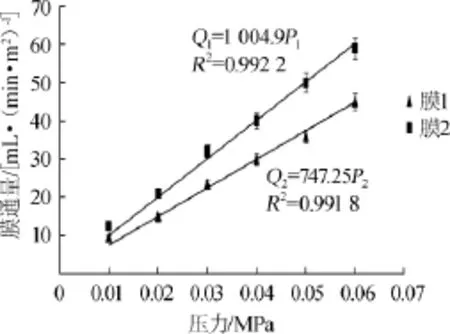
图3 操作压力对超滤膜通量的影响Fig.3 Effect of operating pressure on the flux of ultrafiltration membrane
由图3可知,随着操作压力(P)的增大,两个膜的膜通量(Q1和Q2)均呈增加的趋势,且膜通量与操作压力呈正相关,对其线性回归方程拟合为:Q1=1 004.90P1,相关系数R2=0.972 2;Q2=747.25P2,R2=0.997 5。在相同的操作压力下,膜2的膜通量均大于膜1,这是由于预处理后的纤维素酶液首先通过膜1,在此过程中能除去体系中的部分杂蛋白和其他杂质成分,使得通过膜2的纤维素酶液中杂质含量较少,故在相同的操作压力下,膜2较膜1具有较高的通量。由于本实验所选的中空纤维膜的最高操作压力为0.065MPa,考虑到膜的使用寿命及工业生产对高通量的要求,选择0.050 MPa为膜1的操作压力,膜1的膜通量为37.362 mL/(min·m2),由于纤维素酶液的二级超滤过程为连续过程,故膜1和膜2具有相同的膜通量,因此,当膜2的膜通量为37.362 mL/(min·m2)时,由拟合方程可知其对应的操作压力为0.037 MPa。因此对于经过预处理后的纤维素酶液,首先以0.050 MPa的操作压力通过膜1,收集滤过夜,再以0.037 MPa的操作压力通过膜2,收集截留液,此截留液即为经过二级超滤浓缩后的纤维素酶液,经计算,该过程的纤维素酶纯化倍数为3.15,酶活收率为97.60%。
2.3 纤维素酶液的凝胶色谱分离结果
将经过二级盐析和二级超滤提取的纤维素酶分别进行G-75凝胶色谱层析,结果如图4所示。

图4 二级盐析(A)和二级超滤(B)后纤维素酶液G-75凝胶色谱图谱Fig.4 Gel chromatogram of cellulase solution G-75 after secondary salting-out(A)and secondary ultrafiltration(B)
由图4可知,经二级盐析和二级超滤提取获得的纤维素酶分别经过G-75凝胶色谱层析,均获得5个洗脱峰,经测定,1号、2号、3号洗脱峰具有纤维素酶活性,这是由于纤维素酶是一种复合酶系,由葡聚糖内切酶、葡聚糖外切酶和β-葡糖糖苷酶组成,且三种酶所带电荷和分子质量均不同[20-21],因此在进行凝胶色谱层析过程中,其不同组分的纤维素酶分布于不同的洗脱峰中。将图4(A)中的1号、2号、3号洗脱峰合并,冷冻干燥后测定其纤维素酶活性为13 675.76 U/g,计算其酶活收率为96.3%,纯化倍数为7.34;将图4(B)中的1号、2号、3号洗脱峰合并,冷冻干燥后经测定其纤维素酶活性为12 769.87U/g,经计算,其酶活收率为95.2%,纯化倍数为6.74。
2.4 分离提取纤维素酶两种工艺对比
本研究建立了两种分离提取纤维素酶的生产工艺,即二级盐析-G-75凝胶色谱法(简称盐析-色谱法)和二级超滤-G-75凝胶色谱法(简称超滤-色谱法),两种工艺的对比结果如表1所示。

表1 两种分离提取纤维素酶工艺对比Table 1 Comparison of two kinds of separation and extraction process of cellulase
由表1可知,两种工艺的总酶活收率均>90%,而且超滤色谱法略高于盐析色谱法;盐析色谱法的总纯化倍数为31.41,超滤色谱法为21.23,说明盐析-色谱法较超滤-色谱法能获得更高纯度的纤维素酶,经过盐析-色谱法提取后,纤维素酶活性为13675.76U/g,高于超滤-色谱法(12769.87U/g)。但从实际生产过程及规模来看,盐析过程由于要加入大量无机盐,会对后续环保处理带来较大压力,而且盐析过程不适合连续操作,而膜分离过程适合连续操作,并且处理规模大,不需要添加其他物质。因此,在小规模间歇过程分离提取纤维素酶时,可以选择盐析-色谱法;在连续、大规模分离提取纤维素酶时,可以选择膜分离-色谱法。
3 结论
本研究建立了两种分离提取纤维素酶的方法,分别为二级盐析-G-75凝胶色谱法和二级超滤-G-75凝胶色谱法。通过(NH4)2SO4饱和度对纤维素酶沉淀效果的研究以及盐析后凝胶色谱分析,确立了二级盐析-G-75凝胶色谱法分离提取纤维素酶的工艺为:纤维素酶发酵液经0.22μm微滤膜预处理后,先采用20%饱和度的(NH4)2SO4沉淀部分杂蛋白,再用80%饱和度的(NH4)2SO4使上清液中的纤维素酶沉淀,最后经G-75凝胶色谱层析,冷冻干燥后得固体纤维素酶粉末,纤维素酶活性为13 675.76 U/g,总酶活收率为91.96%,总纯化倍数为31.41;通过考察纤维素酶系分子质量大小以及膜通量与操作压力之间的线性关系,并最终通过凝胶色谱分析,确立了二级超滤-G-75凝胶色谱法分离提取纤维素酶的工艺为:纤维素酶发酵液经0.22μm微滤膜预处理后,以30.165 mL/(min·m2)的膜通量分别流过膜孔径为6×104Da和1×104Da的超滤膜,此过程为连续过程,两个膜的操作压力分别为0.050 MPa和0.037 MPa,再将其经过G-75凝胶色谱层析,经冷冻干燥后得固体纤维素酶粉末,纤维素酶活性为12 769.87U/g,总酶活收率为92.91%,总纯化倍数为21.23。
研究表明,两种工艺均适合工业化分离提取纤维素酶,各具特点。二级盐析-G-75凝胶色谱法适合小规模间歇操作,其获得的纤维素酶纯度高;二级超滤-G-75凝胶色谱法适合大规模连续操作,不需要添加其他物质,对环境无污染。
参考文献:
[1]张治山,袁希钢.玉米燃料乙醇生命周期净能量分析[J].环境科学,2006,27(3):437-441.
[2]胡志远,戴 杜,蒲耿强,等.木薯燃料乙醇生命周期能量效率评价[J].上海交通大学学报,2004,38(10):1715-1718.
[3]SWANA J,YANGY,BEHNAM M,et al.An analysisof net energy production and feedstock availability for biobutanol and bioethanol[J].Bioresource Technol,2011,102(2):2112-2117.
[4]VONBLOTTNITZH,CURRANM A.Areview of assessmentsconducted on bio-ethanol asatransportation fuel from anet energy,greenhouse gas,and environmental life cycle perspective[J].J Clean Prod,2007,15(7):607-619.
[5]孔德柱,王玉春,孙 健,等.燃料乙醇生产用生物原料的土地使用、能耗、环境影响和水耗分析[J].过程工程学报,2011,11(3):452-459.
[6]邓天福,杜开书,李广领.纤维素酶及其在酿造业中的应用[J].中国酿造,2011,30(12):17-19.
[7]于 跃,张 剑.纤维素酶降解纤维素机理的研究进展[J].化学通报,2016,79(2):118-128.
[8]岳国君.纤维素乙醇工程概论[M].北京:化学工业出版社,2014:24-29.
[9]姚国欣,王建明.第二代和第三代生物燃料发展现状及启示[J].中外能源,2010,15(9):23-36.
[10]WOCKEN C,AULICH T,PANSGRAU P.Renewable hydroprocessing technology and refinery integration options[C]//NPRA Annual Meeting,March 21-23,2010,Phoenix AZ,USA.
[11]孙 彦.生物分离工程[M].北京:化学工业出版社,2004:29-33.
[12]张晓月,孜力汗,李勇昊.里氏木霉Rut-C30产纤维素酶培养基优化及其酶解特性[J].过程工程学报,2014,14(2):312-317.
[13]程少博,肖 林,方 诩,等.NB/T 13005—2016用于生物燃料乙醇制备的纤维素酶酶活力测定方法[S].北京:中国电力出版社,2017.
[14]BRADFORD M.A rapid and sensitive method for the quantitation of protein using the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[15]万印华,陈向荣,马光辉,等.超滤分离蛋白质过程快速优化新技术及其应用[J].膜科学与技术,2011,31(3):228-233.
[16]孙 彦.生物分离工程[M].北京:化学工业出版社,2004:6-7.
[17]章克昌.酒精与蒸馏酒工艺学[M].北京:中国轻工业出版社,2013:380-382.
[18]朱长乐.膜科学与技术[M].北京:高等教育出版社,2004:43-45.
[19]朱年青,夏文静,勇 强.里氏木霉纤维素酶的分离纯化及酶学性质[J].生物加工过程,2010,8(3):40-43.
[20]GAMA F M,VILANOVA M,MOTA M.Exo-and endo-glucanolytic activity of cellulases purified from Trichoderma reesei[J].Biotechnol Tech,1998,12(9):677-681.
[21]MURASHIMA K,NISHIMURA T,NAKAMURA Y,et al.Purification and characterization of new endo-1,4-D-glucanasesfrom Rhizopusoryzae[J].Enzyme Microbial Technol,2002(30):319-326.

