高盐胁迫下米曲霉FUJX 001产草甘膦降解酶空间结构变化研究
童火艳,王凤雪,吴晓江,张 鹏,万 茵,刘成梅,付桂明*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学 食品学院,江西 南昌 330031;3.南昌大学 中德食品工程中心,江西 南昌 330047)
草甘膦(glyphosate)是一种非选择性内吸传导型广谱有机磷除草剂,具有高效、广谱、低毒、低残留、环境友好等优点,已成为世界上应用最广、用量最大的除草剂[1-2]。由于其化学性质稳定、自然降解速度慢,可通过在饮用水、农作物中残留等多种途径进入人体。世界卫生组织(world health organization,WHO)的研究表明[3],草甘膦会造成小鼠胎仔数的减少及精子数的降低,且人体长期接触草甘膦后,会导致流产及早产率的升高。随着它的广泛应用,草甘膦及其代谢物氨基甲基膦酸的安全性引起人们的普遍关注。大豆发酵食品是中国乃至东亚国家历史悠久的传统食品[4]。目前在耐草甘膦的转基因大豆豆粒里已检测到草甘膦及其代谢物的残留[5]。随着我国对转基因大豆产品消耗量和进口量的逐年增加,大豆中草甘膦残留风险将增加。草甘膦在转基因大豆中残留、加工过程中的消长及危害已成为研究的热点[6-8]。
随着草甘膦的大量使用,其残留危害和消除策略受到人们的广泛关注。草甘膦在土壤中的自然降解半衰期约为60 d,其降解方式有光降解、化学降解和微生物降解。微生物降解条件温和、高效,成为草甘膦降解的未来发展趋势。能够降解草甘膦的微生物种类主要有:枯草芽孢杆菌[9]、铜绿假单胞菌[10]、酵母菌[11]、拟青霉[12]和米曲霉[13]等。微生物降解草甘膦的途径主要有两个:一个是氨甲基磷酸(aminomethyl phosphonic acid,AMPA)途径,草甘膦在转氨酶的作用下C-N键氧化断裂生成为AMPA,再在磷酰基乙酸水解酶(phosphonoacetate hydrolase,PhnA)的作用下C-P键断裂转化为甲胺和磷酸,甲胺进一步分解成甲醛和氨进入C-N循环;另一途径是肌氨酸途径,草甘膦中的C-P键经C-P裂解酶直接作用脱磷酸生成肌氨酸(sarcosine),并在肌氨酸氧化酶(sarcosineoxidase,SOX)的作用下进一步分解成甘氨酸[14-16]。
酱油是一种在亚洲国家盛行的具有咸味和独特风味的大豆类传统发酵调味品。它是由豆粕和麸皮(或大豆和小麦)的混合原料通过米曲霉制曲发酵,后期添加酵母和乳酸菌进行厌氧发酵,再用盐水淋洗而成的[17]。米曲霉是食品发酵工业中酱油、豆豉制造的主要生产菌之一。米曲霉纯种发酵酱油具有生产工艺条件易于控制、产品质量稳定、安全性高、发酵的酱油口味好、营养丰富[18-19]等优点。本研究以课题组前期筛选到的米曲霉(Aspergillusoryzae)FUJX 001[20]来源的草甘膦降解酶为研究目标,探讨高盐条件下,草甘膦降解酶的空间结构变化,以期为高盐稀态发酵生产酱油过程中草甘膦残留的生物酶法消除提供重要的指导意义。
1 材料与方法
1.1 材料与试剂
米曲霉(Aspergillusoryzae)FUJX 001:实验室筛选的对草甘膦有较高降解率的菌株;葡聚糖凝胶G-150(Sephadex G-150)、葡聚糖凝胶G-50(Sephadex G-50)填料(1.6 cm×45cm):安发玛西亚生物技术公司;二乙基氨基乙基(diethyl aminoethyl,DEAE)-葡聚糖凝胶A-50(Sephadex A-50)填料(1.6 cm×45 cm):上海化学试剂采购供应站分装厂;牛血清白蛋白(bovine serum albumin,BSA):上海源叶生物科技有限公司;考马斯亮蓝G-250(生化试剂)、Tris-HCl(色谱纯):北京索莱宝科技有限公司;甲醇(色谱纯)、溴化钾、硫酸铵、氯化钠、亚硝酸钠、硫酸(均为分析纯):西陇科学股份有限公司;草甘膦(纯度≥95%):成都格拉西亚卡尔科技有限公司。
产酶发酵培养基:酵母膏1 g,硫酸铵2 g,可溶性淀粉3 g,氯化钠2 g,蒸馏水900 mL,121℃灭菌15 min。添加经0.45μm微孔滤膜过滤草甘膦溶液(10 g/L,pH 7.0)至草甘膦质量浓度为1 g/L。
1.2 仪器与设备
ZDX-35BI型座式蒸汽灭菌器:上海申安医疗器械厂;DHG-9053型电热恒温干燥箱:上海三发科学仪器有限公司;ZHWY-2102C型恒温培养振荡器:上海智诚分析仪器制造有限公司;TGL-16B型高速离心机:美国热电公司;LC-1260型高效液相色谱仪(high performance liquid chromatography,HPLC):美国安捷伦公司;BS-100A自动部分收集器、HD-1核酸蛋白紫外检测器:上海青浦泸西仪器厂;SHZ-D(Ⅲ)型循环水式真空泵:巩义市英峪予华仪器厂;Mili-Q50超纯水制备系统:美国Millipore公司;MOS-450/AF-CD圆二色光谱仪(circular dichroism,CD):法国Bio-Logic公司;F-7000荧光分光光度计、U-2910紫外分光光度计:日本日立(HIATCHI)高新技术公司;Nicolet5700傅里叶红外光谱(Fourier transforminfrared,FT-IR):美国Thermo Fisher Scientific公司。
1.3 试验方法
1.3.1 草甘膦诱导米曲霉FUJX 001产酶发酵实验
对具有降解草甘膦能力的米曲霉(A.oryzae)FUJX 001进行斜面活化,28℃培养3 d,待长出大量孢子时,用无菌生理盐水(含0.05%Triton X-100)洗脱后制得孢子悬浮液。接种1mL孢子悬浮液于100 mL的产酶发酵培养基,在30℃条件下150 r/min培养2 d获得种子液,再将100 mL种子液接种到4 L产酶发酵培养基,以2 L/min的流速通入无菌空气(过0.45μm微孔滤膜),30℃培养5 d。
1.3.2 草甘膦降解酶的纯化
将抽滤所得的米曲霉菌丝体置于研钵中,快速加入适量的液氮进行研磨后获得菌丝体固体粉末。然后将菌丝体与Tris-HCl缓冲溶液(0.05 mol/L、pH 7.0)按1∶10(g∶mL)的比例混合后,在4℃、7 000×g条件下离心30 min,所得上清液即为草甘膦降解酶粗酶液,测定粗酶液中草甘膦降解酶酶活和蛋白质含量。移取草甘膦降解酶粗酶液20 mL,分别向其中缓慢加入研磨过的硫酸铵粉末,使溶液中硫酸铵饱和度最终达到80%,完全溶解后置于4℃条件下过夜,再经4℃、7 000×g条件下离心30 min,获得沉淀物。用Tris-HCl缓冲溶液将沉淀物溶解定容至10 mL,分别将沉淀溶解液装入透析袋(截留分子质量为1 500 Da)中,透析48 h,经过间断时间更换聚乙二醇进行浓缩,待溶液浓缩至原体积1/2后取出,测定硫酸铵沉淀后的草甘膦降解酶酶活和蛋白质含量。经Sephadex G-150柱层析不能达到完全分离的效果,因此将收集的样品进一步用Sephadex G-50和DEAE-Sephadex A-50纯化。经过Sephadex G-150、Sephadex G-50和DEAE Sephadex A-50三级柱层析纯化,分别收集每级纯化中有草甘膦降解酶活的蛋白峰部分,测定每级柱层析纯化后的草甘膦降解酶酶活和蛋白质含量,并将经过DEAESephadex A-50纯化后有草甘膦降解酶酶活部分,透析、浓缩、冻干备用。
1.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
运用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamidegelelectrophoresis,SDS-PAGE)变性凝胶电泳分析草甘膦降解酶纯度。纯化后的草甘膦降解酶样品溶于Tris-HCl缓冲溶液,使其蛋白质质量浓度约为1 mg/mL,100℃煮沸5 min,离心取上清液,电泳上样量10μL。配制SDS-PAGE变性凝胶电泳分离胶(12 g/100 mL)和浓缩胶(5g/100mL),预电泳电压100V,1h,进入分离胶后调到200 V,考马斯亮蓝R-250染色脱色后,经Multifunction Printer扫描得电泳图[21]。
1.3.4 草甘膦降解酶酶活力的测定
标准品草甘膦溶液的制备:准确称取40 mg草甘膦的标准品溶于少量蒸馏水中,待充分溶解后定容至100 mL。用移液枪分别吸取0、2.00 mL、4.00 mL、6.00 mL、8.00 mL、10.00mL的于100mL容量瓶中,先加入30mL的蒸馏水,再依次加入2 mL硫酸(质量分数50%)、1 mL溴化钾(2.0mol/L)、2 mL亚硝酸钠溶液(0.1mol/L),摇匀静置30min后定容,制得质量浓度依次为0、8.00μg/mL、16.00μg/mL、24.00μg/mL、32.00μg/mL、40.00μg/mL的草甘膦标准品溶液。
取1 mL草甘膦降解酶酶液和9 mL草甘膦溶液(由浓度为0.05 mol/L,pH 7.0的Tris-HCl缓冲溶液配制,草甘膦质量浓度为1g/L)分别经过37℃水预热5min后,混匀反应30min,沸水终止反应,冷却至室温,获得反应液[20,22]。
参照标准品草甘膦溶液的制备步骤,取2 mL反应液,依次加硫酸、溴化钾和亚硝酸钠等试剂对其进行亚硝化处理,再采用HPLC法测定草甘膦含量[23],分别以有酶无底物和有底物无酶的样品为空白对照。
色谱条件:ThermoHypersil-ODS色谱柱(150mm×4.6mm,5μm);流动相为甲醇∶水=2∶98(V/V);流速0.8 mL/min;选用紫外检测器,检测波长240nm:柱温25℃;进样量10μL。
草甘膦降解酶的活力[20]定义为:在温度为37℃,pH 7.0的条件下,每分钟分解1μg草甘膦所需酶的量为1个酶活力单位(U)。
1.3.5 蛋白质含量的测定
蛋白质含量采用Bradford法[24]测定,以牛血清白蛋白(BSA)为标准绘制标准曲线。在10 mL试管中加入1 mL草甘膦降解酶粗酶液和5 mL考马斯亮蓝G-250染液,混匀,室温静置5 min后在波长595 nm处测定光吸光度值。根据牛血清白蛋白标准曲线回归方程,计算粗酶液蛋白质含量。
比酶活、蛋白回收率、酶活回收率、纯化倍数的计算公式如下:


1.3.6 傅里叶红外光谱分析检测
将经1.3.2制备的草甘膦降解酶样品分别用蒸馏水、15%NaCl溶液和20%NaCl溶液配制成质量浓度为0.1mg/mL样液,混匀静置10 s后冻干成粉末,在红外灯下研磨成细小的粉末,直至可以压片,然后用压片机压成透明的薄片,在波数500~4 000 cm-1条件下扫描得到红外光谱。
1.3.7 紫外-可见光扫描图谱分析检测
将经1.3.2制备的草甘膦降解酶样品分别用蒸馏水、15%NaCl溶液和20%NaCl溶液配制成质量浓度为0.07 mg/mL的样液,并进行波长180~500 nm范围的波段扫描,观察其在波长范围内主要特征吸收峰以及不同盐浓度对酶的吸收波长和吸光强度的影响。
1.3.8 圆二色光谱分析检测
将经1.3.2制备的草甘膦降解酶样品分别用蒸馏水、15%NaCl溶液和20%NaCl溶液将其稀释相同的倍数,至草甘膦降解酶的质量浓度为0.1mg/mL,采用圆二色谱仪进行分析检测。
检测条件:扫描波长190~260nm,扫描速度100nm/min,分辨率0.000 6 mdeg,光谱间隔0.1 nm。实验值采取3个平行样的扫描平均值。根据草甘膦降解酶分子中氨基酸的α-碳原子不对称性和主链构象的不对称而具有的光学特性,利用在线dichroweb.cryst.bbk.ac.uk/html/process.shtml软件分析其二级结构的组成情况。
1.3.9 荧光光谱分析检测
分别用蒸馏水、15%NaCl溶液和20%NaCl溶液将1.3.2制备的草甘膦降解酶样品稀释质量浓度为0.03 mg/mL样液,采用荧光光谱仪分析样品的荧光强度及荧光吸收波长。
检测条件:激发波长280 nm,扫描光谱的波长范围为300~500 nm,发射与激发狭缝均为5 nm[25],样品检测量为3 mL。
2 结果与分析
2.1 草甘膦降解酶的纯化
由表1可知,米曲霉(A.oryzae)FUJX 001经液氮研磨,与Tris-HCl缓冲液按一定比列混合后,经离心获得发酵上清液100 mL,测得总蛋白质量为156.40 mg,总酶活为1 686 U。经Sephadex G-150柱层析获得的目的酶经SDS-PAGE电泳后,发现仍有一些分子质量较小且不等的杂条带,这可能是由于Sephadex G-150凝胶填料不能达到完全分离的效果,因此进一步采用Sephadex G-50和DEAE-Sephadex A-50柱层析纯化。经过Sephadex G-150、Sephadex G-50和DEAESephadex A-50柱层析纯化后,酶活回收率分别为51.84%、43.40%和36.21%,纯化倍数分别为1.64、2.42和2.76,说明经过此三步柱层析方法纯化草甘膦降解酶达到较为理想的效果。
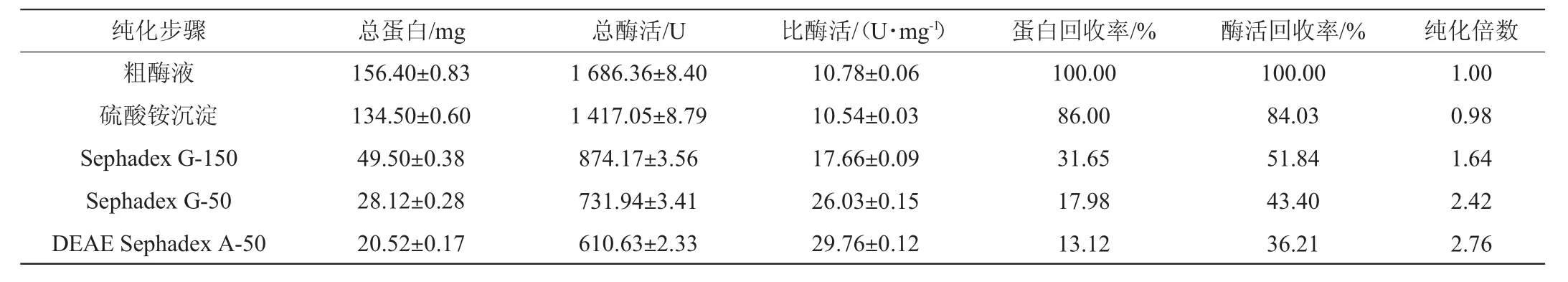
表1 米曲霉中草甘膦降解酶的分离纯化结果Table 1 Results of separation and purification of glyphosate degradation enzyme from A.oryzae
2.2 草甘膦降解酶的分子质量
对纯化后的草甘膦降解酶样品进行SDS-PAGE电泳实验,结果如图1所示。由图1可知,经DEAE-Sephadex A-50柱层析分离纯化后得到的草甘膦降解酶样品有明显的单一条带,分子质量约为34.7 kDa,表明草甘磷降解酶纯度较高,达到电泳纯。
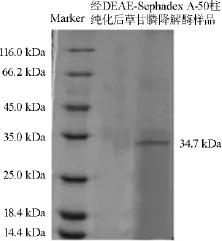
图1 经DEAE-Sephadex A-50柱纯化后草甘膦降解酶的SDS-PAGE电泳图Fig.1 SDS-PAGE electrophoresis of glyphosate degradation enzyme after purification by DEAE-Sephadex A-50 column
2.3 高浓度NaCl对草甘膦降解酶结构的影响
目前国内大部分以米曲霉发酵生产酱油采用高盐稀态酱油发酵,发酵时盐浓度范围为15~25%。研究在此高盐浓度胁迫下,高盐离子浓度和高渗透压对米曲霉中草甘膦降解酶分子空间构象的影响,为研究发酵转基因大豆生产酱油中降解草甘膦提供研究基础。因此本实验研究15%和20%NaCl溶液对草甘膦降解酶结构的影响。
2.3.1 傅里叶红外光谱检测结果
红外光谱是一种可以获知分子化学基团组成和确定物质化学式的高效灵敏的检测方法,其主要是依据光的吸收和电子的跃迁。经15%和20%NaCl溶液处理后,草甘膦降解酶的傅里叶红外光谱检测结果见图2。由图2可知,在4 000~2 900 cm-1氢键区,可能由O-H、C-H和N-H基团振动吸收引起,其峰宽、强度大。其中3 390 cm-1处为O-H和N-H伸缩振动区,可能由N-H键伸缩振动引起,2 977.45 cm-1为C-H伸缩振动区,可能是-CH3键引起,2 595 cm-1为S-H伸缩振动区,附近可能由S-H基团产生吸收峰。1635~1550cm-1吸收峰可能是C-N键和C=O键的振动吸收,1 554 cm-1处对应酰胺Ⅱ带,且1 630 cm-1左右振动吸收对应分子内β-折叠。在1 460~1 000 cm-1范围内可能由CH2键的摇摆振动吸收引起,1 300~1 295 cm-1范围内吸收峰可能是由氨基酸分子内仲酰胺N-H键弯曲、C-H键的延伸或两者间耦合造成的酰胺Ⅲ带所致,1 296 cm-1为C-C伸缩振动区,可能是由CH3键的变性、C-N键延伸引起。1 140 cm-1、1 042 cm-1附近特征吸收峰分别对应分子中C-C、C-OH的伸缩振动[26-27]。在900~850 cm-1之间吸收峰可能是C-C键和羧基上的OH键延伸所致。
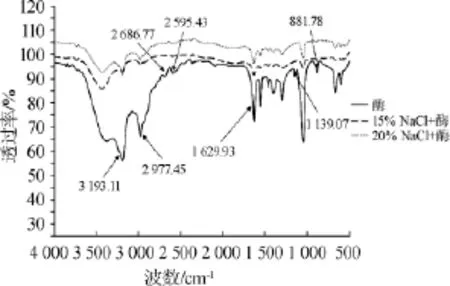
图2 高浓度NaCl对草甘膦降解酶红外光谱的影响Fig.2 Effect of high concentration NaCl on infrared spectroscopy of glyphosate degradation enzyme
由图2可知,15%和20%的NaCl溶液对草甘膦降解酶红外吸收的影响相差不大。与不含NaCl溶液的草甘膦降解酶相比,2种浓度NaCl溶液条件下的草甘膦降解酶在2686.77cm-1、2595.43cm-1、2119.96cm-1、881.78cm-1处的特征吸收峰消失,以及在3193.11cm-1、2977.45cm-1和1629.93~1 139.07 cm-1范围内的特征吸收峰大大削弱。这可能由于高浓度NaCl的存在,造成分子内各部分结构间的排斥作用增强,与蛋白分子中极性基团发生相互作用,从而影响部分化学键的伸展方式[28]。
2.3.2 全波段扫描图谱
草甘膦降解酶溶液经不含NaCl、15%NaCl和20%NaCl溶液处理后进行180~500 nm全波段扫描的紫外吸收图谱如图3所示。由图3可知,不含NaCl的草甘膦降解酶液在波长214 nm处呈现最大吸收强度2.471,而含15%和20%NaCl的草甘膦降解酶溶液在波长205 nm处具有最大吸收强度,与不含NaCl的草甘膦降解酶的吸收强度相比,分别下降为2.085、2.012。在15%NaCl和20%NaCl溶液条件下,草甘膦降解酶的最大吸收波长蓝移9 nm,紫外吸收强度明显有减弱的趋势,这可能是因为高浓度NaCl溶液改变酶分子所在微环境,影响了草甘膦降解酶分子中的生色基团或共轭体系等分子结构,从而使草甘膦降解酶的紫外吸收强度减弱,且最大吸收波长λmax伴随蓝移现象。
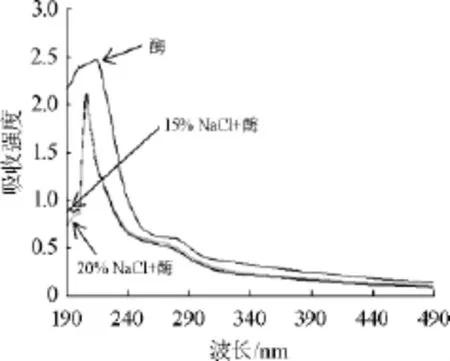
图3 盐溶液对草甘膦降解酶全波段紫外吸收图谱的影响Fig.3 Effect of saline solution on the full band ultraviolet absorption spectrometry of glyphosate degradation enzyme
2.3.3 圆二色谱分析
β-折叠结构相对明确而稳定,而α-螺旋、β-转角和无规则卷曲相对开放、灵活[29]。
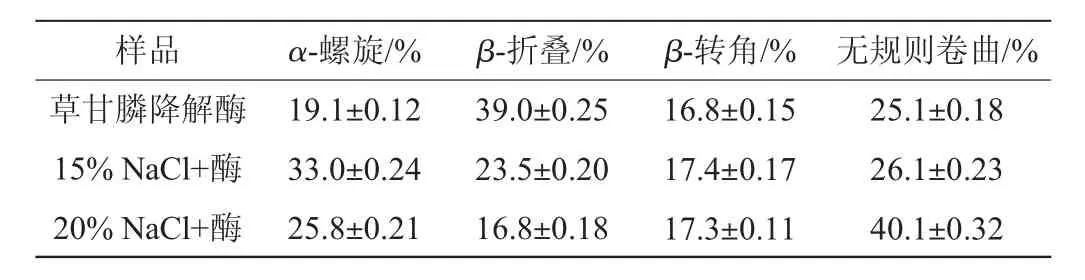
表2 盐溶液对草甘膦降解酶二级结构的影响Table 2 Effect of saline solution on the secondary structure of glyphosate degradation enzyme
由表2可知,不含NaCl溶液的草甘膦降解酶二级结构中β-折叠结构比例最高,说明未经高盐处理的草甘膦降解酶结构较为有序。与不含NaCl溶液的草甘膦降解酶二级结构相比,含15%NaCl的草甘膦降解酶分子中α-螺旋比例从19.1%上升至33%,β-折叠比例从39%降低至23.5%,说明经15%NaCl溶液处理后的草甘膦降解酶结构由有序向无序转变,草甘膦降解酶结构变得松散、不稳定,草甘膦降解酶分子整体结构更加灵活;另外两种构象所占比例变化相对较小;与含15%NaCl溶液的草甘膦降解酶分子相比,含20%NaCl的草甘膦降解酶分子中无规则卷曲比例迅速增加,由26.1%增加至40.1%,β-折叠比例由23.5%进一步降低至16.8%,α-螺旋比例由33%下降至25.8%,β-转角所占比例无明显变化。这说明高浓度NaCl会诱导β-折叠先向α-螺旋,再向无规则卷曲转化。这也许是由于高浓度NaCl的存在,对草甘膦降解酶分子的侧链影响较大,增加了草甘膦降解酶蛋白质二级结构各部分间的离子作用,增加了分子结构的无规则卷曲,而无规则卷曲这类有序的非重复性结构经常构成酶活性部位和其他蛋白质特异的功能部位。综上所述,含20%NaCl的溶液比含15%NaCl的溶液更加有可能对草甘膦降解酶酶活产生影响。
2.3.4 荧光光谱分析
天然蛋白质中只有色氨酸、酪氨酸和苯丙氨酸有荧光性,这3种氨基酸残基由于侧链芳香族基团不同而有不同的荧光光谱。由于色氨酸残基荧光量子产率较酪氨酸和苯丙氨酸高,荧光光谱主要显示色氨酸残基的荧光性[30]。
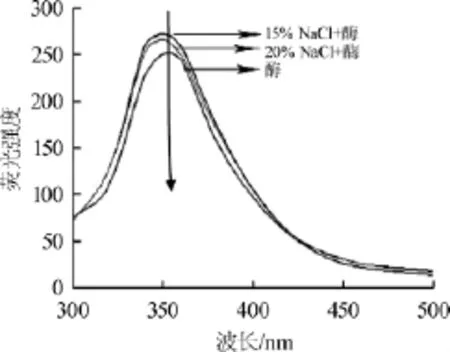
图4 盐溶液对草甘膦降解酶荧光光谱的影响Fig.4 Effect of saline solution on fluorescence intensity spectrometry of glyphosate degradation enzyme
由图4可知,与不含NaCl溶液的草甘膦降解酶的荧光图谱相比,含有15%和20%NaCl溶液的草甘膦降解酶最大荧光波长λmax从352.8 nm蓝移到350.0 nm,与不含NaCl溶液的草甘膦降解酶最大荧光强度(250.1)相比,分别增大到272.4和265.8。通常而言,最大荧光波长与蛋白质分子中色氨酸残基的位置有关[31]。15%和20%NaCl溶液处理的草甘膦降解酶最大荧光波长λmax从352.8 nm蓝移到350.0 nm,表明草甘膦降解酶分子中部分色氨酸残基在高盐环境中发生了掩埋。荧光强度增强说明NaCl会诱导草甘膦降解酶结构发生一定程度改变[32],暴露出部分发色基团,减弱了芳香族氨基酸的亲水作用或荧光淬灭相关的作用。随着盐浓度从15%增至20%,荧光强度继续减弱,表明盐浓度过高会提高蛋白质脱水程度,减弱了与色氨酸等构象相关的相互作用力,其三级结构发生一定程度变化[32]。
3 结论
本研究对具有降解草甘膦能力的米曲霉(Aspergillus oryzae)FUJX 001进行液态发酵培养,收集菌丝体,经液氮研磨,获得的粗酶液经硫酸铵沉淀初步分离后,再经过Sephadex G-150、Sephadex G-50和DEAE-Sephadex A-50三级柱层析纯化后,酶活回收率达36.21%,纯化倍数达2.76倍。所获草甘膦降解酶的分子质量约为34.7 kDa。结果表明,与不含NaCl溶液的草甘膦降解酶相比,含15%和20%NaCl溶液的草甘膦降解酶部分特征吸收峰大大削弱和消失;紫外吸收强度减弱,吸收波长蓝移;α-螺旋比例上升,β-折叠比例降低,无规则卷曲比例增加;最大荧光强度增强且伴随微弱的蓝移。草甘膦降解酶分子在高浓度NaCl下,影响酶分子所在的微环境,引入较高浓度离子,与蛋白分子中极性基团发生相互作用,同时引起蛋白质脱水,导致其蛋白质二、三级结构均发生一定变化。为进一步研究草甘膦降解酶在高盐状态下如何与底物结合、蛋白结构与酶活变化的关系等提供基础,同时为草甘膦降解酶在含15%~20%NaCl溶液酱油发酵条件下,如何发挥降解草甘膦能力,消除转基因大豆中残留草甘膦提供一定理论依据。
参考文献:
[1]苏少泉.草甘膦述评[J].农药,2005,44(4):145-149.
[2]卢 信,赵炳梓,张佳宝,等.除草剂草甘膦的性质及环境行为综述[J].土壤通报,2005,36(5):785-790.
[3]MAÑASF,PERALTA L,RAVIOLOJ,et al.Genotoxicity of AMPA,the environmental metaboliteof glyphosate,assessed by the Comet assay and cytogenetic tests[J].Ecotoxicol Environ Saf,2009,72(3):834-837.
[4]李诗雯.米曲霉蛋白酶系协同水解大豆蛋白的研究[D].武汉:湖北工业大学,2015.
[5]LI B,DENG X,GUO D,et al.Determination of glyphosate and aminomethylphosphonic acid residues in foodsusing high performance liquid chromatography-massspectrometry/massspectrometry[J].Chin J Chromatogr,2007,25(4):486-490.
[6]APPENZELLER L M,MUNLEY S M,HOBAN D,et al.Subchronic feeding study of herbicide-tolerant soybean DP-356Ø43-5 in Sprague-Dawley rats[J].Food Chem Toxicol,2008,46(6):2201-2213.
[7]HAMMOND B G,JEZ JM.Impact of food processing on the safety assessment for proteinsintroduced into biotechnology-derived soybean and corn crops[J].Food Chem Toxicol,2011,49(4):711-721.
[8]BRAKE D G,EVENSON D P.A generational study of glyphosate-tolerant soybeans on mouse fetal,postnatal,pubertal and adult testicular development[J].Food Chem Toxicol,2004,42(1):29-36.
[9]余贤美,安 淼,刘加芬,等.枯草芽孢杆菌Bs-15对草甘膦的降解特性[J].山东农业科学,2015,47(9):69-72.
[10]SHEN Y J,HONG Y F,HONG Q,et al.Isolation,identification and characteristicsof aphoxim-degrading bacterium XSP-1[J].Environ Sci,2007,28(12):2833-2837.
[11]汤鸣强,尤民生.抗草甘膦酵母菌ZM-1的分离鉴定及其生长降解特性[J].微生物通报,2010,37(9):1402-1409.
[12]吴丹丹,张 纯,冯 莉,等.草甘膦抗性真菌的分离与鉴定[J].环境昆虫学报,2013,35(3):300-304.
[13]吴学华,付桂明,万 茵,等.草甘膦降解菌A-F02的分离鉴定及降解特性研究[J].安徽农业科学,2010,38(15):7731-7733.
[14]SINGH B K,WALKERA.Microbial degradation of organophosphorus compounds[J].Fems Microbiol Rev,2006,30(3):428-471.
[15]FIELDS S C.Synthesis of natural products containing a C-P bond[J].Tetrahedron,1999,55(42):12237-12273.
[16]DING W,REDDY K N,ZABLOTOWICZ R M,et al.Physiological responses of glyphosate-resistant and glypgosate-sensitive soybean to aminomethylphosphonic acid,a metabolite of glyphosate[J].Chemosphere,2011,83(4):593-598.
[17]赵国忠,姚云平,曹小红,等.2种米曲霉发酵酱油风味物质比较[J].食品科学,2014,35(24):249-253.
[18]何胜华,马 莺,李海梅.韩国高盐稀态发酵酱油速酿工艺的探讨[J].中国酿造,2005,24(9):46-48.
[19]童 佳,赵国忠,赵建新,等.米曲霉发酵高盐稀态酱油过程中典型挥发性风味物质的形成[J].中国酿造,2017,36(5):22-29.
[20]胡 明.降解草甘膦米曲霉菌株的紫外诱变选育及其胞内降解酶的酶学性质分析[D].南昌:南昌大学,2013.
[21]LAEMMLIU K.Cleavage of structural proteins during the assembly of thehead of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[22]钞亚鹏,赵永芳,刘斌斌,等.甲基营养菌WB-1甲胺磷降解酶的产生、部分纯化及性质[J].微生物学报,2000,40(5):523-526.
[23]王凤雪,胡 明,刘成梅,等.亚硝化衍生检测除草剂产品中草甘膦方法比较[J].农药,2015,54(5):334-336.
[24]BRADFORD M M A.A rapid and sensitive method for quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(s1-2):248-254.
[25]邹树平.糖基化对β-D-葡萄糖醛酸苷酶催化特性及构象的影响[D].天津:天津大学,2010.
[26]彭严芳.近红外光谱特征波段解析方法研究[D].北京:北京中医药大学,2014.
[27]谢 微.含氧化合物红外光谱信息特征的研究[D].成都:四川大学,2006.
[28]赵 昕,盛芬玲,赵敏桂,等.NaCl胁迫下盐芥和拟南芥化合物含量与蛋白质结构变化比较—傅立叶红外光谱法[J].应用与环境生物学报,2008,14(3):371-377.
[29]YONGY H,YAMAGUCHIS,MATATSUMRA Y.Effectsof enzymatic deamidation by protein-glutaminase on structure and functional propertiesof wheat gluten[J].J Agr Food Chem,2006,54(16):6034-6040.
[30]TANGCH,YANGX Q,CHEN Z,et al.Physicochemical and structural characteristics of sodium caseinate biopolymers induced by microbial transglutaminase[J].J Food Biochem,2005,29(4):402-421.
[31]KIM S H,KINSELLA JE.Effects of reduction with dithiothreitol on somemolecular propertiesof soy glycinin[J].J Agr Food Chem,1986,34(4):623-627.
[32]YU Z L,ZENG W C,ZHANG W H,et al.Effect of ultrasound on the activity and conformation ofα-amylase,papain and pepsin[J].Ultrason Sonochem,2014,21(3):930-936.

