ADAM17-shRNA对MCF-7乳腺癌细胞裸鼠移植瘤的抑制作用研究*
张笑博,孟祥潮,张雪鹏,孙影,贾文婷
(1.华北理工大学附属医院 肿瘤外科,河北 唐山 063000;2.华北理工大学基础医学院 病理科,河北 唐山 063210)
解聚素-金属蛋白酶17(a disintegrin and metalloteinase 17,ADAM17)作为一种膜蛋白,可剪切活化肿瘤坏死因子-α[1-3]。其剪切活化多种表皮生长因子受体(epidermal growth factor receptor,EGFR)的配体来激活EGFR及下游通路,促进肿瘤细胞的侵袭、转移[4-6]。RNA干扰是将siRNA或短发夹RNA(short hairpin RNA,shRNA)载体转入靶细胞,高效沉默目的基因,从而实现该基因功能的缺失[7]。本实验利用慢病毒介导ADAM17-shRNA转染MCF-7乳腺癌细胞,然后种植于裸小鼠皮下,观察ADAM17-shRNA对乳腺癌生物学行为的影响并探究其作用机制,为以ADAM17为靶点的新药开发提供实验基础。
1 材料与方法
1.1 材料
30只BALB/c-nu/nu裸鼠,4周龄,雌性,体重约16~20 g,由北京华阜康生物科技有限公司提供。人乳腺癌MCF-7细胞系购于中国医学科学院天津血液研究所,兔抗鼠ADAM17、EGFR、蛋白激酶B(protein kinase B,PKB)(又称Akt)及细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)由英国Abcam公司提供,携带红色荧光的ADAM17-shRNA慢病毒和携带红色荧光的ADAM17-shNC慢病毒由上海吉玛制药技术有限公司设计合成。
1.2 培养MCF-7细胞
将乳腺癌细胞置于含10%胎牛血清和1%抗生素(青霉素、链霉素)的DMEM高糖培养基中,在37℃、5%二氧化碳CO2饱和湿度培养箱中无菌培养。
1.3 ADAM17-shRNA转染MCF-7细胞
取生长至60%融合的乳腺癌细胞,用携带红色荧光蛋白且感染复数约为100的ADAM17-shRNA慢病毒转染,转染试剂为Lipofectamine 2000,根据说明书操作。24 h后换液,置于37℃、5%CO2培养箱中继续培养。3 d后荧光显微镜下观察转染效率,拍片,3次平行实验。
1.4 肿瘤细胞的种植与组织处理
将30只裸鼠随机分为转染组(接种转染ADAM17-shRNA的乳腺癌MCF-7细胞)、空载体组(接种转染shNC的乳腺癌MCF-7细胞)及对照组(接种正常乳腺癌MCF-7细胞),每组10只。3组细胞分别制成密度为5×105个/ml的单细胞悬液,裸鼠腹腔内注射雌激素3 d后,称重,麻醉。将现制的3组细胞悬液以0.2 ml/只,分别种植在各组裸鼠右侧鼷部皮下,SPF环境中继续饲养。12 d后接种部位出现明显质地较硬的肿瘤结节,1次/4 d,测量肿瘤最长径及其与之垂直方向的最大横径并计算瘤结节体积和抑瘤率。
移植后第28天处死裸鼠,取出移植瘤,绘制肿瘤生长曲线。将瘤体组织分成2份,一份用4%低聚甲醛固定、包埋及切片,行苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色。另一份于-80℃冰箱保存,待后续实验使用。
1.5 HE染色
将固定好的肿瘤组织依次经过石蜡包埋、切片,常规行HE染色,分别于100和400倍光学显微镜下观察移植瘤组织的形态变化。
1.6 Western blot检测
Western blot检测 ADAM17、EGFR、Akt及 ERK蛋白的表达,将3组瘤体分别用预冷的磷酸盐缓冲液清洗3次后,称取100 mg左右肿瘤组织,置于5 ml EP管中,滴加1 ml预冷的组织裂解液(含2%蛋白酶抑制剂),4℃冰上裂解1 h。用眼科剪将移植瘤组织剪碎,组织悬液4℃,12 000 r/min,离心10min。考马斯亮蓝法测定蛋白浓度,煮沸变性,各组取30 μg样本加入泳道,配制5%浓缩胶和10%分离胶,进行8% SDS-聚丙烯酰胺凝胶电泳。在4℃冰浴条件下,90 V电压电泳至出现红色Marker,调电压至120 V,随后电转至聚偏氟乙烯膜。以5%脱脂奶粉室温封闭1 h后,滴加一抗anti-ADAM17、anti-EGFR、anti-phosphorylatedEGFR、anti-Akt、antiphosphorylated Akt、anti-ERK、anti-phosphorylated ERK及β-actin,比例均为1∶1 000,4℃孵育过夜。TBST清洗,滴加辣根过氧化物酶标记的二抗室温孵育1 h,增强化学发光剂显色,凝胶成像系统扫描条带,Image J软件分析光密度值。
1.7 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,比较用单因素或重复测量设计的方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 ADAM17-shRNA转染率
将携带红色荧光且感染复数为100的慢病毒转染MCF-7乳腺癌细胞72 h,置于荧光显微镜下,根据转染细胞的最强荧光判断转染率,可见荧光率>80%,证明慢病毒介导的ADAM17-shRNA成功转染MCF-7细胞。见图1。
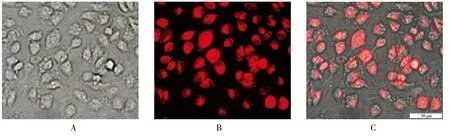
图1 MCF-7细胞转染效果 (荧光显微镜×400)
2.2 各组裸鼠体内抑瘤效果
根据各组移植瘤平均体积,绘制肿瘤生长曲线。3组裸鼠成瘤后12、16、20、24和28 d的瘤体体积比较,采用重复测量设计的方差分析,结果:①不同时间点的瘤体体积比较,差异有统计学意义(F=8452.421,P=0.000);②3组裸鼠的瘤体体积比较,差异有统计学意义(F=934.321,P=0.000),转染组较对照组、空载体组瘤体体积生长缓慢,相对抑瘤效果较好;③3组裸鼠的肿瘤体积变化趋势比较,差异有统计学意义(F=768.389,P=0.000)。见表1和图2、3。
表1 3组裸鼠不同时间点肿瘤体积比较 (n =10,mm3,±s)
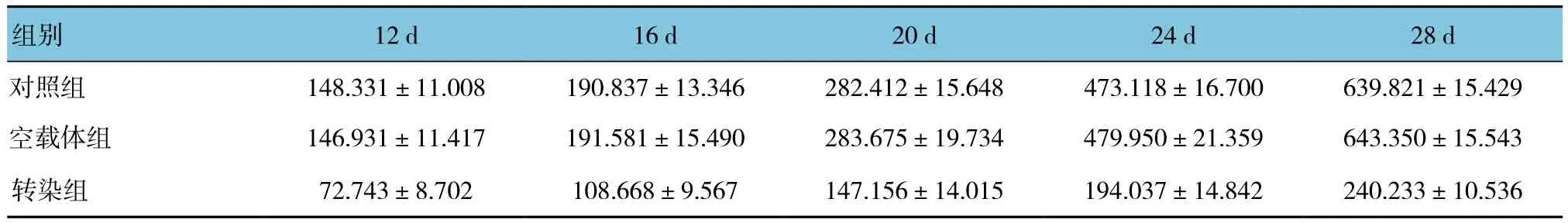
表1 3组裸鼠不同时间点肿瘤体积比较 (n =10,mm3,±s)
组别 12 d 16 d 20 d 24 d 28 d对照组 148.331±11.008 190.837±13.346 282.412±15.648 473.118±16.700 639.821±15.429空载体组 146.931±11.417 191.581±15.490 283.675±19.734 479.950±21.359 643.350±15.543转染组 72.743±8.702 108.668±9.567 147.156±14.015 194.037±14.842 240.233±10.536
2.3 移植瘤组织的形态学变化
HE染色结果显示,移植瘤组织呈乳腺浸润性导管癌特征:实质与间质分界清楚,癌细胞呈巢状、梁索状及腺管状分布,异型性明显,染色质凝集呈粗颗粒状,核仁增大,并可见多数核分裂相;对照组与空载体组无明显差异;转染组较对照组、空载体组坏死多。见图4。
2.4 3组裸鼠ADAM17、EGFR、p-EGFR、Akt、p-Akt、ERK及p-ERK蛋白表达水平
3 组裸鼠的 ADAM17、EGFR、p-EGFR、Akt、p-Akt、ERK及p-ERK蛋白表达水平比较,采用单因素方差分析,差异有统计学意义(P<0.05),转染组肿瘤组织中 ADAM17、EGFR、p-EGFR、Akt、p-Akt、ERK 及 p-ERK的蛋白表达水平与对照组和空载体组比较,差异有统计学意义(P<0.05),转染组低于对照组和空载体组见表2和图5。

图2 处死后的荷瘤裸鼠及其肿瘤
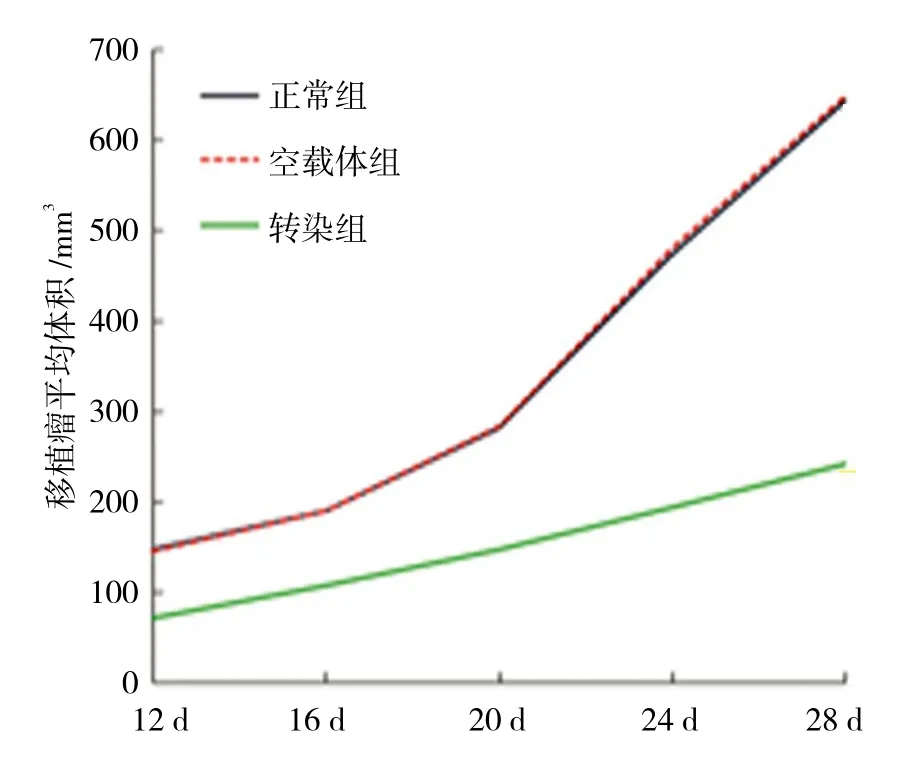
图3 3组裸鼠不同时间点的肿瘤体积变化趋势
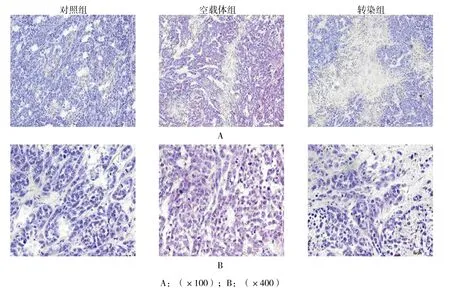
图4 移植瘤组织的形态学变化 (HE染色)
表2 3组裸鼠ADAM17、EGFR、p-EGFR、Akt、p-Akt、ERK及p-ERK蛋白表达水平比较 (n =10,±s)
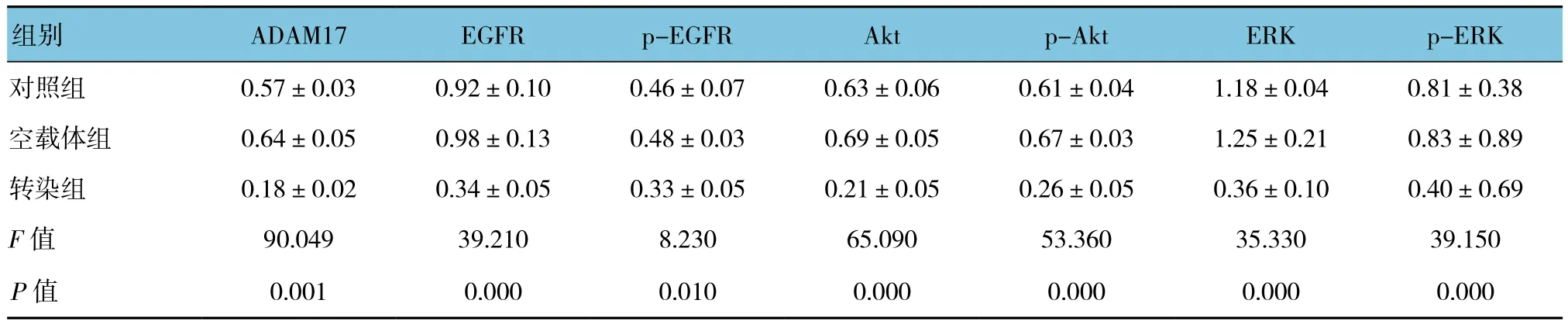
表2 3组裸鼠ADAM17、EGFR、p-EGFR、Akt、p-Akt、ERK及p-ERK蛋白表达水平比较 (n =10,±s)
组别 ADAM17 EGFR p-EGFR Akt p-Akt ERK p-ERK对照组 0.57±0.03 0.92±0.10 0.46±0.07 0.63±0.06 0.61±0.04 1.18±0.04 0.81±0.38空载体组 0.64±0.05 0.98±0.13 0.48±0.03 0.69±0.05 0.67±0.03 1.25±0.21 0.83±0.89转染组 0.18±0.02 0.34±0.05 0.33±0.05 0.21±0.05 0.26±0.05 0.36±0.10 0.40±0.69 F值 90.049 39.210 8.230 65.090 53.360 35.330 39.150 P值 0.001 0.000 0.010 0.000 0.000 0.000 0.000
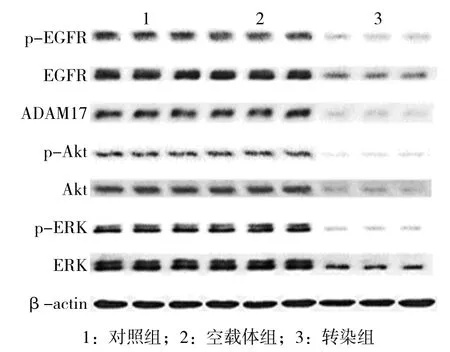
图5 3组裸鼠肿瘤组织中p-EGFR、EGFR、ADAM17、p-Akt、Akt、p-ERK及ERK蛋白的表达
3 讨论
乳腺癌是全球女性最常见的恶性肿瘤之一。近年来,乳腺癌发病日趋年轻化,已严重影响年轻女性的身心健康,在女性恶性肿瘤死因中居首位[8-9]。据统计,2008年全球新发女性乳腺癌患者140万,占全部女性恶性肿瘤发病率的24.1%[10]。尽管外科手术、放化疗技术水平逐渐提高,但并没有改善乳腺癌患者预后。其中肿瘤细胞高度侵袭是乳腺癌患者的主要死因,因此,靶向治疗受到极大关注。
ADAM其重要功能是水解细胞膜上的肿瘤坏死因子,故又称为肿瘤坏死因子α前体转换酶[11]。ADAM17具有多个功能结构域,这些结构有水解蛋白、释放活性因子功能[12]。其与ADAMs家族其他成员一样,可以剪切多种EGFR配体,进而激活EGFR等相关信号传导通道,影响肿瘤细胞的增殖、侵袭及转移[13]。RNA干扰是双链RNA所导致的特异性序列转录后基因沉默,已成为沉默目的基因表达的有效手段[14]。蔡准等[15]在细胞水平研究发现,转染ADAM17-shRNA的人MCF-7乳腺癌细胞中ADAM17 mRNA和ADAM17蛋白表达水平下降,机制与其对ADAM17基因有沉默作用有关。陈国福等[16]利用shRNA干扰沉默人乳腺癌MCF-7细胞中ADAM17,发现实验组的MCF-7细胞进入S期和G2/M期的比例低于对照组和干扰组。刘永存等[17]采用免疫组织化学、Western blot检测法发现,通过抑制ADAM17的表达可以进一步沉默Hep G2的血管内皮细胞生长因子受体2蛋白的表达水平。研究发现,ADAM17在多种恶性肿瘤组织,如胃癌、乳腺癌及脑胶质瘤中高表达,与肿瘤的增殖、侵袭及转移等密切相关。本课题组前期研究发现,利用siRNA沉默ADAM17表达后,在细胞和动物水平可有效抑制乳腺癌的增殖、转移及侵袭,同时将ADAM17-siRNA注射到MCF-7裸鼠移植瘤周围,肿瘤的生长受到抑制[1,18-20]。因为shRNA比siRNA作用更稳定、高效且特异性更强,本课题组在细胞水平也证实ADAM17-shRNA可有效抑制乳腺癌的生长和侵袭[19-20]。本研究针对ADAM17基因设计合成特异性慢病毒介导的ADAM17-shRNA,并将其成功转染入MCF-7细胞,然后将其种植于裸鼠皮下,发现转染ADAM17-shRNA的MCF-7细胞在裸鼠体内的生长受到抑制。
多项体外研究证明,ADAM17活化EGFR后,激活EGFR-PI3K-Akt和/或EGFR-MEK-ERK信号传导通道,进一步影响肿瘤细胞的增殖、侵袭及迁移[8,13-17]。ZHENG 等[21]证明,ADAM17通过活化EGFR-PI3K-Akt促进胶质瘤细胞的增殖和侵袭。GIRICZ等[22]证明,ADAM17通过激活EGFRPI3K-Akt信号通路促进乳腺癌细胞的增殖和转移。THOMPSON等[23]研究发现,MEK-ERK通路在肿瘤形成及发展过程中起重要作用。但目前在动物水平验证ADAM17作用机制的报道少见。本研究利用转染ADAM17-shRNA的MCF-7乳腺癌裸鼠移植瘤模型,发现伴随着ADAM17蛋白在转染组肿瘤组织中的表达下降,转染组肿瘤组织中 EGFR、p-EGFR、Akt、p-Akt、ERK及p-ERK的蛋白表达水平低于对照组和空载体组。说明ADAM17-EGFR-PI3K-Akt和ADAM17-EGFR-MEK-ERK 2条信号传导通路均参与ADAM17-shRNA的作用过程。
参 考 文 献:
[1]MENG X, HU B, HOSSAIN M M, et al.ADAM17-siRNA inhibits MCF-7 breast cancer through EGFR-PI3K-AKT activation[J].Int J Oncol 2016, 49(2):682-690.
[2]韩旭, 杨星飞, 张雪鹏, 等.ADAM17在乳腺癌组织中的表达及意义[J].现代中西医结合杂志, 2010, 19(20):2486-2488.
[3]刘爽, 马荣.ADAM17在恶性肿瘤中的研究及其进展[J].现代生物医学进展, 2013, 13(17):3386-3389.
[4]FENG Y, TSAI Y H, XIAO W, et al.Loss of ADAM17-Mediated tumor necrosis factor alpha signaling in intestinal cells attenuates mucosal atrophy in a mouse model of parenteral nutrition[J].Molecular & Cellular Biology, 2015, 35(21):3604-3621.
[5]LI X, MARETZKY T, WESKAMP G, et al.iRhoms 1 and 2 are essential upstream regulators of ADAM17-dependent EGFR signaling[J].Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(19):6080-6085.
[6]张艳, 乔炜超, 孙影, 等.FoxM1和ADAM17在乳腺癌中的表达及其临床意义[J].中国医药导报, 2016, 13(20):92-95.
[7]王婷, 高玉珍, 沈明志, 等.条件性RNA干扰技术研究进展[J].现代生物医学进展, 2015, 15(3):547-550.
[8]DAVIS N M, SOKOLOSKY M, STADELMAN K, et al.Deregulation of the EGFR/PI3K/PTEN/Akt/mTORC1 pathway in breast cancer:possibilities for therapeutic intervention[J].Oncotarget, 2014, 5(13):4603-4650.
[9]BODAI B I, TUSO P.Breast cancer survivorship:a comprehensive review of long-term medical issues and lifestyle recommendations[J].Perm J, 2015, 19(2):48-79.
[10]唐志柳, 白洁, 顾丽娜, 等.2000~2010年我国前列腺癌和乳腺癌流行状况的系统性综述[J].中国肿瘤, 2013, 22(4):260-265.
[11]MORENO-CACERES J, MAINEZ J, MAYORAL R, et al.Caveolin-1-dependent activation of the metalloprotease TACE/ADAM17 by TGF-β in hepatocytes requires activation of Src and the NADPH oxidase NOX1[J].Febs Journal, 2016, 283(7):1300-1310.
[12]QIAN M, SHEN X, WANG H.The distinct role of ADAM17 in APP proteolysis and microglial activation related to alzheimer’s disease[J].Cellular and Molecular Neurobiology, 2016,36(4):471-482.
[13]FENG Y, DAI X, LI X, et al.EGF signalling pathway regulates colon cancer stem cell proliferation and apoptosis[J].Cell Proliferation, 2012, 45(5):413-419.
[14]徐俊, 毛颖, 苗荻, 等.RNA干扰技术的研究进展[J].生物技术世界, 2012, 13(03):15-17.
[15]蔡准, 吴丽君, 张雪鹏, 等.ADAM17-shRNA对人乳腺癌MCF-7细胞增殖的影响及机制[J].山东医药, 2017, (04):21-24.
[16]陈国福, 吴丽君, 张雪鹏, 等.shRNA沉默ADAM17基因对人乳腺癌细胞MCF-7增殖的影响[J].大连医科大学学报,2016(6):542-545.
[17]刘永存, 伍丽萍, 李锋, 等.ADAM17基因沉默对肝癌细胞HepG2的VEGFR2自分泌表达的影响[J].现代肿瘤医学,2016(19):3020-3024.
[18]陈国福, 吴丽君, 张雪鹏, 等.缺氧条件下沉默解聚素-金属蛋白酶17基因对人乳腺癌MCF-7细胞增殖的影响[J].中国现代医学杂志, 2016, 26(15):22-27.
[19]蔡准, 张媛媛, 张雪鹏, 等.缺氧条件下ADAM17-shRNA对人乳腺癌MCF-7细胞侵袭、迁移的影响[J].山东医药, 2016,56(18):5-7.
[20]彭晓兵, 孙影, 张雪鹏, 等.转染ADAM17-shRNA的骨髓间充质干细胞对MCF-7乳腺癌细胞增殖能力的影响[J].广东医学, 2015, 36(19):2955-2958.
[21]ZHENG X, JIANG F, KATAKOWSKI M, et al.ADAM17 promotes glioma cell malignant phenotype[J].Molecular Carcinogenesis, 2012, 51(2):150-164.
[22]GIRICZ O, CALVO V, PETERSON E A, et al.TACE-dependent TGF-a shedding drives triple-negative breast cancer cell invasion[J].International Journal of Cancer, 2013, 133(11):2587-2595.
[23]THOMPSON K N, WHIPPLE R A, YOON J R, et al.The combinatorial activation of the PI3K and Ras/MAPK pathways is sufficient for aggressive tumor formation, while individual pathway activation supports cell persistence[J].Oncotarget, 2015,6(34):35231-35246.

