离体肝切除联合自体肝移植治疗肝巨大血管瘤1例
段小辉,毛先海,周力学,田秉璋,杨建辉,蒋波
(湖南省人民医院 肝胆外科,湖南 长沙 410005)
部分巨大肝中央型肿瘤因往往累及主肝静脉、肝后叶下腔静脉或第一肝门,导致常规手术方法难以切除或手术风险巨大,1988年德国PICHLMAYR首先应用离体肝切除联合字体肝移植成功切除1例胃平滑肌肉瘤肝巨大转移灶[1]。此后全球多个中心陆续有个案报道,部分学者还对此术式进行改良,以避免腔静脉及门静脉体外转流的应用。但因无肝期时间长,术后并发症高,湖南省人民医院在研究文献基础上,将该术式进行了进一步改进,采用在体保留部分完整肝叶的离体肝切除联合自体余肝成功移植1例中央型肝巨大血管瘤,效果良好,现报告如下。
1 资料与方法
1.1 病例资料
女性患者,50岁,右上腹胀痛1年,因B超发现肝脏巨大血管瘤入院。既往体健,无不良生活嗜好。入院查体:体重58 kg,一般情况好,巩膜无黄染,心肺无异常,腹平坦,肝右肋下3指可触及,质中,无触痛,脾肋下未触及,移动性浊音阴性。术前检查:HBsAg(-),评估肝功能属Child A级,吲哚菁绿15min滞留率为6.3%,MRI示:Ⅳ、Ⅴ、Ⅵ及Ⅷ段巨大肝血管瘤,大小19cm×15cm×13cm,瘤体累及肝右静脉并包绕肝中静脉、门静脉右前后支及肝右动脉前后支(见图1、2)。正常肝体积测定:Ⅰ、Ⅱ及Ⅲ段正常肝体积总和386 ml,Ⅶ段肝体积281 ml,患者体重58 kg,Ⅰ、Ⅱ及Ⅲ段正常肝体积/体重为0.66%;Ⅶ段正常肝体积/体重比0.48%(见图3、4)。
1.2 手术方法
1.2.1 在体保留Ⅰ、Ⅱ及Ⅲ段的右三叶肝切除全身麻醉,采用上腹部屋顶形切口进腹,解剖第一肝门,离断胆囊管、肝右动脉右前支、肝中动脉及门脉左内叶支,分离出右肝管、肝右动脉及门脉左右支并分别置血管牵引带,游离出肝上及肝下下腔静脉并留置牵引带,备全肝血流阻断用,分离右侧肝周韧带,游离并缝线扎离断右侧第三肝门处肝短静脉和粗大的肝右后上下静脉各1支。待肝后下腔静脉右侧半完全游离后将肝右静脉留置血管牵引带,遂安置绕肝提带。在开放肝血流情况下,超声外科吸引器(cavitron ultrasonic surgical aspirator,CUSA)结合超声刀和双极电凝沿肝镰状韧带右侧1cm处离断左叶间裂肝实质至肝后下腔静脉平面,依次离断右肝管、肝右动脉、门静脉右支及肝右静脉,将右三叶肝连同肿瘤完整移出体外,并立即经门静脉右支、肝右动脉以0~4℃脏器保存液进行持续低温灌注(见图5、6)。
1.2.2 体外肝肿瘤切除及受累血管修复在体外0~4℃脏器保存液持续灌注下,以CUSA联合双极电凝行肝巨大肿瘤切除。解剖分离从肝右静脉左侧缘开始,紧贴血管瘤体边缘进行分离,与瘤体相连的所有脉管支均仔细结扎或缝扎,确保拟保留Ⅶ段肝的流入流出道血管、胆管结构的完整性,将肝血管瘤完整切除后,分别通过门静脉右支、肝右动脉及右肝管和肝右静脉进行低温灌注试漏,以6-0或7-0 Prolene缝线进行缝扎修补漏液处,确保残留Ⅶ段肝断面和流入流出的脉管无漏血、漏胆(见图7)。
1.2.3 自体余肝原位再植以5-0 Prolene缝线连续缝合肝右静脉,6-0 Prolene缝线连续缝合门静脉右支,开放植入肝血流,然后以7-0 Prolene缝线多点间断对端吻合肝右动脉。肝断面再次止血后以6-0微桥线端端吻合右肝管,并留置8号T管1根,清理术野,放置腹腔引流管,关腹(见图8、9)。
1.2.4 术后处理术毕即拔除气管插管并送入重症监护室,术后3 d持续监测生命体征和肝功能,注意观察有无活动性出血,予以吸氧、护肝、抗炎、营养支持及对症处理。
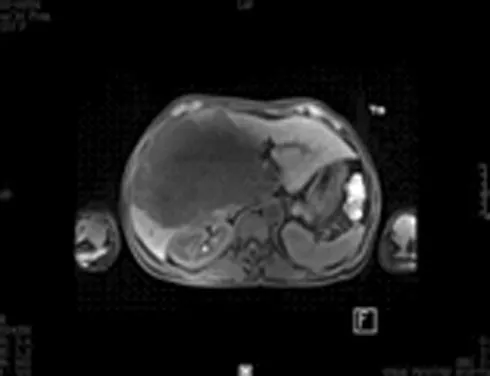
图1 MRI示肝脏巨大血管瘤

图2 MRI示血管瘤包绕肝右动脉前后支
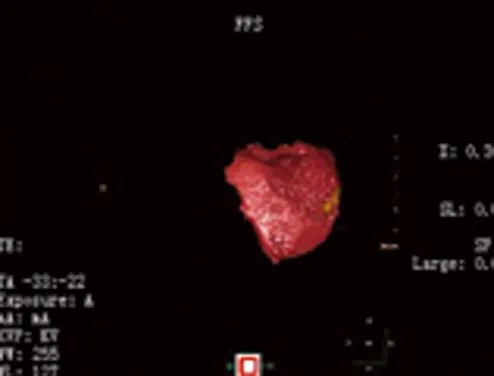
图3 Ⅰ、Ⅱ及Ⅲ段肝体积总和386 ml
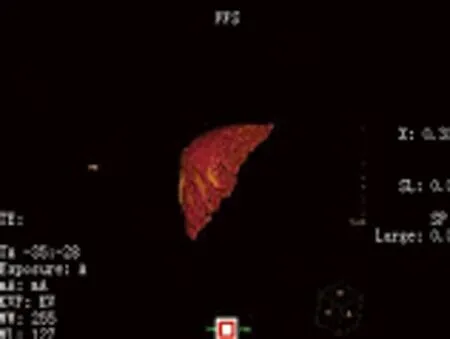
图4 Ⅶ段肝体积281 ml

图5 术中所见肝血管瘤及Ⅶ段正常肝脏
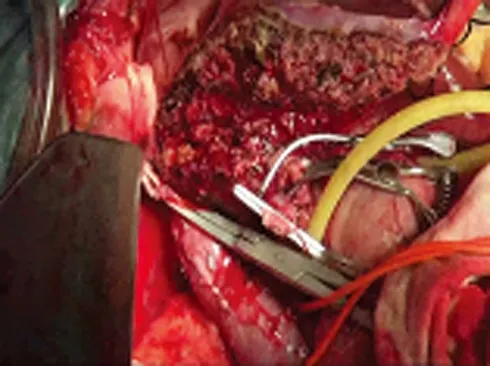
图6 切除右三叶肝脏

图7 体外肝血管瘤切除后剩余肝脏
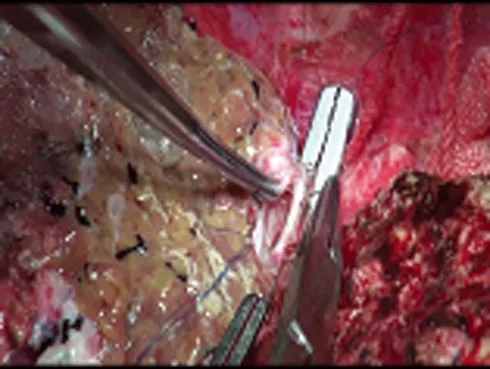
图8 自体余肝再移植
2 结果
患者手术顺利,手术时间12 h,未进行腔静脉及门静脉转流,无肝期为0min,出血量1 900 ml,自体血回输1 000 ml,输白蛋白30 g,术后病假证实为肝脏海绵状血管瘤。术后谷丙转氨酶和胆红素均于第1天达峰值后快速下降,第3天均完全正常。术后第3天肠道功能恢复,予流质饮食。术后第7天复查CT示植入的Ⅶ段肝组织血运良好,体积增长至348 ml,在体保留的Ⅰ、Ⅱ及Ⅲ段肝组织体积增长至639 ml,仅右肝断面少量渗液,未予处理于第10天自行吸收。第11天痊愈出院。随访24个月,肝功能正常,CT示无新生血管瘤,生活质量高(见图10)。
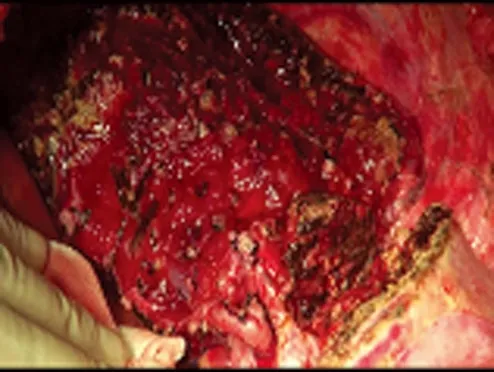
图9 自体肝植入后肝灌注良好
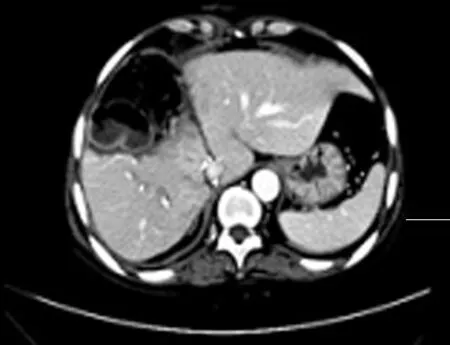
图10 术后2年CT复查
3 讨论
肝切除技术的进步和肝移植技术的广泛应用,使得大部分既往所谓困难的肝肿瘤得以顺利切除。然而,仍有部分肝中央型肿瘤因其累及或侵犯主肝静脉、肝后下静脉或第一肝门而导致常规手术无法切除或手术风险极大,而供肝稀缺或肝移植指征不足又限制了此类患者的肝移植应用[2-3]。随着肝移植技术的不断进步,集肝移植、血管外科、冷灌注及冷保存等技术为一身的离体肝切自体肝移植术除逐渐被应用于肝脏外科以治疗一些常规方法无法切除的肝脏占位行病变[4]。
由PICHLMAYR等[1]最初提出的离体肝切除自体肝移植术其原理是腔静脉及门静脉在体外转流前提下,完整切除肝脏及肝后下腔静脉,并予以持续低温灌注,在体外进行肝脏肿瘤切除和需保留血管的修复重建,再将自体余肝原位植入。这一技术融合了现代肝切除技术、肝移植技术及血管外科技术于一体。体外静脉转流的应用克服了下腔静脉和门静脉长时间血流凝滞和继发的全身血流动力学障碍[5]。而肝脏持续低温灌注技术的应用则充分保证了离体肝脏缺血耐受的安全时限,使术者可以安全的进行较长时间离体困难肝肿瘤的切除以及精细的血管外科操作[5]。因此该手术被认为是肝脏外科技术的一次重大革新,可提高常规手术无法切除或手术风巨大的中央型肝肿瘤的手术切除率。
但此术式因常出现较严重的肝脏缺血再灌注损伤,术后并发症多,死亡率高达22.5%;且要求手术医生必须兼备良好的肝脏外科技术和肝移植经验,因此仍属风险大的手术[6]。国内外范围报道较少,其适应症更宜选择无严重肝硬化和肝功能障碍,因肿瘤累及主肝静脉或第一肝门采用常规方法难以切除或手术风险巨大的中央型肝肿瘤病例[7]。
最初由PICHLMAYR等[1]提出的离体肝切除自体肝移植术需要长时间体外静脉转流,而体外静脉转有其自身缺陷:首先是转流耗时过多,其次转流泵本身费用昂贵,再者术中体外转流容易造成循环以及凝血功能的紊乱,增加麻醉及手术风险。有鉴于此,有学者对该术式进行了改良,采用人造血管暂时置换肝后段下腔静脉,临时再建体循环回流通路,确保循环稳定,同时利用自体门静脉与人造血管进行暂时性门腔端侧分流,避免无肝期门静脉系统血液淤滞导致的肠道水肿,电解质及酸碱失衡,体外切除肿瘤后拆除临时性血管搭桥,行残肝自体移植[8]。叶啟发等[9]通过改进PICHLMAYR的术式提出了半离体自体肝移植术,首先离断入肝血管,进行体内全肝低温灌注,在体切除肿瘤,而后行肝门血管吻合,该术式未横断肝上下腔静脉,保留三叶肝结构及肝后下腔静脉的完整性,无需体外静脉转流。以上两种手术改良均有效避免了长时间体外静脉转流带来的不利因素,但未能解决术中无肝期时间长的问题。研究显示,术中无肝期时间长短与离体肝切除自体肝移植术后患者恢复及预后相关[10]。
本例患者术前肝功能状态良好,肝脏轮廓饱满光整、无明确肝硬化表现。血管瘤巨大,瘤体累及肝右静脉并包绕肝中静脉、门静脉右前后支及肝右动脉前后支,传统肝切除术难以达到根治目的,是施行体外肝切除、自体肝移植的最佳适应证,本研究在文献基础上将该术式进行了进一步改进[1,8-9]。在确定实施离体肝切除前,笔者通过MRI血管成像充分评估病人肝脏病变及全肝血管重要解剖情况,在体保留部分完整的Ⅰ、Ⅱ及Ⅲ段肝脏组织,有效避免了静脉转流所带来的困难和并发症,保留部分完整的肝脏保证患者术中没有无肝期,提高了手术的安全性,减少了术后并发症。本例患者术后第3天肝功能即正常,未发生无肝期所带来的并发症。
剩余肝脏的成功自体移植并有效发挥功能是确保手术安全性和有效性的关键[11]。因此,术前应对肿瘤切除后的剩余肝脏体积进行精确测算,术中应尽可能保全剩余肝脏的肝动脉、门静脉双重血供以及充分的肝静脉回流,确保回植入体内的剩余肝脏发挥最大功能。另外特别注意的是肝脏再植前可通过门静脉、肝动脉及胆管各自的主要管道进行灌注,以确认余肝断面血管胆管已妥善结扎。部分切除的近肝大血管应得到完善的修复,以避免余肝移植后大出血或漏胆。
离体肝切除自体肝移植技术对于提高累计肝静脉和下腔静脉中央型肝脏肿瘤的切除率,增加肝切除手术的安全性具有重要意义[12]。该手术方式具有其独特的优点和广泛的实用价值,可在临床上根据具体情况推广实用。但该手术难度大,操作者应具备良好的肝移植知识,且有娴熟的肝切除技术和血管外科技术方能顺利完成该手术。另外离体肝切除自体肝移植技术临床经验的积累以及相关基础研究的开展仍处于摸索阶段,有待于进一步的探索。
参 考 文 献:
[1]PICHLMAYR R, BRETSCHNEIDER H J, KIRCHNER E, et al.Ex situ operation on the liver.A new possibility in liver surgery[J].Langenbecks Arch Chir, 1988, 373(2):122-126.
[2]WANG F Q, LU Q, YAN J, et al.Ex vivo hepatectomy and partial liver autotransplantation for hepatoid adenocarcinoma:A case report[J].Oncol Lett, 2015, 9(5):2199-2204.
[3]JADRIJEVIĆ S, ŠUMAN O, JAKUS D M, et al.Ex vivo liver resection with replacement of inferior vena cava without the use of cardiopulmonary bypass in a patient with metastatic adrenocortical carcinoma[J].Int J Urol, 2017, 24(2):166-167.
[4]BAKER M A, MALEY W R, NEEDLEMAN L, et al.Ex vivo resection of hepatic neoplasia and autotransplantation:a case report and review of the literature[J].J Gastrointest Surg, 2015, 19(6):1169-1176.
[5]WEN H, DONG J H, ZHANG J H, et al.Ex Vivo Liver Resection and Autotransplantation for End-Stage Alveolar Echinococcosis:A Case Series[J].Am J Transplant, 2016, 16(2):615-624.
[6]JIANYONG L, JINGCHENG H, WENTAO W, et al.Ex vivo liver resection followed by autotransplantation to a patient with advanced alveolar echinococcosis with a replacement of the retrohepatic inferior vena cava using autogenous vein grafting:a case report and literature review[J].Medicine (Baltimore), 2015,94(7):e514.
[7]MAO L, CHEN J, LIU Z, et al.Extracorporeal hepatic resection and autotransplantation for primary gastrointestinal stromal tumor of the liver[J].Transplant Proc, 2015, 47(1):174-178.
[8]ZHANG K M, HU X W, DONG J H, et al.Ex-situ liver surgery without veno-venous bypass[J].World J Gastroenterol, 2012,18(48):7290-7295.
[9]叶啟发, 范晓礼, 明英姿, 等.36例自体肝移植的临床疗效[J].中华消化外科杂志, 2013, 12(9):676-680.
[10]TUXUN T, AINI A, LI Y P, et al.Systematic review of feasibility, safety and efficacy of ex situ liver resection and autotransplantation[J].Zhonghua Yi Xue Za Zhi, 2016, 96(28):2251-2257.
[11]SCHREM H, KLEINE M, LANKISCH T O, et al.Long-term results after adult ex situ split liver transplantation since its introduction in 1987[J].World J Surg, 2014, 38(7):1795-1806.
[12]TUERGANAILI A, SHAO Y M, ZHAO J M, et al.The clinical practice of improvement the “Volume and Quality” of functional liver in autologous liver transplantation for the patients with alveolar echinococcosis[J].Zhonghua Yi Xue Za Zhi, 2017,97(4):270-275.

