高糖条件下致钙信号改变的机制研究
赵灿,吴永全
(首都医科大学附属北京友谊医院 心脏中心,北京 100050)
我国成人糖尿病的患病率高达9.7%[1],糖尿病是心房颤动(以下简称房颤)的独立危险因素[2-3]。房颤可促使心脏电生理及结构改变[4]。糖尿病与房颤高度相关[5-7],但其致房颤的机制还不清楚。糖尿病可以导致心肌收缩功能异常[8-9],这与钙信号异常相关[10]。房颤也与钙信号密切相关[11]。氧化应激是两者机制联系的一个切合点,心脏钙通道雷诺定受体(ryanodine receptor,RYR)是氧化应激的靶点,因此糖尿病高血糖可能通过氧化应激影响钙信号[12]。本实验旨在研究高糖对钙信号的影响及其机制。
1 材料与方法
1.1 实验动物
清洁级雄性SD大鼠,1~3日龄,体重(5.75±0.33)g,由北京维通利华实验动物技术有限公司提供。
1.2 主要试剂
荧光染料fluo-4(中国科学院生物物理研究所),L-Glucose、胰酶、Ⅰ型胶原酶、尿酸购自美国Sigma公司,α-actin一抗(美国Santa公司),α-actin二抗(杭州华安生物公司),BCA试剂盒(上海碧云天生物技术有限公司),RYR2一抗(美国Millipore公司),RYR2二抗(英国Abcam公司),FKBP12.6一抗(美国Proteintech Group公司),β-actin(美国Epitomics公司),4%多聚甲醛(武汉博士德生物工程有限公司)。
1.3 细胞培养
无菌条件下,取出1~3日龄SD大鼠心房组织,用PBS清洗该组织块2次,然后将组织剪成约1mm×1mm×1mm大小;加入4 ml酶消化液(0.1%胰酶和0.1%Ⅰ型胶原酶),混悬10 s,37℃条件下消化10min,用滴管吹打制成单细胞悬液,自然沉淀并收集上清,用含10% FBS培养基终止消化后放置于4℃环境中。剩下的组织再加入3~4 ml酶消化液,混悬10 s,37℃条件下消化10min,按上述方法收集上清并终止消化后放置于4℃条件下,重复该步骤2、3次,直至组织完全被消化。用200目不锈钢筛网过滤细胞消化液,1 200 r/min离心10min,弃上清,用含10% FBS 的DMEM/F12培养基混悬沉淀细胞,接种于25cm2培养瓶,放置于37℃、5%二氧化碳CO2培养箱,差速贴壁1 h后,吸出培养基,按实验需要接种于6孔板中继续培养。
1.4 实验分组
1.4.1 第1部分实验分为4组:左旋葡萄糖(L-glucose,LG)组(5.5 mol右旋葡萄糖+17.5 mol左旋葡萄糖)、正常葡萄糖(normal glucose,NG)组(5.5 mol右旋葡萄糖)、高葡萄糖组(high glucose,HG)组(23.0 mol右旋葡萄糖)、HG+ 尿酸组(100μmol尿酸)。
1.4.2 第2部实验分为3组:①过氧化亚硝基阴离子(ONOO-)组:5.5 mol右旋葡萄糖孵育48 h后,给予5μmol ONOO-刺激6 h;②分解后的过氧化亚硝基阴离子(DC-ONOO-)组:5.5 mol右旋葡萄糖孵育48 h后,给予5μmol DC-ONOO-刺激6 h;③ONOO-+尿酸组:5.5 mol 右旋葡萄糖孵育48 h后,予以100μmol尿酸预处理6 h,再给予5μmol ONOO-刺激6 h。
1.5 大鼠心房肌细胞的培养
待心房肌细胞生长至80%融合时,弃培养基,用温育的PBS冲洗细胞2次,在室温下用4%多聚甲醛固定细胞。用PBS冲洗细胞,在4℃条件下,用0.1%Triton X-100透膜15min,洗涤细胞,4% BSA封闭细胞30min。加入按比例稀释的α-actin一抗,在4℃冰箱中孵育细胞过夜。洗涤细胞加入α-actin二抗,37℃条件下放置1 h。再次洗涤细胞后在倒置荧光显微镜(日本Olympus公司)下观察图像。
1.6 钙瞬变的测定
将心肌单细胞与10μmol/L钙荧光指示剂Fluo-4 AM(上海赛默飞世尔科技有限公司)共同孵育,细胞外液灌流。将孵育好的心肌细胞置入LSM-Pascal型激光扫描共聚焦显微镜(德国Zeiss公司)的载物台上,用温育好的细胞外液覆盖,在镜下进行观察。调节激光共聚焦显微镜为线扫描的成像方式,观察钙瞬变,通过MATLAB 7.0软件分析,得出钙瞬变的特征。
1.7 Western blot检测
Western blot检测大鼠心房肌细胞RYR2、FKBP12.6。将提取的心房肌蛋白用BCA蛋白定量试剂盒定量,取45μl蛋白上样到10% SDS-PAGE凝胶电泳。将凝胶上的蛋白转移至PVDF膜,用5%脱脂奶粉+TBST在摇床上封闭1 h,加入相应一抗4℃孵育过夜,洗涤后加入二抗,室温孵育1 h,TBST洗膜后加入ECL试剂、曝光、显影、定影、冲洗胶片及对胶片进行扫描分析。
1.8 统计学方法
数据分析采用SPSS 13.0统计软件,计量资料以(±s)表示,比较用单因素方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠心房肌细胞的鉴定
大鼠心房肌细胞培养48 h后,倒置相差显微镜下单个心房肌细胞呈扁平形、梭形、杆状,某些细胞在贴壁后形成三角形,顶部突出,在部分视野中可观察到自发性搏动的细胞,采用免疫细胞化学鉴定,确定为大鼠心房肌细胞。见图1。
与阴性对照(见图1A)相比,加入α-actin 蛋白的大鼠心房肌细胞在胞膜和胞浆中均呈绿色荧光(见图1B),即α-actin检测呈阳性。
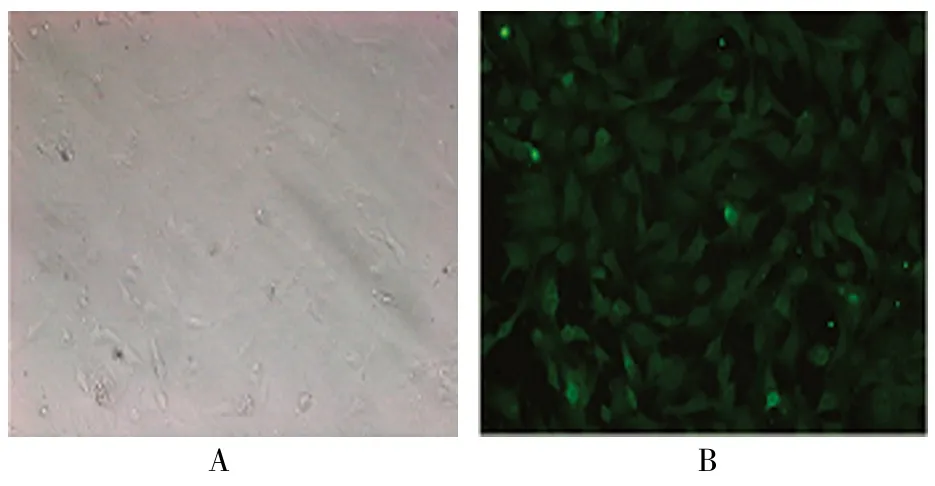
图1 大鼠心房肌细胞 (×200)
2.2 各组钙瞬变频率和幅度比较
2.2.1 第1部分本实验观察高糖及氧化应激对大鼠心房肌细胞钙瞬变幅度和频率的影响,结果显示,各组钙瞬变频率比较,经单因素方差分析,差异无统计学意义(P>0.05);各组钙瞬变幅度比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,HG组的钙瞬变幅度与NG组比较,差异有统计学意义(t=4.011,P=0.000),HG组高于NG组;HG+尿酸组钙瞬变幅度为与HG组比较,差异有统计学意义(t=3.380,P=0.001),HG+尿酸组低于HG组。见表1。
2.2.2 第2部分各组钙瞬变频率比较,经单因素方差分析,差异无统计学意义(P>0.05)。各组钙瞬变幅度比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,DC-ONOO-组钙瞬变幅度与ONOO-组比较,差异有统计学意义(t=2.808,P=0.005),氧化应激刺激因子ONOO-可促进钙的释放;ONOO-+尿酸组钙瞬变幅度与ONOO-比较,差异有统计学意义(t=3.309,P=0.001),氧化应激抑制因子尿酸可以减弱ONOO-对钙释放的促进作用。见表2。
2.3 各组RYR2和FKBP12.6蛋白表达水平比较
2.3.1 第1部分LG组、NG组、HG组、HG+尿酸组的RYR2蛋白相对表达量分别为(1.047±0.978)、(0.940±0.016)、(0.564±0.620) 和(0.983±0.132),经单因素方差分析,差异有统计学意义(F=18.278,P=0.001)。进一步两两比较经LSD-t检验,HG组RYR2蛋白相对表达量与NG组比较,差异有统计学意义(t=10.169,P=0.001),HG组较NG组下降;LG组与NG组RYR2蛋白蛋白相对表达量比较,差异无统计学意义(t=1.870,P=0.175);HG+尿酸组RYR2蛋白相对表达量与HG组比较,差异有统计学意义(t=4.976,P=0.008),HG+尿酸组较HG组升高(见图2、3)。LG组、NG组、HG组、HG+尿酸组的FKBP12.6蛋白相对表达量分别为(0.593±0.007)、(0.614±0.014)、(0.438±0.135) 和(0.804±0.507),经单因素方差分析,差异有统计学意义(F=12.813,P=0.002)。进一步两两比较经LSD-t检验,HG组FKBP12.6蛋白相对表达量与NG组比较,差异有统计学意义(t=2.950,P=0.031),HG组较NG组下降;LG组与NG组FKBP12.6蛋白相对表达量比较,差异无统计学意义(t=2.255,P=0.087);HG+尿酸组FKBP12.6蛋白相对表达量与HG组比较,差异有统计学意义(t=4.349,P=0.012),HG+尿酸组较HG组升高(见图2、4)。
表1 第1部分钙瞬变频率和幅度比较 (±s)

表1 第1部分钙瞬变频率和幅度比较 (±s)
注:1)NG组与比较,P<0.05;2)与HG组比较,P<0.05
组别 细胞数 频率 幅度LG 组 29 7.72±5.08 2.21±0.45 NG组 31 7.48±4.82 2.12±0.50 HG 组 29 8.10±6.02 2.66±0.601)HG+尿酸组 38 7.50±3.96 2.22±0.532)F值 0.158 6.400 P值 0.854 0.000
表2 第2部分钙瞬变频率和幅度比较 (±s)

表2 第2部分钙瞬变频率和幅度比较 (±s)
注:†与ONOO-组比较,P<0.05
组别 细胞数 频率 幅度ONOO-组 36 5.47±3.54 4.29±1.46 ONOO-+ 尿酸组 33 3.94±2.96 3.28±1.28†DC-ONOO-组 33 4.36±2.75 3.43±0.98†F值 2.120 6.932 P值 0.125 0.002
2.3.2 第2部分ONOO-组、DC-ONOO-组、ONOO-+尿酸组的RYR2蛋白相对表达量分别为(0.423±0.051)、(0.673±0.042) 和(0.667±0.214),经单因素方差分析,差异有统计学意义(F=70.841,P=0.000)。进一步两两比较经LSD-t检验,ONOO-组RYR2蛋白相对表达量与DC-ONOO-组比较,差异有统计学意义(t=6.586,P=0.003),DC-ONOO-组较ONOO-组升高;ONOO-+尿酸组RYR2蛋白相对表达量与ONOO-组比较,差异有统计学意义(t=11.082,P=0.000),ONOO-+尿酸组较ONOO-组升高(见图5、6)。ONOO-组、DC-ONOO-组、ONOO-+尿酸组的FKBP12.6蛋白相对表达量分别为(0.230±0.217)、(0.849±0.051)和(0.857±0.050),经单因素方差分析,差异有统计学意义(F=165.062,P=0.000)。进一步两两比较经LSD-t检验,ONOO-组FKBP12.6蛋白相对表达量与DC-ONOO-组比较,差异有统计学意义(t=17.308,P=0.000),DC-ONOO-组较ONOO-组升高;ONOO-+尿酸组FKBP12.6蛋白相对表达量与ONOO-组比较,差异有统计学意义(t=17.582,P=0.000),ONOO-+尿酸组较ONOO-组升高(见图5、7)。

图2 第1部分各组RYR2和FKBP12.6蛋白的表达

图3 第1部分各组RYR2蛋白的表达水平比较 (±s)
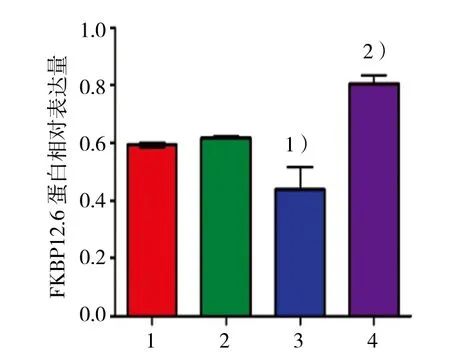
图4 第1部分各组FKBP12.6蛋白的表达水平比较 (±s)
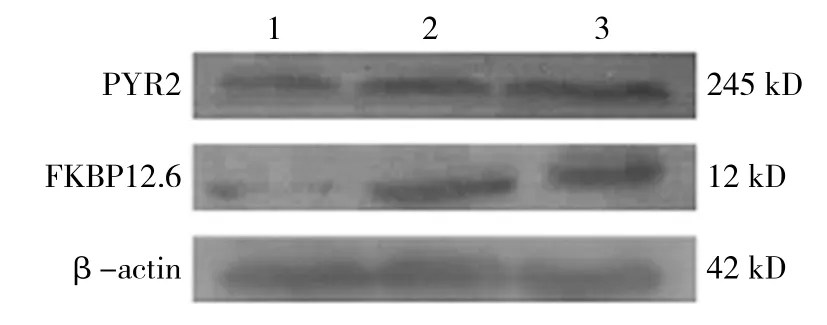
图5 第2部分各组RYR2和FKBP12.6蛋白的表达

图6 第2部分各组RYR2蛋白的表达水平比较 (±s)

图7 第2部分各组FKBP12.6蛋白的表达水平比较 (±s)
3 讨论
糖尿病与房颤的发生密切相关[13],糖尿病是房颤的高风险因素,与非糖尿病患者相比,糖尿病患者具有更高的房颤患病率,糖尿病病程越长,血糖控制不良的患者,房颤发生的风险更大[14]。尽管有很多研究证实糖尿病与房颤密切相关,但是糖尿病致房颤的潜在机制还不清楚,而且既往大多研究是以心室肌细胞为研究对象。高血糖及氧化应激是糖尿病的两大特征,值得注意的是细胞内钙信号异常也是糖尿病病理生理过程中的一个重要特征,而且可能与心律失常相关[15]。
近来有研究证实,心房肌细胞钙信号异常是调控心房颤动的关键环节,钙信号甚至可以成为房颤的一个创新的治疗靶点[11]。钙离子是最简单,同时也是最复杂的细胞信使。过去20多年的研究发现了钙信号的基本单元钙火花[16],以及相关钙信号事件,包括钙波和钙瞬变。心肌细胞内钙火花等钙信号事件在心律失常的发生中起重要作用。钙信号事件受多种Ca2+通道蛋白―RYR2及其上游调控因子―FKBP12.6的调节。通过这些钙调控蛋白的作用,调节钙通道蛋白的活性和钙离子的释放与重吸收[11,17]。
既往的研究已经证明,在心室肌细胞中,糖尿病会使钙信号出现异常,这与肌浆网RYR2及其磷酸化有关,并进一步确认RYR2及其调节蛋白FKBP12.6在心室肌钙信号中的作用,尽管RYR2及其磷酸化可导致钙释放增加,但是心室肌细胞并不意味着心房肌细胞会出现同样的现象,本研究是建立在心房肌细胞基础上的。
本实验给予高糖刺激大鼠心房肌细胞48 h,HG组钙释放增加,HG组RYR2蛋白表达水平下降,应用氧化应激抑制因子―尿酸可减少钙的释放,而RYR2蛋白的表达上调,本实验通过对RYR2蛋白的测定证实高糖刺激下钙的释放可能与钙通道RYR2有关。而LG组与NG组在蛋白表达方面无差异,可以推断钙通道的激活是由高糖引起,而非高渗透压所致,所以高糖可以激活RYR2信号传导通路。
持续的高糖刺激可引起氧化应激和硝化应激,导致过量一氧化氮NO和O2-产生,两者通过非酶促化学反应可形成氧化活性极高的ONOO-[18]。RYR2等钙通道调控蛋白含有大量的自由巯基,是活性氧和氮类氧化损伤的极好目标。高糖对心房肌钙信号的影响可能与高糖氧化应激相关。本实验显示,给予外源性ONOO-刺激后,RYR2蛋白的表达与DC-ONOO-组有差异,钙离子的释放增多,说明ONOO-参与钙通道的活化。而高糖可以不断产生内源性ONOO-,是一个长时间的刺激,更能参与钙通道活化,调节钙信号的释放。
尿酸是体内核酸嘌呤的代谢产物,是体内天然抗氧化物质,是ONOO-的特异性清除剂。本研究结果显示,加用尿酸后,与HG组相比,钙释放减少,钙通道蛋白RYR2也出现相应的改变,且ONOO-+尿酸组较ONOO-组钙释放减少,进一步表明尿酸可以消除ONOO-的氧化应激作用,影响钙信号的释放。
目前,高糖引起钙通道RYR2蛋白表达改变的机制并不清楚。FKBPl2.6能和RYR2结合,其中FKBPl2.6对维持RYR2通道的稳定是必需的。FKBPl2.6结合RYR2可以稳定RYR2闭合状态,减少Ca2+漏出,促进RYR2之间在兴奋收缩过程中的耦联,增强开闭的同步协调性[17]。本研究证实,高糖对RYR2蛋白表达的影响可能与其调节蛋白FKBPl2.6相关。
研究揭示,高糖可以激活RYR2钙信号通路,增加钙的释放,氧化应激抑制因子―尿酸可以减少钙的释放。高糖可能通过氧化应激引起RYR2蛋白上游信号通路分子―FKBP12.6调控钙信号。本研究在一定程度上为糖尿病致心律失常机制的研究提供了理论基础。
参 考 文 献:
[1]YANG W, LU J, WENG J, et al.China national diabetes and metabolic disorders study group.Prevalence of diabetes among men and women in China[J].N Engl J Med, 2010, 362(12):1090-1010.
[2]MÉNDEZ-BAILÓN M, MUÑOZ-RIVAS N, JIMÉNEZ-GARCÍA R, et al.Impact of type 2 diabetes mellitus in hospitalizations for atrial fibrillation in Spain[J].Int J Cardiol, 2016, 221:688-694.
[3]STASZEWSKY L, CORTESI L, BAVIERA M, et al.Diabetes mellitus as risk factor for atrial fibrillation hospitalization:Incidence and outcomes over nine years in a region of Northern Italy[J].Diabetes Res Clin Pract, 2015, 109(3):476-484.
[4]YANG Q, QI X, DANG Y, et al.Effects of atorvastatin on atrial remodeling in a rabbit model of atrial fibrillation produced by rapid atrial pacing[J].BMC Cardiovasc Disord, 2016, 16(1):142.
[5]PALLISGAARD J L, SCHJERNING A M, LINDHARDT T B,et al.Risk of atrial fibrillation in diabetes mellitus:a nationwide cohort study[J].Eur J Prev Cardiol, 2016, 23(6):621-627.
[6]DUBLIN S, GLAZER N L, SMITH N L, et al.Diabetes mellitus,glycemic control, and risk of atrial fibrillation[J].J Gen Intern Med, 2010, 25(8):853-858.
[7]HUXLEY R R, FILION K B, KONETY S, et al.Meta-analysis of cohort and case-control studies of type 2 diabetes mellitus and risk of atrial fibrillation[J].American Journal of Cardiology, 2011,108(1):56-62.
[8]HUYNH K, BERNARDO B C, MCMULLEN J R, et al.Diabetic cardiomyopathy:mechanisms and new treatment strategies targeting antioxidant signaling pathways[J].Pharmacology Therapeutics, 2014, 142(3):375-415.
[9]FREDERSDORF S, THUMANN C, ZIMMERMANN W H,et al.Increased myocardial SERCA expression in early type 2 diabetes mellitus is insulin dependent:in vivo and in vitro data[J].Cardiovasc Diabetol, 2012, 11:57.
[10]ZHAO S M, WANG Y L, GUO C Y, et al.Progressive decay of Ca2+homeostasis in the development of diabetic cardiomyopathy[J].Cardiovasc Diabetol, 2014, 13(1):75.
[11]DOBREV D, NATTEL S.Calcium handling abnormalities in atrial fibrillation as a target for innovative therapeutics[J].J Cardiovasc Pharmacol, 2008, 52(4):293-299.
[12]YAN Y, LIU J, WEI C, et al.Bidirectional regulation of Ca2+sparks by mitochondria-derived reactive oxygen species in cardiac myocytes[J].Cardiovasc Res, 2008, 77(2):432-441.
[13]DEVIDI M, BUDDAM A, DACHA S, et al.Atrial fibrillation and its association with endocrine disorders[J].J Atr Fibrillation,2014, 6(5):959.
[14]OSTGREN C J, MERLO J, RASTAM L, et al.Atrial fibrillation and its association with type 2 diabetes and hypertension in a Swedish community[J].Diabetes Obes Metab, 2004, 6(5):367-374.
[15]EISNER D.Calcium in the heart:from physiology to disease[J].Exp Physiol, 2014, 99(10):1273-1282.
[16]HOANG-TRONG T M, ULLAH A, Jafri M S calcium sparks in the heart:dynamics and regulation[J].Res Rep Biol, 2015, 6:203-214.
[17]ODA T, YANG Y, UCHINOUMI H, et al.Oxidation of ryanodine receptor (RyR) and calmodulin enhance Ca release and pathologically alter, RyR structure and calmodulin affinity[J].J Mol Cell Cardiol, 2015, 85(4):240-248.
[18]SOBEL B E, SCHNEIDER D J.Cardiovascular complications in diabetes mellitus[J].Curt Opin Pharmacol, 2005, 5(2):143-148.

