红树林淡紫拟青霉胞外多糖体外抗HSV-1的实验研究*
李国军,胡海岩,王永霞,杜勇俊,张媛媛,常彩红,林英姿
(海南医学院1.临床学院,2.热带医学与检验学院,海南 海口 571109)
单纯疱疹病毒Ⅰ型(herpes simplex virus,HSV-1)属于疱疹病毒科α病毒亚科,为DNA病毒,其引起的角膜炎致盲率居各种角膜病之首,引起的病毒性脑炎死亡率、致残率较高。临床常用的抗HSV-1药物主要为核苷类,不仅副作用较大且易产生耐药性,因此研发高效且副作用小的抗病毒药物尤为重要[1-2]。
课题组前期从海南红树林中分离出一株淡紫拟青霉,其产生的胞外多糖初步证实具有一定的抗病毒作用。本研究拟进一步探讨该多糖的抗病毒作用,为筛选新型抗病毒药物提供实验基础。
1 材料与方法
1.1 材料
1.1.1 药物淡紫拟青霉胞外多糖由本实验室获得,用双蒸水配成20 g/L母液,0.22μm微孔滤膜过滤除菌,分装,-20℃保存。临用时以DMEM维持液稀释至所需浓度。
1.1.2 试剂及细胞株DMEM培养基(美国Hyclone公司),胰酶(美国Amersco公司),胎牛血清(杭州四季青公司),MTT(美国Sigma公司),Vero细胞(美国ATCC细胞库,CCL81)。
1.1.3 病毒株单纯疱疹病毒Ⅰ型由海南医学院热带医学与检验学院实验室保存。
1.1.4 仪器设备生物安全柜(美国Baker公司,SG403A-HE),酶联免疫检测仪(上海天美科学仪器有限公司),二氧化碳CO2培养箱(美国Nuaire公司,NU-4750E),倒置显微镜(深圳拓天仪器设备有限公司),电子分析天平(北京赛多利斯科学仪器有限公司),低速台式离心机(上海安亭科学仪器厂),细胞培养板(美国Corning公司)等。
1.2 方法
1.2.1 病毒滴度测定将24孔板中生长状态良好的Vero细胞培养液吸弃,加入用DMEM维持液作10倍系列梯度稀释(1×10-9~1×10-1)的HSV-1病毒株1 ml,每一稀释度设6个复孔,将不加病毒液的正常细胞作为对照,置于37℃、5% CO2培养箱中培养2 h后弃上清液,加入完全培养液1 ml/孔。逐日观察细胞病变程度(cytopathic effect,CPE),记录细胞病变情况,无细胞病变为(-),1%~25%细胞病变为(+),26%~50%细胞病变为(++),51%~75%细胞病变为(+++),76%~100%细胞病变为(++++)。当病毒对照组CPE达(+++)以上时终止培养,判定结果。按Reed-Muench公式,计算病毒半数感染量(50%tissue culture infective dose,TCID50)以确定病毒滴度[3]。实验重复3次。
lgTCID50=距离比×稀释度对数之差+高于50%病变率的稀释度的对数
距离比=高于50%病变率的百分数-50%/(高于50%病变率的百分数-低于50%病变率的百分数)
1.2.2 淡紫拟青霉胞外多糖的细胞毒性测定将不同稀释度淡紫拟青霉胞外多糖加入96孔板生长状态良好的Vero细胞中,100μl/孔,每个浓度设6个复孔,设不加药物的维持液作为对照,继续培养72 h,隔天换液1次,于培养结束前4 h,每孔加入5.0 mg/ml MTT 20μl,继续培养4 h,吸弃上清液,加入二甲亚砜100μl/孔,振荡5min,用酶标仪测定570 nm处光密度(optical density,OD)值,取6孔平均值计算各浓度细胞存活率及药物对细胞的半数有毒浓度(50%cytotoxic concentration,CC50)。实验重复3次。

1.2.3 MTT法检测淡紫拟青霉胞外多糖对病毒的直接灭活作用将不同浓度淡紫拟青霉胞外多糖与100 TCID50病毒液等体积混合,于37℃接触2 h,各管病毒依次10倍稀释,加入单层96孔板Vero细胞中,100μl/孔,感染2 h后换完全培养液,置于37℃、5% CO2培养箱中培养,逐日观察CPE,待病毒对照孔CPE达(+++)(++++)且细胞对照正常时,吸弃培养液,MTT法检测病毒抑制率。每一药物浓度设4个复孔,同时设病毒对照组和正常细胞对照组。实验重复3次。
1.2.4 MTT法检测淡紫拟青霉胞外多糖对病毒的吸附作用在单层96孔板Vero细胞中加入100 TCID50HSV-1,100μl/孔,同时加入不同浓度淡紫拟青霉胞外多糖,每一浓度设6个复孔,37℃孵育2 h,吸弃孔内液体,加入维持液,在37℃、5% CO2培养箱中培养至病毒对照孔CPE达(+++)(++++)且细胞对照正常时,MTT法测淡紫拟青霉胞外多糖对病毒的吸附作用。同时设病毒对照组和正常细胞对照组。实验重复3次。
抑制率(%)=(实验组OD值-病毒对照组OD值)/(正常细胞对照组OD值-病毒对照组OD值)
1.2.5 MTT法检测淡紫拟青霉胞外多糖对病毒生物合成的影响以100 TCID50的HSV-1感染96孔板中Vero细胞,37℃孵育2 h,吸弃病毒液,加入不同浓度淡紫拟青霉胞外多糖,每一浓度设6个复孔,在37℃、5% CO2培养箱中培养48~72 h,待病毒对照CPE达(+++)(++++)且细胞对照正常时,MTT法测淡紫拟青霉胞外多糖对病毒生物合成的影响。同时设病毒对照组和正常细胞对照组。实验重复3次。
1.3 统计学方法
数据分析采用Graph Pad Prism 6统计软件,计量资料以均数±标准差(±s)表示,比较用方差分析,方差齐则两两比较用LSD-t检验,量效关系采用回落归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 接种病毒滴度
按Reed-Meuench法计算病毒的TCID50为10-4.6,即100μl接种滴度为10-4.6的病毒,可使50% Vero细胞发生明显病变,实验用病毒为100 TCID50。
2.2 淡紫拟青霉胞外多糖对Vero细胞的毒性
淡紫拟青霉胞外多糖对Vero细胞的CC50为1 724.2μg/ml,多糖浓度<900.0μg/ml时,细胞存活率>90%;多糖浓度为1 000μg/ml时细胞存活率为84.6%;当多糖浓度>1 000μg/ml时,细胞存活率<80%。因此,后续实验用多糖浓度控制在<1 000μg/ml,在所用多糖浓度范围内未见其对Vero细胞有增殖作用,说明该多糖对Vero细胞毒性较低,是一种非常安全的多糖(见图1)。正常Vero细胞和淡紫拟青霉胞外多糖作用后的Vero细胞见图2、3。

图1 淡紫拟青霉胞外多糖浓度与Vero细胞存活率的关系

图2 正常Vero细胞 (×100)
图3 1 000.0μg/ml淡紫拟青霉胞外多糖作用72 h的Vero 细胞 (×100)
2.3 淡紫拟青霉胞外多糖对病毒无直接灭活作用
25~1 000μg/ml淡紫拟青霉胞外多糖对HSV-1直接作用的TCID50相同,均为10-4.3,说明该多糖对HSV-1无直接灭活作用。
2.4 淡紫拟青霉胞外多糖干扰HSV-1吸附
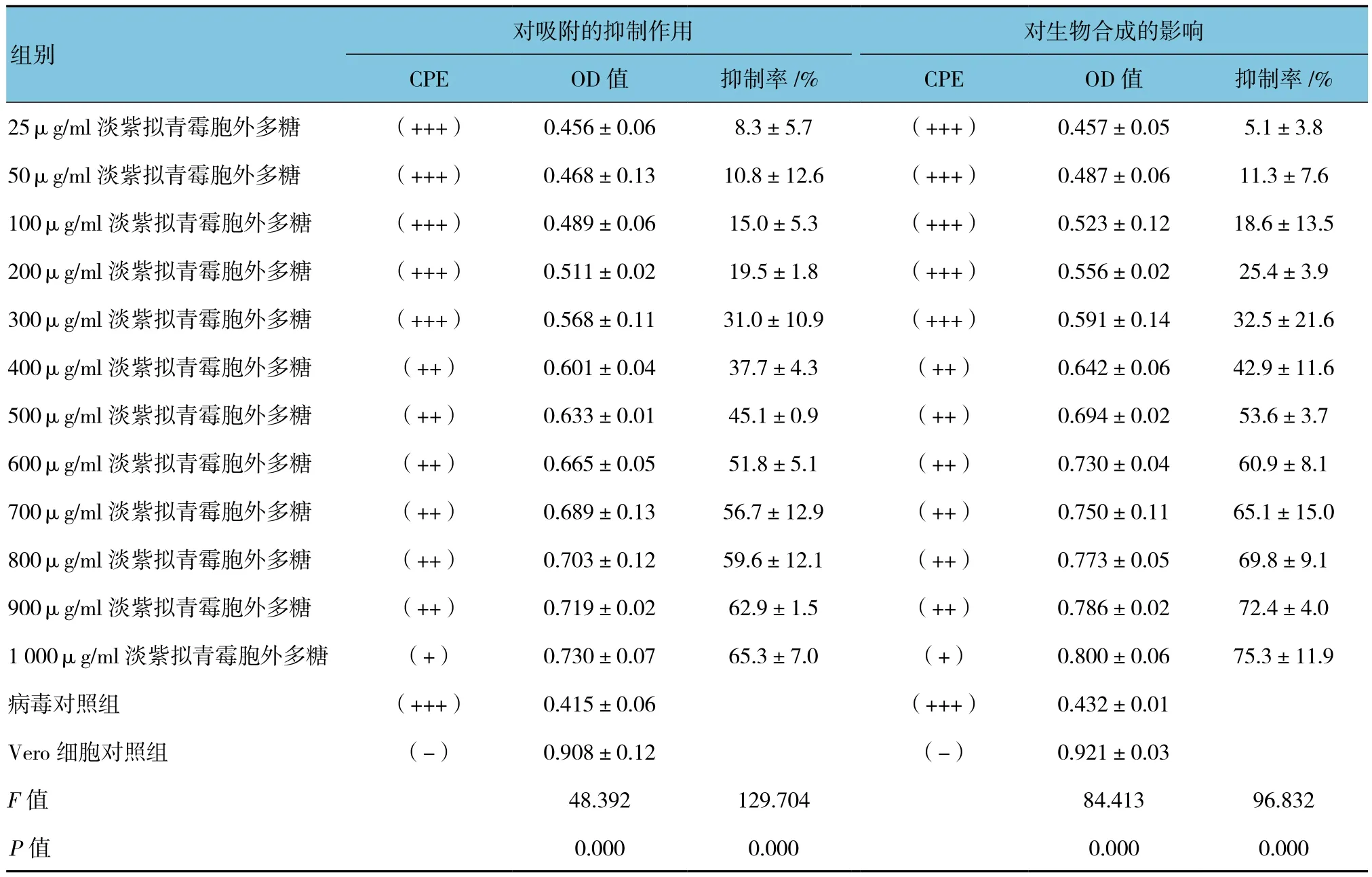
当病毒对照组CPE达(+++)以上时,淡紫拟青霉胞外多糖作用的Vero细胞CPE(+)~(+++)不等,说明在所用浓度范围内该多糖具有一定的抗病毒作用,且表现出一定量效关系。HSV-1回归方程:Y=0.0647X+7.879,R=0.982,其半数抑制浓度(50% inhibiting concentration,IC50)为 650.7μg/ml。50~1 000μg/ml多糖对病毒吸附的抑制作用与病毒对照组比较,差异有统计学意义(P<0.05),表明该多糖可在一定程度上干扰病毒吸附,即使多糖浓度达1 000μg/ml时,抑制率仅为65.3%,并未达到完全抑制。见附表。
2.5 淡紫拟青霉胞外多糖抑制HSV-1的生物合成
25~1 000μg/ml淡紫拟青霉胞外多糖对HSV-1生物合成作用有不同程度的抑制,且随着药物浓度增加,抑制率逐渐升高,CPE逐渐减轻,表现出一定的量效关系。HSV-1回归方程:Y=0.076X+8.376,R=0.980,其IC50为547.7μg/ml,25~1 000μg/ml多糖对病毒吸附的抑制作用与病毒对照组比较,差异有统计学意义(P<0.05)。当多糖浓度达1 000μg/ml时,抑制率为75.3%,说明该多糖对病毒生物合成作用有较强的抑制作用,但仍不能达到完全抑制。见附表。
附表 淡紫拟青霉胞外多糖对HSV-1吸附及生物合成的影响 (±s)
附表 淡紫拟青霉胞外多糖对HSV-1吸附及生物合成的影响 (±s)
组别对吸附的抑制作用 对生物合成的影响CPE OD值 抑制率/% CPE OD值 抑制率/%25μg/ml淡紫拟青霉胞外多糖 (+++) 0.456±0.06 8.3±5.7 (+++) 0.457±0.05 5.1±3.8 50μg/ml淡紫拟青霉胞外多糖 (+++) 0.468±0.13 10.8±12.6 (+++) 0.487±0.06 11.3±7.6 100μg/ml淡紫拟青霉胞外多糖 (+++) 0.489±0.06 15.0±5.3 (+++) 0.523±0.12 18.6±13.5 200μg/ml淡紫拟青霉胞外多糖 (+++) 0.511±0.02 19.5±1.8 (+++) 0.556±0.02 25.4±3.9 300μg/ml淡紫拟青霉胞外多糖 (+++) 0.568±0.11 31.0±10.9 (+++) 0.591±0.14 32.5±21.6 400μg/ml淡紫拟青霉胞外多糖 (++) 0.601±0.04 37.7±4.3 (++) 0.642±0.06 42.9±11.6 500μg/ml淡紫拟青霉胞外多糖 (++) 0.633±0.01 45.1±0.9 (++) 0.694±0.02 53.6±3.7 600μg/ml淡紫拟青霉胞外多糖 (++) 0.665±0.05 51.8±5.1 (++) 0.730±0.04 60.9±8.1 700μg/ml淡紫拟青霉胞外多糖 (++) 0.689±0.13 56.7±12.9 (++) 0.750±0.11 65.1±15.0 800μg/ml淡紫拟青霉胞外多糖 (++) 0.703±0.12 59.6±12.1 (++) 0.773±0.05 69.8±9.1 900μg/ml淡紫拟青霉胞外多糖 (++) 0.719±0.02 62.9±1.5 (++) 0.786±0.02 72.4±4.0 1 000μg/ml淡紫拟青霉胞外多糖 (+) 0.730±0.07 65.3±7.0 (+) 0.800±0.06 75.3±11.9病毒对照组 (+++) 0.415±0.06 (+++) 0.432±0.01 Vero细胞对照组 (-) 0.908±0.12 (-) 0.921±0.03 F值 48.392 129.704 84.413 96.832 P值 0.000 0.000 0.000 0.000
3 讨论
多糖类化合物具有良好的生物活性,早在1943年便开始作为药物使用。红树林真菌由于生活在寡营养、弱碱性的含盐海洋环境中,形成了独特的耐饥、耐碱和耐盐特性,使其可产生出完全不同于陆生真菌的新颖生物活性物质[4-5]。研究表明,红树林真菌胞外多糖主要为杂多糖,具有良好的抗病毒、抗肿瘤及免疫调节等生物活性[6-7]。
课题组前期从海南红树林中分离获得一株淡紫拟青霉[8]。经证实该株真菌产生的胞外多糖在体外有减轻单纯疱疹病毒和柯萨奇病毒的致细胞病变效应[9]。体内实验证实,该多糖可延长单纯疱疹病毒颅内感染小鼠的生存时间,提高存活率[11],说明该多糖具有一定的抗病毒作用。在前期研究基础上,本研究以Vero细胞作为病毒感染靶细胞,进一步探讨其抗HSV-1的作用。研究发现,该多糖对Vero细胞的CC50为1 724.2μg/ml,多糖浓度<900μg/ml时细胞存活率>90%,说明该多糖对Vero细胞的毒性作用较小,对细胞无明显增殖作用,是一种非常安全的多糖。本实验将不同浓度淡紫拟青霉胞外多糖作用于HSV-1感染的不同环节,发现该多糖对HSV-1无直接杀伤作用,但可抑制病毒吸附,尤其600~1 000μg/ml多糖抑制作用较强,抑制率>50%,说明该多糖可能具有一定的封闭、改变或竞争细胞表面病毒受体的作用,亦或作用于细胞使细胞处于抗病毒应激状态。研究还发现,该多糖对HSV-1生物合成具有一定的抑制作用,其IC50为547.7μg/ml,在所用浓度范围内抑制率与药物浓度呈量效关系,尤其600~1 000μg/ml多糖抑制作用较强,抑制率达>60%,但抑制作用的靶点仍需进一步研究。
总之,本研究发现红树林来源的淡紫拟青霉胞外多糖具有一定的抗HSV-1作用,在一定浓度范围内可抑制病毒吸附和生物合成,在900~1 000μg/ml浓度范围内该多糖对HSV-1吸附的抑制率>60%,对病毒生物合成的抑制率>70%,说明其抑制病毒生物合成的作用稍强于抑制吸附的作用,但均不能达到完全抑制。本研究仅对淡紫拟青霉胞外多糖的抗病毒作用进行初探,其结构和作用机制仍需进一步研究。
参 考 文 献:
[1]SZPARA M L , PARSONS L R, ENQUIST L.Sequence variability in clinical and laboratory isolates of herpes simplex virus 1 reveals new mutations[J].Journal of Virology, 2010, 84(10):5303-5313.
[2]ANTOINE T E, PARK P J, SHUKLA D.Glycoprotein targeted therapeutics:a new era of anti-herpes simplex virus-1 therapeutics[J].Reviews in Medical Virology, 2013, 23(3):194-208.
[3]傅继华.病毒学实用实验技术[M].济南:山东科学技术出版社,2001:61-63.
[4]CHI Z M, FANG Y.Exopolysaccharides from marine bacteria[J].J Ocean Uni China, 2005, 4(1):67-74.
[5]AL-SAYED H A, GHANEM E H, SALEH K M.Bacterial community and some physico-chemical characteristics in a subtropical mangrove environment in Bahrain[J].Marine Pollution Bulletin, 2005, 50:147-155.
[6]YAMADA T, IRITANI M, OHISHI H, et al.Pericosines, antitumour metabolites fromthe sea hare-derived fungus periconia byssoides.Structures and biological activities[J].Org Biomol Chem, 2007,5(24):3979-3986.
[7]AFIYATULLOV S H, KALINOVSKY A I, PIVKIN M V, et al.New diterpene glycosides of the fungus acremonium striatisporum isolated from a sea cucumber[J].Nat Prod Res, 2006, 20(10):902-908.
[8]饶朗毓, 陈政良, 林英姿.一株具免疫增强活性红树林真菌的筛选及鉴定[J].中国热带医学, 2011, 11(6):683-685.
[9]裴华, 林英姿, 饶朗毓.一株海南红树林真菌胞外多糖抗病毒活性初步研究[J].海南医学院学报, 2012, 18(2):152-154.
[10]裴华, 林英姿, 饶朗毓.一株红树林真菌抗单纯疱疹病毒Ⅱ型的研究[J].海南医学, 2012, 23(3):1-3.
[11]裴华, 林英姿, 饶朗毓.红树林真菌PH0016胞外多糖对单纯疱疹病毒Ⅰ型活性的影响[J].山东医药, 2012, 52(7):24-26.

