人脐带间充质干细胞修复老龄啮齿类动物Ⅲ度压疮的效果研究
压疮(pressure ulcers)是指局部组织长时间受压,血液循环障碍,局部持续缺血、缺氧、营养不良而致的软组织溃烂和坏死,多见于大型外科术后[1]、脑脊髓损伤等导致的活动能力受限的病人[2]、ICU[3]以及卧床不起的老年病人。目前,世界人口老龄化程度加剧且护理人力资源短缺,改善与更新压疮、溃疡等慢性伤口的护理管理迫在眉睫[4-5]。随着干细胞研究的深入及再生生物医学的发展,人脐带间充质干细胞 (human umbilical cord mesenchymal stem cells, huMSCs)以其高分化潜能、高增殖力、低免疫原性、取材方便、无伦理学争议等优点,为伤口愈合的细胞生物治疗提供了广阔前景[6-8]。本研究采用体外培养扩增huMSCs,观察评价皮下注射huMSCs对老龄啮齿类动物背部压疮的干预效果,为临床应用提供理论依据。
1 材料与方法
1.1 huMSC的培养及鉴定 取材:采用足月妊娠剖宫产健康新生儿新鲜脐带标本(由广州军区总医院产科提供),经产妇授权同意。标本采集后4 ℃保存,2 h内处理。实验方案经医院医学伦理委员会批准。 胎牛血清(FBS) 购自Hyclone;小鼠抗人核单抗购自Chemicon (MAB1281),小鼠抗人线粒体单抗购自Chemicon (MAB1273)。葡萄糖、NaCl、KCl、KH2PO4、Na2HPO4·12H2O、NaH2PO4·2H2O、多聚甲醛等均为国产分析纯常规试剂。
制备流程:将长度约10 cm的脐带在75%乙醇中漂洗后剪碎至1 mm3大小的组织块,用 0.2%胶原酶Ⅱ消化后过滤,离心,用DMEM/F12 (+)和10%重悬细胞,按1×105cells/cm2接种细胞于T-25 cm2塑料透气培养瓶中。3~5 d后更换培养基,去掉未贴壁细胞。以后每3 d 换液1次,至细胞融合至约80%,用2.5 g/L胰酶消化、传代,以5×104/cm2细胞浓度传代扩增。
活性检验:倒置显微镜观察细胞形态;台盼蓝染色观察计数死/活细胞数目,计算细胞活性(生存率)。
成品鉴定:流式细胞仪检测第3 代细胞表面 CD29、CD44、CD40、CD106及CD34的表达,行细胞免疫表型鉴定;第3代细胞用多聚甲醛固定后做细胞免疫组化,确定huMSC内人核及人线粒体的表达。
1.2 压疮动物模型的复制及创面管理 12只22 月龄健康雌性C57BL/6J小鼠(体质量25~35 g)购自广州军区总医院大学动物中心,采用磁铁对夹皮肤压疮造模法,即以一对磁铁片对夹小鼠背部皮肤12 h,连续3 d,以建立Ⅲ度压疮动物模型。模型成型后,压疮局域行皮肤外科手术十字切口并加清创胶及溃疡贴。huMSCs组在压疮近围健康组织行huMSCs皮下注射 (n=6);每个压疮注射6个位点。对照组同法皮下注射生理盐水 (n=6)。
1.3 压疮愈合终点指标检测
1.3.1 压疮面积:压疮初始面积 (original wound area, AO) 约等于模具面积,为5 mm2。压疮愈合面积(final wound area, AF)的计算采用椭圆的面积公式,即长×宽×π[9]。
1.3.2 创面愈合率 (healing rate, HR):HR的计算公式为: (AO-AF)/AO×100%[10]。
1.3.3 组织病理学的量化分析:4周后皮肤组织取材,组织石蜡包埋、切片,做常规HE染色及血管内皮生长因子 (vascular endothelial growth factor,VEGF) 免疫组化,显微镜下观察,采用Dashti-Rahmatabadi 等[11]的方法并加以改良,行病理学量化分析。比对皮肤创面愈合程度(部分愈合为1分,完全愈合为2分)、炎性反应程度(炎细胞浸润>50%为1分,炎细胞浸润30%~50%为2分,炎细胞浸润<30%为3分)、纤维(无纤维再生为1分,有纤维再生为2分)及肉芽组织再生情况(无肉芽组织再生为1分,有肉芽组织再生为2分)。VEGF染色程度依次分为:强阳性 (3分),阳性 (2分),弱阳性 (1分),阴性 (0分)。

2 结果
HuMSCs组治疗后压疮创面面积显著小于对照组 (P<0.05),HR显著高于对照组 (P<0.05),创面病理学综合评分显著优于对照组 (P<0.01)。VEGF在huMSCs组均为阳性或强阳性表达,而对照组VEGF表达较弱,2组差异有统计学意义(P<0.01)。病理学综合评分与VEGF表达密切相关 (P=0.002)。
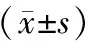
表1 2组压疮创面综合评价比较
3 讨论
3.1 压疮高发但可控 压疮病人住院治疗时间延长、生活质量严重降低、被社会孤立、情绪低沉,治疗费用高,使压疮的预防与治疗显得尤为重要。大多数的压疮是可以预防的,压疮的发生率是临床护理质量的评价指标之一。也正因如此,针对压疮的病理生理、预防及治疗的研究一直都是临床与基础医学研究监护的热点。压疮的形成是一个长期、复杂的过程, 关于人压疮的活体研究还处于起步期[12], 通过以病人为主要研究对象的临床试验所获得的信息仍然相当匮乏。而使用动物模型,能有效模拟临床压疮的发生发展过程,可控性强,可以用于压疮病理生理机制及防治措施的实验研究。
3.2 HuMSCs的优点 骨髓间充质干细胞(bone marrow mesenchymal stem cells, bmMSCs) 是再生医学的研究重点。bmMSCs主要来源于骨髓,但骨髓组织取材困难,需行骨髓穿刺术,来源受限,且随病人年龄增长,骨髓老化可致细胞数量、质量和增殖分化能力显著降低,并存在病毒感染的潜在危险。bmMSCs体外培养还存在老化、纯化成本高、技术要求高等问题,因此限制了其临床应用。近年研究表明,huMSCs有望成为bmMSCs的理想替代物,用于皮肤病学及再生医学的研究[6-8, 10-15]。HuMSCs增殖分化潜能高而免疫原性低,扩增时培养体系能统一,便于质控,同时采集时对产妇及新生儿无任何危害及损伤,采集方便,易于保存和运输。因此,huMSCs在老年病人群体具有广阔的临床应用前景。
3.3 HuMSCs可能通过VEGF加速皮肤压疮局灶愈合 本实验中,治疗组huMSCs局部注射后压疮疮面干燥紧缩,病理学研究表明组织结构修复重建显著优于对照组,可能与huMSCs移植后显著高调组织VEGF的表达有关。VEGF又称血管通透性因子 (vascular permeability factor, VPF) 或血管调理素 (vasculotropin),是一组功能强大且能产生多种效应的细胞因子,其生物学特性主要表现在两方面:增加微血管通透性和特异性地与血管内皮细胞受体结合,促进血管内皮细胞的分裂和增殖,进而导致新生血管的生成。本研究中,huMSCs组压疮创面愈合程度高、炎性反应程度弱、肉芽组织新生活跃;创面愈合综合评价显著优于对照组,VEGF多为强阳性或阳性,且表达强度与创面愈合程度密切相关,提示huMSCs移植后通过促进局部缺血组织内微小侧支血管重塑从而促进压疮修复[16-17]。
结合本文部分实验结果,复习目前有关huMSCs移植与皮肤损伤修复重建相关研究可知,虽然huMSCs移植可促进老龄啮齿类动物压疮的修复,但其临床转化还需要大量的动物实验数据的支持及临床前标准化操作规范的指导。而且,面对不同的病人和不同的压疮分期,如何综合评价治疗效果及甄选效果评价参数仍需进一步研究。
致谢:感谢北京军事医学科学院基础医学研究所刘少君研究员对本课题的指导。
[]
[1] Still MD, Cross LC, Dunlap M, et al. The turn team: a novel strategy for reducing pressure ulcers in the surgical intensive care unit [J]. J Am Coll Surg, 2013, 216(3):373-379.
[2] Groah SL, Schladen M, Pineda CG, et al. Prevention of pressure ulcers among people with spinal cord injury: A systematic review [J]. PM R,2015, 7(6):613-636.
[3] Krupp AE, Monfre J. Pressure ulcers in the ICU patient: an update on prevention and treatment [J]. Curr Infect Dis Rep, 2015, 17(3):468.
[4] Levine JM, Ayello EA, Zulkowski KM, et al. Pressure ulcer knowledge in medical residents: an opportunity for improvement [J]. Adv Skin Wound Care, 2012, 25(3):115-117.
[5] Smith ME, Totten A, Hickam DH, et al. Pressure ulcer treatment strategies: a systematic comparative effectiveness review [J]. Ann Intern Med, 2013, 159(1):39-50.
[6] Liu L, Yu Y, Hou Y, et al. Human umbilical cord mesenchymal stem cells transplantation promotes cutaneous wound healing of severe burned rats [J]. PLoS One,2014, 9(2):e88348.
[7] Liu LY, Hou YS, Chai JK, et al. Basic fibroblast growth factor/vascular endothelial growth factor in the serum from severe burn patients stimulates the proliferation of cultured human umbilical cord mesenchymal stem cells via activation of Notch signaling pathways [J]. J Trauma Acute Care Surg, 2013, 75(5):789-797.
[8] Nan W, Liu R, Chen H, et al. Umbilical cord mesenchymal stem cells combined with a collagen fibrin double-layered membrane accelerates wound healing [J]. Wounds,2015, 27(5):134-140.
[9] Strong AL, Bowles AC, MacCrimmon CP, et al. Characterization of a murine pressure ulcer model to assess efficacy of adipose-derived stromal cells [J]. Plast Reconstr Surg Glob Open,2015, 3(3):e334.
[10] Zhao G, Liu F, Lan S, et al. Large-scale expansion of Wharton’s jelly-derived mesenchymal stem cells on gelatin microbeads, with retention of self-renewal and multipotency characteristics and the capacity for enhancing skin wound healing [J]. Stem Cell Res Ther,2015, 19(6):38.
[11] Dashti-Rahmatabadi MH, Noorbala MT. A comparison between the efficacy of iranian and syrian hydrogel dressings on wound healing in rats[J]. Iran Red Crescent Med J, 2011, 13(5):338-341.
[12] Salcido R, Popescu A, Ahn C. Animal models in pressure ulcer research [J].J Spinal Cord Med, 2007, 30(2):107-116.
[13] Jadalannagari S, Aljitawi OS. Ectodermal differentiation of Wharton’s jelly mesenchymal stem cells for tissue engineering and regenerative medicine applications [J]. Tissue Eng Part B Rev, 2015, 21(3):314-322.
[14] Azari O, Babaei H, Derakhshanfar A, et al. Effects of transplanted mesenchymal stem cells isolated from Wharton’s jelly of caprine umbilical cord on cutaneous wound healing; histopathological evaluation[J]. Vet Res Commun,2011, 35(4):211-222.
[15] Schneider RK, Püllen A, Kramann R, et al. Long-term survival and characterisation of human umbilical cord-derived mesenchymal stem cells on dermal equivalents [J]. Differentiation, 2010, 79(3):182-193.
[16] Behl T, Kotwani A. Exploring the various aspects of the pathological role of vascular endothelial growth factor (VEGF) in diabetic retinopathy [J]. Pharmacol Res, 2015, 99 (6):137-148.
[17] Jia J, Dellinger AE, Weiss ES, et al. Direct evidence of target inhibition with anti-VEGF, EGFR, and mTOR therapies in a clinical model of wound healing [J]. Clin Cancer Res, 2015, 21(15): 3442-3452.

